Unidad Enlace Qumico Enlaces Interatmicos Uniones intermoleculares Recordar





































- Slides: 57

Unidad “Enlace Químico” Enlaces Interatómicos Uniones intermoleculares

Recordar: Conceptos de: l Electrón de valencia l Electronegatividad

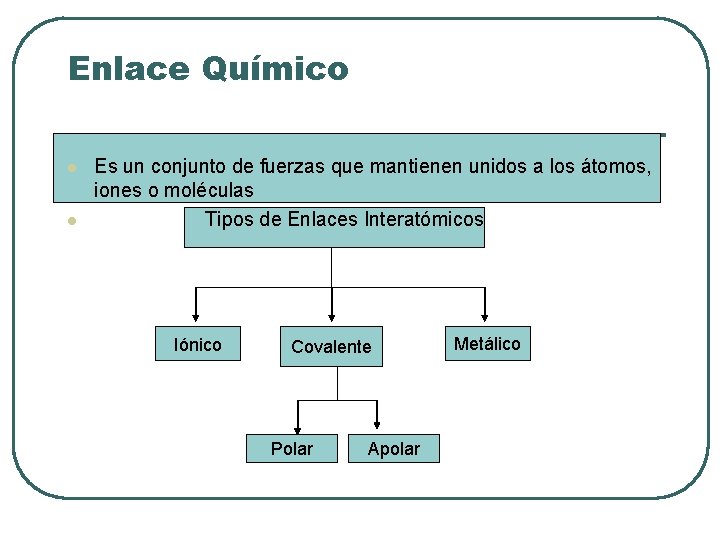
Enlace Químico l l Es un conjunto de fuerzas que mantienen unidos a los átomos, iones o moléculas Tipos de Enlaces Interatómicos Iónico Covalente Polar Apolar Metálico

Estructuras de Lewis Gilber Lewis ideó un sistema de símbolos para representar en forma simple los electrones de valencia con puntos o cruces alrededor del símbolo del elemento. l Ejemplo 22 s 2 2 p 63 s 1 Na : 1 s Na • 11 Ø

Reglas del Octeto y del Dueto l Cuando los átomos se enlazan, ceden, aceptan o comparten electrones para adquirir la configuración de un gas noble. l Cuando completan 8 electrones un su última capa se dice que cumplen con la ley del Octeto Cuando completan 2 electrones en su última capa de dice que cumplen con la ley del Dueto. ( H , Li , Be y B) l l Ejemplo 22 s 2 2 p 63 s 1 Na : 1 s 11 22 s 2 2 p 6 Na : 1 s 11 Na • Na+

Formación de Iones l l Los átomos que presentan entre 1 a 3 electrones de valencia CEDEN sus electrones para adquirir la configuración de un gas noble. Los átomos que tienen entre 4 y 7 electrones de valencia ACEPTAN los electrones necesarios para adquirir la configuración electrónica del gas noble más cercano

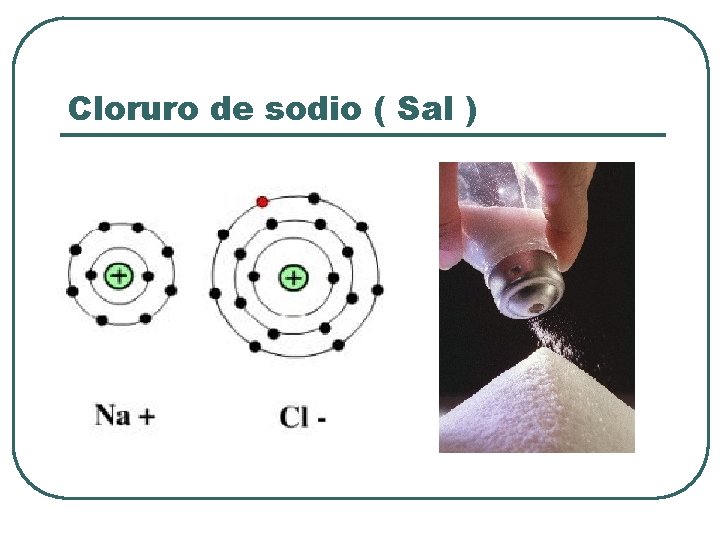
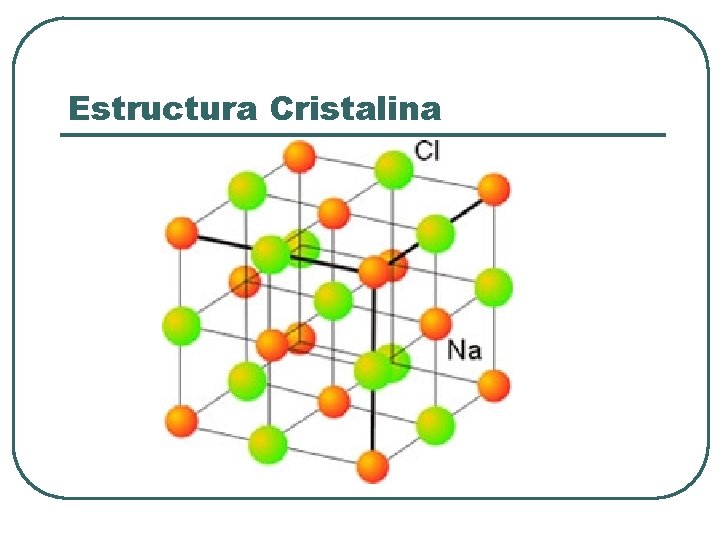
1. -Enlace iónico l l Unión que se produce por Transferencia de electrones de un átomo a otro, formándose dos iones con cargas opuestas que se unen por fuerzas electrostáticas Este tipo de enlace se produce entre átomos con gran diferencia de electronegatividad. Igual o superior a 1, 7 Ej: Na. Cl : Cl = 3, 0 Na = 0, 9 2, 1 Enlace Iónico


Cloruro de sodio ( Sal )

Estructura Cristalina

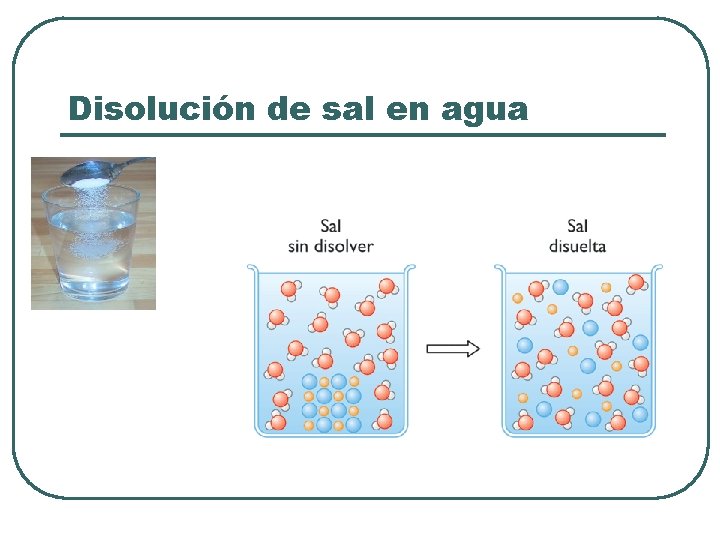
Propiedades de los compuestos iónicos l l l Son sólidos a temperatura ambiente Solubles en agua y otros solventes polares Conducen la corriente eléctrica cuando están fundidos y en solución , pero no en estado sólido Tienen altos puntos de fusión y ebullición Al disolverse en agua se disocian

Disolución de sal en agua

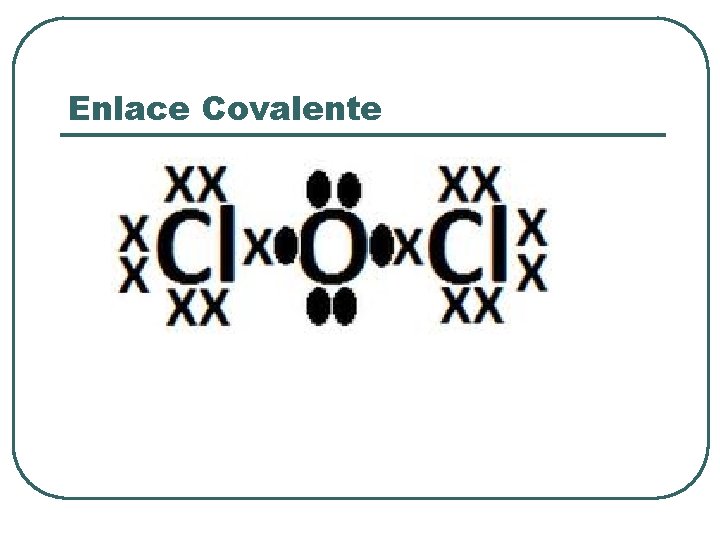
2. -Enlace Covalente l l l Unión entre átomos que comparten electrones de valencia Ocurre con átomos de tendencia a ganar electrones( muy electronegativos) Los átomos comparten electrones para adquirir la configuración electrónica de un gas noble

Enlace Covalente

¿Cómo diferenciar un enlace covalente de un enlace iónico? l l l Por la diferencia de electronegatividad Inferior a 1, 7 Enlace Covalente Igual o superior a 1, 7 Enlace Iónico l Ej: Na. Cl : Cl = 3, 0 Na = 0, 9 2, 1 Enlace Iónico l Ej: HBr Br = 2, 8 H = 2, 1 0, 7 Enlace Covalente

Forma de escribir los enlaces Iónicos y Covalentes l l l Mediante las estructuras de Lewis Enlace Iónico : mediante iones(+ y -) Enlace Covalente : ordenando los electrones para que se demuestre que están compartiendo electrones

Ejercitemos l Para cada compuesto indicar el tipo de enlace y la forma de escribirlo según Lewis. l 1) KF l 2)Al. Cl 3 l 3)HBr l 4)I 2 l 5)Mg. O

Tipos de Enlaces Covalentes De acuerdo a la polaridad del enlace l l Polar: se produce cuando los átomos que comparten electrones presenta una diferencia de electronegatividad Apolar: se produce cuando la diferencia de electronegatividad sea 0

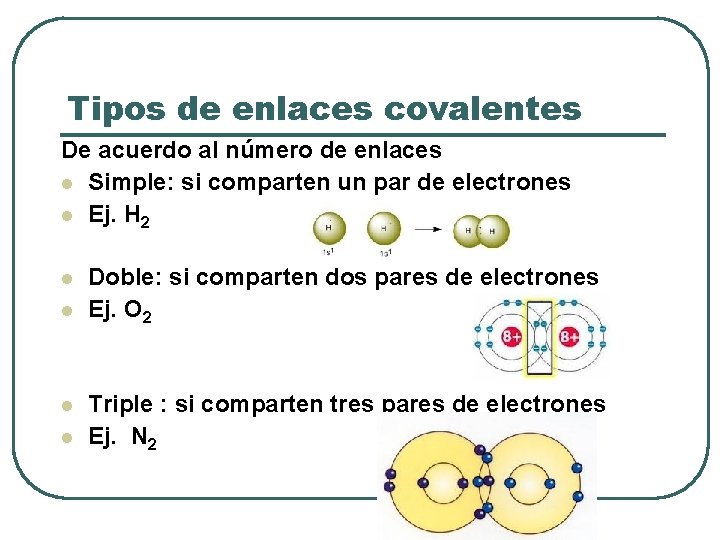
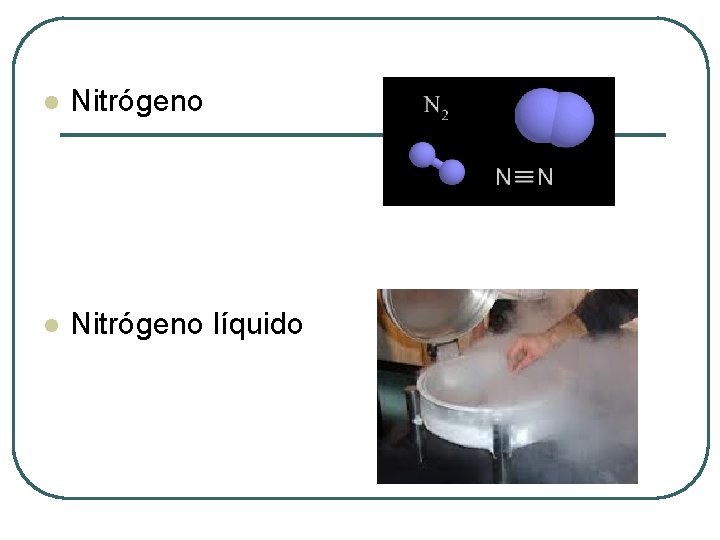
Tipos de enlaces covalentes De acuerdo al número de enlaces l Simple: si comparten un par de electrones l Ej. H 2 l l Doble: si comparten dos pares de electrones Ej. O 2 Triple : si comparten tres pares de electrones Ej. N 2

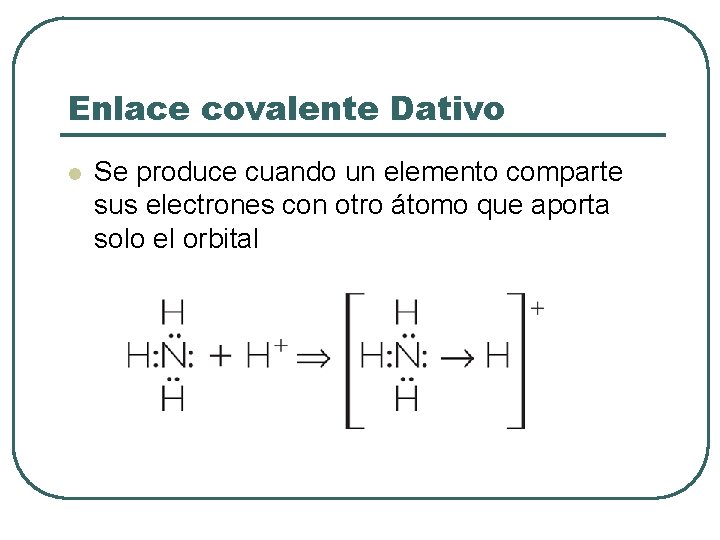
Enlace covalente Dativo l Se produce cuando un elemento comparte sus electrones con otro átomo que aporta solo el orbital

Sustancias Covalentes l Reticulares : Sustancias formadas por un número indefinido de átomos unidos unos con otros por enlace covalente l Ej Grafito l Moleculares: Sustancias formadas por l moléculas individuales unidas entre si por enlaces intermoleculares Ej. H 2 O N 2 CH 4 Diamante


3. - Enlace metálico l Se produce en elementos “ metálicos”, en donde el salto de electrones de un átomo a otro genera atracción entre ellos que los mantiene unidos



Geometría de Enlace l l Ya sabemos que el enlace iónico forma estructuras cristalinas ordenadas. pero ¿Qué estructuras forman los compuestos covalentes?

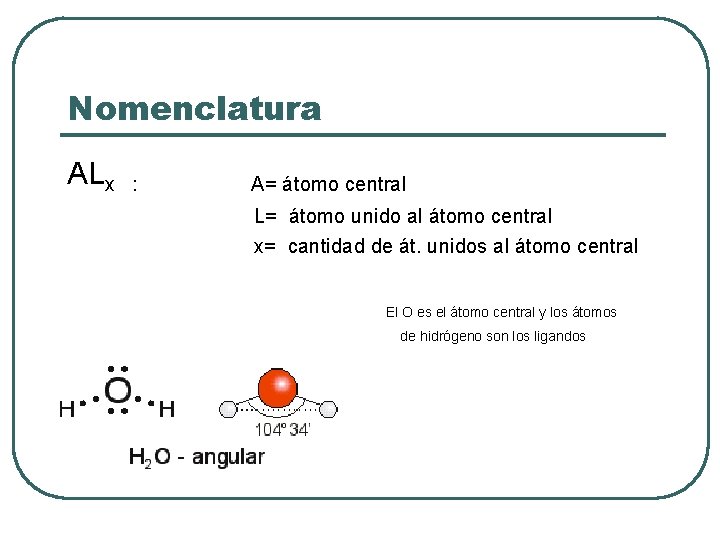
Nomenclatura ALx : A= átomo central L= átomo unido al átomo central x= cantidad de át. unidos al átomo central El O es el átomo central y los átomos de hidrógeno son los ligandos

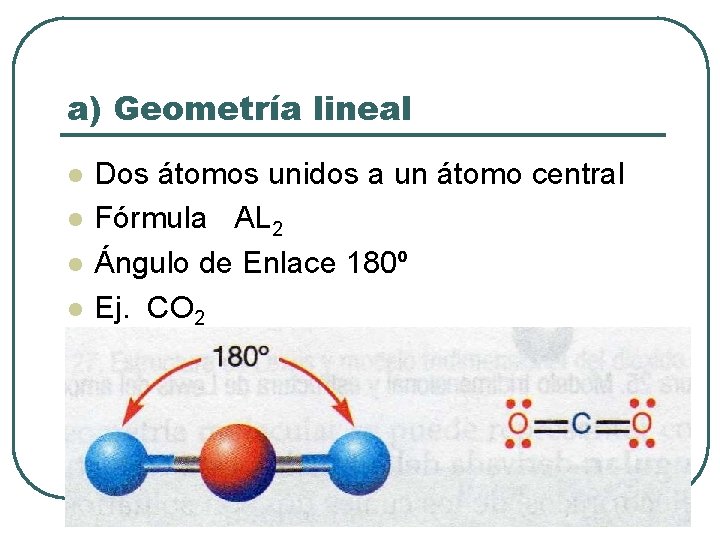
a) Geometría lineal l l Dos átomos unidos a un átomo central Fórmula AL 2 Ángulo de Enlace 180º Ej. CO 2

b) Geometría angular l l l Dos átomos unidos a un átomo central En el átomo central existen 2 pares de electrones No enlazante Fórmula AL 2 Ángulo de Enlace 104, 5° Ej. Agua

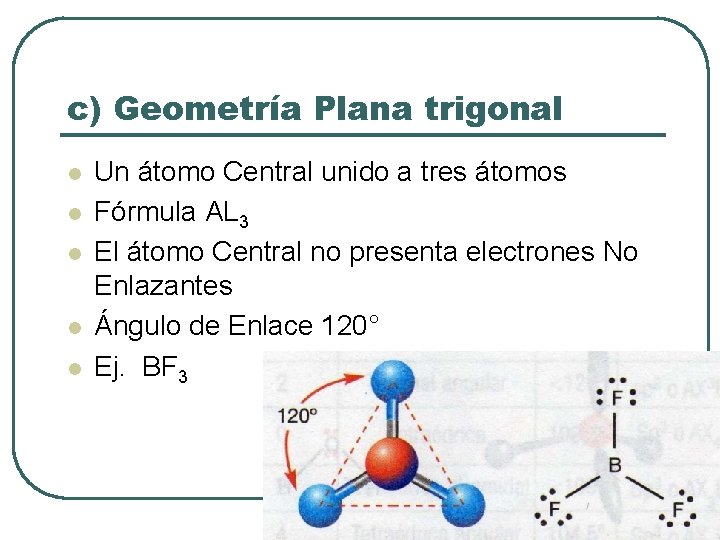
c) Geometría Plana trigonal l l Un átomo Central unido a tres átomos Fórmula AL 3 El átomo Central no presenta electrones No Enlazantes Ángulo de Enlace 120° Ej. BF 3

d) Geometría piramidal trigonal l l El átomo Central unido a tres átomos El átomo Central presenta un par de electrones No Enlazantes Fórmula AL 3 Ángulo de Enlace 107° Ej. NH 3

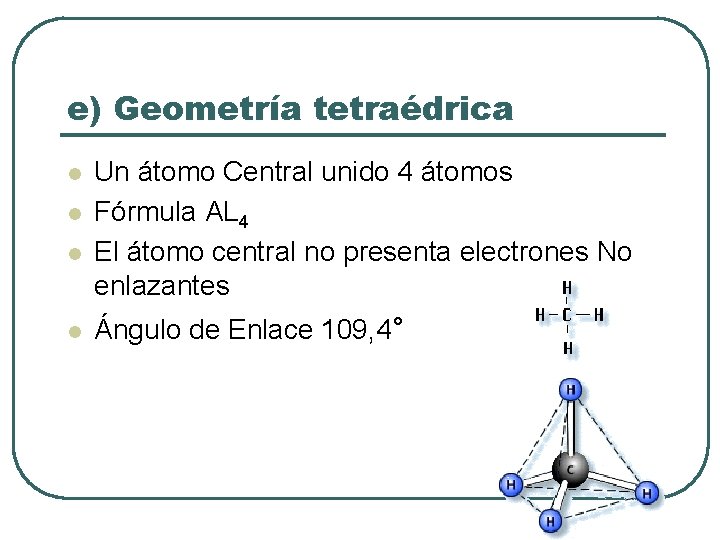
e) Geometría tetraédrica l l Un átomo Central unido 4 átomos Fórmula AL 4 El átomo central no presenta electrones No enlazantes Ángulo de Enlace 109, 4°


Completemos el siguiente cuadro resumen Tipo de Geometría Lineal Angular Plana trigonal Piramidal trigonal Tetraédrica Nºe enlazante Nº e NO enlazante Ángulo de Esquema enlace Ejemplo

Ejercitemos l Indicar el tipo de geometría que tienen los siguientes compuestos 1)CCl 4 2) BF 3 3) SF 2

l 4) PH 3 l 5) Cl 2


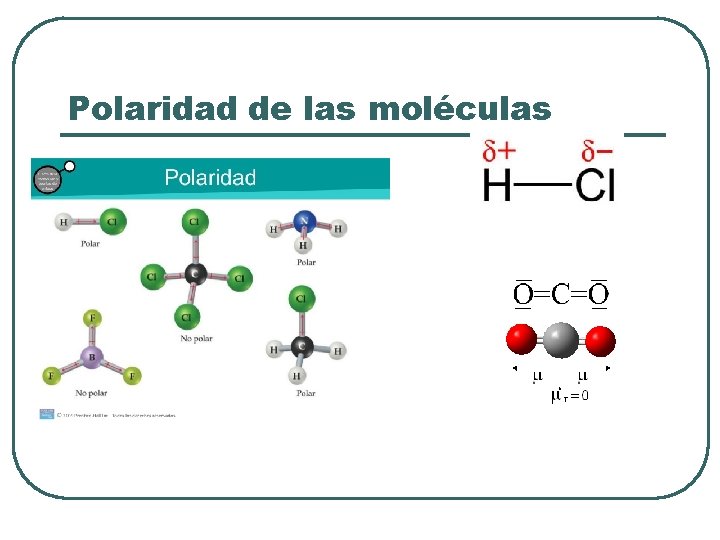
Polaridad de las moléculas


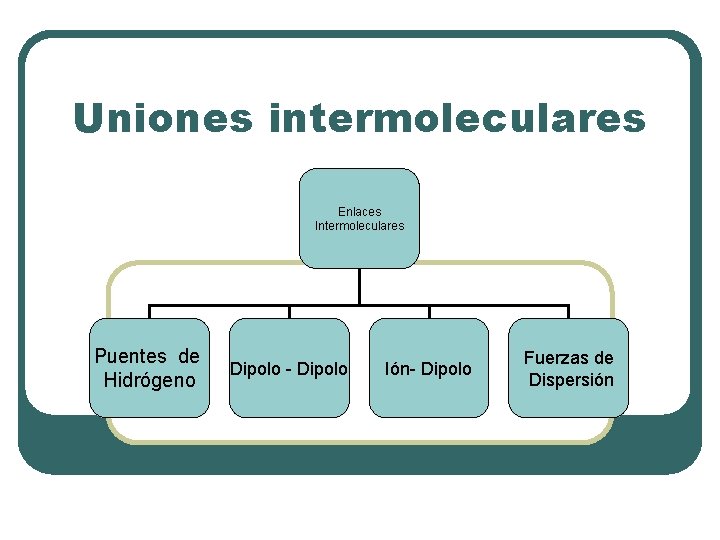
Uniones intermoleculares Enlaces Intermoleculares Puentes de Hidrógeno Dipolo - Dipolo Ión- Dipolo Fuerzas de Dispersión

Molécula de agua



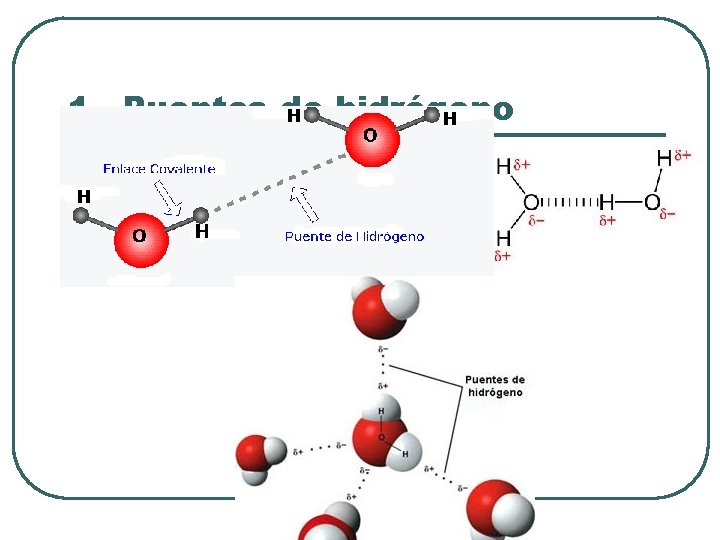
1. - Puentes de hidrógeno


Definición l l l Unión intermolecular Moléculas que tienen átomos de Hidrógeno Unido a un elemento muy electronegativo como el N, O , F

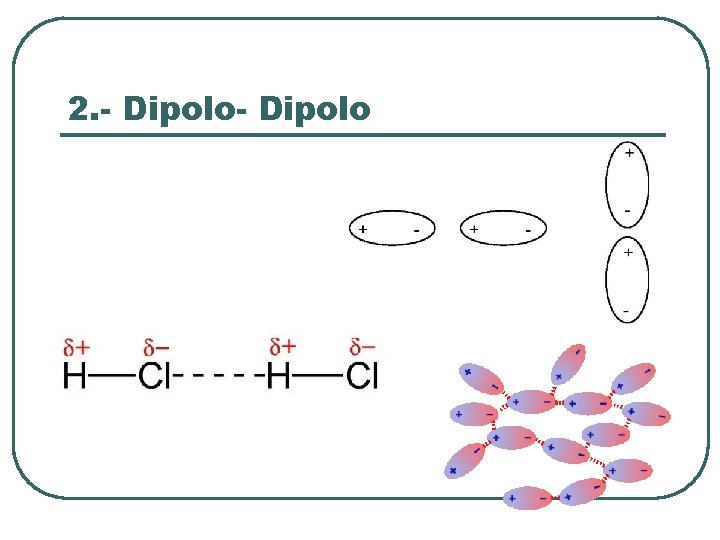
2. - Dipolo


Definición l l Enlace Intermolecular Moléculas polares Unión por polos opuestos Unión electrostática

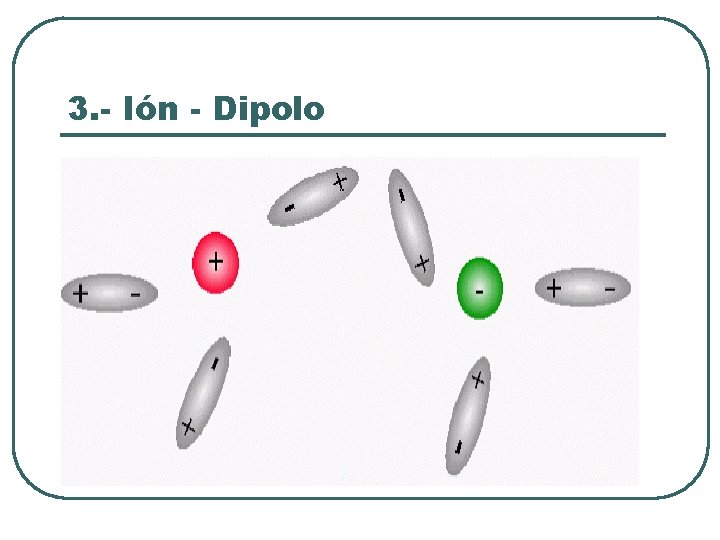
3. - Ión - Dipolo


Definición l l l Unión entre un ión y una molécula polar Unión electrostática A través de las cargas opuestas

Dipolo- Dipolo Inducido l l Entre una molécula polar y una apolar La molécula polar distorsiona la nube electrónica de la molécula apolar, lo que crea en ella un polo instantánea y una atracción entre ambas moléculas

l Nitrógeno líquido

Fuerzas de dispersión l l Fuerzas de Van der Waals Fuerzas de London

Fuerzas de dispersión l l Fuerzas de Van der Waals Fuerzas de London

 Fuerzas de london
Fuerzas de london Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Polar y no polar
Polar y no polar Enlace covalente sigma
Enlace covalente sigma Certificado de afiliación exequial grupo recordar
Certificado de afiliación exequial grupo recordar Cuales son los verbos regulares
Cuales son los verbos regulares Vamos a recordar
Vamos a recordar Un tiempo para recordar
Un tiempo para recordar Ejemplo de recordar
Ejemplo de recordar Argon punto de fusion y ebullicion
Argon punto de fusion y ebullicion Clases de fuerzas intermoleculares
Clases de fuerzas intermoleculares Ch2fcooh nombre
Ch2fcooh nombre Forcas intermoleculares
Forcas intermoleculares Diatomica
Diatomica Fuerzas intermoleculares ejemplos
Fuerzas intermoleculares ejemplos Momento dipolo dipolo
Momento dipolo dipolo Centenas
Centenas Desmosomas
Desmosomas Hemidesmosomas
Hemidesmosomas Uniones y conexiones wan
Uniones y conexiones wan Uniones de filete
Uniones de filete Depurinacion
Depurinacion Tipos de uniones de soldadura
Tipos de uniones de soldadura Depurinacion
Depurinacion Diferenciaciones de membrana
Diferenciaciones de membrana Uniones covalentes
Uniones covalentes Soldadura tipo filete
Soldadura tipo filete Transitria
Transitria Union celula celula
Union celula celula Tejido cartilaginoso
Tejido cartilaginoso Uniones fijas soldadas
Uniones fijas soldadas Uniones traslapadas
Uniones traslapadas No polar
No polar Espuma para rasurar es solución coloide o suspension
Espuma para rasurar es solución coloide o suspension Proteinas de membrana funcion
Proteinas de membrana funcion Integrinas
Integrinas Epitelio intestino delgado
Epitelio intestino delgado Sin embargo conectores
Sin embargo conectores Solubilidad en proteinas
Solubilidad en proteinas Estructura del arn
Estructura del arn Peridica
Peridica Resultante
Resultante Sitios mineduc cl enlaces textos escolares 2do
Sitios mineduc cl enlaces textos escolares 2do Enlace covalente polar ejemplos
Enlace covalente polar ejemplos Union covalente e ionica
Union covalente e ionica Enlaces sigma y pi ejemplos
Enlaces sigma y pi ejemplos Acido desoxiguanilico
Acido desoxiguanilico Nnn enlaces bc
Nnn enlaces bc Enlaces covalentes ejemplos
Enlaces covalentes ejemplos Fqcolindres 4 eso
Fqcolindres 4 eso Co2 estructura de lewis
Co2 estructura de lewis Nnn enlaces bc
Nnn enlaces bc Entalpia de reaccion
Entalpia de reaccion Ffa enlaces gratuitos ejemplo
Ffa enlaces gratuitos ejemplo Enlaces extraoracionales ejemplos
Enlaces extraoracionales ejemplos