Estructuras de Lewis para compuestos y Fuerzas Intermoleculares














- Slides: 22

Estructuras de Lewis para compuestos y Fuerzas Intermoleculares ( Fuerzas de atracción entre compuestos) SEMANA 3 -----2017 Licda. Isabel Fratti de Del Cid Diseño de diapositivas con imágenes e ilustraciones cortesía de Licda: Lilian Judith Guzmán Melgar

Estructuras de Lewis ó fórmulas electrón punto para compuestos En éstas estructuras, se colocan alrededor del símbolo de los átomos participantes, sus electrones de valencia , tratando de que en las uniones formadas, se completen octetos, es decir queden 8 electrones alrededor de cada átomo participante. Los octetos se obtienen cuando los átomos al unirse establecen enlaces iónicos o covalentes ( simples, dobles, triples, coordinados) En algunos casos no se cumplen octetos ( Ejemplo: octetos incompletos ( menos de 8 e-) y expandidos ( más de 8 e -. ) 2 se verán unos ejemplos.

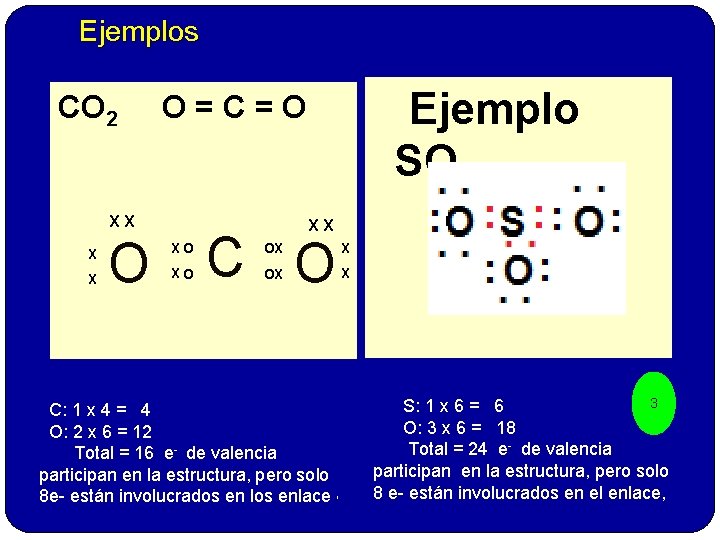
Ejemplos CO 2 XX X X O Ejemplo SO 2 O=C=O XX XO XO C O OX X C: 1 x 4 = 4 O: 2 x 6 = 12 Total = 16 e- de valencia participan en la estructura, pero solo 8 e- están involucrados en los enlace , 3 S: 1 x 6 = 6 O: 3 x 6 = 18 Total = 24 e- de valencia participan en la estructura, pero solo 8 e- están involucrados en el enlace,

Consideraciones generales de las estructuras de LEWIS 1 - Si la fórmula tiene 3 ó más elementos diferentes, se coloca un elemento central( generalmente un no metal diferente al oxígeno como: ( C, N, S, Cl, Br, I). 2 - Si es un oxácido ( Ejs : HNO 3, H 2 CO 3, H 3 PO 4), aunque el H en la fórmula se observa unido al elemento central, no es así, sino se halla unido a uno de los oxígenos formando un enlace simple y ese oxigeno se une al elemento central también formando un enlace simple. Es decir por cada Hidrógeno en el oxácido va a ver un enlace simple H-O y otro enlace simple O-Elemento central, el resto de oxígenos formaran enlaces covalentes dobles (2 e- el oxígeno y 2 e- el elemento central) ó coordinados, donde el par de electrones los 4 pone el elemento central, HASTA COMPLETAR

33 - En oxisales ( K 3 PO 4, Na 2 CO 3), el metal ( Na, K) no se halla unido al elemento central, sino al oxígeno, formando generalmente un enlace iónico( por diferencia de electronegatividad), donde el metal pierde e- y el oxígeno los gana. Este oxigeno se unirá al elemento central a través de un enlace covalente simple. Los otros oxígenos se unirán al elemento central a través de enlaces dobles ó coordinados. Cuando se forman enlaces iónicos en las estructuras de Lewis, no se observan octetos al rededor de los metales que pierden sus electrones de valencia, pues al perder e- los metales logran un octeto interno y éstos no se muestran en 5 éstas estructuras. En los átomos que forman enlaces

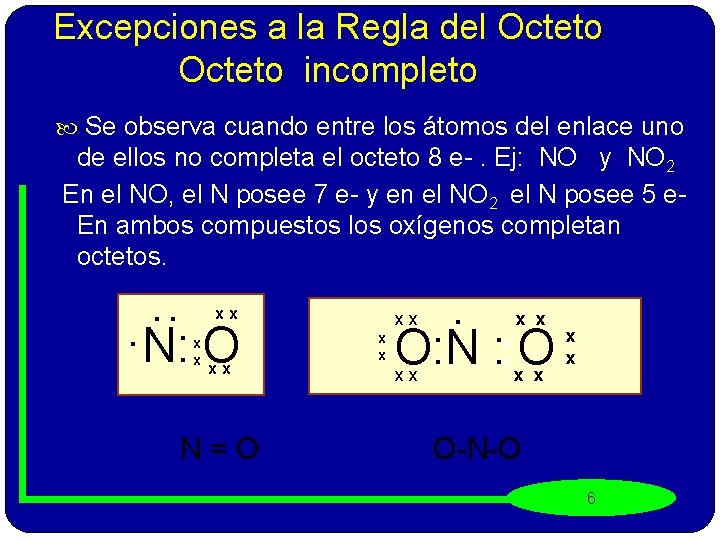
Excepciones a la Regla del Octeto incompleto Se observa cuando entre los átomos del enlace uno de ellos no completa el octeto 8 e-. Ej: NO y NO 2 En el NO, el N posee 7 e- y en el NO 2 el N posee 5 e. En ambos compuestos los oxígenos completan octetos. . xx N: O x x xx N=O xx x x O: N : O xx x x x O-N-O 6

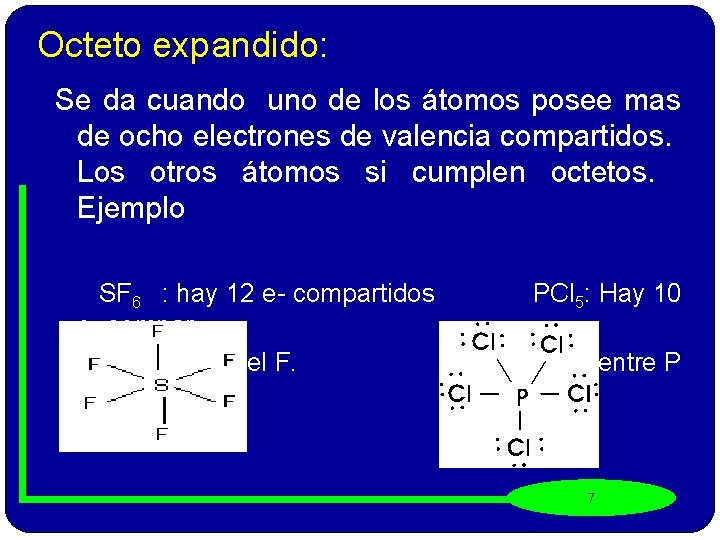
Octeto expandido: Se da cuando uno de los átomos posee mas de ocho electrones de valencia compartidos. Los otros átomos si cumplen octetos. Ejemplo SF 6 : hay 12 e- compartidos e- comparentre el S y el F. y Cl. PCl 5: Hay 10 tidos entre P 7

Elabore las estructuras de Lewis, para los siguientes compuestos, e indique los tipos de enlaces presentes: Iónicos, covalentes simples, dobles, coordinados. H 2 CO 3 K 3 PO 4

HNO 3 SO 2

Na. HCO 3 K 2 SO 4

FUERZAS INTERMOLECULARES (Fuerzas de Atracción Intermoleculares) Las fuerzas intermoleculares son las atracciones mutuas entre moléculas, son mucho mas débiles que los enlaces covalentes y iónicos pero contribuyen a determinar las propiedades físicas de la sustancias moleculares. Como grupo también reciben el nombre de Fuerzas de van der Waals o Fuerzas atractivas en compuestos. 11

Tipos de Fuerzas Intermoleculares ( Atracciones entre compuestos) Fuerzas dipolares (dipolo-dipolo) Puentes de hidrógeno Fuerzas de dispersión ( Fuerzas de London) 12

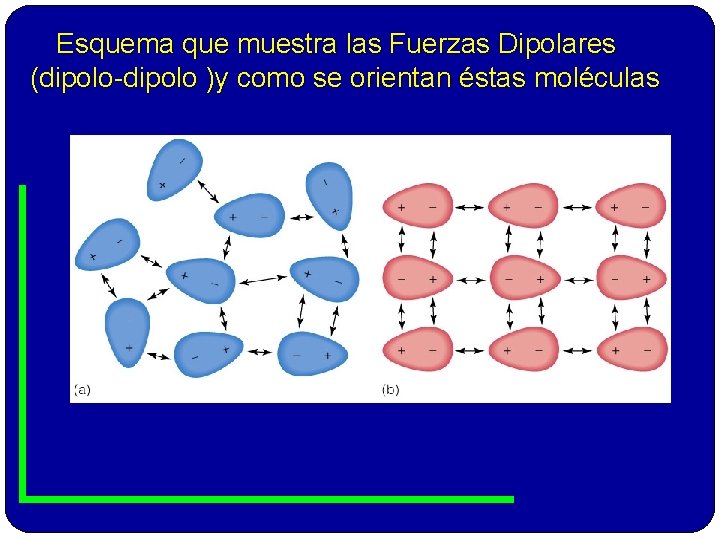
Fuerzas Dipolares (dipolo-dipolo) Se da si la molécula presenta enlace covalente polar ( diferencia de electronegatividad >0. 4 y < 1. 8 ). El extremo parcialmente positivo ( + ) se atrae con el extremo parcialmente negativo ( - ). Estas atracciones son permanentes. Los símbolos δ+ y δ-, indican parcialmente positivo ó negativo, quiere decir, que ningún átomo del enlace perdió ó gano e( no se formaron iones), solo los comparten de forma desigual 13

Esquema que muestra las Fuerzas Dipolares (dipolo-dipolo )y como se orientan éstas moléculas Insert figure 13. 2

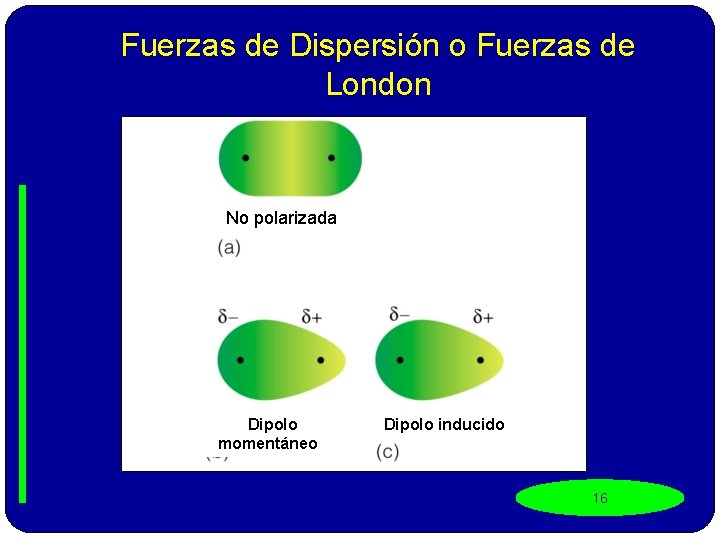
Fuerzas de Dispersión (Fuerzas de London ó dipolos transitorios). Son transitorias , se dan entre moléculas NO polares ( Diferencia de electronegatividad entre o. o-o. 4). Ej: Elementos diatómicos (H 2 ; O 2 ; N 2 ; F 2 ; Cl 2 ; Br 2 ; I 2 ) o moléculas como Si. H 4, Sb. H 3 Los electrones en movimiento, se localizan en una región momentáneamente dándole a esa región una carga parcialmente negativa (δ-), y el otro extremo queda parcialmente positivo (δ+). En éste momento hay atracción. Al moverse los e-, se pierden la polarización y la atracción desaparece, luego vuelven a polarizarse y nuevamente, hay atracción ( por eso se llaman fuerzas de dispersión 15 ó dipolos transitorios).

Fuerzas de Dispersión o Fuerzas de London No polarizada Dipolo momentáneoo Dipolo inducido 16

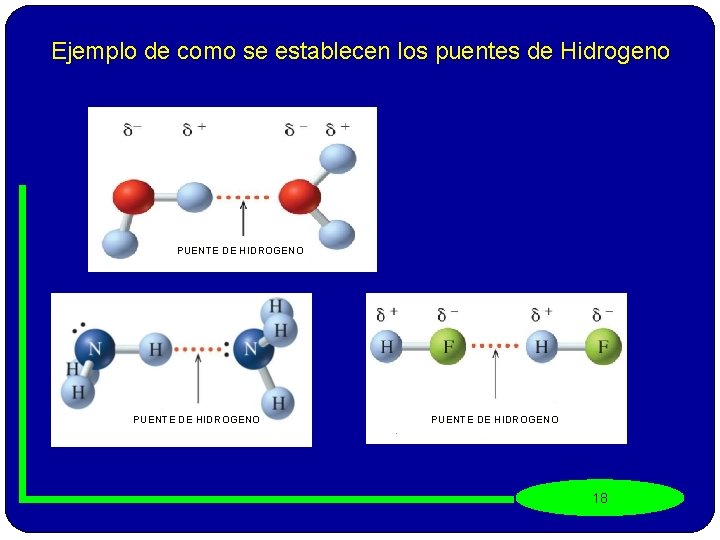
Puentes de Hidrógeno Son las fuerzas intermoleculares entre moléculas polares que contienen átomos de hidrógeno unidos a flúor, oxígeno o nitrógeno. El Hidrogeno menos electronegativo que el F, O y N manifiesta una carga parcialmente positiva, que se atrae con las cargas parcialmente negativas del O y N y F. No basta con que la moléculas poseen H, N, F u O, debe haber una unión directa entre el Hidrógeno y el N, ó el F ó el O. Los puentes de Hidrógenos son más fuertes o intensos, que las fuerzas dipolo-dipolo y las de London. Ej: NH 3, H 2 O, HF La estructura tridimensional de moléculas de gran importancia biológica como proteínas y ácidos 17 nucleicos, se debe en gran parte a éstas fuerzas.

Ejemplo de como se establecen los puentes de Hidrogeno PUENTE DE HIDROGENO 18

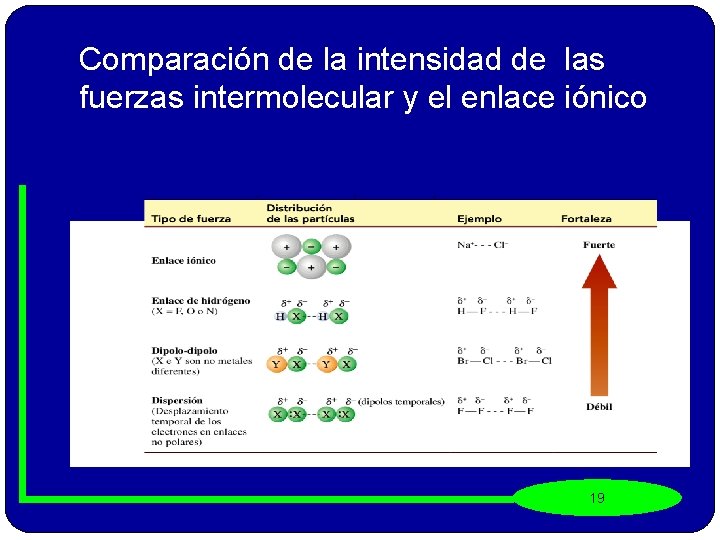
Comparación de la intensidad de las fuerzas intermolecular y el enlace iónico 19

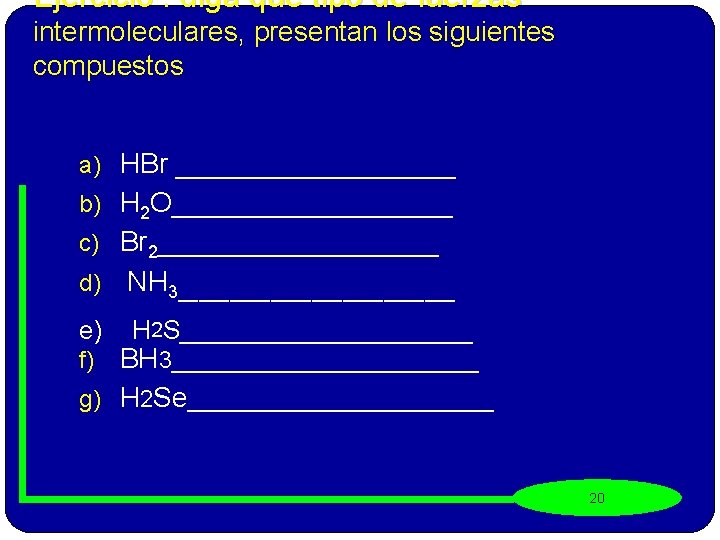
Ejercicio : diga que tipo de fuerzas intermoleculares, presentan los siguientes compuestos a) HBr _________ b) H 2 O_________ c) Br 2_________ d) NH 3______________ e) H 2 S__________ BH 3____________ g) H 2 Se____________ f) 20

Ejercicios adicionales 1 A-Con cual (cuales) de los siguientes átomos : ( O, Cl , N, S, H , Br, Ge) al combinarse el Hidrogeno, formara: A- Enlace covalente polar : ____ B- Puente de Hidrógeno : _____ C- Fuerzas de dispersión o London : _______ 1 B- Haga un esquema de como se producirían los enlaces de hidrogeno , entre NH 3 y H 2 O

2 - Escriba la estructura de Lewis de una molécula hipotética ( A 3 B X 4 ) donde cada átomo de A, forme un enlace covalente simple con X y que a la vez X, forme un enlace covalente simple con B y que el otro átomo de X forme un enlace covalente coordinado con B, donde únicamente B ponga el par de e-, recuerde en éste caso los átomos B y X cumplen octeto, los átomos A solo poseen un electrón de valencia, por lo tanto no muestran octeto, sino que solo se observaran 2 electrones entre A y X)
 Fuerzas intermoleculares so4
Fuerzas intermoleculares so4 Enlace sigma y pi
Enlace sigma y pi Fuerzas intermoleculares
Fuerzas intermoleculares Fuerzas intermoleculares
Fuerzas intermoleculares Dipolo instantâneo
Dipolo instantâneo Fuerza intermolecular
Fuerza intermolecular Fuerza por la distancia
Fuerza por la distancia Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Mapa mental polaridade das moleculas
Mapa mental polaridade das moleculas Tomame y dame fuerzas para seguir tu camino
Tomame y dame fuerzas para seguir tu camino Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Elementos intercalados ejemplos
Elementos intercalados ejemplos Dibujo de estructuras naturales
Dibujo de estructuras naturales Dot respuesta
Dot respuesta Anfigenos
Anfigenos Tensile strength of spaghetti
Tensile strength of spaghetti Fuerzas colineales
Fuerzas colineales Fuerzas internas
Fuerzas internas Sistema de fuerzas concurrentes
Sistema de fuerzas concurrentes