Las fuerzas intermoleculares y los lquidos y slidos




















- Slides: 30

Las fuerzas intermoleculares y los líquidos y sólidos Unidad 5 y 6 Copyright © The Mc. Graw-Hill Companies, Inc. Química, R. Chang, Séptima Edición.

Una fase es una parte homogénea de un sistema y aunque está en contacto con otras partes del mismo, está separada de esas partes por un límite bien definido. 2 fases Fase sólida - hielo Fase líquida - agua Propiedades características de gases, líquidos y sólidos Estado de la materia Volumen/forma Densidad Gas Asume la forma y el volumen del recipiente que lo contiene Líquido Tiene volumen definido pero asume Alta la forma del recipiente que lo contiene Tiene forma y volumen definidos Alta Sólido Baja Compresibilidad Muy compresible Movimiento molecular Muy libre Ligeramente compresible Se deslizan entre sí libremente Prácticamente incompresible Vibraciones alrededor de posiciones fijas 11. 1

Fuerzas intermoleculares son fuerzas de atracción entre las moléculas. Fuerzas intramoleculares mantienen juntos a los átomos de una molécula. Fuerzas intermoleculares contra fuerzas intramoleculares • 41 k. J de energía para evaporar 1 mol de agua (inter) • 930 k. J de energía para romper los dos enlaces O-H en 1 mol de moléculas de agua (intra) “Magnitud” de las fuerzas intermoleculares Las fuerzas intermoleculares suelen ser más débiles que las intramoleculares. puntos de ebullición puntos de fusión DHvap DHfus DHsub 11. 2

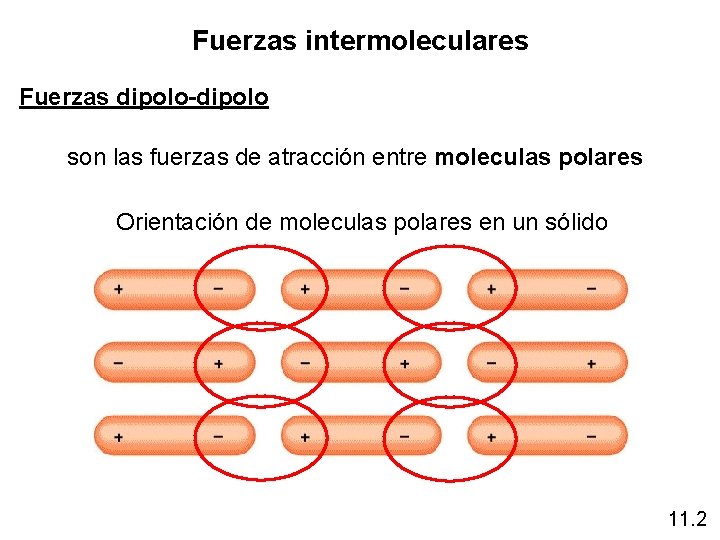
Fuerzas intermoleculares Fuerzas dipolo-dipolo son las fuerzas de atracción entre moleculas polares Orientación de moleculas polares en un sólido 11. 2

Fuerzas intermoleculares Fuerzas ion-dipolo son las fuerzas de atracción entre ion y una molécula polar Interacción ion-dipolo 11. 2

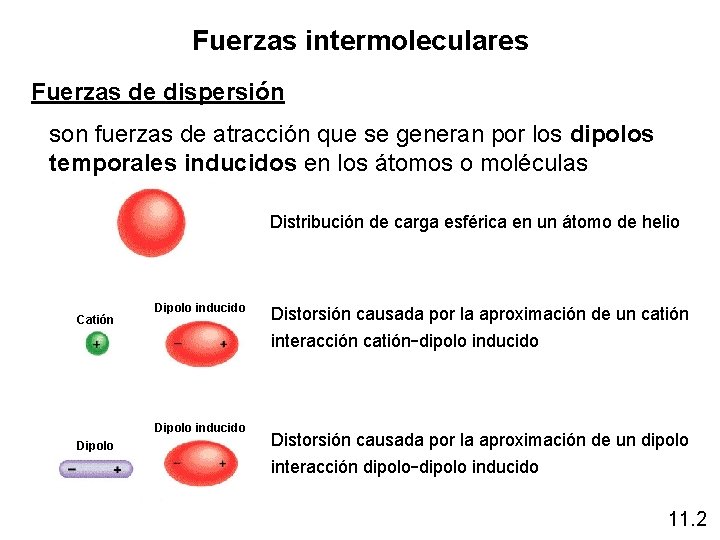
Fuerzas intermoleculares Fuerzas de dispersión son fuerzas de atracción que se generan por los dipolos temporales inducidos en los átomos o moléculas Distribución de carga esférica en un átomo de helio Catión Dipolo inducido interacción catión-dipolo inducido Dipolo Distorsión causada por la aproximación de un catión Distorsión causada por la aproximación de un dipolo interacción dipolo-dipolo inducido 11. 2

Fuerzas intermoleculares Fuerzas de dispersión Polarizabilidad qué tan fácil se distorsiona la distribución electrónica del átomo (o de las moléculas) Polarizabilidad incrementa a medida que: • aumenta el número de electrones, • se hace mas difusa la nube electrónica. Las fuerzas de dispersión usualmente aumentan con la masa molar. Puntos de fusión de compuestos no polares similares Compuestos Puntos de fusión (°C) 11. 2

¿Qué tipo(s) de fuerzas intermoleculares existen entre cada una de las siguientes moléculas? HBr es una molécula polar: fuerzas dipolo-dipolo, además de las fuerzas de dispersión entre moléculas de HBr. CH 4 es no polar: fuerzas de dispersión. SO 2 O SO 2 es una molécula polar: fuerzas dipolo-dipolo, además de las fuerzas de dispersión entre moléculas de SO 2. 11. 2

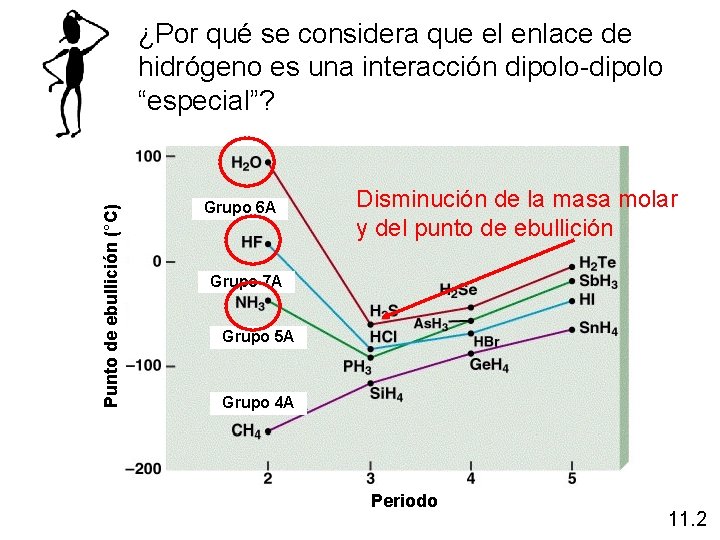
Fuerzas intermoleculares El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo entre el átomo de hidrógeno de un enlace polar, como N-H, O-H o F-H y un átomo electronegativo de O, N o F. A H…B H…A A A y B representan N, O o F o 11. 2

Punto de ebullición (°C) ¿Por qué se considera que el enlace de hidrógeno es una interacción dipolo-dipolo “especial”? Grupo 6 A Disminución de la masa molar y del punto de ebullición Grupo 7 A Grupo 5 A Grupo 4 A Periodo 11. 2

Propiedades de los líquidos Tensión superficial es la cantidad de energía requerida para estirar o aumentar la superficie de un líquido por unidad de área. Fuerzas intermoleculares fuertes Alta tensión superficial 11. 3

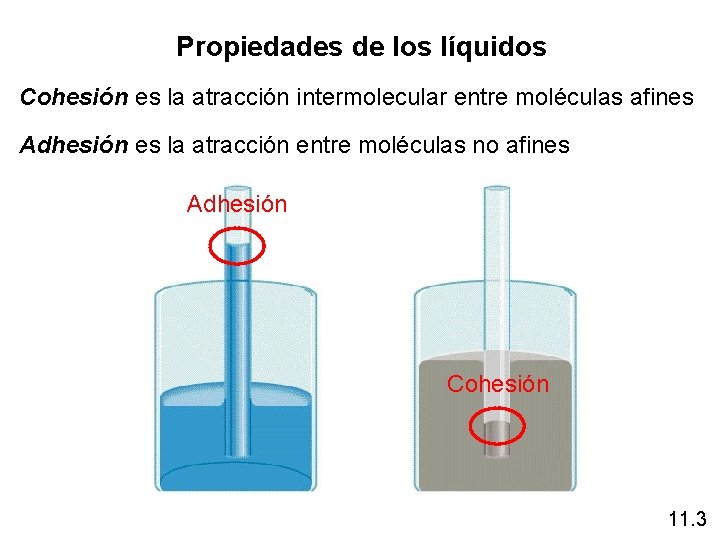
Propiedades de los líquidos Cohesión es la atracción intermolecular entre moléculas afines Adhesión es la atracción entre moléculas no afines Adhesión Cohesión 11. 3

Propiedades de los líquidos Viscosidad es una medida de la resistencia de un fluido a fluir. Fuerzas intermoleculares fuertes Viscosidad alta Viscosidad de algunos líquidos comunes a 20 °C Líquido Viscosidad (N s/m 2)* Acetona (C 3 H 6 O) Benceno (C 6 H 6) Sangre Tetracloruro de carbono (CCl 4) Etanol (C 2 H 5 OH) Éter dietílico (C 2 H 5 OC 2 H 5) Glicerol (C 3 H 8 O 3) Mercurio (Hg) Agua (H 2 O) * Las unidades en el SI de la viscosidad son el newton-segundo por metro cuadrado. 11. 3

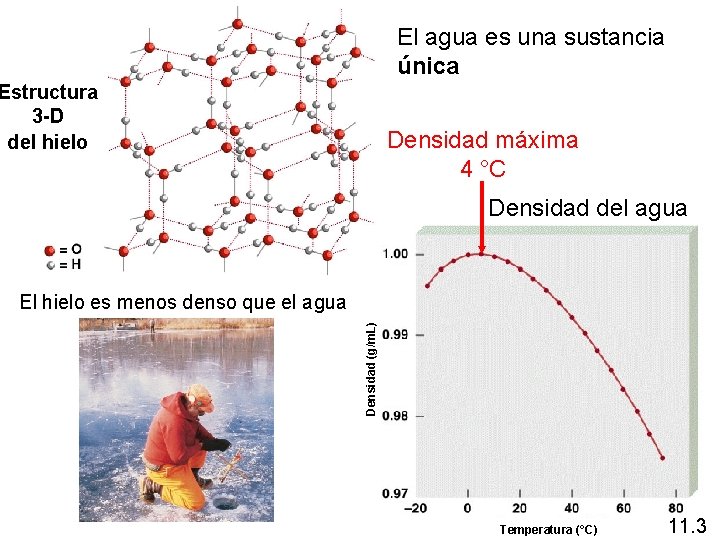
El agua es una sustancia única Estructura 3 -D del hielo Densidad máxima 4 °C Densidad del agua Densidad (g/m. L) El hielo es menos denso que el agua Temperatura (°C) 11. 3

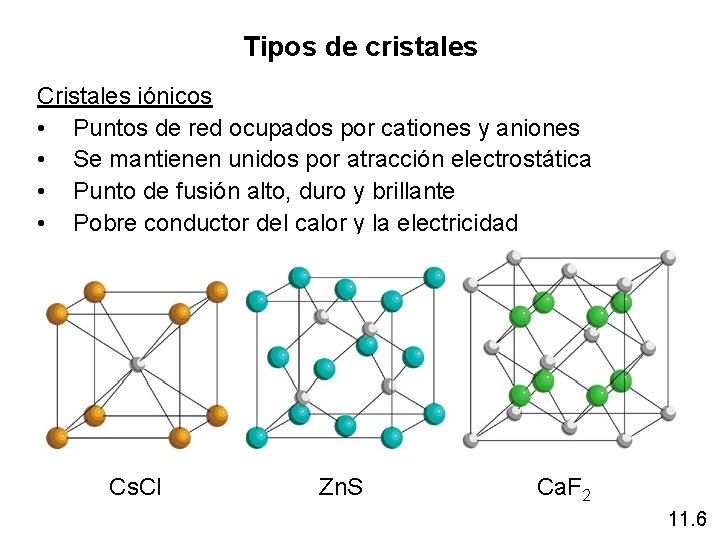
Tipos de cristales Cristales iónicos • Puntos de red ocupados por cationes y aniones • Se mantienen unidos por atracción electrostática • Punto de fusión alto, duro y brillante • Pobre conductor del calor y la electricidad Cs. Cl Zn. S Ca. F 2 11. 6

Tipos de cristales Cristales covalentes • Puntos de red ocupados por átomos • Se mantienen unidos por enlaces covalentes • Duro, punto de fusión alto • Pobre conductor del calor y la electricidad átomos de carbono diamante grafito 11. 6

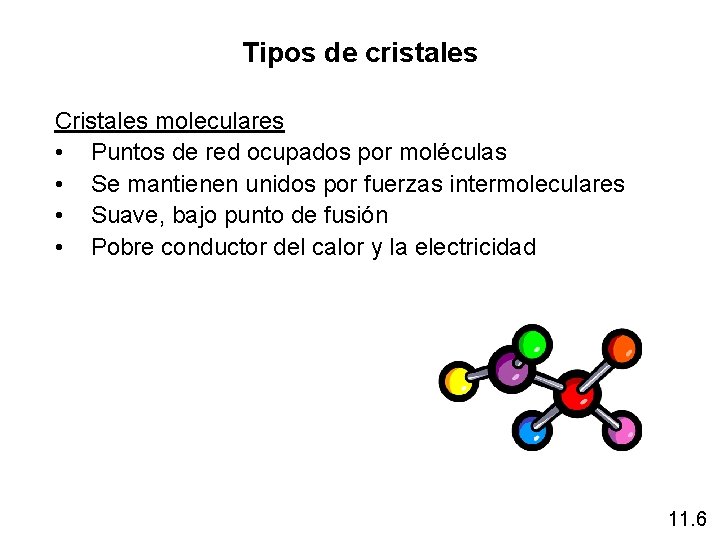
Tipos de cristales Cristales moleculares • Puntos de red ocupados por moléculas • Se mantienen unidos por fuerzas intermoleculares • Suave, bajo punto de fusión • Pobre conductor del calor y la electricidad 11. 6

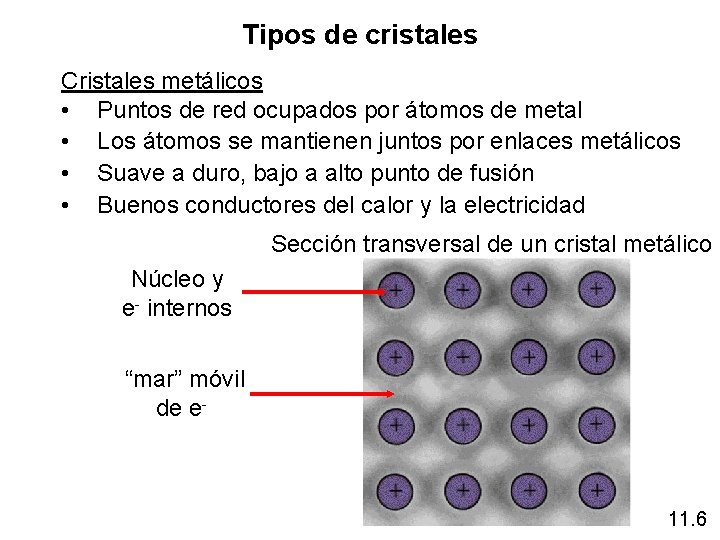
Tipos de cristales Cristales metálicos • Puntos de red ocupados por átomos de metal • Los átomos se mantienen juntos por enlaces metálicos • Suave a duro, bajo a alto punto de fusión • Buenos conductores del calor y la electricidad Sección transversal de un cristal metálico Núcleo y e- internos “mar” móvil de e- 11. 6

Tipos de cristales y propiedades generales Tipo de cristal Fuerza(s) que mantiene(n) las celdas unidas Propiedades generales Ejemplos Iónico Atracción electrostática Duro, brillante, alto punto de fusión, pobre Na. Cl, Li. F, Mg. O, Ca. CO 3 conductor del calor y la electricidad Covalente Enlace covalente Duro, alto punto de fusión, pobre conductor del calor y la electricidad Molecular* Fuerzas de dispersión, fuerzas dipolo-dipolo, enlaces de H Suave, bajo punto de fusión, pobre Ar, CO 2, I 2, H 2 O, C 12 H 12 O 11 conductor del calor y la electricidad (sacarosa) Metálico Enlace metálico Suave a duro, bajo a alto punto de fusión, Todos los elementos metálicos; buen conductor del calor y la electricidad ejemplo, Na, Mg, Fe, Cu C(diamante), †Si. CO 2 (cuarzo) * Se incluyen en esta categoría los cristales formados por átomos individuales. † El diamante es un buen conductor térmico. 11. 6

Cambios de fase Número de moléculas E 1 Energía cinética E Temperatura Condensación Número de moléculas Evaporación Gas Líquido E 1 Energía cinética E T 2 > T 1 Menor orden Sólido Mayor orden 11. 8

La presión de vapor de equilibrio es la presión de vapor medida cuando un equilibrio dinámico existe entre la condensación y la evaporación H 2 O (l) H 2 O (g) Equilibrio dinámico = Velocidad de evaporación Velocidad de condensación Equilibrio dinámico establecido Velocidad de evaporación Velocidad de condensación Tiempo 11. 8

Aparato para medir la presión de vapor de un líquido Vacío Espacio vacío Líquido Antes de la evaporación Líquido En el equilibrio 11. 8

Calor molar de vaporización (DHvap) es la energía requrida para vaporizar 1 mol de un líquido. Ecuación de Clausius-Clapeyron ln P = - DHvap RT P = presión de vapor (equilibrio) + C T = temperatura (K) R = constante de los gases (8. 314 J/K • mol) Presión de vapor (atm) Presión de vapor vs. Temperatura Éter dietílico Agua Temperatura (°C) Mercurio 11. 8

El punto de ebullición es la temperatura a la cual la presión de vapor (equilibrio) de un líquido es igual a la presión externa. El punto de ebullición normal es la temperatura a la cual el líquido ebulle cuando la presión externa es de 1 atm. Calor molar de vaporización para líquidos seleccionados Substancia Punto de ebullición* DHvap (k. J/mol) Argón (Ar) Benceno (C 6 H 6) Etanol (C 2 H 5 OH) Éter dietílico (C 2 H 5 OC 2 H 5) Mercurio (Hg) Metano (CH 4) Agua (H 2 O) * En °C y medido a 1 atm 11. 8

Cambios de fase Gas Congelación Líquido Fusión El punto de fusión de un sólido o el punto de congelación de un líquido es la temperatura a la cual las fases sólida y líquida coexisten en el equilibrio Temperatura H 2 O (s) H 2 O (l) Sólido 11. 8

Calor molar de fusión (DHfus) es la energía requerida para fundir 1 mol de una sustancia sólida. Calor molar de fusión para líquidos seleccionados Substancia Punto de ebullición* DHfus (k. J/mol) Argón (Ar) Benceno (C 6 H 6) Etanol (C 2 H 5 OH) Éter dietílico (C 2 H 5 OC 2 H 5) Mercurio (Hg) Metano (CH 4) Agua (H 2 O) * En °C y medido a 1 atm 11. 8

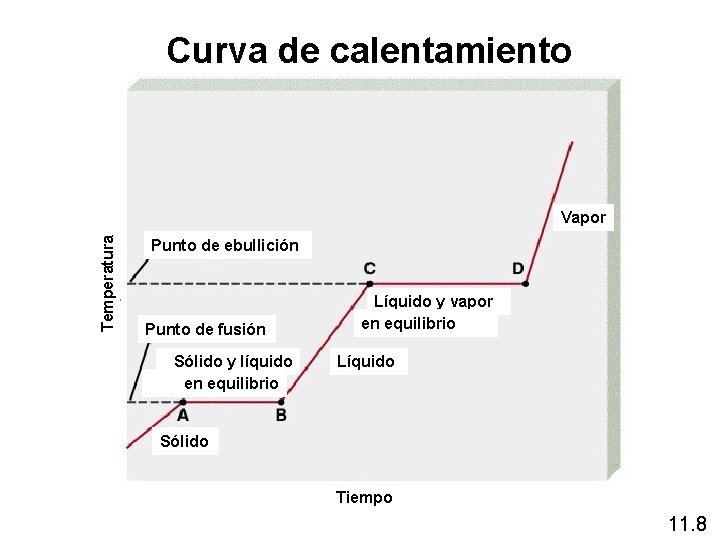
Curva de calentamiento Temperatura Vapor Punto de ebullición Punto de fusión Sólido y líquido en equilibrio Líquido y vapor en equilibrio Líquido Sólido Tiempo 11. 8

Cambios de fase Gas Líquido Deposición Sublimación Calor molar de sublimación (DHsub) es la energía requerida para sublimar 1 mol de un sólido. Temperatura H 2 O (s) H 2 O (g) DHsub = DHfus + DHvap (Ley de Hess) Sólido 11. 8

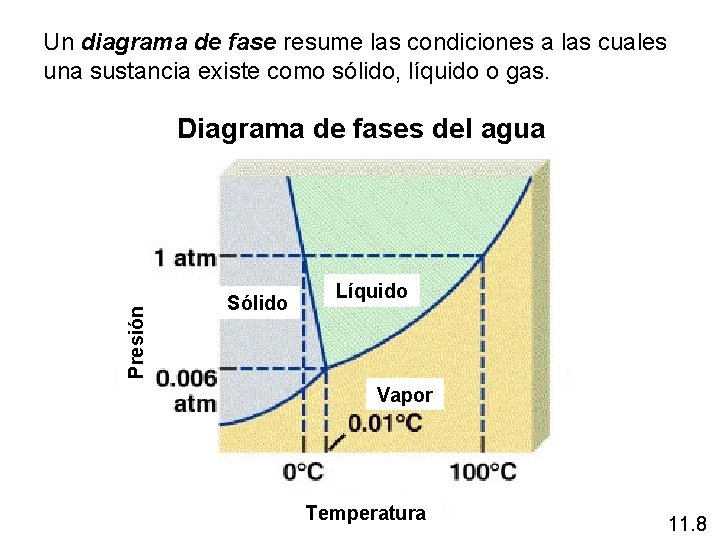
Un diagrama de fase resume las condiciones a las cuales una sustancia existe como sólido, líquido o gas. Presión Diagrama de fases del agua Sólido Líquido Vapor Temperatura 11. 8

Diagrama de fases del dióxido de carbono Líquido Presión Sólido Vapor Temperatura 11. 8
 Clases de fuerzas intermoleculares
Clases de fuerzas intermoleculares Tipo de hibridacion
Tipo de hibridacion Momento dipolo dipolo
Momento dipolo dipolo Ch2fcooh nombre
Ch2fcooh nombre Dipolo instantâneo
Dipolo instantâneo Argon punto de fusion y ebullicion
Argon punto de fusion y ebullicion Lquidos
Lquidos Lquidos
Lquidos Contacto a distancia
Contacto a distancia Residuo solido
Residuo solido Residuos slidos
Residuos slidos Slidos
Slidos Qué son las fuerzas intramoleculares
Qué son las fuerzas intramoleculares Mapa mental polaridade das moleculas
Mapa mental polaridade das moleculas Misiones se hace con las manos de los que dan
Misiones se hace con las manos de los que dan Fuerzas internas del mercado
Fuerzas internas del mercado Fisica 3 eso fuerzas
Fisica 3 eso fuerzas 10 ejemplos fuerzas de van der waals ejemplos
10 ejemplos fuerzas de van der waals ejemplos Ley orgánica de las fuerzas armadas 2013
Ley orgánica de las fuerzas armadas 2013 Dibujos las fuerzas y sus efectos
Dibujos las fuerzas y sus efectos Punto de torque
Punto de torque Preguntas sobre las 5 fuerzas de porter
Preguntas sobre las 5 fuerzas de porter Modelo de las 5 fuerzas de porter
Modelo de las 5 fuerzas de porter Teorema de las fuerzas vivas
Teorema de las fuerzas vivas Definicion fuerza elastica
Definicion fuerza elastica Modelo de las 5 fuerzas de porter
Modelo de las 5 fuerzas de porter Que son las fuerzas de fricción
Que son las fuerzas de fricción Universidad de las fuerzas armadas espe
Universidad de las fuerzas armadas espe Lenguas de hombres
Lenguas de hombres Joel 2 29-32
Joel 2 29-32 Un una unos
Un una unos