TEMA 1 ESTRUCTURA Y PROPIEDADES 1 Introduccin La


























































- Slides: 152

TEMA 1 ESTRUCTURA Y PROPIEDADES

1. - Introducción

La Química Orgánica es la parte de la química que estudia los Compuestos de Carbono Más del 95% de las sustancias químicas conocidas son compuestos del carbono y más de la mitad de los químicos actuales en el mundo se denominan a sí mismos químicos orgánicos. Todos los compuestos responsables de la vida (ácidos nucleicos, proteínas, enzimas, hormonas, azúcares, lípidos, vitaminas, etc. ) son sustancias orgánicas. La industria química (fármacos, polímeros, pesticidas, herbicidas, etc. ) juega un papel muy importante en la economía mundial e incide en muchos aspectos de nuestra vida diaria con sus productos.

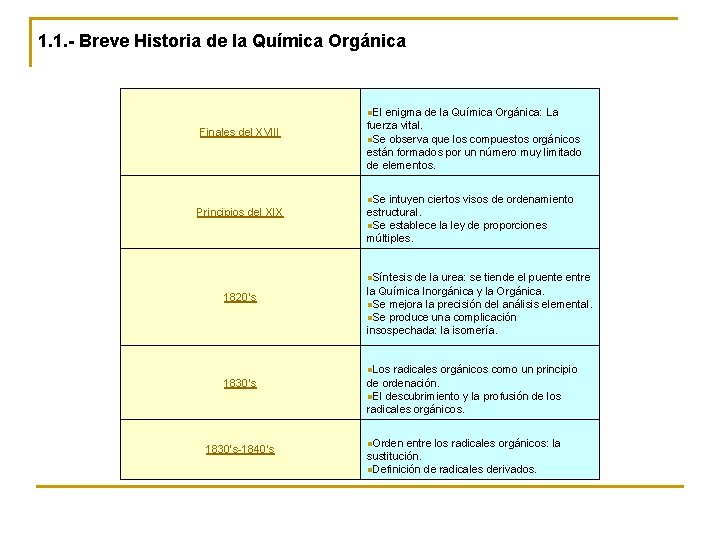
1. 1. - Breve Historia de la Química Orgánica n. El enigma de la Química Orgánica: La Finales del XVIII fuerza vital. n. Se observa que los compuestos orgánicos están formados por un número muy limitado de elementos. n. Se intuyen ciertos visos de ordenamiento Principios del XIX estructural. n. Se establece la ley de proporciones múltiples. n. Síntesis de la urea: se tiende el puente entre 1820’s la Química Inorgánica y la Orgánica. n. Se mejora la precisión del análisis elemental. n. Se produce una complicación insospechada: la isomería. n. Los radicales orgánicos como un principio 1830’s-1840’s de ordenación. n. El descubrimiento y la profusión de los radicales orgánicos. n. Orden entre los radicales orgánicos: la sustitución. n. Definición de radicales derivados.

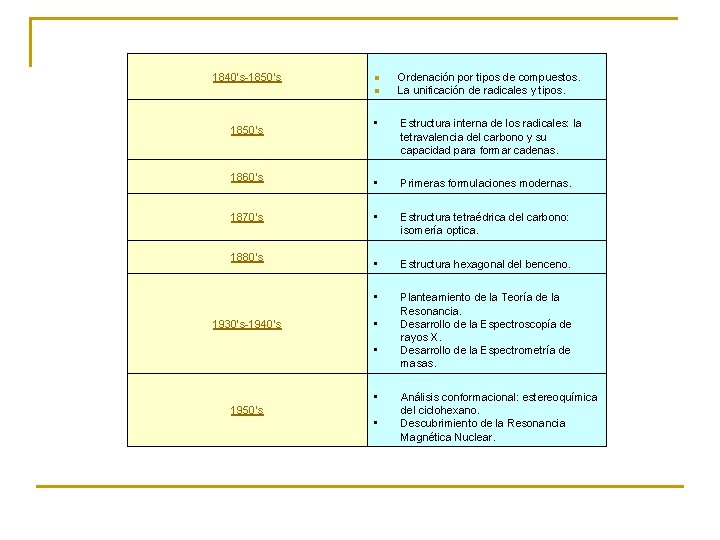
1840’s-1850’s n Ordenación por tipos de compuestos. n La unificación de radicales y tipos. 1850’s 1860’s 1870’s 1880’s 1930’s-1940’s • Estructura interna de los radicales: la tetravalencia del carbono y su capacidad para formar cadenas. • Primeras formulaciones modernas. • Estructura tetraédrica del carbono: isomería optica. • Estructura hexagonal del benceno. • Planteamiento de la Teoría de la Resonancia. Desarrollo de la Espectroscopía de rayos X. Desarrollo de la Espectrometría de masas. • • • 1950’s • Análisis conformacional: estereoquímica del ciclohexano. Descubrimiento de la Resonancia Magnética Nuclear.

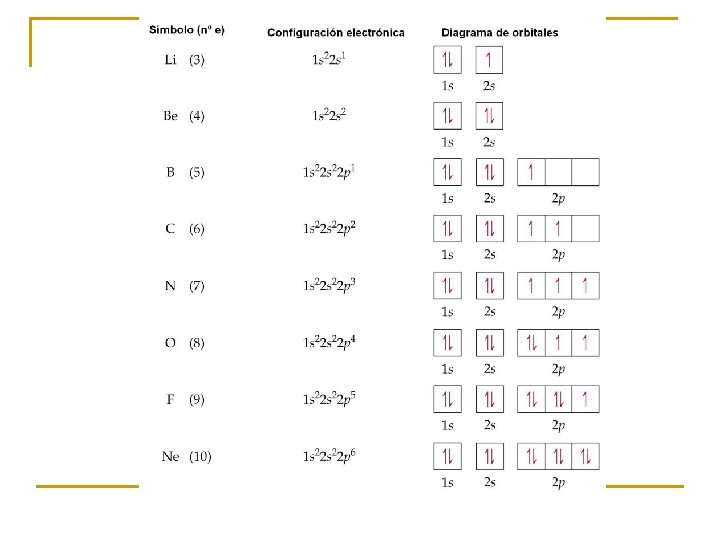
2. - Estructura de los átomos

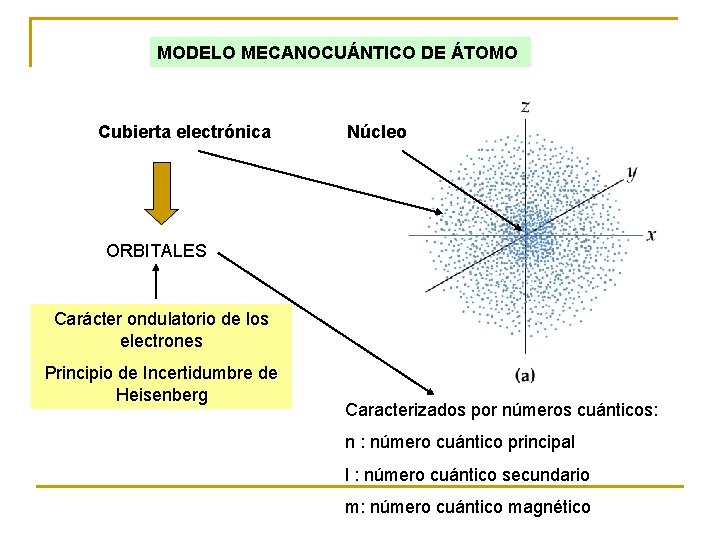
MODELO MECANOCUÁNTICO DE ÁTOMO Cubierta electrónica Núcleo ORBITALES Carácter ondulatorio de los electrones Principio de Incertidumbre de Heisenberg Caracterizados por números cuánticos: n : número cuántico principal l : número cuántico secundario m: número cuántico magnético

NIVELES Y SUBNIVELES EN LA CUBIERTA ELECTRÓNICA

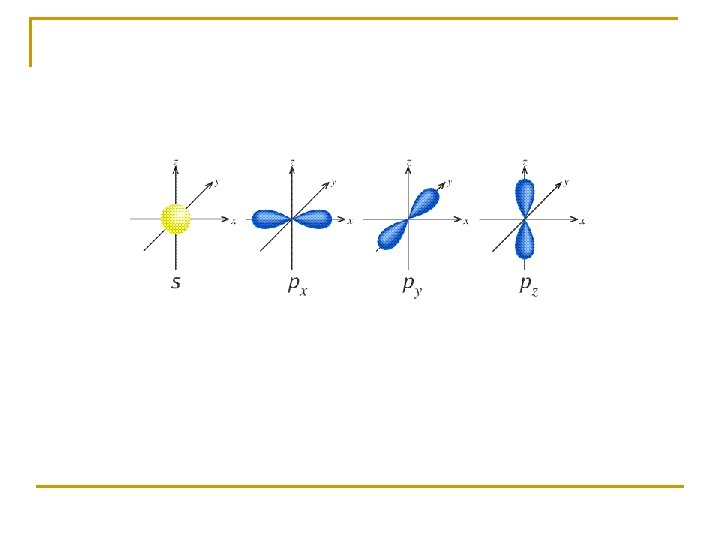
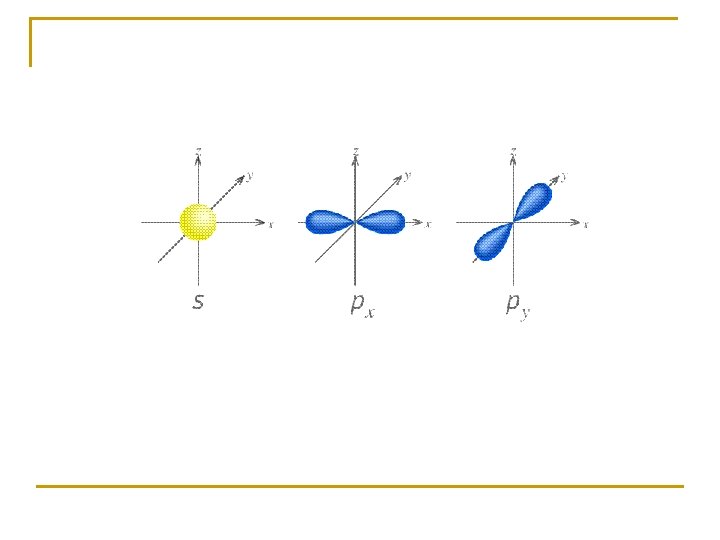
ORBITALES 1 s y 2 s ORBITAL s

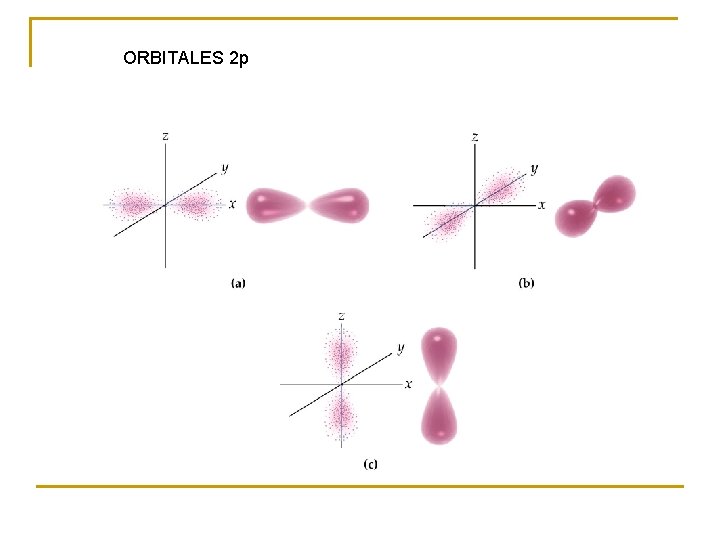
ORBITALES 2 p

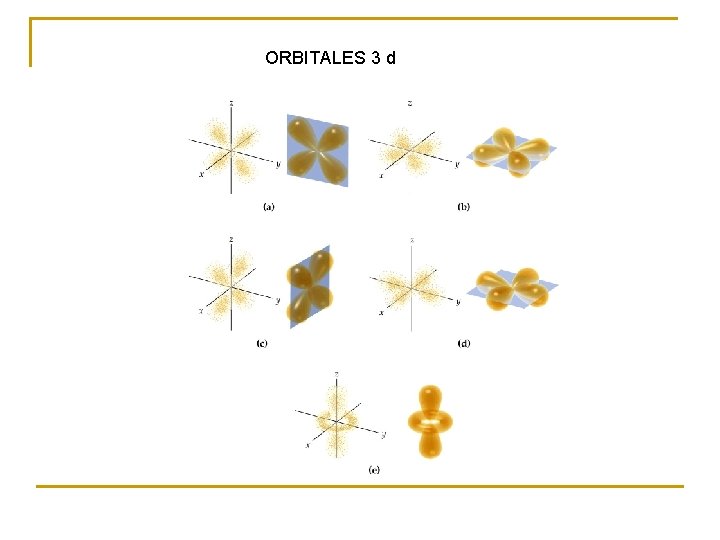
ORBITALES 3 d

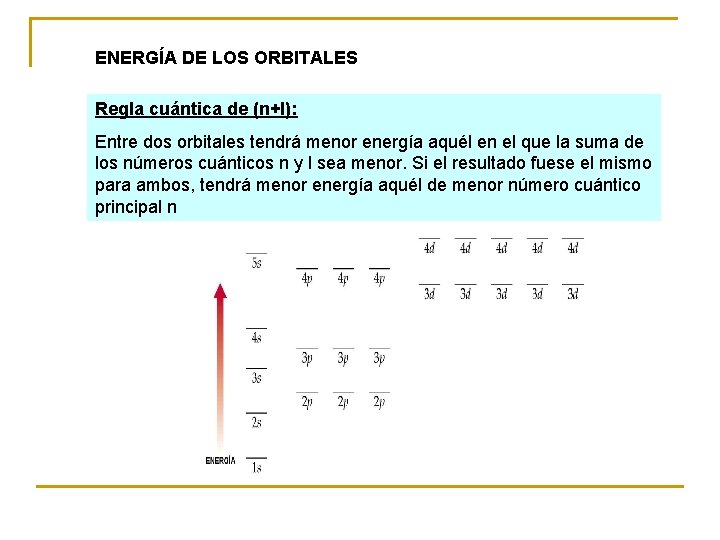
ENERGÍA DE LOS ORBITALES Regla cuántica de (n+l): Entre dos orbitales tendrá menor energía aquél en el que la suma de los números cuánticos n y l sea menor. Si el resultado fuese el mismo para ambos, tendrá menor energía aquél de menor número cuántico principal n

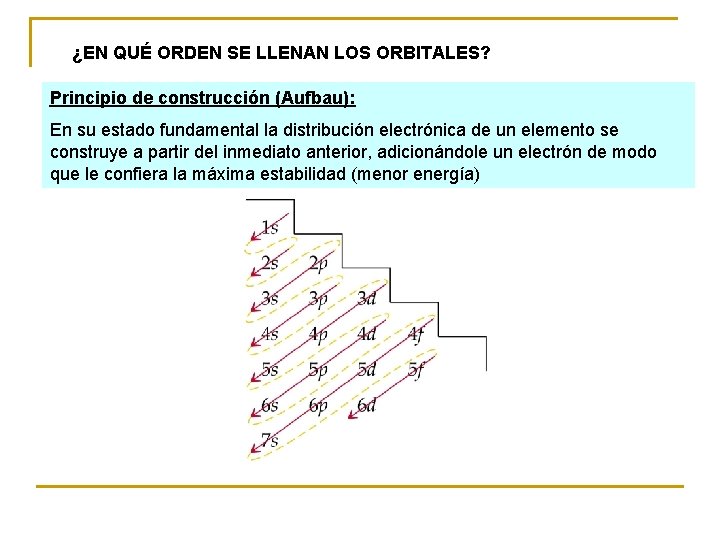
¿EN QUÉ ORDEN SE LLENAN LOS ORBITALES? Principio de construcción (Aufbau): En su estado fundamental la distribución electrónica de un elemento se construye a partir del inmediato anterior, adicionándole un electrón de modo que le confiera la máxima estabilidad (menor energía)

¿CUÁNTOS ELECTRONES CABEN EN UN ORBITAL? Principio de exclusión de Pauli (1925): En un determinado sistema cuántico (átomo o molécula) no pueden existir dos electrones con los cuatro números cuánticos idénticos Por tanto, en un orbital sólo caben dos electrones que compartirían tres números cuánticos y se diferenciarían en el número cuántico de spin (s)

¿CÓMO SE LLENAN LOS GRUPOS DE ORBITALES DE IGUAL ENERGÍA? Regla de la máxima multiplicidad de Hund: Cuando una serie de orbitales de igual energía (p, d , f) se están llenando con electrones, éstos permanecerán desapareados mientras sea posible, manteniendo los espines paralelos


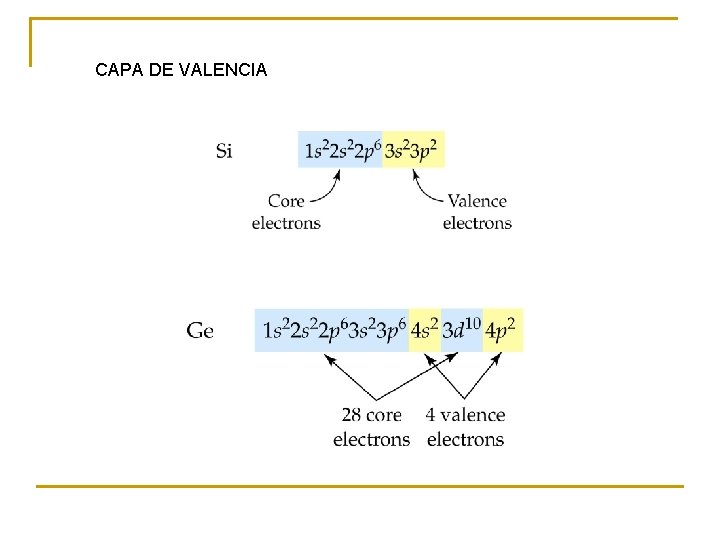
CAPA DE VALENCIA

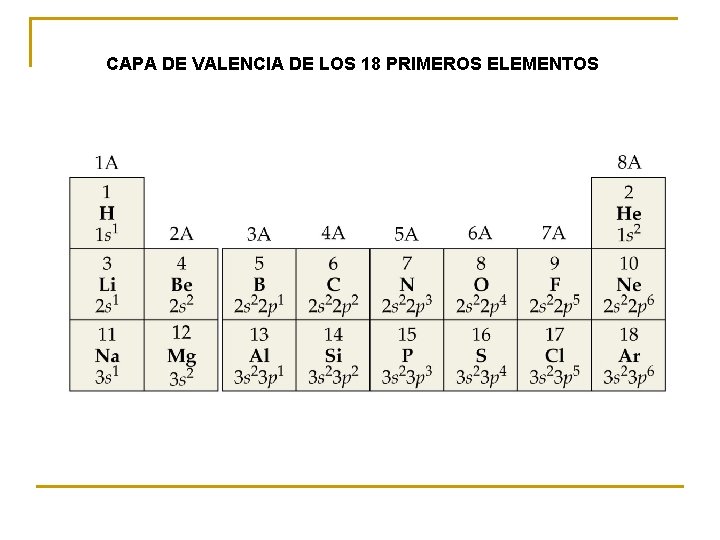
CAPA DE VALENCIA DE LOS 18 PRIMEROS ELEMENTOS

Grupos del Sistema Periódico

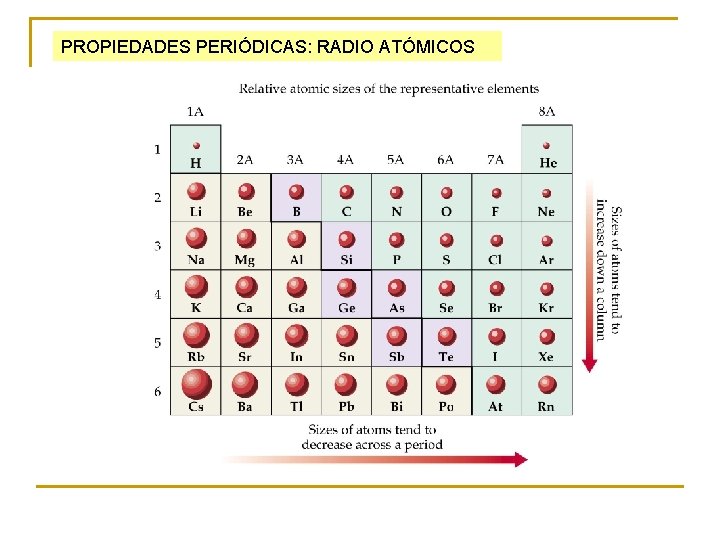
PROPIEDADES PERIÓDICAS: RADIO ATÓMICOS

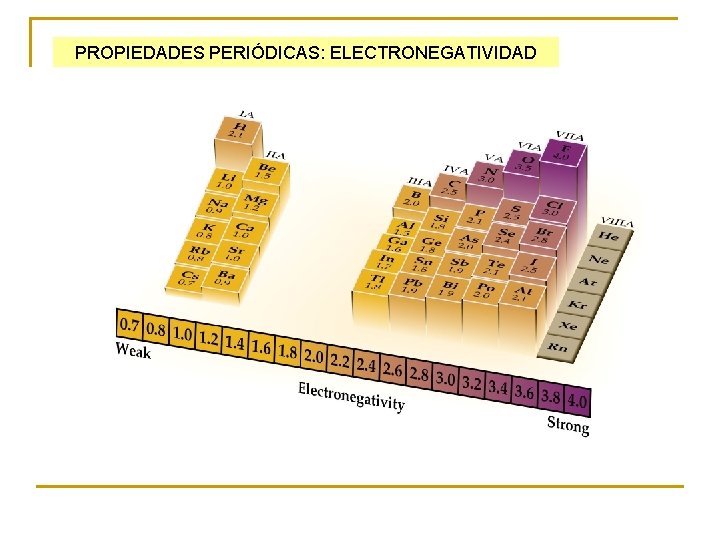
PROPIEDADES PERIÓDICAS: ELECTRONEGATIVIDAD

3. - Enlace y moléculas

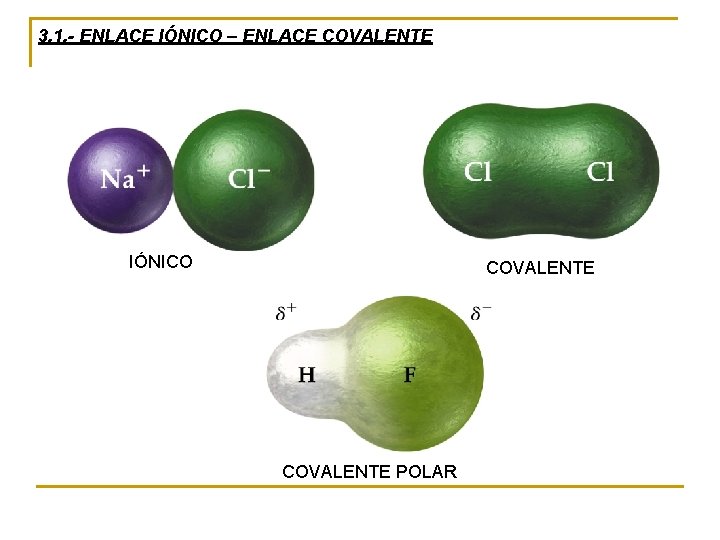
3. 1. - ENLACE IÓNICO – ENLACE COVALENTE IÓNICO COVALENTE POLAR

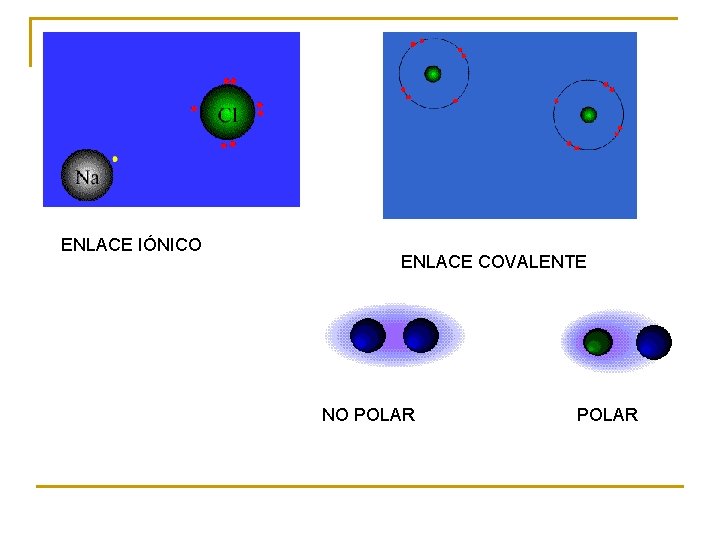
ENLACE IÓNICO ENLACE COVALENTE NO POLAR

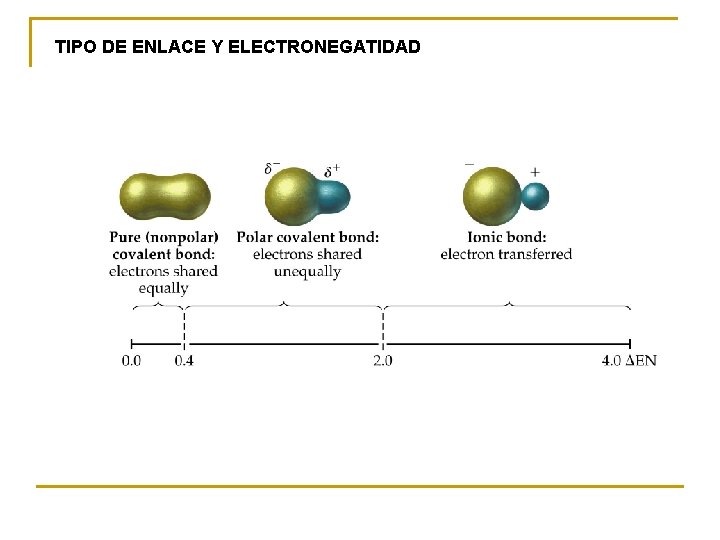
TIPO DE ENLACE Y ELECTRONEGATIDAD

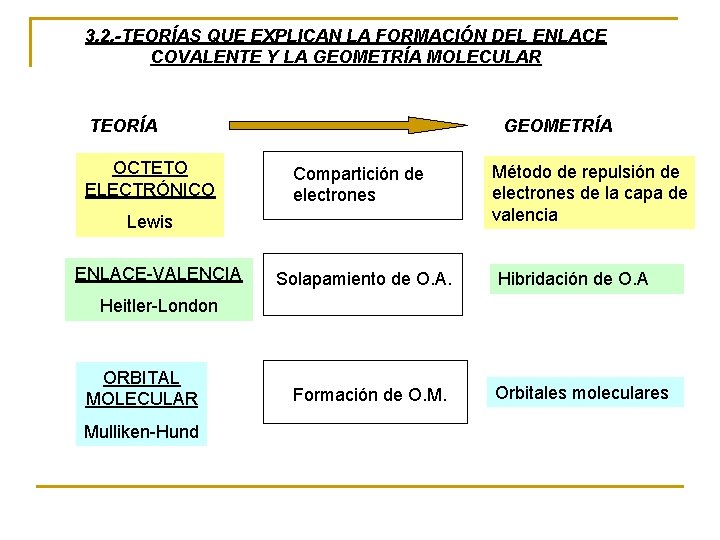
3. 2. -TEORÍAS QUE EXPLICAN LA FORMACIÓN DEL ENLACE COVALENTE Y LA GEOMETRÍA MOLECULAR TEORÍA OCTETO ELECTRÓNICO GEOMETRÍA Compartición de electrones Lewis ENLACE-VALENCIA Solapamiento de O. A. Método de repulsión de electrones de la capa de valencia Hibridación de O. A Heitler-London ORBITAL MOLECULAR Mulliken-Hund Formación de O. M. Orbitales moleculares

3. 3. -TEORÍA DE LEWIS Átomos Los átomos forman moléculas porque compartiendo electrones alcanzan el octeto electrónico Moléculas Diatómicas


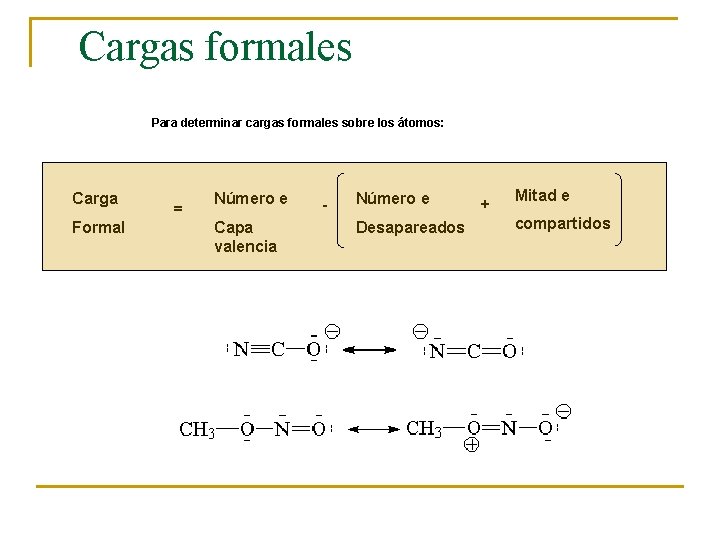
En el establecimiento de las estructuras de Lewis es muy importante tener en cuenta tres aspectos 1. - Asignar cargas formales a los átomos 2. - Valorar la existencia de formas resonantes 3. - Hay átomos que no cumplen la regla del octeto

Cargas formales Para determinar cargas formales sobre los átomos: Carga Formal = Número e Capa valencia - Número e Desapareados + Mitad e compartidos


Ejercicio: Usar el concepto de carga formal para determinar la estructura de Lewis más estable para a) CO 2 b) N 2 O a) Diferentes estructuras de Lewis que satisfacen la regla del octeto Para cada una de ellas se puede calcular la carga formal de cada átomo: La carga formal se minimiza cuando el átomo de carbono se coloca en el centro y establece dobles enlaces con los átomos de oxígeno

b) Para el N 2 O las posibles estructuras de Lewis con cargas formales son las siguientes: Se comprueba que las estructuras a) y d) son igual de buenas en cuanto a las cargas formales, sin embargo, habrá que convenir que la más importante (contribuye más al híbrido de resonancia) es la d) porque en ella la carga negativa está situada sobre el átomo de oxígeno, elemento más electronegativo que el nitrógeno.

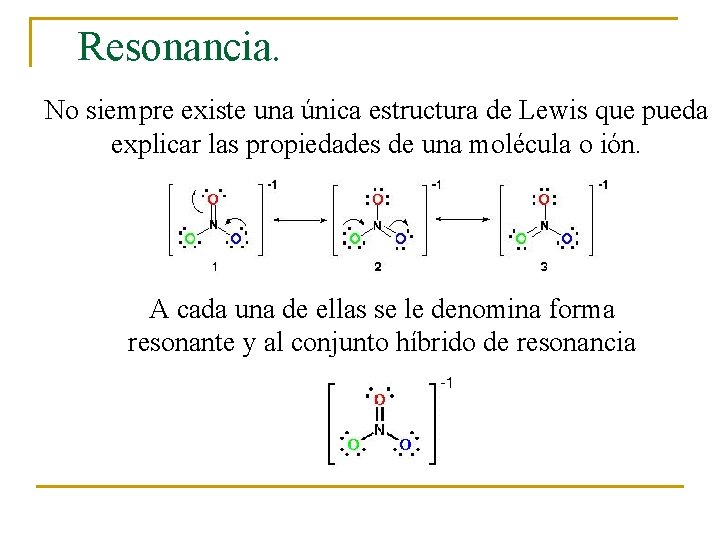
Resonancia. No siempre existe una única estructura de Lewis que pueda explicar las propiedades de una molécula o ión. A cada una de ellas se le denomina forma resonante y al conjunto híbrido de resonancia

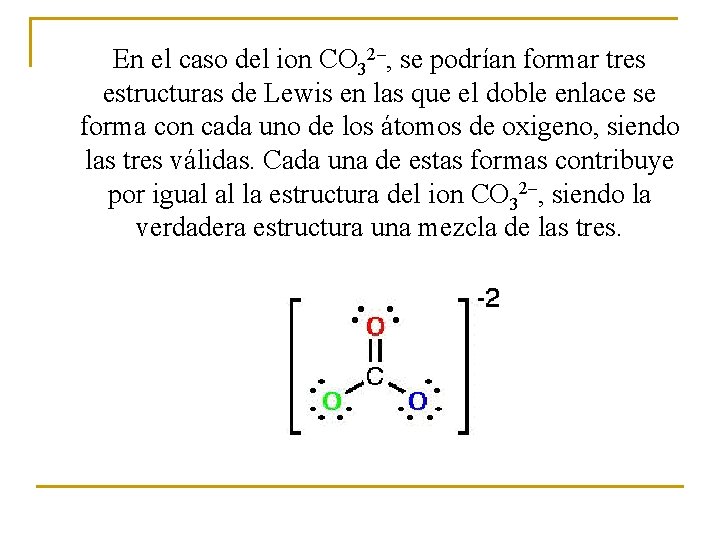
En el caso del ion CO 32–, se podrían formar tres estructuras de Lewis en las que el doble enlace se forma con cada uno de los átomos de oxigeno, siendo las tres válidas. Cada una de estas formas contribuye por igual al la estructura del ion CO 32–, siendo la verdadera estructura una mezcla de las tres.

Condiciones para escribir formas resonantes: 1. Para pasar de una forma resonante a otra solamente puedo mover electrones, nunca átomos. 2. Todas las estructuras resonantes que yo escriba deben ser estructuras de Lewis válidas. 3. Las estructuras resonantes deben poseer el mismo número de electrones desapareados. 4. Las estructuras resonantes más importantes son las de menor energía potencial.

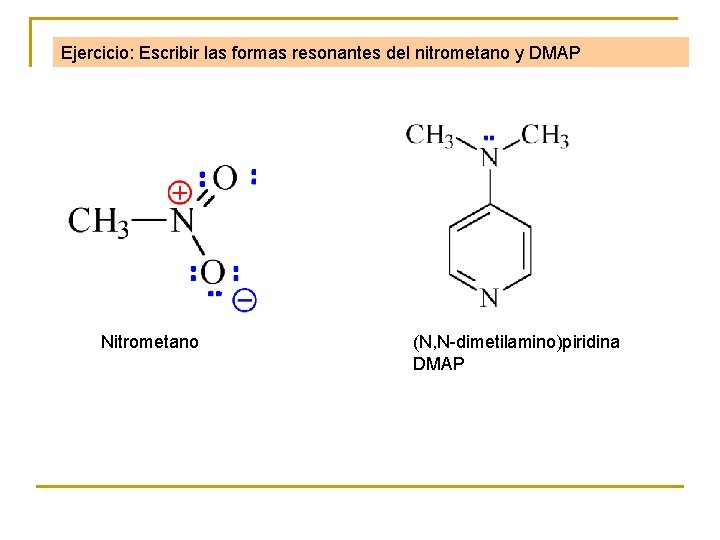
Ejercicio: Escribir las formas resonantes del nitrometano y DMAP Nitrometano (N, N-dimetilamino)piridina DMAP

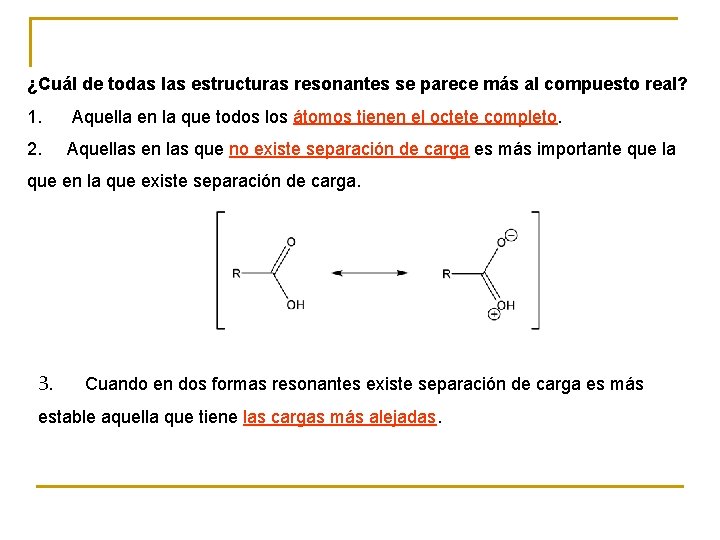
¿Cuál de todas las estructuras resonantes se parece más al compuesto real? 1. Aquella en la que todos los átomos tienen el octete completo. 2. Aquellas en las que no existe separación de carga es más importante que la que en la que existe separación de carga. 3. Cuando en dos formas resonantes existe separación de carga es más estable aquella que tiene las cargas más alejadas.

4. Las estructuras de resonancia que lleven carga negativa sobre un átomo electronegativo contribuye más que cuando esa carga va sobre otro átomo. 5. Si hay dos formas resonantes iguales la resonancia será más importante. Cuando una forma resonante es muchísimo más estable que las demás la resonancia no existe y la molécula real se parece mucho a esta forma. Cuando todas las formas resonantes son importantes, entonces la molécula real sí es un híbrido de todas las formas resonantes.

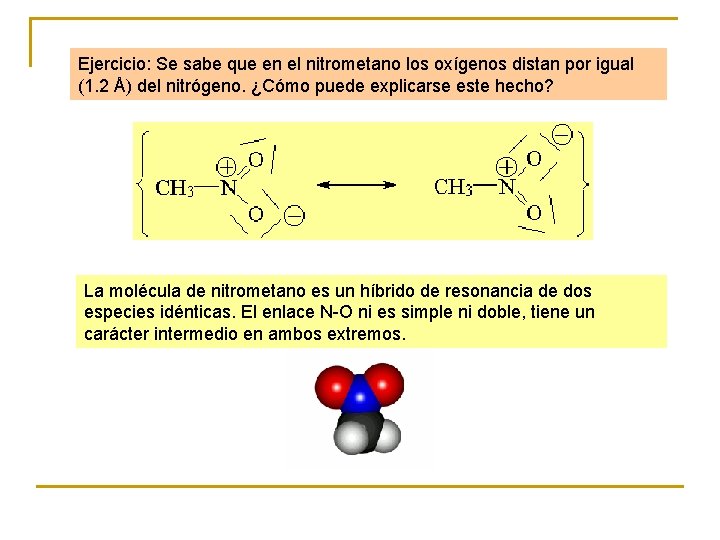
Ejercicio: Se sabe que en el nitrometano los oxígenos distan por igual (1. 2 Å) del nitrógeno. ¿Cómo puede explicarse este hecho? La molécula de nitrometano es un híbrido de resonancia de dos especies idénticas. El enlace N-O ni es simple ni doble, tiene un carácter intermedio en ambos extremos.

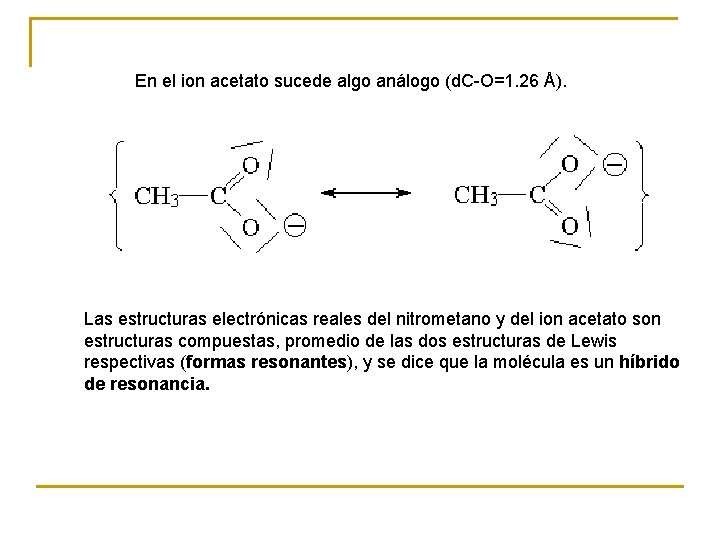
En el ion acetato sucede algo análogo (d. C-O=1. 26 Å). Las estructuras electrónicas reales del nitrometano y del ion acetato son estructuras compuestas, promedio de las dos estructuras de Lewis respectivas (formas resonantes), y se dice que la molécula es un híbrido de resonancia.

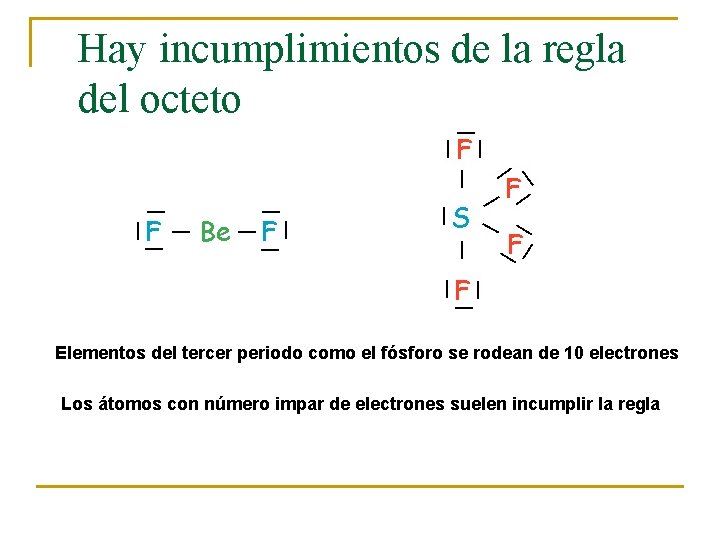
Hay incumplimientos de la regla del octeto Elementos del tercer periodo como el fósforo se rodean de 10 electrones Los átomos con número impar de electrones suelen incumplir la regla

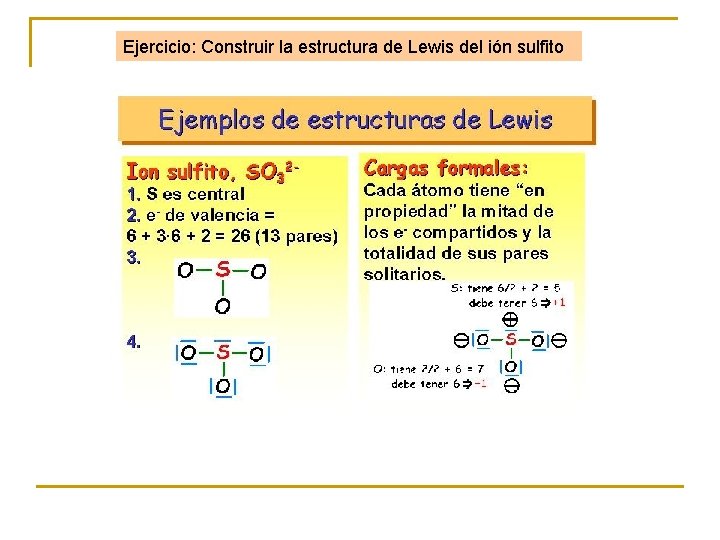
Ejercicio: Construir la estructura de Lewis del ión sulfito

Ejercicio: Construir la estructura de Lewis del dióxido de carbono

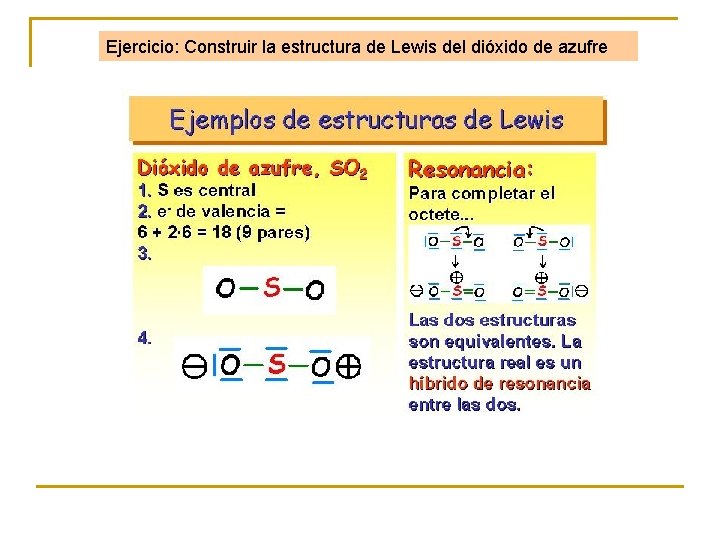
Ejercicio: Construir la estructura de Lewis del dióxido de azufre

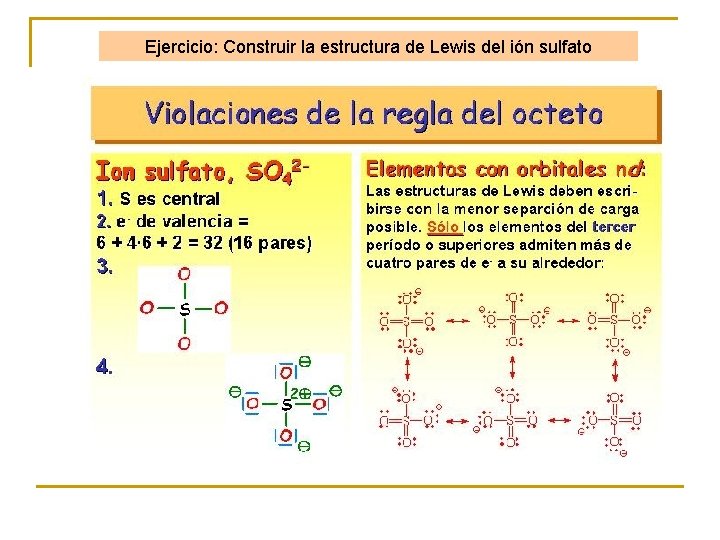
Ejercicio: Construir la estructura de Lewis del ión sulfato

Ejercicio: Construir la estructura de Lewis del trifluoruro de boro

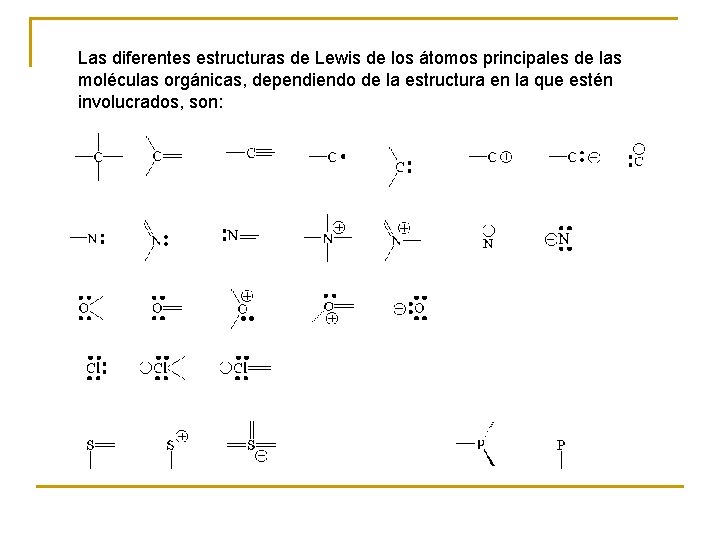
Las diferentes estructuras de Lewis de los átomos principales de las moléculas orgánicas, dependiendo de la estructura en la que estén involucrados, son:

GEOMETRÍA MOLECULAR: MÉTODO DE REPULSIÓN DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA Los pares de electrones se disponen en torno al átomo central de modo que se minimicen las repulsiones eléctricas entre ellos Cuatro pares de e rodeando el átomo de nitrógeno. Se dirigen hacia los vértices de un tetraedro (Geometría electrónica) Como sólo se enlazan 3 de los 4 pares electrónicos, la forma de la molécula será piramidal (Geometría molecular)

Dos pares de e enlazados: Molécula lineal Tres pares de e enlazados: Molécula triangular plana Cuatro pares de e: Molécula tetraédrica Molécula piramidal Molécula angular Cuatro enlazados Tres enlazados Dos enlazados Enlazado- Enlazado < No enlazado- No enlazado Repulsión entre pares de electrones

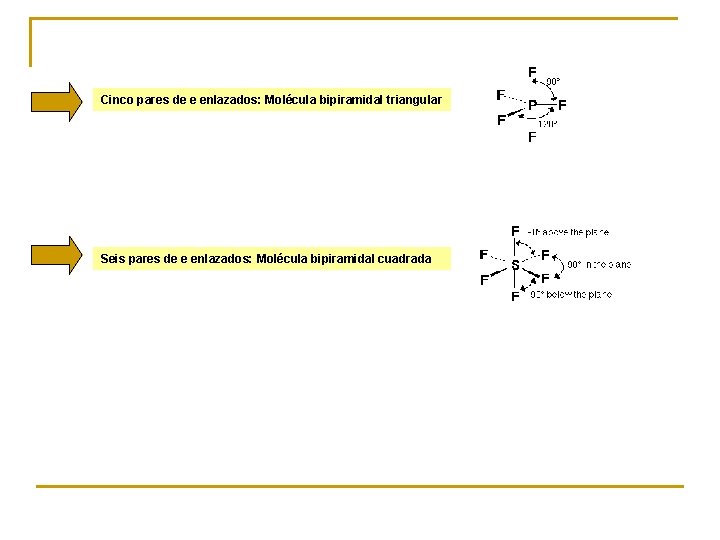
Cinco pares de e enlazados: Molécula bipiramidal triangular Seis pares de e enlazados: Molécula bipiramidal cuadrada

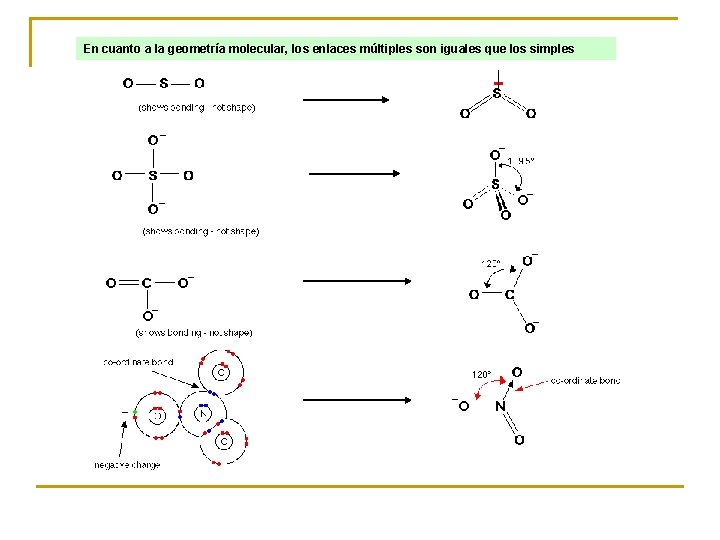
En cuanto a la geometría molecular, los enlaces múltiples son iguales que los simples

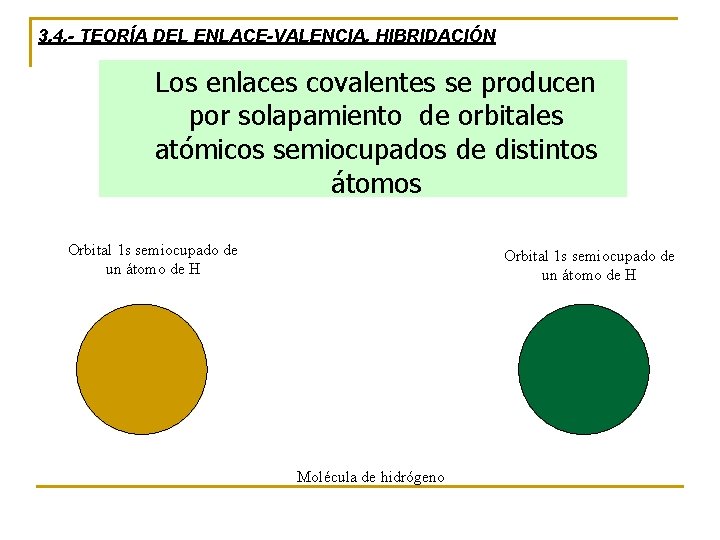
3. 4. - TEORÍA DEL ENLACE-VALENCIA. HIBRIDACIÓN Los enlaces covalentes se producen por solapamiento de orbitales atómicos semiocupados de distintos átomos Orbital 1 s semiocupado de un átomo de H Molécula de hidrógeno

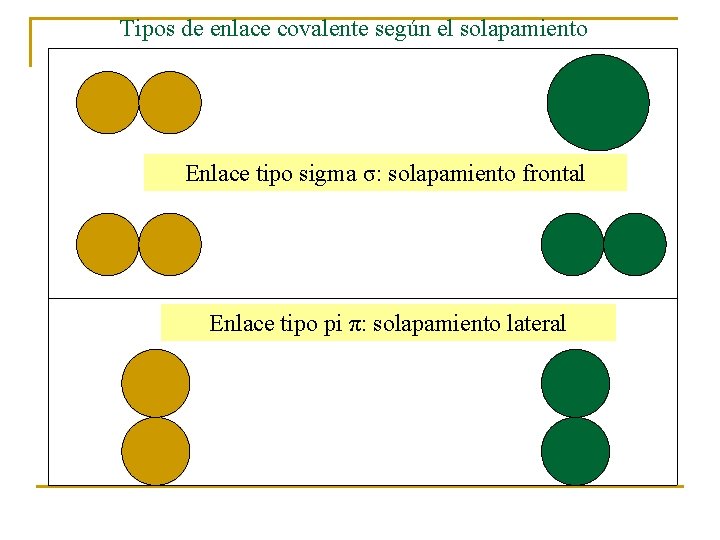
Tipos de enlace covalente según el solapamiento Enlace tipo sigma σ: solapamiento frontal Enlace tipo pi π: solapamiento lateral

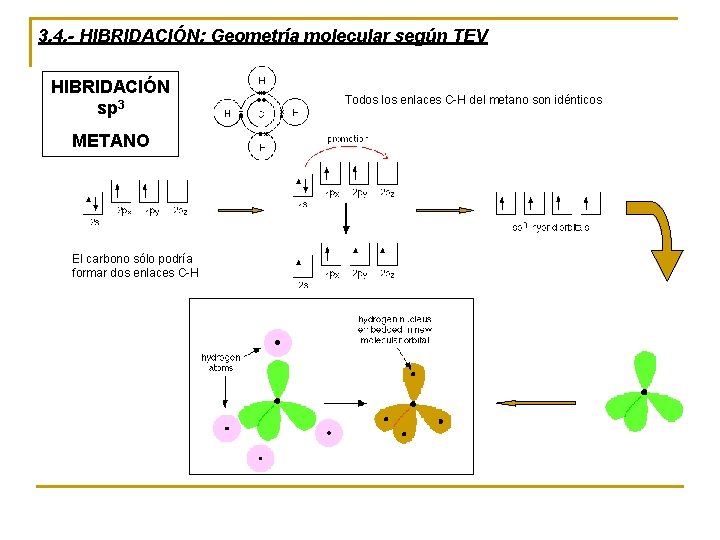
3. 4. - HIBRIDACIÓN: Geometría molecular según TEV HIBRIDACIÓN sp 3 METANO El carbono sólo podría formar dos enlaces C-H Todos los enlaces C-H del metano son idénticos


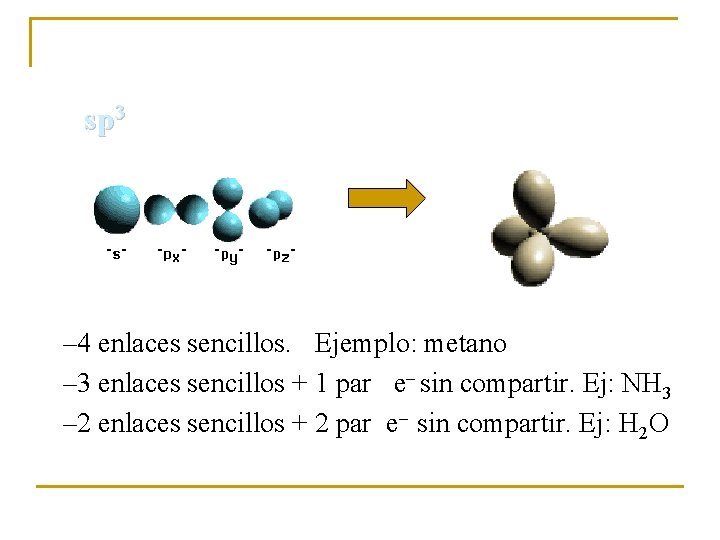
sp 3 – 4 enlaces sencillos. Ejemplo: metano – 3 enlaces sencillos + 1 par e– sin compartir. Ej: NH 3 – 2 enlaces sencillos + 2 par e– sin compartir. Ej: H 2 O

Un carbono unido a cuatro átomos siempre tendrá hibridación sp 3 y una estructura tetraédrica. Así son los alcanos, haluros de alquilo, alcoholes, éteres y aminas, entre otros. Todos estos compuestos tienen estabilidad suficiente como para poder ser almacenados sin problemas especiales. Un carbono unido a menos de cuatro átomos también puede tener hibridación sp 3 pero la estructura variará dependiendo del número de sustituyentes: Estructura Tipo de compuesto Geometría Carbaniones Carbenos Piramidal Angular Los carbaniones y carbenos son especies altamente reactivas (intermedios de reacción) y en general tienen un tiempo de vida muy corto.

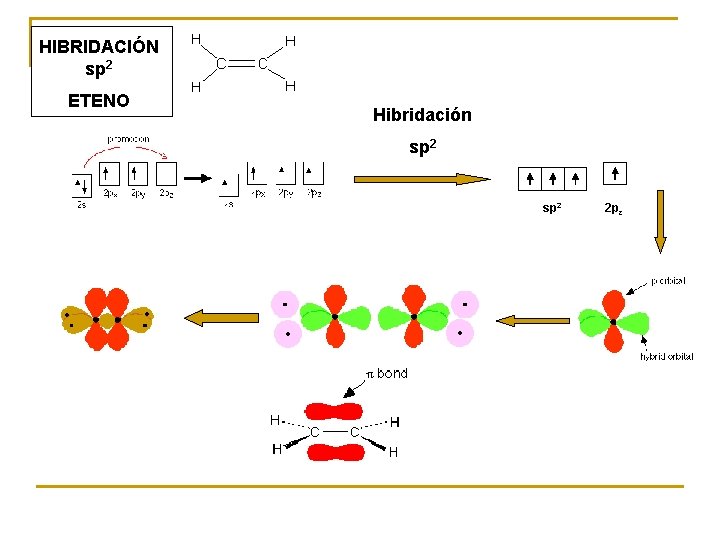
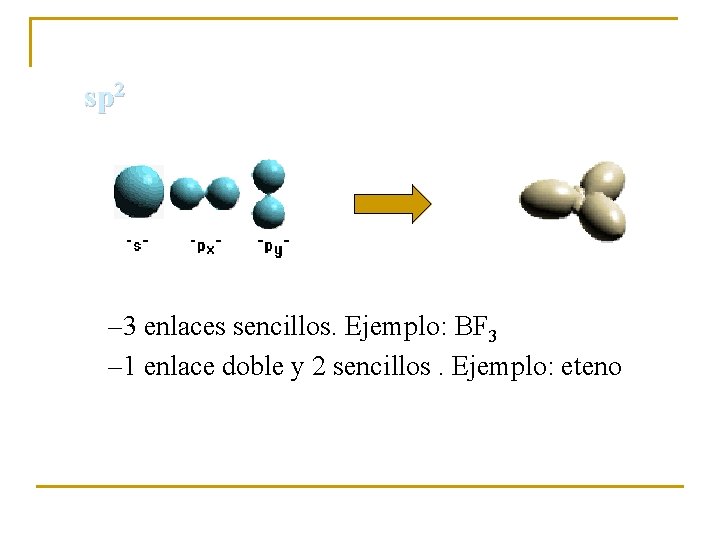
HIBRIDACIÓN sp 2 ETENO Hibridación sp 2 2 pz


sp 2 – 3 enlaces sencillos. Ejemplo: BF 3 – 1 enlace doble y 2 sencillos. Ejemplo: eteno

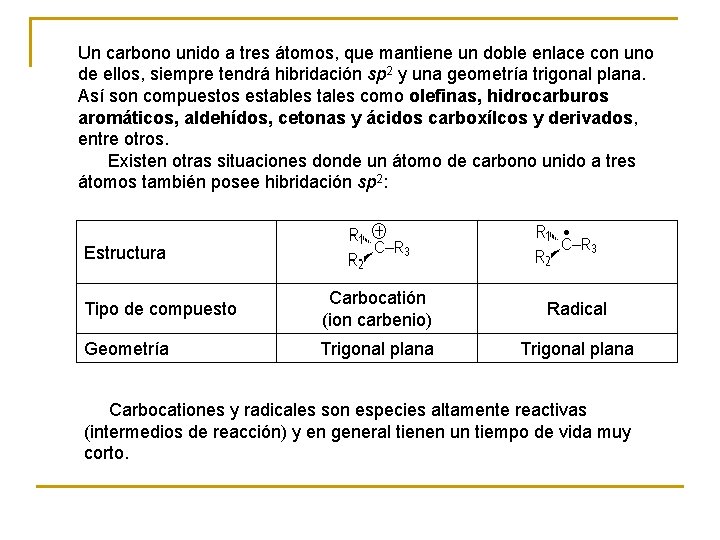
Un carbono unido a tres átomos, que mantiene un doble enlace con uno de ellos, siempre tendrá hibridación sp 2 y una geometría trigonal plana. Así son compuestos estables tales como olefinas, hidrocarburos aromáticos, aldehídos, cetonas y ácidos carboxílcos y derivados, entre otros. Existen otras situaciones donde un átomo de carbono unido a tres átomos también posee hibridación sp 2: Estructura Tipo de compuesto Carbocatión (ion carbenio) Radical Geometría Trigonal plana Carbocationes y radicales son especies altamente reactivas (intermedios de reacción) y en general tienen un tiempo de vida muy corto.

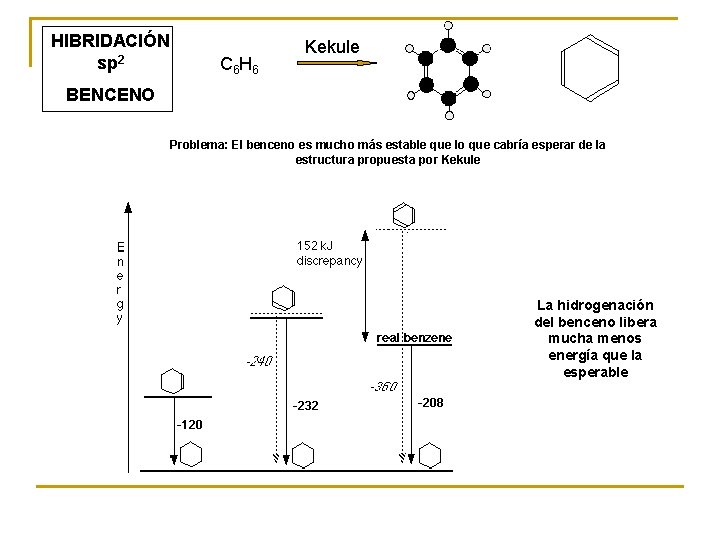
HIBRIDACIÓN sp 2 C 6 H 6 Kekule BENCENO Problema: El benceno es mucho más estable que lo que cabría esperar de la estructura propuesta por Kekule La hidrogenación del benceno libera mucha menos energía que la esperable

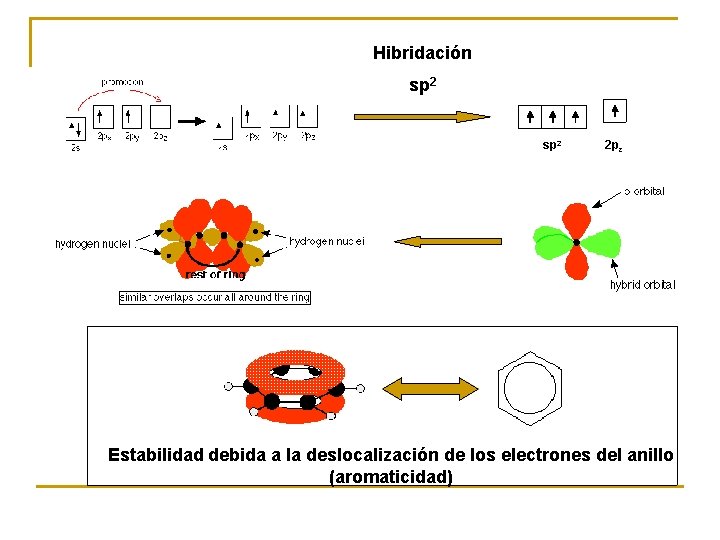
Hibridación sp 2 2 pz Estabilidad debida a la deslocalización de los electrones del anillo (aromaticidad)

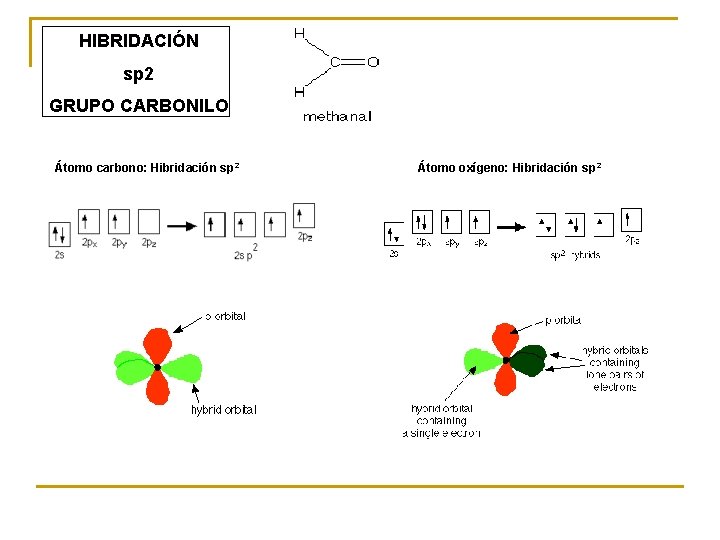
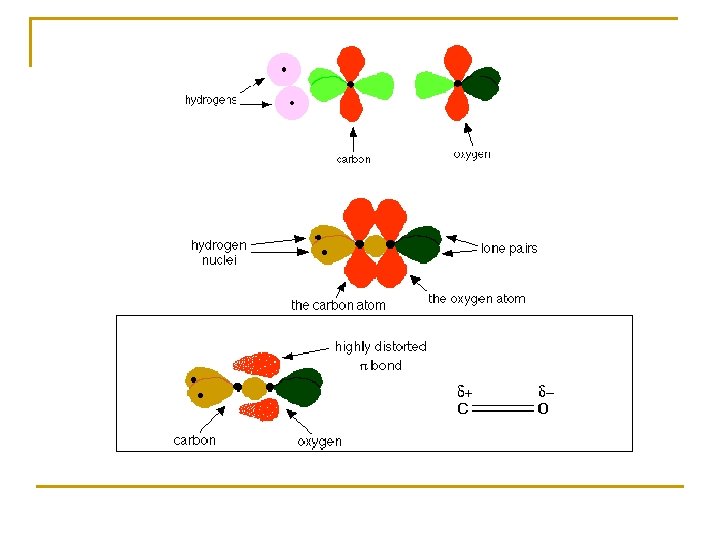
HIBRIDACIÓN sp 2 GRUPO CARBONILO Átomo carbono: Hibridación sp 2 Átomo oxígeno: Hibridación sp 2


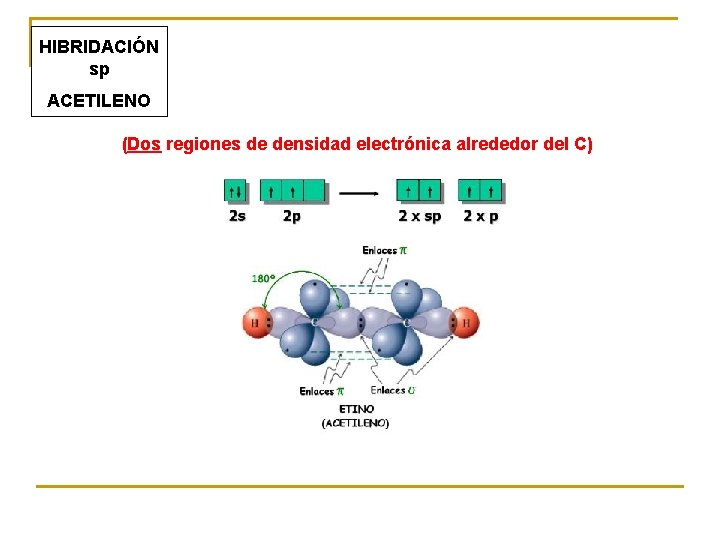
HIBRIDACIÓN sp ACETILENO (Dos regiones de densidad electrónica alrededor del C)


sp – 2 enlaces sencillos. Ejemplo: Be. F 2 – 2 enlaces dobles. Ejemplo: CO 2 – 1 enlace triple y 1 sencillo. Ejemplo: etino

Un carbono unido a dos átomos, que mantiene un triple enlace con uno de ellos, siempre tendrá una hibridación sp y una estructura lineal. Existen otras posibilidades: Estructura Tipo de compuesto Aleno Acetiluro Geometría Lineal Los alenos son compuestos estables. Los acetiluros son especies reactivas (intermedios de reacción).

Electronegatividad del carbono en función de su hibridación El carbono tiene mayor electronegatividad a medida que aumenta el carácter s de la hibridación. Por tanto los carbonos del etano (sp 3) son menos electronegativos que los del eteno (sp 2) y éstos a su vez menos electronegativos que los del etino (sp). El cálculo de las densidades electrónicas en estos tres compuestos refleja claramente este hecho: (azul +, rojo -) Etano Eteno Etino Los hidrógenos tienen una coloración azul más acusada desde el etano al etino, prueba de su menor densidad electrónica como consecuencia de la electronegatividad creciente del carbono.

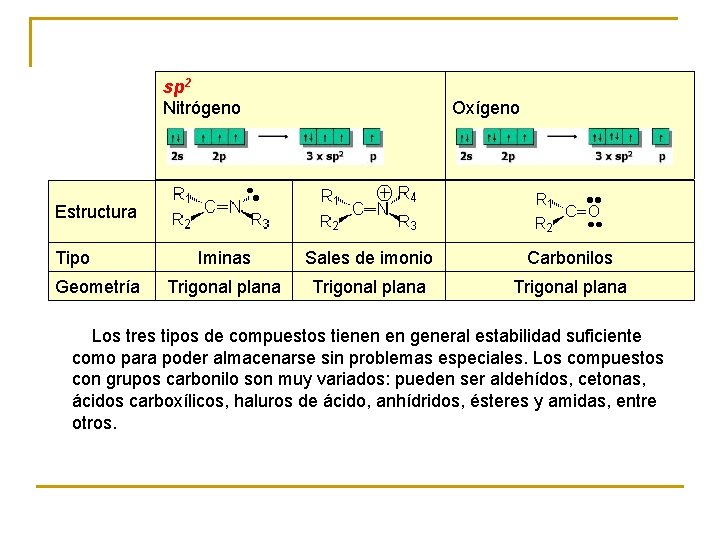
HIBRIDACIÓN DE ORBITALES ATÓMICOS EN NITRÓGENO Y OXÍGENO sp 3 Nitrógeno Oxígeno Estructura Tipo Geometría Aminas Sales de amonio Alcoholes Éteres Alcóxidos Piramidal Tetraédrica Angular - Las aminas, sales de amonio, alcoholes y éteres son especies estables. Los alcóxidos son especies muy reactivas (intermedios de reacción).

sp 2 Nitrógeno Oxígeno Estructura Tipo Geometría Iminas Sales de imonio Carbonilos Trigonal plana Los tres tipos de compuestos tienen en general estabilidad suficiente como para poder almacenarse sin problemas especiales. Los compuestos con grupos carbonilo son muy variados: pueden ser aldehídos, cetonas, ácidos carboxílicos, haluros de ácido, anhídridos, ésteres y amidas, entre otros.

Estructura sp . Nitrógeno Tipo Nitrilos Geometría Lineal Los nitrilos son compuestos estables

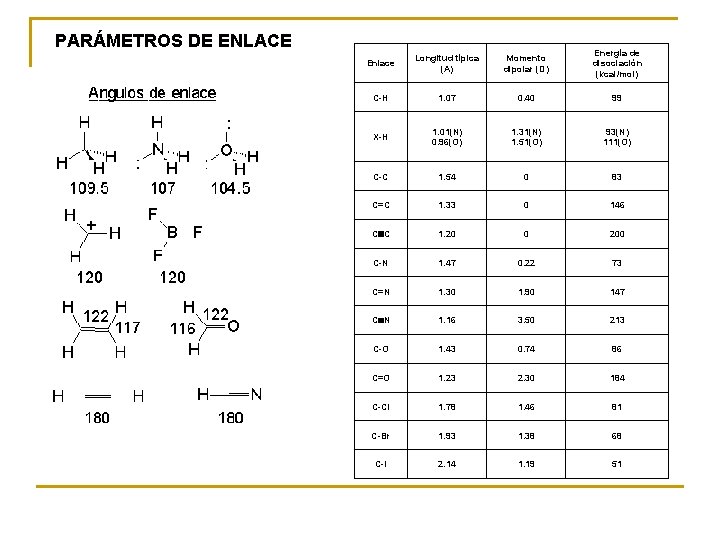
PARÁMETROS DE ENLACE Enlace Longitud típica (A) Momento dipolar (D) Energía de disociación (kcal/mol) C-H 1. 07 0. 40 99 X-H 1. 01(N) 0. 96(O) 1. 31(N) 1. 51(O) 93(N) 111(O) C-C 1. 54 0 83 C=C 1. 33 0 146 CºC 1. 20 0 200 C-N 1. 47 0. 22 73 C=N 1. 30 1. 90 147 CºN 1. 16 3. 50 213 C-O 1. 43 0. 74 86 C=O 1. 23 2. 30 184 C-Cl 1. 78 1. 46 81 C-Br 1. 93 1. 38 68 C-I 2. 14 1. 19 51

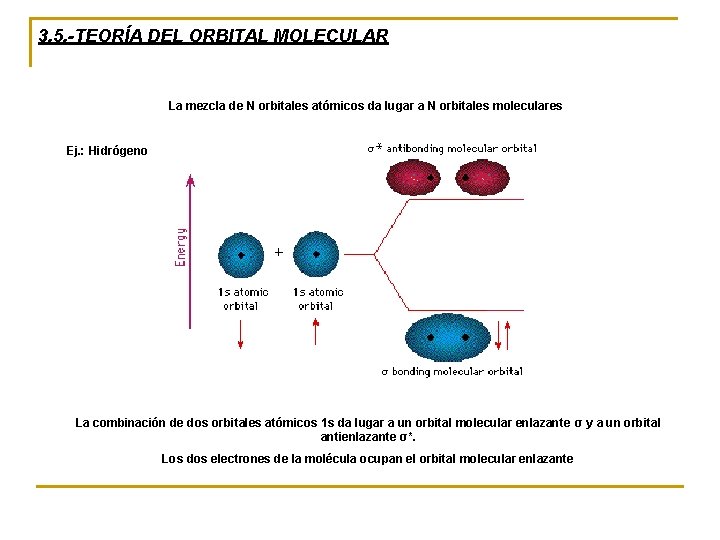
3. 5. -TEORÍA DEL ORBITAL MOLECULAR La mezcla de N orbitales atómicos da lugar a N orbitales moleculares Ej. : Hidrógeno La combinación de dos orbitales atómicos 1 s da lugar a un orbital molecular enlazante σ y a un orbital antienlazante σ*. Los dos electrones de la molécula ocupan el orbital molecular enlazante

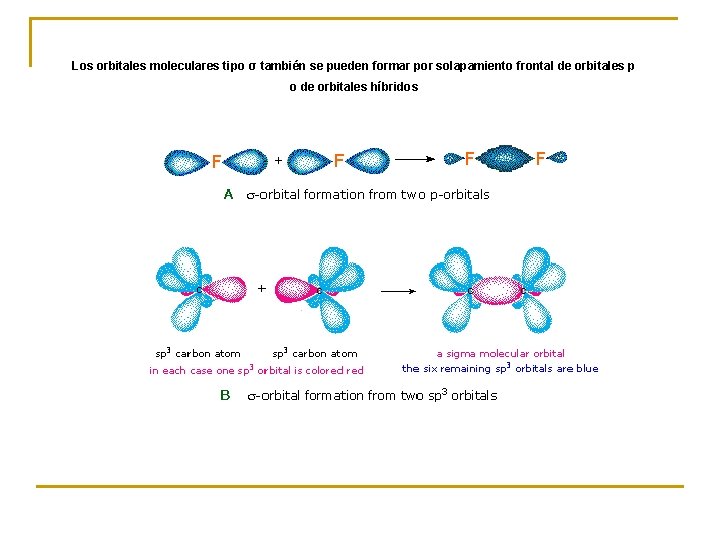
Los orbitales moleculares tipo σ también se pueden formar por solapamiento frontal de orbitales p o de orbitales híbridos

Los orbitales moleculares tipo π se producen por solapamiento lateral de orbitales p

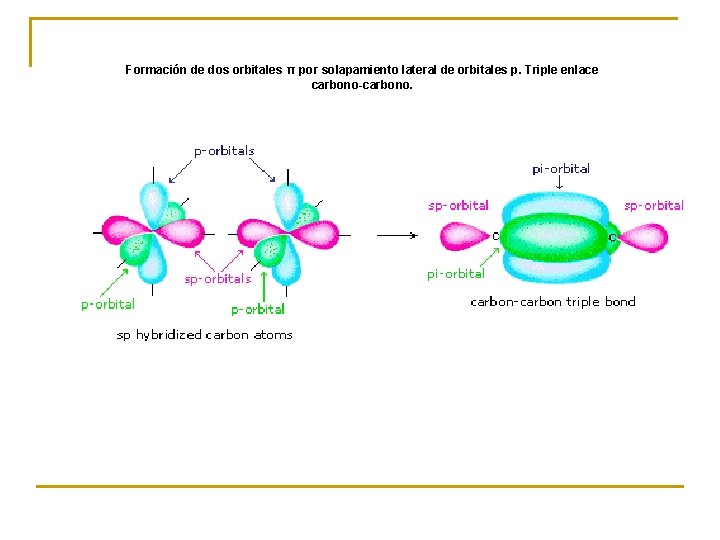
Formación de dos orbitales π por solapamiento lateral de orbitales p. Triple enlace carbono-carbono.

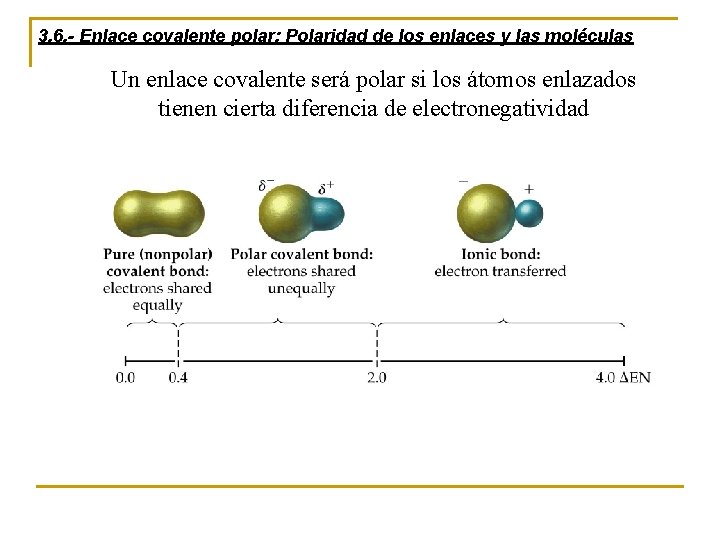
3. 6. - Enlace covalente polar: Polaridad de los enlaces y las moléculas Un enlace covalente será polar si los átomos enlazados tienen cierta diferencia de electronegatividad

Cada enlace tiene un momento dipolar “ ” (magnitud vectorial que depende la diferencia de electronegatividad entre los átomos cuya dirección es la línea que une ambos átomos y cuyo sentido va del menos electronegativo al más electronegativo).

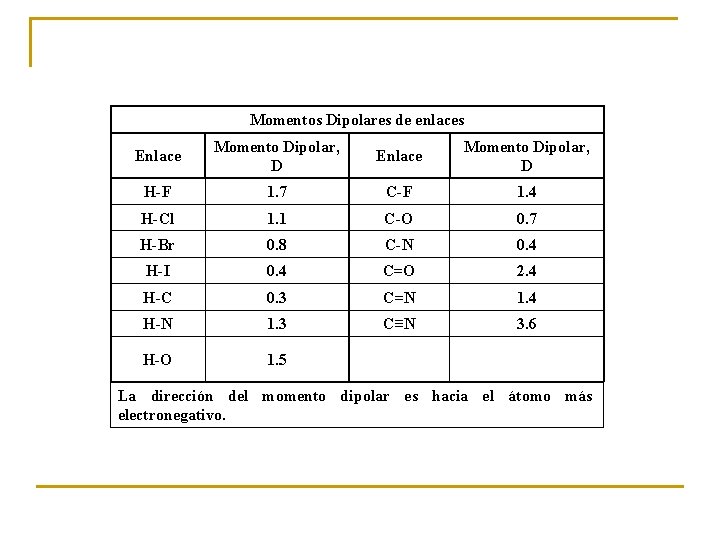
Momentos Dipolares de enlaces Enlace Momento Dipolar, D H-F 1. 7 C-F 1. 4 H-Cl 1. 1 C-O 0. 7 H-Br 0. 8 C-N 0. 4 H-I 0. 4 C=O 2. 4 H-C 0. 3 C=N 1. 4 H-N 1. 3 C≡N 3. 6 H-O 1. 5 La dirección del momento dipolar es hacia el átomo más electronegativo.

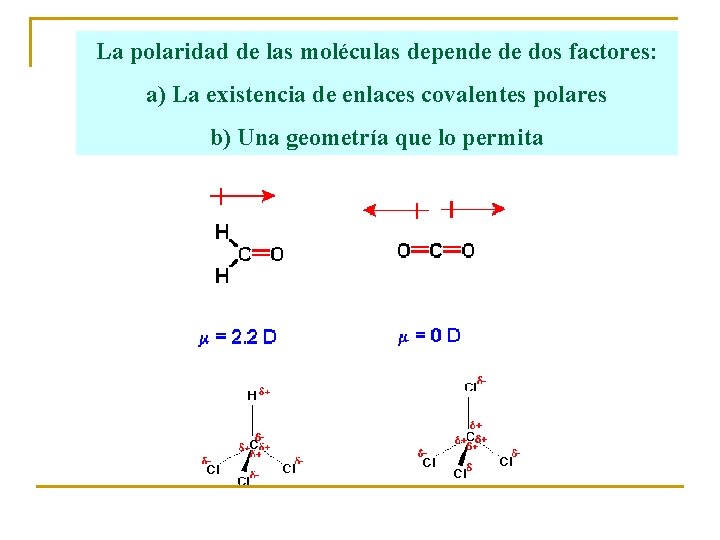
La polaridad de las moléculas depende de dos factores: a) La existencia de enlaces covalentes polares b) Una geometría que lo permita

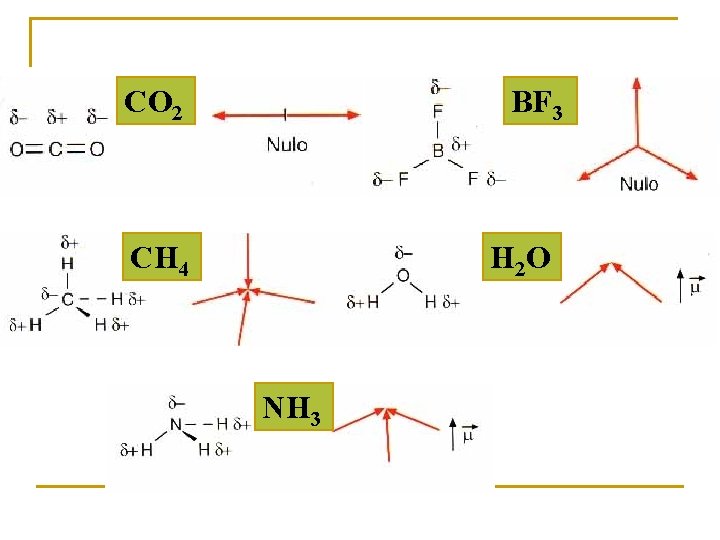
Moléculas polares. Tienen no nulo: Moléculas con un sólo enlace covalente. Ej: HCl. Moléculas angulares, piramidales, . . Ej: H 2 O, NH 3 Moléculas apolares Tienen nulo: Moléculas con enlaces apolares. Ej: H 2, Cl 2. Moléculas simétricas = 0. Ej: CH 4, CO 2.

CO 2 BF 3 CH 4 H 2 O NH 3

4. - REPRESENTACIÓN DE LAS MOLÉCULAS EN QUÍMICA ORGÁNICA

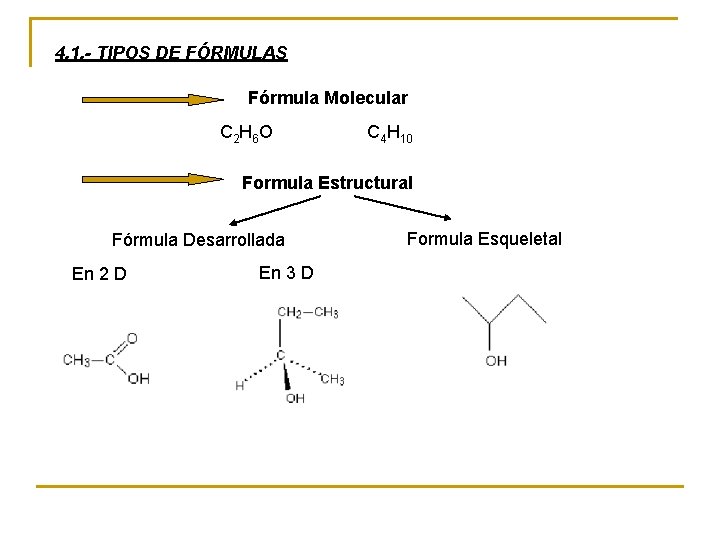
4. 1. - TIPOS DE FÓRMULAS Fórmula Molecular C 2 H 6 O C 4 H 10 Formula Estructural Fórmula Desarrollada En 2 D En 3 D Formula Esqueletal

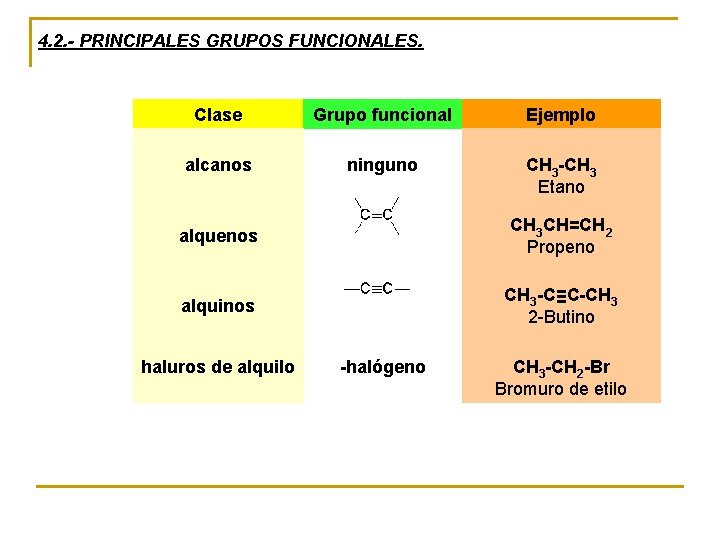
4. 2. - PRINCIPALES GRUPOS FUNCIONALES. Clase Grupo funcional Ejemplo alcanos ninguno CH 3 -CH 3 Etano alquenos alquinos haluros de alquilo CH 3 CH=CH 2 Propeno CH 3 -C≡C-CH 3 2 -Butino -halógeno CH 3 -CH 2 -Br Bromuro de etilo

Clase (homo) aromáticos (hetero) aromáticos Grupo funcional Ejemplo Tolueno 3 -Metilpiridina

Clase Grupo funcional Ejemplo alcoholes fenoles -OH CH 3 -CH 2 -OH Etanol Ph-OH Fenol éteres -O- CH 3 -CH 2 -O-CH 2 -CH 3 Dietiléter aldehídos Etanal cetonas Propanona

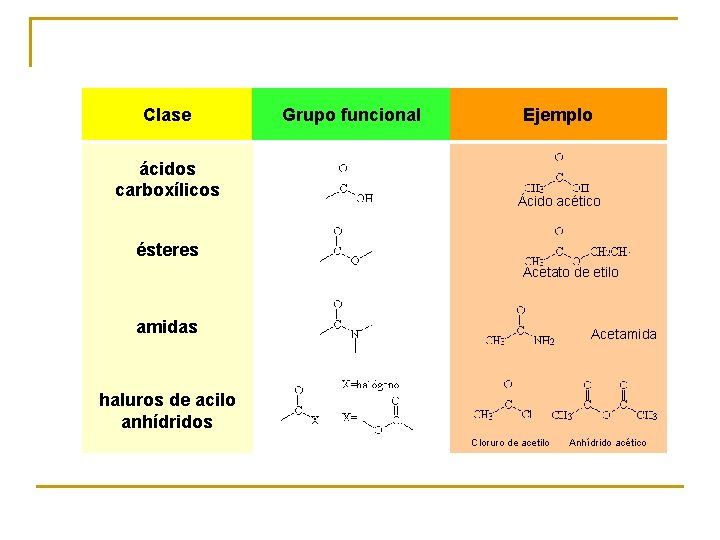
Clase Grupo funcional ácidos carboxílicos Ejemplo Ácido acético Acetato de etilo Acetamida amidas haluros de acilo anhídridos ésteres Cloruro de acetilo Anhídrido acético

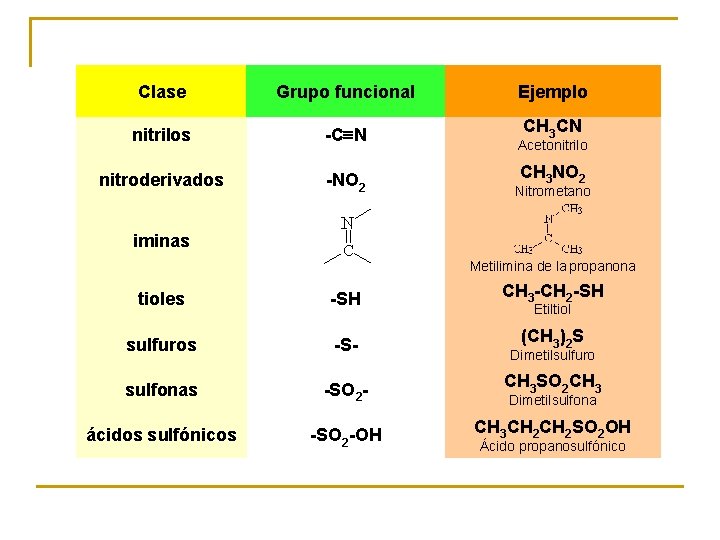
Clase Grupo funcional Ejemplo nitrilos -CºN CH 3 CN nitroderivados -NO 2 Nitrometano iminas Acetonitrilo CH 3 NO 2 Metilimina de la propanona tioles -SH CH 3 -CH 2 -SH sulfuros -S- (CH 3)2 S sulfonas -SO 2 - CH 3 SO 2 CH 3 ácidos sulfónicos -SO 2 -OH CH 3 CH 2 SO 2 OH Etiltiol Dimetilsulfuro Dimetilsulfona Ácido propanosulfónico

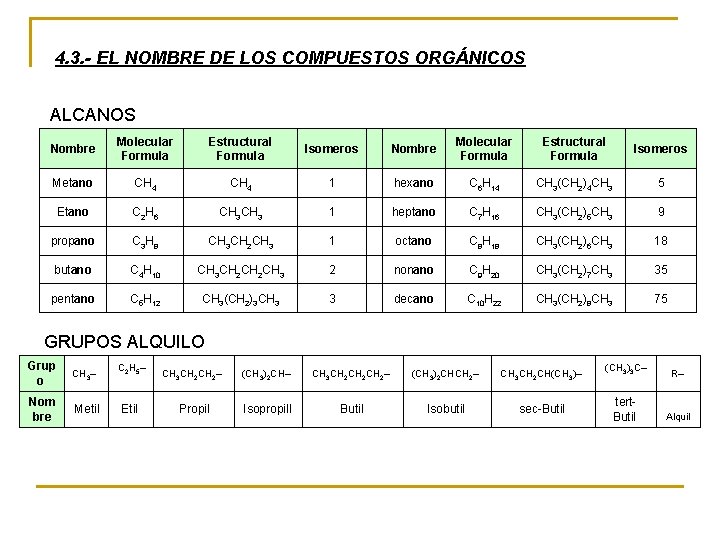
4. 3. - EL NOMBRE DE LOS COMPUESTOS ORGÁNICOS ALCANOS Nombre Molecular Formula Estructural Formula Isomeros Metano CH 4 1 hexano C 6 H 14 CH 3(CH 2)4 CH 3 5 Etano C 2 H 6 CH 3 1 heptano C 7 H 16 CH 3(CH 2)5 CH 3 9 propano C 3 H 8 CH 3 CH 2 CH 3 1 octano C 8 H 18 CH 3(CH 2)6 CH 3 18 butano C 4 H 10 CH 3 CH 2 CH 3 2 nonano C 9 H 20 CH 3(CH 2)7 CH 3 35 pentano C 5 H 12 CH 3(CH 2)3 CH 3 3 decano C 10 H 22 CH 3(CH 2)8 CH 3 75 GRUPOS ALQUILO Grup o CH 3– C 2 H 5– CH 3 CH 2– (CH 3)2 CH– CH 3 CH 2 CH 2– (CH 3)2 CHCH 2– CH 3 CH 2 CH(CH 3)– (CH 3)3 C– R– Nom bre Metil Etil Propil Isopropill Butil Isobutil sec-Butil tert. Butil Alquil

CICLOALCANOS Nombre Molecular Formula Estructural Formula Esqueletal Formula Ciclopropano C 3 H 6 Ciclobutano Ciclopentano C 4 H 8 C 5 H 10 C 6 H 12 C 7 H 14 Cicloheptano Cicloalcano Cn. H 2 n (CH 2)n Ciclohexano

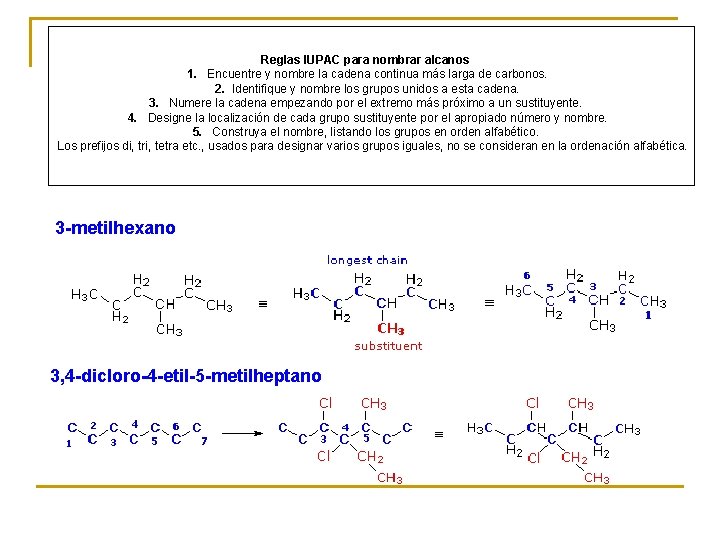
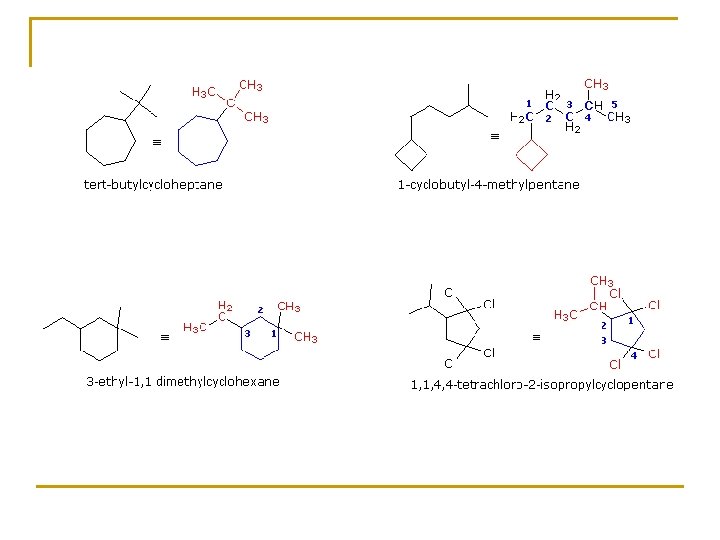
Reglas IUPAC para nombrar alcanos 1. Encuentre y nombre la cadena continua más larga de carbonos. 2. Identifique y nombre los grupos unidos a esta cadena. 3. Numere la cadena empezando por el extremo más próximo a un sustituyente. 4. Designe la localización de cada grupo sustituyente por el apropiado número y nombre. 5. Construya el nombre, listando los grupos en orden alfabético. Los prefijos di, tri, tetra etc. , usados para designar varios grupos iguales, no se consideran en la ordenación alfabética. 3 -metilhexano 3, 4 -dicloro-4 -etil-5 -metilheptano


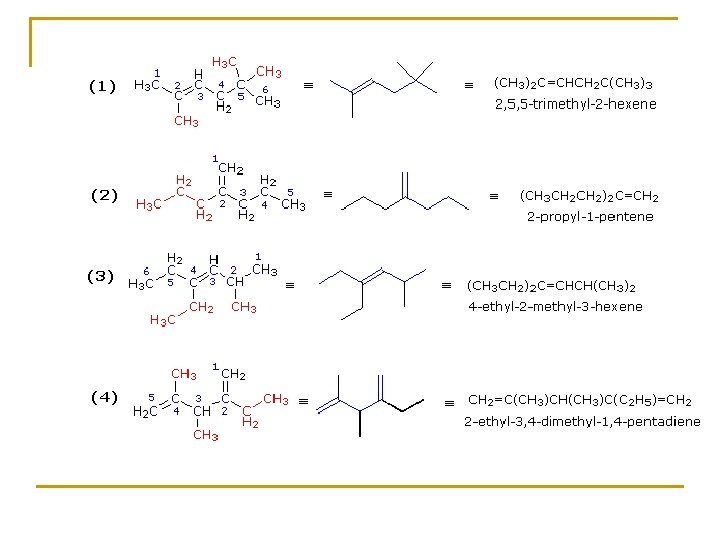
Reglas IUPAC para la nomenclatura de Alquenos 1. El sufijo -eno indica un alqueno o cicloalqueno. 2. La cadena principal debe incluir los dos átomos de carbono unidos por el doble enlace. 3. La cadena principal debe ser numerada por el extremo más próximo al doble enlace. Si la insaturación está en el centro de la cadena se empieza a numerar por el extremo que tenga más próximo un sustituyente. 4. El más pequeño de los números asignados a los átomos del doble enlace se utiliza para indicar la posición de la insaturación. Si hay más de un doble enlace el compuesto es denominado dieno, trieno, . . 5. En los cicloalquenos a los carbonos del doble enlace se les asigna los números 1 y 2. El número 1 puede ser determinado por la regla de los sustituyentes. 6. Grupos sustituyentes más importantes conteniendo doble enlace son: H 2 C=CH– Grupo vinilo H 2 C=CH–CH 2– Grupo alilo

¿Cuál es el nombre de los siguientes alquenos? 1. - (CH 3)2 C=CHCH 2 C(CH 3)3 3. - (C 2 H 5)2 C=CHCH(CH 3)2 4. - 2. - (CH 3 CH 2)2 C=CH 2=C(CH 3)CH(CH 3)C(C 2 H 5)=CH 2


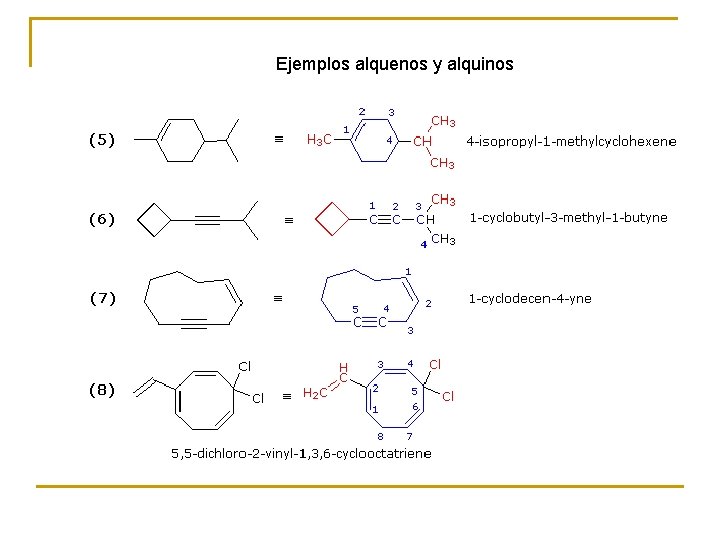
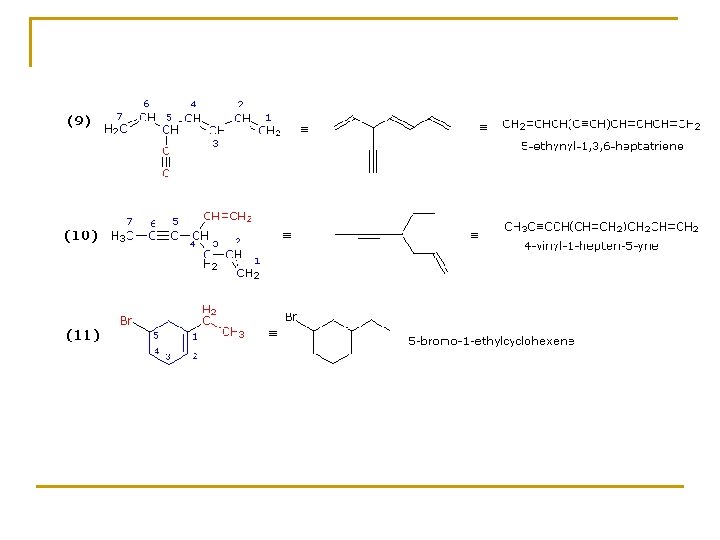
Reglas IUPAC para la Nomenclatura de Alquinos 1. El sufijo -ino indica alquino o cicloalquino. 2. La cadena principal debe contener a los dos carbonos unidos por el triple enlace. 3. La cadena principal debe ser numerada desde el extremo más próximo al triple enlace. Si el triple enlace está situado en el centro de la cadena se aplica la regla de los sustituyentes. 4. El menor número de los carbonos unidos por triple enlace debe ser usado como localizador de la insaturación. 5. Si están presentes varios enlaces múltiples, cada uno debe tener su localizador. Los dobles enlaces preceden a los triples en los nombres IUPAC, pero la cadena debe ser numerada a partir del extremo que tenga más próximo un enlace múltiple sea cual sea su naturaleza. 6. A causa de su carácter linear, los anillos que pueden acomodar un triple enlace deben tener al menos diez carbonos. En los cicloalquinos simples los carbonos unidos por el triple enlace son numerados con el 1 y el 2. El número 1 se determina por la proximidad de los sustituyentes. 7. Grupos sustituyentes conteniendo triple enlace son: HC≡C– Grupo Etinil HC≡CH–CH 2– Grupo Propargil

Ejemplos alquenos y alquinos


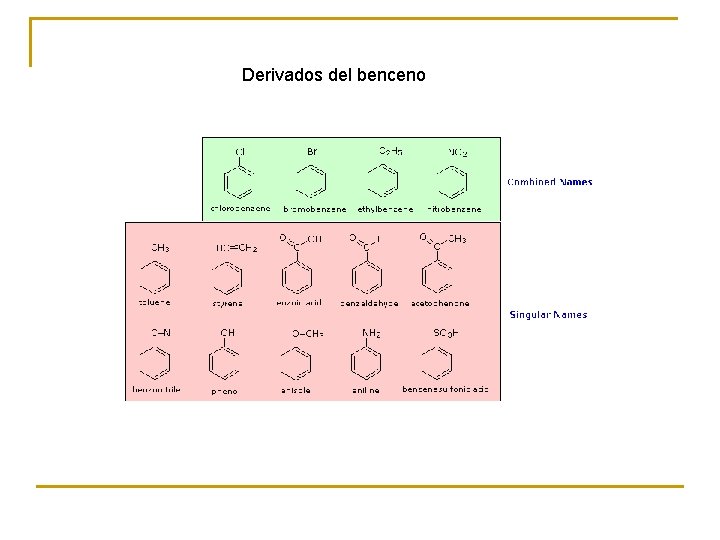
Derivados del benceno



5. - FUERZAS INTERMOLECULARES

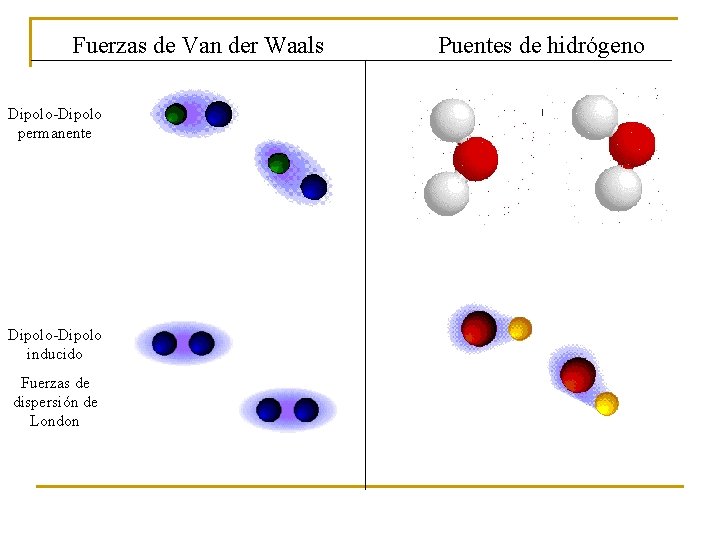
Fuerzas de Van der Waals Dipolo-Dipolo permanente Dipolo-Dipolo inducido Fuerzas de dispersión de London Puentes de hidrógeno

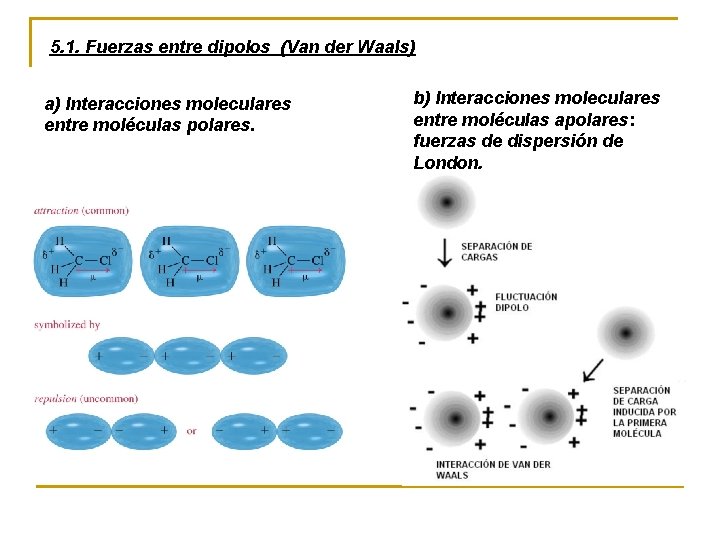
5. 1. Fuerzas entre dipolos (Van der Waals) a) Interacciones moleculares entre moléculas polares. b) Interacciones moleculares entre moléculas apolares: fuerzas de dispersión de London.

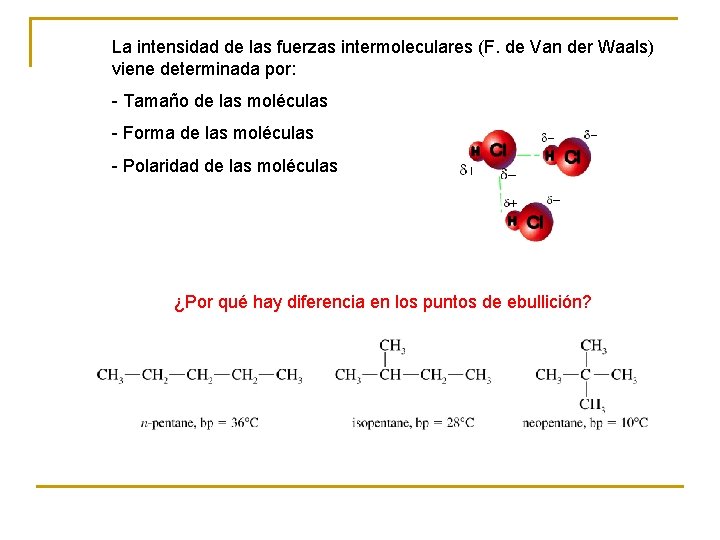
La intensidad de las fuerzas intermoleculares (F. de Van der Waals) viene determinada por: - Tamaño de las moléculas - Forma de las moléculas - Polaridad de las moléculas ¿Por qué hay diferencia en los puntos de ebullición?

Efecto de las Fuerzas intermoleculares sobre el Punto de ebullición PUNTO DE EBULLICIÓN (ºC) DE ALGUNOS ELEMENTOS Y COMPUESTOS Aumento Tamaño Atómico Molecular Ar (40) -186 Kr (83) -153 Xe (131) -109 CH 4 (16) -161 (CH 3)4 C (72) 9. 5 (CH 3)4 Si (88) 27 (CH 3)4 C (72) 9. 5 (CH 3)2 CCl 2 (113) 69 (CH 3)3 CC(CH 3)3 (114) 106 CH 3(CH 2)3 CH 3 (72) 36 Cl(CH 2)3 Cl (113) 121 CH 3(CH 2)6 CH 3 (114) 126 H 2 C=CH 2 (28) -104 F 2 (38) -188 CH 3 C≡CCH 3 (54) -32 CF 4 (88) -130 H 2 C=O (30) -21 CH 3 CH=O (44) 20 (CH 3)3 N (59) 3. 5 (CH 3)2 C=O (58) 56 HC≡N (27) 26 CH 3 C≡N (41) 82 (CH 2)3 O (58) 50 CH 3 NO 2 (61) 101 CCl 4 (154) 77 Forma Molecular Esférica Lineal: Polaridad Molecular No polar: Polar:

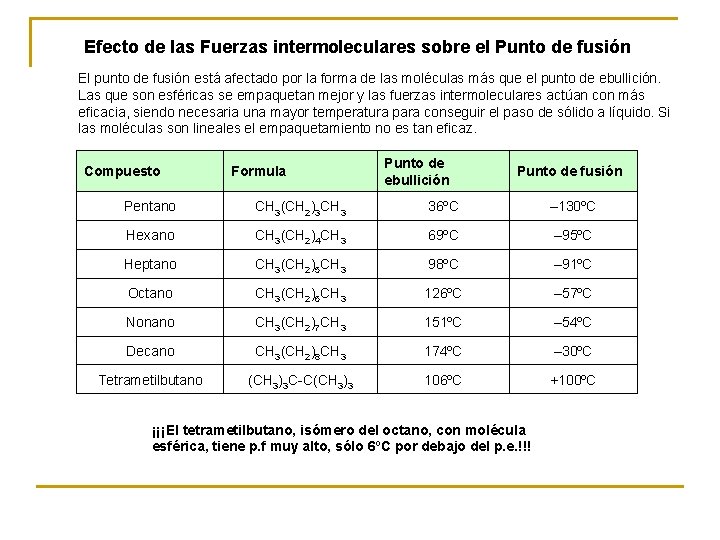
Efecto de las Fuerzas intermoleculares sobre el Punto de fusión El punto de fusión está afectado por la forma de las moléculas más que el punto de ebullición. Las que son esféricas se empaquetan mejor y las fuerzas intermoleculares actúan con más eficacia, siendo necesaria una mayor temperatura para conseguir el paso de sólido a líquido. Si las moléculas son lineales el empaquetamiento no es tan eficaz. Compuesto Formula Punto de ebullición Punto de fusión Pentano CH 3(CH 2)3 CH 3 36ºC – 130ºC Hexano CH 3(CH 2)4 CH 3 69ºC – 95ºC Heptano CH 3(CH 2)5 CH 3 98ºC – 91ºC Octano CH 3(CH 2)6 CH 3 126ºC – 57ºC Nonano CH 3(CH 2)7 CH 3 151ºC – 54ºC Decano CH 3(CH 2)8 CH 3 174ºC – 30ºC Tetrametilbutano (CH 3)3 C-C(CH 3)3 106ºC +100ºC ¡¡¡El tetrametilbutano, isómero del octano, con molécula esférica, tiene p. f muy alto, sólo 6ºC por debajo del p. e. !!!

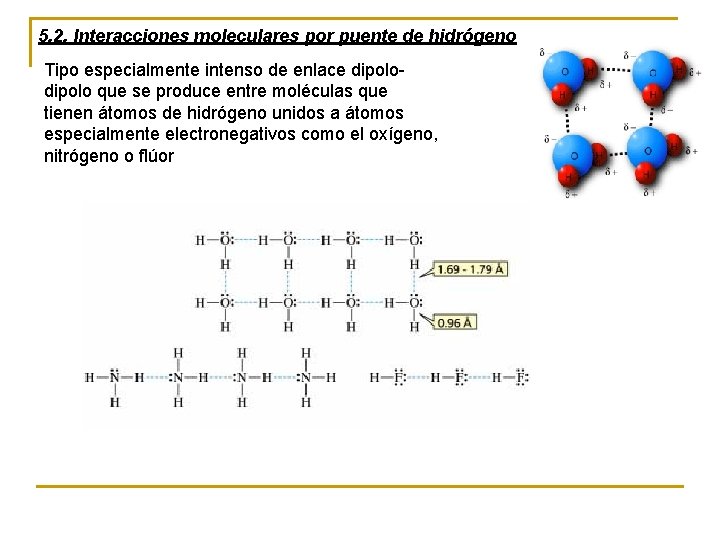
5. 2. Interacciones moleculares por puente de hidrógeno Tipo especialmente intenso de enlace dipolo que se produce entre moléculas que tienen átomos de hidrógeno unidos a átomos especialmente electronegativos como el oxígeno, nitrógeno o flúor

El agua, los alcoholes y las aminas primarias y secundarias pueden actuar cono donantes o aceptores de hidrógeno Los éteres, aldehidos, cetonas y ésteres sólo pueden actuar como aceptores

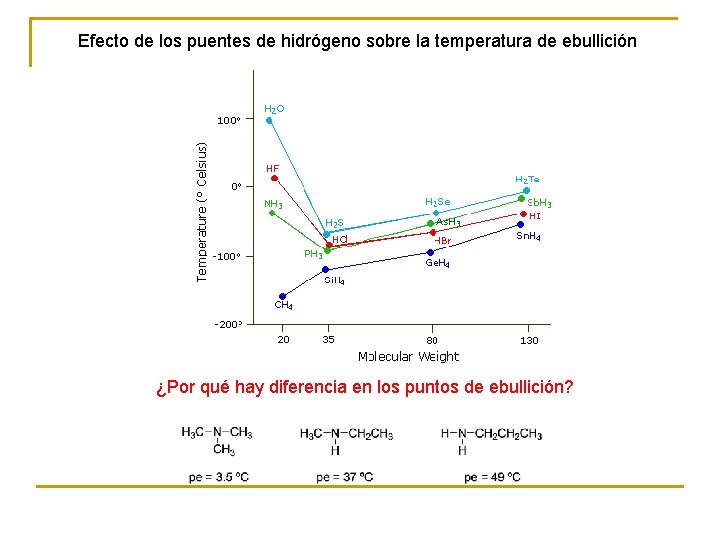
Efecto de los puentes de hidrógeno sobre la temperatura de ebullición ¿Por qué hay diferencia en los puntos de ebullición?

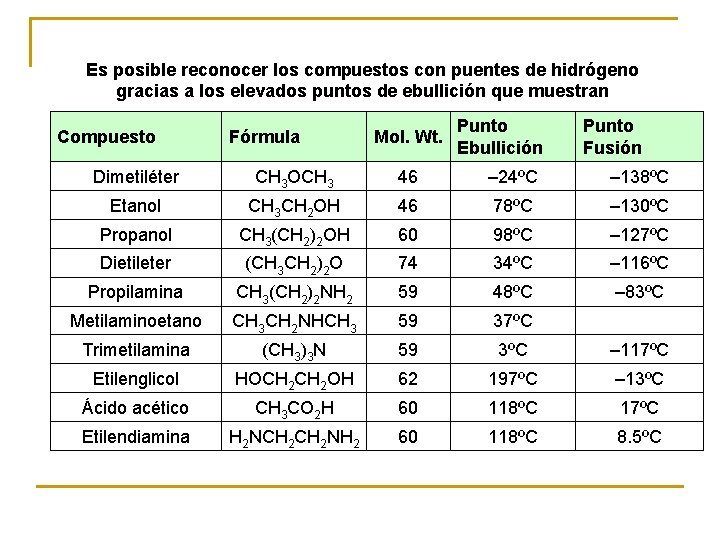
Es posible reconocer los compuestos con puentes de hidrógeno gracias a los elevados puntos de ebullición que muestran Compuesto Fórmula Mol. Wt. Punto Ebullición Punto Fusión Dimetiléter CH 3 OCH 3 46 – 24ºC – 138ºC Etanol CH 3 CH 2 OH 46 78ºC – 130ºC Propanol CH 3(CH 2)2 OH 60 98ºC – 127ºC Dietileter (CH 3 CH 2)2 O 74 34ºC – 116ºC Propilamina CH 3(CH 2)2 NH 2 59 48ºC – 83ºC Metilaminoetano CH 3 CH 2 NHCH 3 59 37ºC Trimetilamina (CH 3)3 N 59 3ºC – 117ºC Etilenglicol HOCH 2 OH 62 197ºC – 13ºC Ácido acético CH 3 CO 2 H 60 118ºC 17ºC Etilendiamina H 2 NCH 2 NH 2 60 118ºC 8. 5ºC

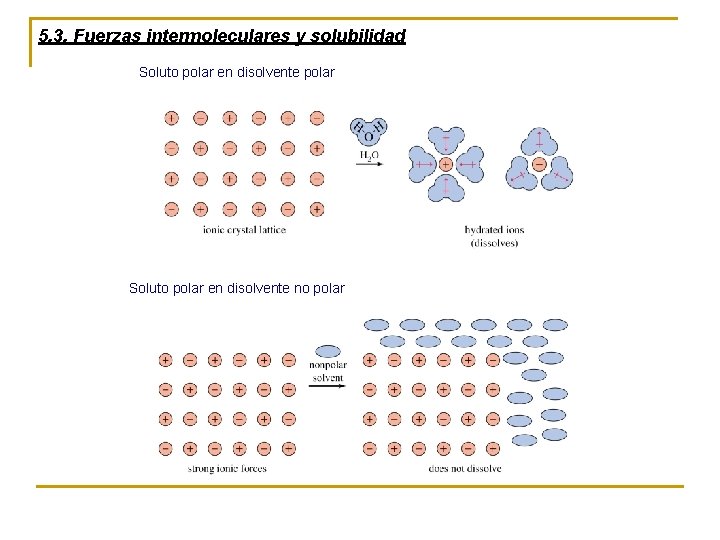
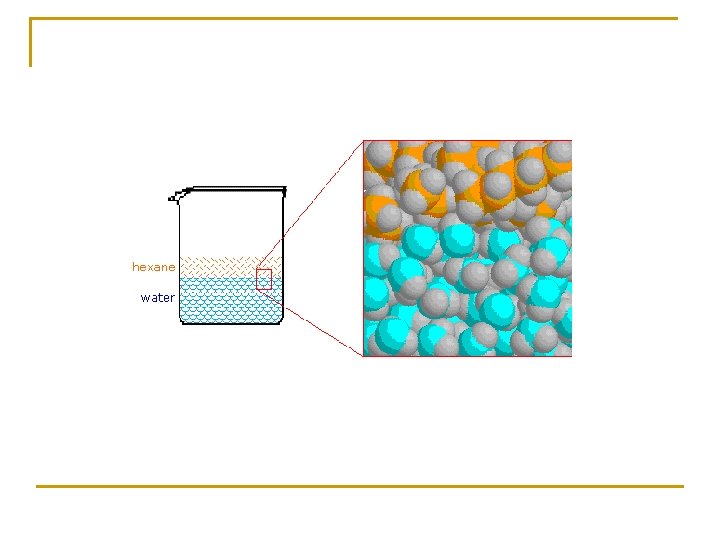
5. 3. Fuerzas intermoleculares y solubilidad Soluto polar en disolvente polar Soluto polar en disolvente no polar

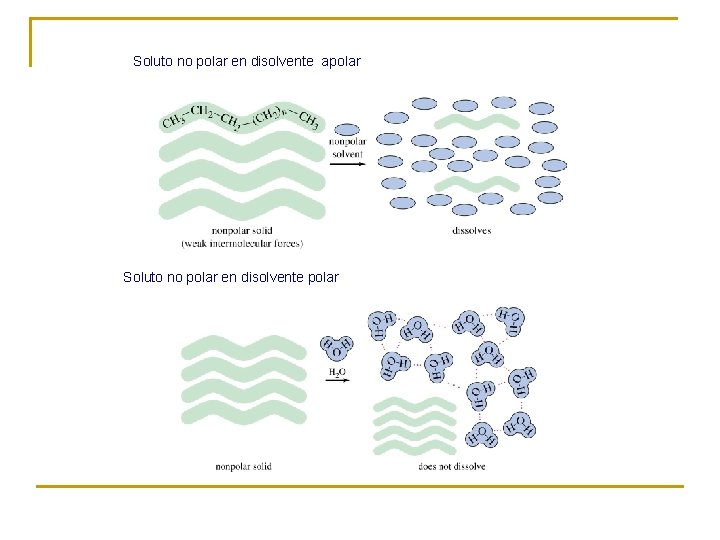
Soluto no polar en disolvente apolar Soluto no polar en disolvente polar


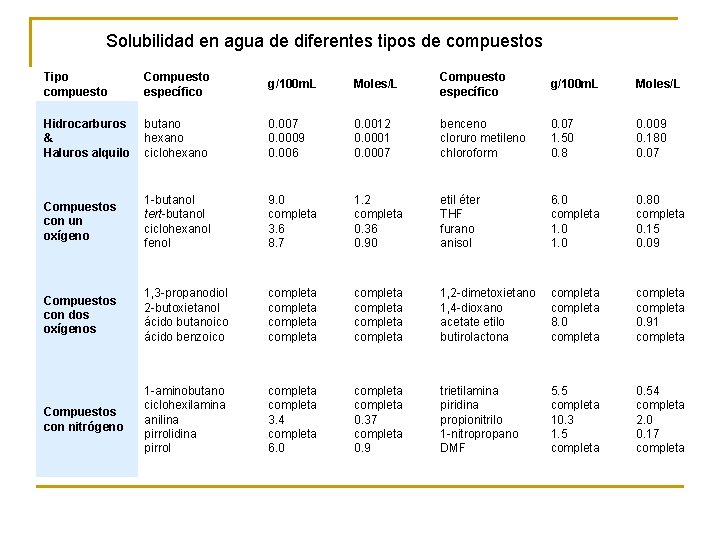
Solubilidad en agua de diferentes tipos de compuestos Tipo compuesto Compuesto específico g/100 m. L Moles/L Hidrocarburos & Haluros alquilo butano hexano ciclohexano 0. 007 0. 0009 0. 006 0. 0012 0. 0001 0. 0007 benceno cloruro metileno chloroform 0. 07 1. 50 0. 8 0. 009 0. 180 0. 07 Compuestos con un oxígeno 1 -butanol tert-butanol ciclohexanol fenol 9. 0 completa 3. 6 8. 7 1. 2 completa 0. 36 0. 90 etil éter THF furano anisol 6. 0 completa 1. 0 0. 80 completa 0. 15 0. 09 Compuestos con dos oxígenos 1, 3 -propanodiol 2 -butoxietanol ácido butanoico ácido benzoico completa completa 1, 2 -dimetoxietano 1, 4 -dioxano acetate etilo butirolactona completa 8. 0 completa 0. 91 completa Compuestos con nitrógeno 1 -aminobutano ciclohexilamina anilina pirrolidina pirrol completa 3. 4 completa 6. 0 completa 0. 37 completa 0. 9 trietilamina piridina propionitrilo 1 -nitropropano DMF 5. 5 completa 10. 3 1. 5 completa 0. 54 completa 2. 0 0. 17 completa

6. -ÁCIDOS Y BASES

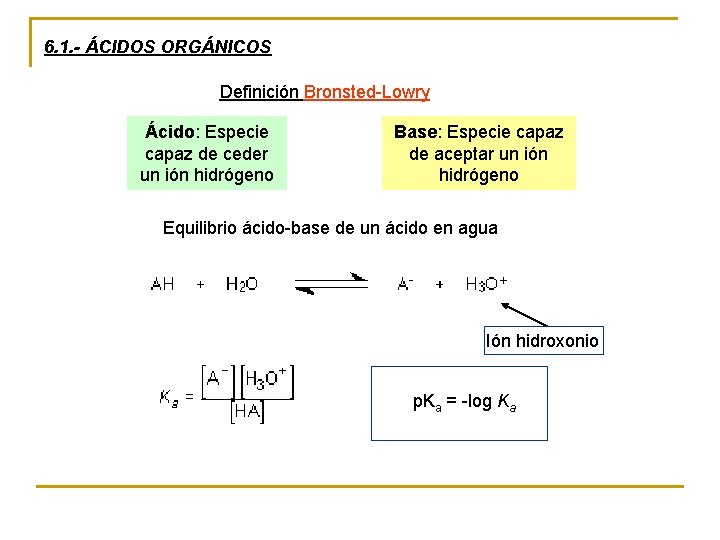
6. 1. - ÁCIDOS ORGÁNICOS Definición Bronsted-Lowry Ácido: Especie capaz de ceder un ión hidrógeno Base: Especie capaz de aceptar un ión hidrógeno Equilibrio ácido-base de un ácido en agua Ión hidroxonio p. Ka = -log Ka

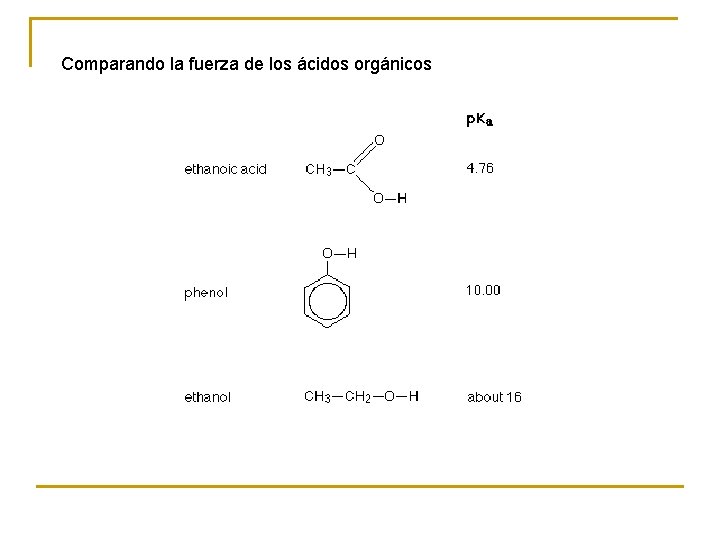
Comparando la fuerza de los ácidos orgánicos

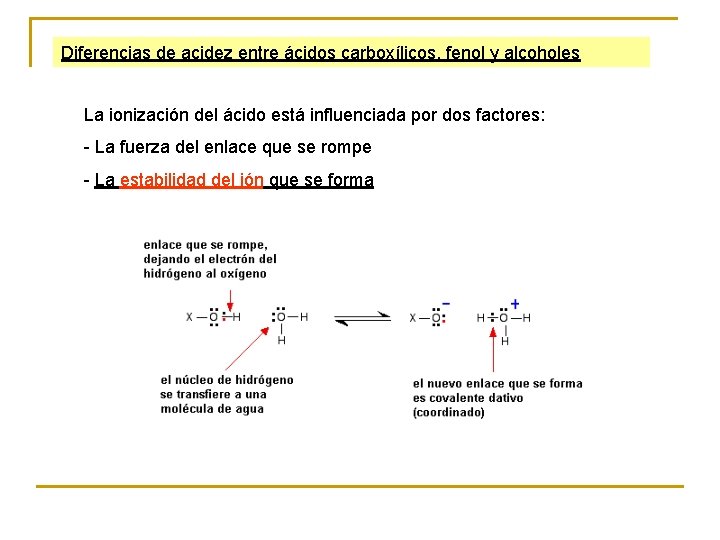
Diferencias de acidez entre ácidos carboxílicos, fenol y alcoholes La ionización del ácido está influenciada por dos factores: - La fuerza del enlace que se rompe - La estabilidad del ión que se forma

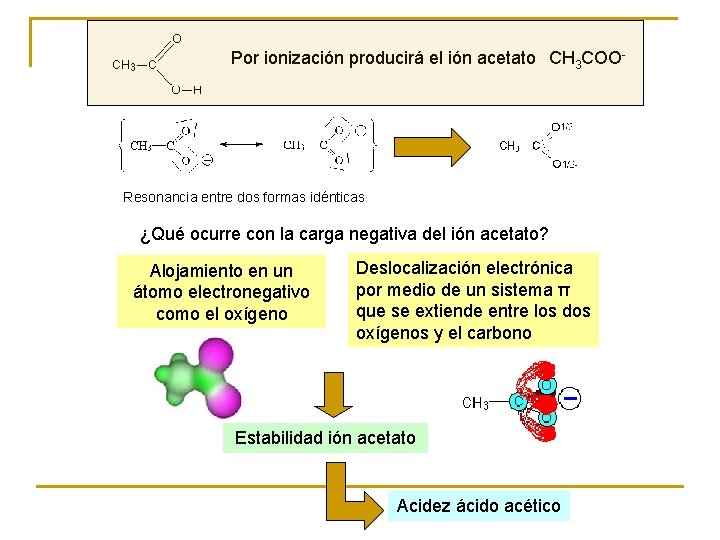
Por ionización producirá el ión acetato CH 3 COO- Resonancia entre dos formas idénticas ¿Qué ocurre con la carga negativa del ión acetato? Alojamiento en un átomo electronegativo como el oxígeno Deslocalización electrónica por medio de un sistema π que se extiende entre los dos oxígenos y el carbono Estabilidad ión acetato Acidez ácido acético

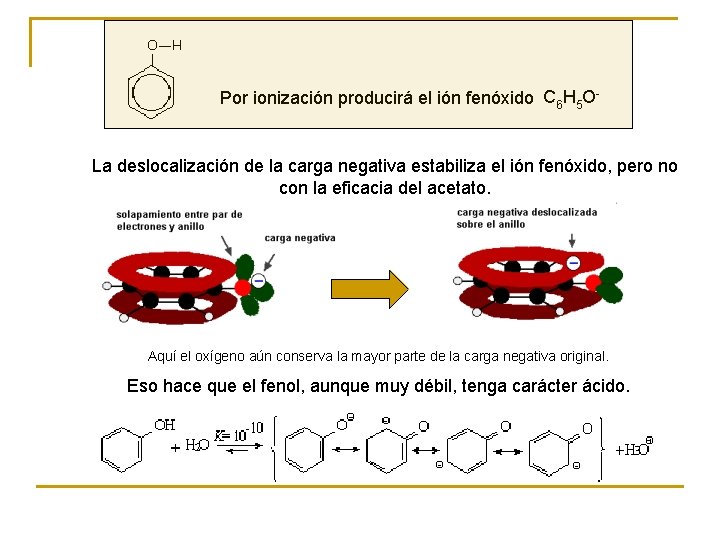
Por ionización producirá el ión fenóxido C 6 H 5 O- La deslocalización de la carga negativa estabiliza el ión fenóxido, pero no con la eficacia del acetato. Aquí el oxígeno aún conserva la mayor parte de la carga negativa original. Eso hace que el fenol, aunque muy débil, tenga carácter ácido.

Por ionización produciría el ión etóxido CH 3 -CH 2 O- No hay posibilidad de deslocalizar la carga negativa, que permanece completamente en el átomo de oxígeno. Esta carga negativa atraerá los iones de hidrógeno formando el alcohol.

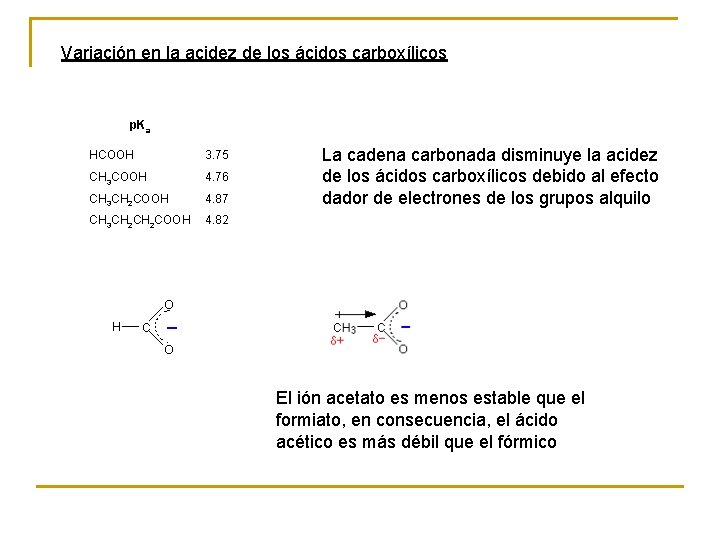
Variación en la acidez de los ácidos carboxílicos p. Ka HCOOH 3. 75 CH 3 COOH 4. 76 CH 3 CH 2 COOH 4. 87 CH 3 CH 2 COOH 4. 82 La cadena carbonada disminuye la acidez de los ácidos carboxílicos debido al efecto dador de electrones de los grupos alquilo El ión acetato es menos estable que el formiato, en consecuencia, el ácido acético es más débil que el fórmico

La presencia de átomos electronegativos en la cadena carbonada aumenta la acidez del ácido por deslocalización de la carga negativa del ión carboxilato p. Ka CH 3 COOH 4. 76 CH 2 Cl. COOH 2. 86 CHCl 2 COOH 1. 29 CCl 3 COOH 0. 65 El ácido tricloacético es un ácido fuerte p. Ka CH 2 FCOOH 2. 66 CH 2 Cl. COOH 2. 86 CH 2 Br. COOH 2. 90 CH 2 ICOOH 3. 17 Cuanto más electronegativo es el halógeno más fuerte es el ácido p. Ka CH 3 CH 2 COOH 4. 82 CH 3 CH 2 CHCl. COOH 2. 84 CH 3 CHCl. CH 2 COOH 4. 06 CH 2 Cl. CH 2 COOH 4. 52 El efecto del halógeno es muy significativo si se une al carbono adyacente al grupo carboxílico. Su efecto en carbonos más lejanos es muy poco significativo

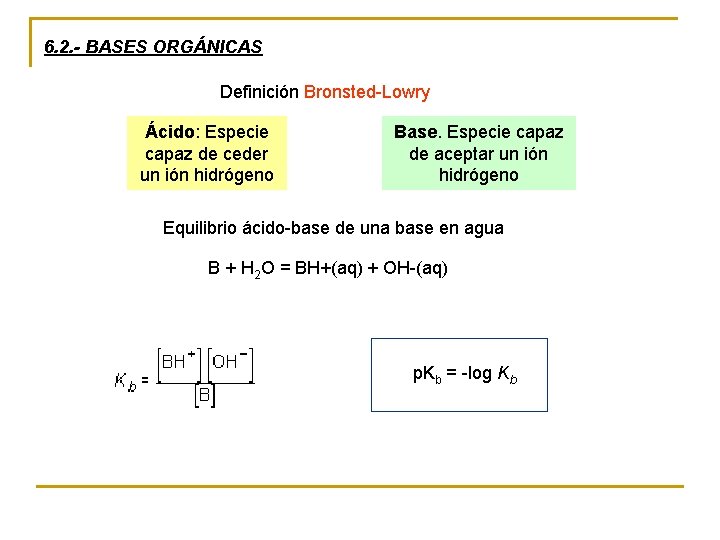
6. 2. - BASES ORGÁNICAS Definición Bronsted-Lowry Ácido: Especie capaz de ceder un ión hidrógeno Base. Especie capaz de aceptar un ión hidrógeno Equilibrio ácido-base de una base en agua B + H 2 O = BH+(aq) + OH-(aq) p. Kb = -log Kb


Comparación de la fuerza de bases débiles Las aminas alifáticas son más fuertes que el amoniaco Las aminas aromáticas son más débiles que el amoniaco

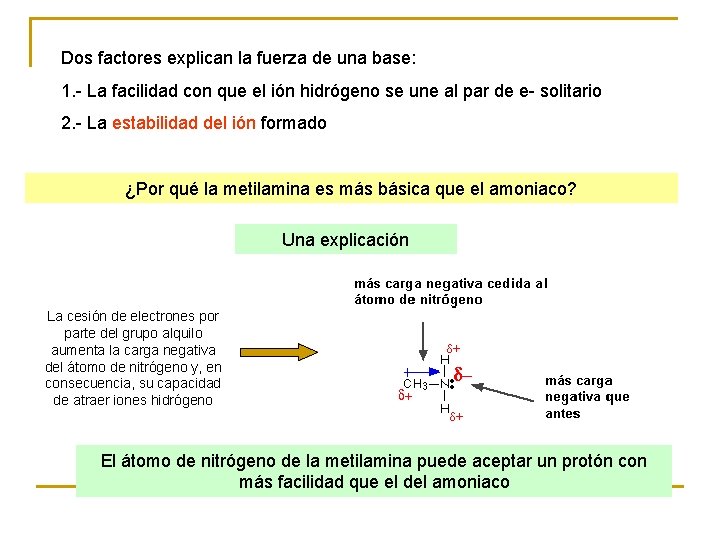
Dos factores explican la fuerza de una base: 1. - La facilidad con que el ión hidrógeno se une al par de e- solitario 2. - La estabilidad del ión formado ¿Por qué la metilamina es más básica que el amoniaco? Una explicación La cesión de electrones por parte del grupo alquilo aumenta la carga negativa del átomo de nitrógeno y, en consecuencia, su capacidad de atraer iones hidrógeno El átomo de nitrógeno de la metilamina puede aceptar un protón con más facilidad que el del amoniaco

Otra explicación El grupo metilo estabiliza el ión metilamonio La cesión de electrones por parte del grupo alquilo dispersa la carga positiva creada sobre el átomo de nitrógeno Los iones que forma la metilamina al aceptar un protón son más estables que los que forma el amoniaco p. Kb CH 3 NH 2 3. 36 CH 3 CH 2 NH 2 3. 27 CH 3 CH 2 NH 2 3. 16 CH 3 CH 2 CH 2 NH 2 3. 39 La cesión de carga eléctrica es similar en todos los grupos alquilo, por ello, las demás aminas primarias alifáticas tienen fuerzas básicas similares

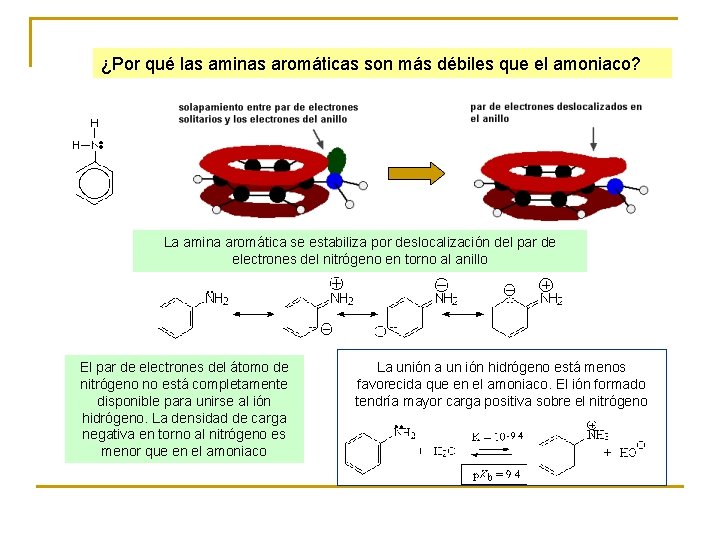
¿Por qué las aminas aromáticas son más débiles que el amoniaco? La amina aromática se estabiliza por deslocalización del par de electrones del nitrógeno en torno al anillo El par de electrones del átomo de nitrógeno no está completamente disponible para unirse al ión hidrógeno. La densidad de carga negativa en torno al nitrógeno es menor que en el amoniaco La unión a un ión hidrógeno está menos favorecida que en el amoniaco. El ión formado tendría mayor carga positiva sobre el nitrógeno

5. - ISOMERÍA

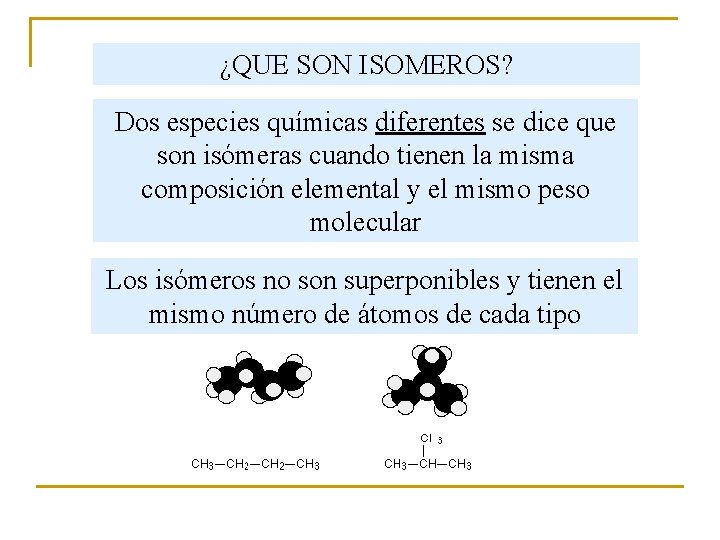
¿QUE SON ISOMEROS? Dos especies químicas diferentes se dice que son isómeras cuando tienen la misma composición elemental y el mismo peso molecular Los isómeros no son superponibles y tienen el mismo número de átomos de cada tipo

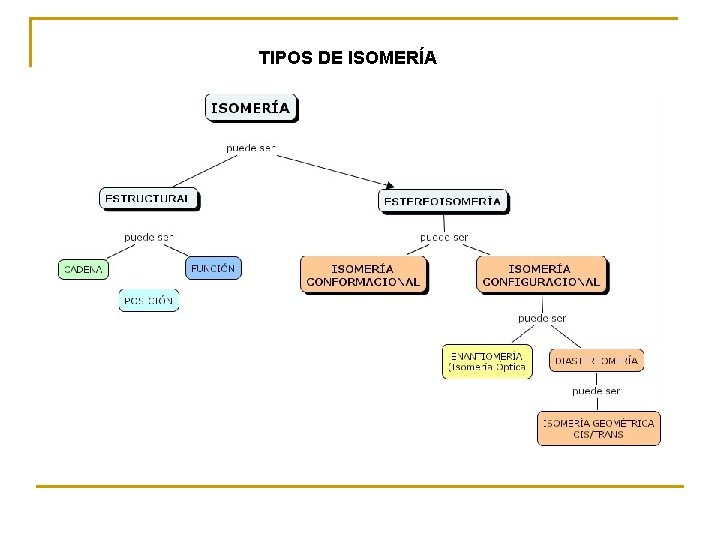
TIPOS DE ISOMERIA ISOMEROS ESTRUCTURALES ESTEREOISOMEROS

TIPOS DE ISOMERÍA

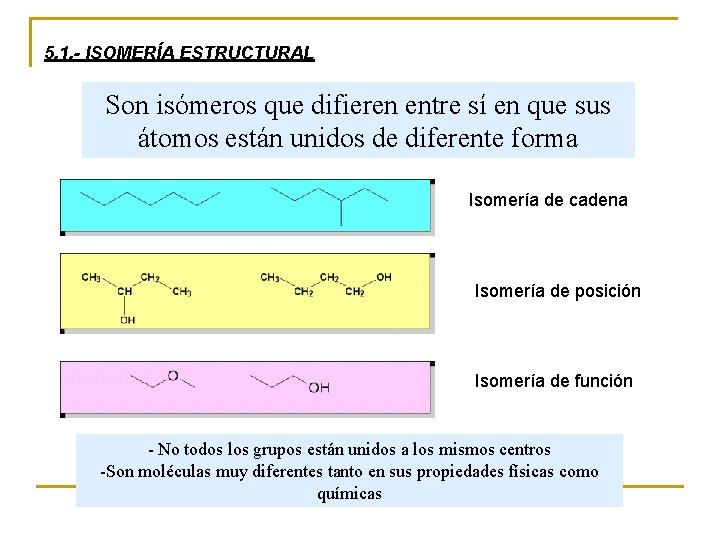
5. 1. - ISOMERÍA ESTRUCTURAL Son isómeros que difieren entre sí en que sus átomos están unidos de diferente forma Isomería de cadena Isomería de posición Isomería de función - No todos los grupos están unidos a los mismos centros -Son moléculas muy diferentes tanto en sus propiedades físicas como químicas

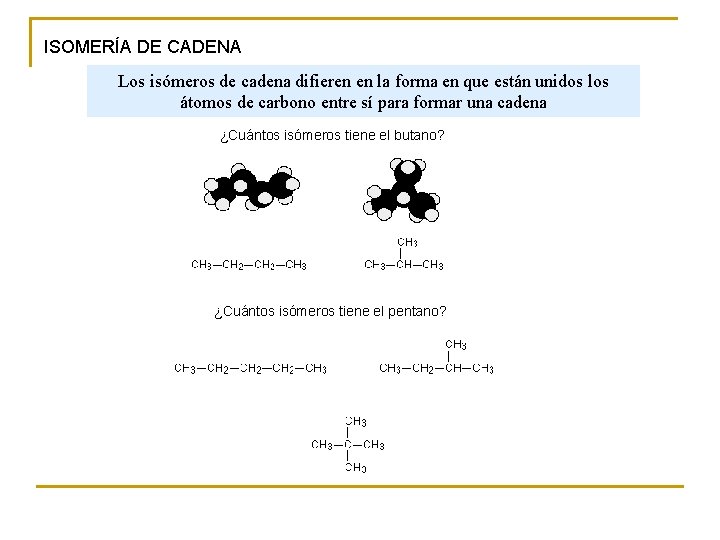
ISOMERÍA DE CADENA Los isómeros de cadena difieren en la forma en que están unidos los átomos de carbono entre sí para formar una cadena ¿Cuántos isómeros tiene el butano? ¿Cuántos isómeros tiene el pentano?

ISOMERÍA DE POSICIÓN Los isómeros de posición difieren en las posiciones que ocupan sus grupos en la estructura carbonada Hay dos isómeros estructurales con la fórmula molecular C 3 H 7 Br Del alcohol con fórmula molecular C 4 H 9 OH se obtienen: Dos isómeros de posición Dos isómeros de cadena

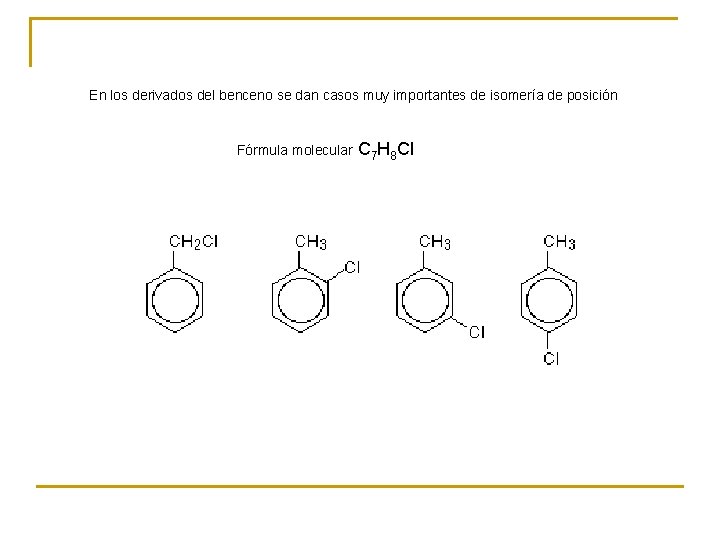
En los derivados del benceno se dan casos muy importantes de isomería de posición Fórmula molecular C 7 H 8 Cl

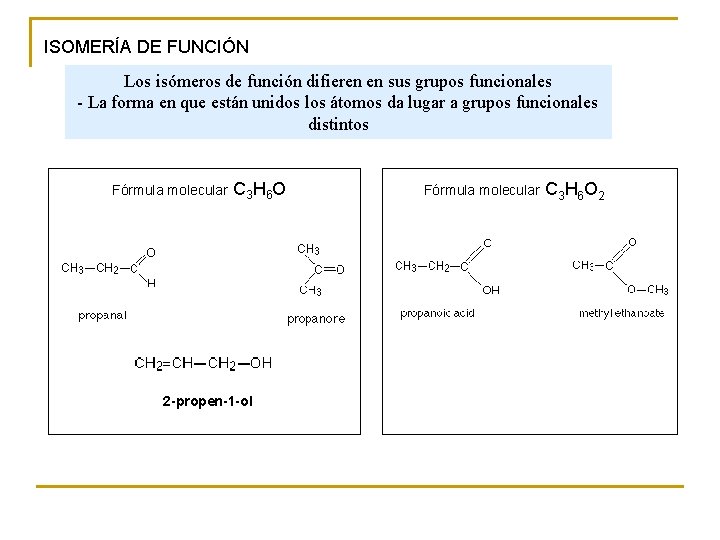
ISOMERÍA DE FUNCIÓN Los isómeros de función difieren en sus grupos funcionales - La forma en que están unidos los átomos da lugar a grupos funcionales distintos Fórmula molecular C 3 H 6 O 2 -propen-1 -ol Fórmula molecular C 3 H 6 O 2

5. 2. - ESTEREOISOMERÍA - ESTEREOISOMEROS CONFORMACIONALES -ESTEREOISOMEROS CONFIGURACIONALES - ENANTIOMEROS - DIASTEROISOMEROS

ESTEREOISOMEROS CONFORMACIONALES La transformación de unos en otros consiste en giros de grupos en el espacio alrededor de enlaces sencillos SON ESTEREOISOMEROS NO AISLABLES POR SEPARADO A TEMPERATURA AMBIENTE O PROXIMA A ELLA La barrera energética a superar para la interconversion es baja Confórmeros del etano

ESTEREOISOMEROS CONFIGURACIONALES Para transformar uno en otro, no basta con realizar giros alrededor de enlaces sencillos sino que es necesario romper y formar enlaces. SON ESTEREOISOMEROS AISLABLES POR SEPARADO A TEMPERATURA AMBIENTE O PROXIMA A ELLA Diasteroisómeros La barrera energética a superar para la interconversión de estereoisómeros configuracionales es alta Enantiómeros

QUIRAL ES AQUEL QUE NO ES SUPERPONIBLE CON SU IMAGEN EN EL ESPEJO

MOLÉCULA QUIRAL

AQUIRAL ES AQUEL QUE ES SUPERPONIBLE CON SU IMAGEN EN EL ESPEJO Tienen elementos de simetría

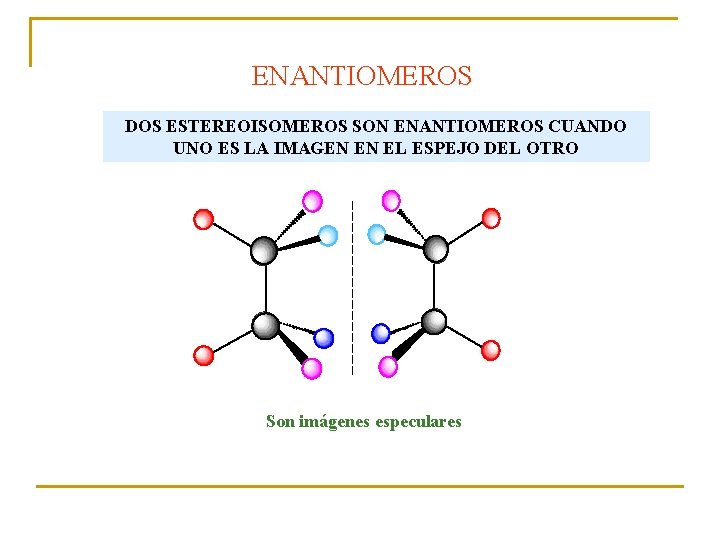
ENANTIOMEROS DOS ESTEREOISOMEROS SON ENANTIOMEROS CUANDO UNO ES LA IMAGEN EN EL ESPEJO DEL OTRO Son imágenes especulares

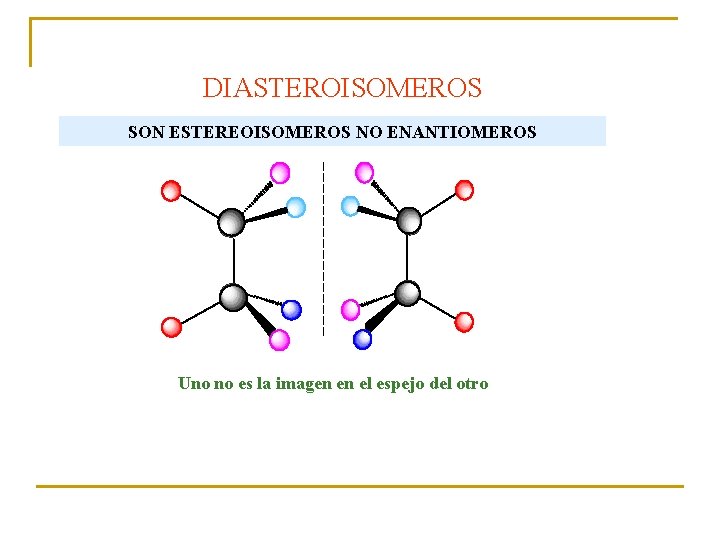
DIASTEROISOMEROS SON ESTEREOISOMEROS NO ENANTIOMEROS Uno no es la imagen en el espejo del otro

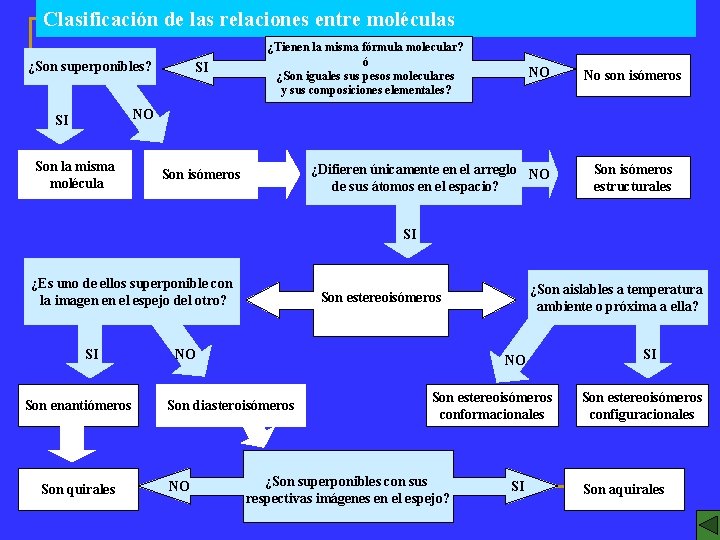
Clasificación de las relaciones entre moléculas ¿Son superponibles? SI ¿Tienen la misma fórmula molecular? ó ¿Son iguales sus pesos moleculares y sus composiciones elementales? NO No son isómeros NO SI Son la misma molécula ¿Difieren únicamente en el arreglo NO de sus átomos en el espacio? Son isómeros estructurales SI ¿Es uno de ellos superponible con la imagen en el espejo del otro? SI Son enantiómeros Son quirales NO NO Son diasteroisómeros NO ¿Son aislables a temperatura ambiente o próxima a ella? Son estereoisómeros conformacionales ¿Son superponibles con sus respectivas imágenes en el espejo? SI SI Son estereoisómeros configuracionales Son aquirales
 Induccin
Induccin Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Lukis
Lukis Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Delimitación de un proyecto de tesis ejemplo
Delimitación de un proyecto de tesis ejemplo Subtema
Subtema Tipo de entrevistas
Tipo de entrevistas Enlace covalente
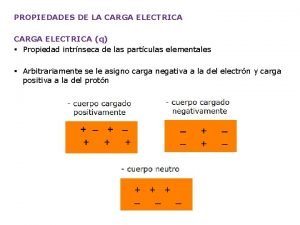
Enlace covalente Propiedades químicas del azufre
Propiedades químicas del azufre Propiedades quimicas de cloro
Propiedades quimicas de cloro Texto expositivo ejemplo
Texto expositivo ejemplo Propiedades de personas
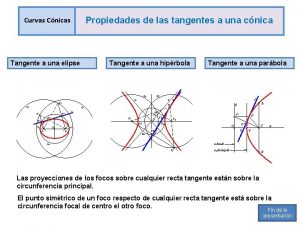
Propiedades de personas Propiedades de la tangente
Propiedades de la tangente Potencia de un logaritmo
Potencia de un logaritmo Nombre de la formula
Nombre de la formula Propiedades mecanicas
Propiedades mecanicas Materiales de origen natural
Materiales de origen natural Niels bohr 1913
Niels bohr 1913 Propiedades de inecuaciones con valor absoluto
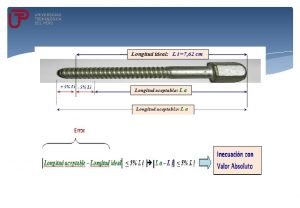
Propiedades de inecuaciones con valor absoluto Propiedades físicas de la materia
Propiedades físicas de la materia Prototipo textual de un poema
Prototipo textual de un poema Centro organizador de microtubulos
Centro organizador de microtubulos Fuerza conservativa
Fuerza conservativa Texto qu
Texto qu Propiedad de la igualdad
Propiedad de la igualdad Propiedades del ácido clorhídrico
Propiedades del ácido clorhídrico Propiedades de los circuitos
Propiedades de los circuitos Do
Do Diagrama t-v de una sustancia pura
Diagrama t-v de una sustancia pura Propiedades de la materia
Propiedades de la materia Esto significa
Esto significa Propiedad de la luz
Propiedad de la luz Formacion de eclipses
Formacion de eclipses Desigualdades
Desigualdades Vapor saturado
Vapor saturado Plano complejo
Plano complejo Propiedades del alginato
Propiedades del alginato Radicación y sus propiedades
Radicación y sus propiedades Radio tangente secante diametro y cuerda
Radio tangente secante diametro y cuerda Nombre cientifico
Nombre cientifico Propiedades fisicas de las cetonas
Propiedades fisicas de las cetonas 5 propiedades de los rayos x
5 propiedades de los rayos x Propiedades de la masa
Propiedades de la masa Propiedades quimicas de los alquinos
Propiedades quimicas de los alquinos Propiedades fisicoquímicas del agua
Propiedades fisicoquímicas del agua Concepto lipidos
Concepto lipidos Propiedades de papel
Propiedades de papel Mecanismos de cohesión ejemplos
Mecanismos de cohesión ejemplos Sistema continuo definicion
Sistema continuo definicion Mapa conceptual de la luz
Mapa conceptual de la luz Teorema de valor absoluto
Teorema de valor absoluto Determinante de la suma de matrices
Determinante de la suma de matrices Como se llama eso
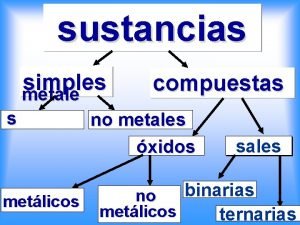
Como se llama eso Mapa conceptual de sustancias simples y compuestas
Mapa conceptual de sustancias simples y compuestas Propiedades de los espejos
Propiedades de los espejos Concepto de materia en química
Concepto de materia en química Propiedades de la potencia
Propiedades de la potencia Lcteos
Lcteos Almecinas propiedades
Almecinas propiedades Ecuación de boltzmann
Ecuación de boltzmann Propiedades de los numeros complejos
Propiedades de los numeros complejos Colores frios y calidos
Colores frios y calidos Propiedades del despeje
Propiedades del despeje Ecuaciones exponenciales y logarítmicas
Ecuaciones exponenciales y logarítmicas Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Identificacion de las propiedades fisicas de los materiales
Identificacion de las propiedades fisicas de los materiales Propiedades de los radicales ejemplos
Propiedades de los radicales ejemplos Propiedades de los materiales definición
Propiedades de los materiales definición Propiedades organolepticas de la materia
Propiedades organolepticas de la materia El comportamiento de un gas
El comportamiento de un gas Propiedades fisicas de los hidrocarburos
Propiedades fisicas de los hidrocarburos Butanamida estructura
Butanamida estructura Propiedades fisicas alcanos
Propiedades fisicas alcanos Cuáles son las propiedades del átomo de carbono
Cuáles son las propiedades del átomo de carbono Aldehidos y cetonas propiedades quimicas
Aldehidos y cetonas propiedades quimicas Descripción de las propiedades de la materia
Descripción de las propiedades de la materia Archubi propiedades
Archubi propiedades Las propiedades visuales de la forma
Las propiedades visuales de la forma C qumica
C qumica Rectngulos
Rectngulos Como se clasifican las propiedades de los materiales
Como se clasifican las propiedades de los materiales Partes del electroscopio
Partes del electroscopio Propiedades de los sistemas
Propiedades de los sistemas Logaritmo de la unidad ejemplo
Logaritmo de la unidad ejemplo Arco en fisica
Arco en fisica Ejemplos de conjuntos finitos
Ejemplos de conjuntos finitos Relaciones binarias ejemplos
Relaciones binarias ejemplos Desigualdades lineales propiedades
Desigualdades lineales propiedades Propiedades quimicas de los esteres
Propiedades quimicas de los esteres Fusibilidad de la madera
Fusibilidad de la madera Gases nobles
Gases nobles Propiedades exponenciales
Propiedades exponenciales Trapecios y trapezoides
Trapecios y trapezoides Flores de heno propiedades
Flores de heno propiedades Tabla de las propiedades
Tabla de las propiedades Cemento propiedades
Cemento propiedades Propiedades físicas de la materia
Propiedades físicas de la materia Adecuacin
Adecuacin Propiedades de los radicales ejemplos
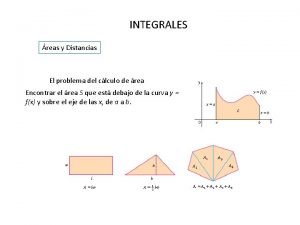
Propiedades de los radicales ejemplos Integrales propiedades
Integrales propiedades Propiedades de la luz para niños
Propiedades de la luz para niños Sustancia
Sustancia Pirimidinas
Pirimidinas Fuerza neta
Fuerza neta Propiedades del sonido
Propiedades del sonido Propiedades semejantes
Propiedades semejantes Ducina ou cimalha
Ducina ou cimalha Propiedades de las soluciones
Propiedades de las soluciones Valor absoluto propiedades
Valor absoluto propiedades Propiedades de la suma
Propiedades de la suma El cuadrado de saturno
El cuadrado de saturno Propiedad
Propiedad Tres propiedades del aire
Tres propiedades del aire G=h-ts
G=h-ts Nivel supramolecular
Nivel supramolecular Diversidad de la materia
Diversidad de la materia Propiedades de los hidrocarburos aromáticos
Propiedades de los hidrocarburos aromáticos Formula de presion de vapor propiedades coligativas
Formula de presion de vapor propiedades coligativas Propiedades químicas de los fenoles
Propiedades químicas de los fenoles Formula del carbonilo
Formula del carbonilo Propiedades de sumatoria
Propiedades de sumatoria Producto escalar entre vectores
Producto escalar entre vectores Problemas de circunferencias resueltos
Problemas de circunferencias resueltos Propiedades de los materiales
Propiedades de los materiales Ejercicios de radio atómico
Ejercicios de radio atómico Propiedades fisicas de los esteres
Propiedades fisicas de los esteres Induccion matematica
Induccion matematica Halogenos anfigenos nitrogenoides carbonoideos
Halogenos anfigenos nitrogenoides carbonoideos Propiedades de la inecuación
Propiedades de la inecuación Modelos exponenciales
Modelos exponenciales Cuales son las propiedades de los compuestos ionicos
Cuales son las propiedades de los compuestos ionicos 5 materiales solidos
5 materiales solidos Generalidades de los hidrocarburos
Generalidades de los hidrocarburos Grupo funcional importancia
Grupo funcional importancia Propiedades transformada z
Propiedades transformada z Imagenes de intensidad en musica
Imagenes de intensidad en musica Cuáles son los niveles de organización biológica
Cuáles son los niveles de organización biológica Importancia de conocer las propiedades logarítmicas
Importancia de conocer las propiedades logarítmicas Halogenuros de vinilo
Halogenuros de vinilo Propiedades del algebra de boole
Propiedades del algebra de boole Plasticos caracteristicas y propiedades
Plasticos caracteristicas y propiedades Propiedades generales
Propiedades generales Propiedades de la potencia
Propiedades de la potencia Propiedades valor absoluto
Propiedades valor absoluto Propiedades de la materia
Propiedades de la materia Mercurio propiedades
Mercurio propiedades Indice de hausner y carr
Indice de hausner y carr Contrario a exponencial
Contrario a exponencial Propiedades del texto
Propiedades del texto