SEMANA 3 ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES





- Slides: 14

SEMANA 3 ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES QUÍMICA 2017 1

Estructuras de Lewis o fórmulas de electrón punto de compuestos Muestran los e- de valencia (# de columna) de los átomos, y en compuestos muestra los ecompartidos ó pares de enlace, los e- libres ó pares no enlazados. (Asumir que hay 4 lados con 2 e- como máximo por lado). Se utilizado en compuestos covalentes para determinar si el enlace covalentes es simple, doble, triple ó dativo (coordinado). 2

Como armar la estructura de Lewis Ej: H 2 S 04 1. Al centro el no-metal con subíndice 1. (S) 2. Rodearlo con el no-metal de subíndice mayor. (O 4) 3. Colocar los electrones de valencia de cada átomo, tratando de queden pares de electrones enlazando los átomos. 4. Si no se completan octetos, trasladar pares de electrones libres hacia el enlace para completar. • El H o Metales se unen a Oxígenos. • El H se llena con 2 electrones. 3

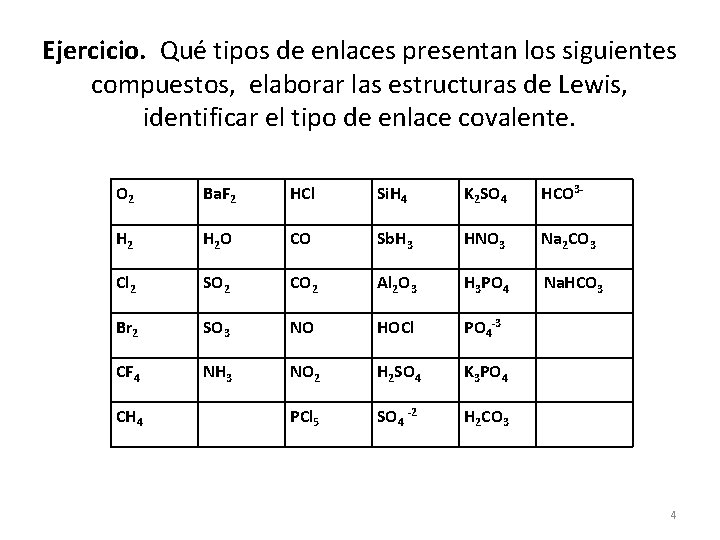
Ejercicio. Qué tipos de enlaces presentan los siguientes compuestos, elaborar las estructuras de Lewis, identificar el tipo de enlace covalente. O 2 Ba. F 2 HCl Si. H 4 K 2 SO 4 HCO 3 - H 2 O CO Sb. H 3 HNO 3 Na 2 CO 3 Cl 2 SO 2 CO 2 Al 2 O 3 H 3 PO 4 Na. HCO 3 Br 2 SO 3 NO HOCl PO 4 -3 CF 4 NH 3 NO 2 H 2 SO 4 K 3 PO 4 PCl 5 SO 4 -2 H 2 CO 3 CH 4 4

Excepciones a la regla del Octeto • OCTETO INCOMPLETO: • Se da cuando uno de los átomo del enlace no completa el octeto. Ej: NO (el N queda con 7 electrones de valencia). . xx N: O x x xx 5

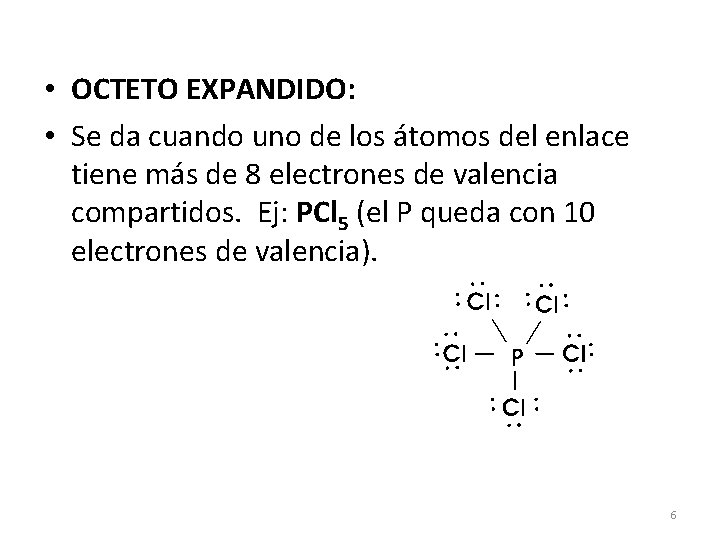
• OCTETO EXPANDIDO: • Se da cuando uno de los átomos del enlace tiene más de 8 electrones de valencia compartidos. Ej: PCl 5 (el P queda con 10 electrones de valencia). 6

FUERZAS ó ATRACCIONES INTERMOLECULARES también llamadas Fuerzas de Van der Walls (son atracciones entre moléculas ó compuestos) • Fuerzas de dispersión (ó de London) • Fuerzas dipolares (dipolo-dipolo) • Puentes de hidrógeno A diferencia de los enlaces interatómicos iónico y covalente, estas atracciones se dan entre moléculas. Son más débiles pero contribuyen a determinar las propiedades físicas de las sustancias moleculares. 7

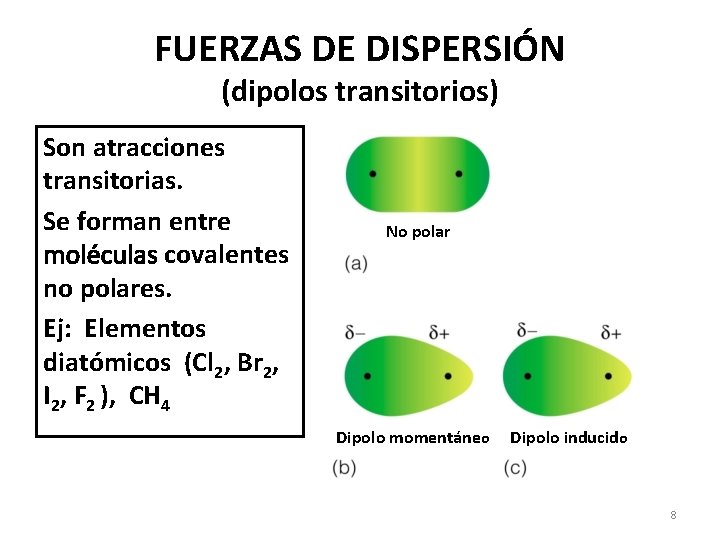
FUERZAS DE DISPERSIÓN (dipolos transitorios) Son atracciones transitorias. Se forman entre moléculas covalentes no polares. Ej: Elementos diatómicos (Cl 2, Br 2, I 2, F 2 ), CH 4 No polar Dipolo momentáneo Dipolo inducido 8

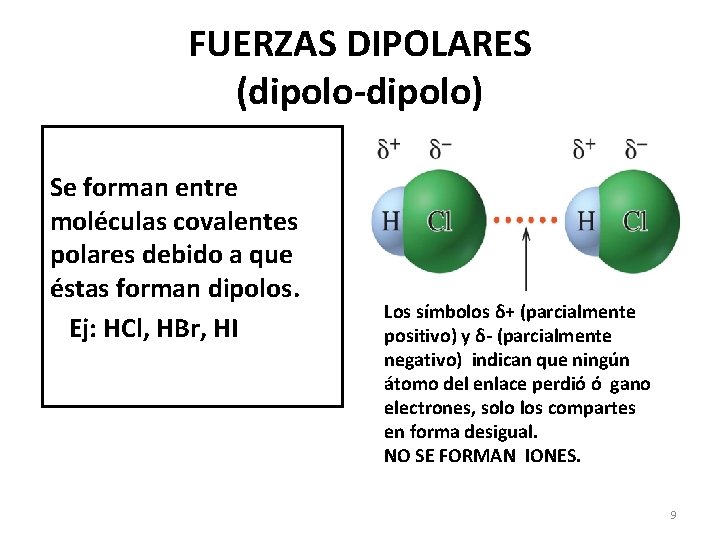
FUERZAS DIPOLARES (dipolo-dipolo) Se forman entre moléculas covalentes polares debido a que éstas forman dipolos. Ej: HCl, HBr, HI Los símbolos δ+ (parcialmente positivo) y δ- (parcialmente negativo) indican que ningún átomo del enlace perdió ó gano electrones, solo los compartes en forma desigual. NO SE FORMAN IONES. 9

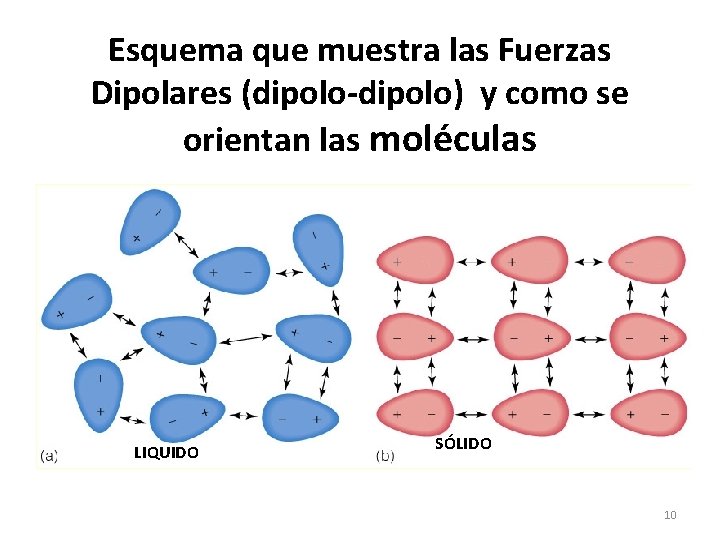
Esquema que muestra las Fuerzas Dipolares (dipolo-dipolo) y como se orientan las moléculas LIQUIDO SÓLIDO 10

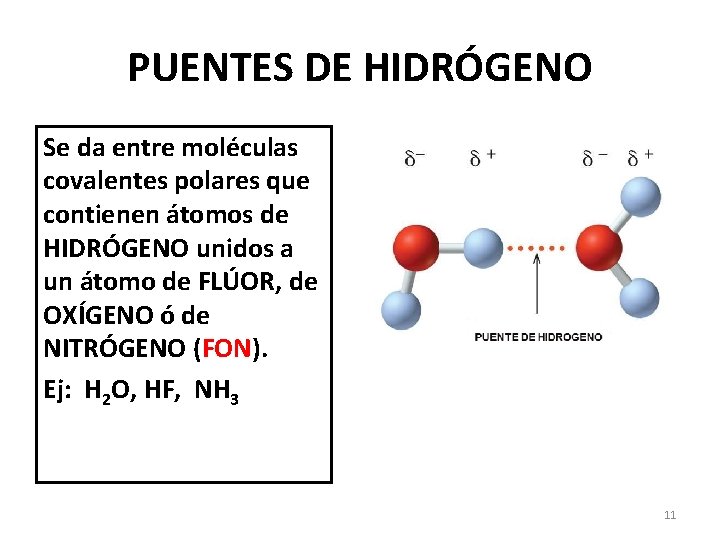
PUENTES DE HIDRÓGENO Se da entre moléculas covalentes polares que contienen átomos de HIDRÓGENO unidos a un átomo de FLÚOR, de OXÍGENO ó de NITRÓGENO (FON). Ej: H 2 O, HF, NH 3 11

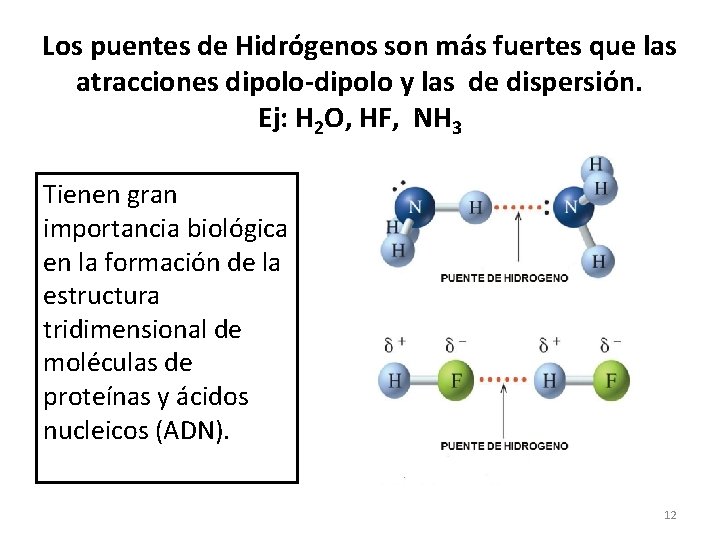
Los puentes de Hidrógenos son más fuertes que las atracciones dipolo-dipolo y las de dispersión. Ej: H 2 O, HF, NH 3 Tienen gran importancia biológica en la formación de la estructura tridimensional de moléculas de proteínas y ácidos nucleicos (ADN). 12

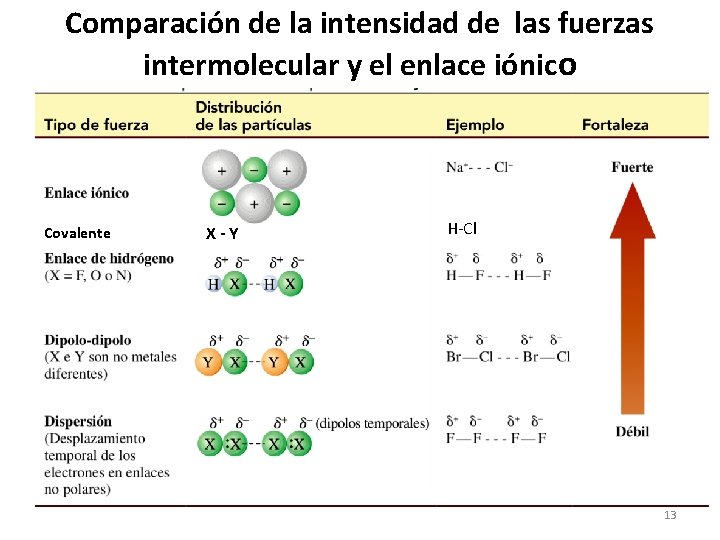
Comparación de la intensidad de las fuerzas intermolecular y el enlace iónico Covalente X-Y H-Cl 13

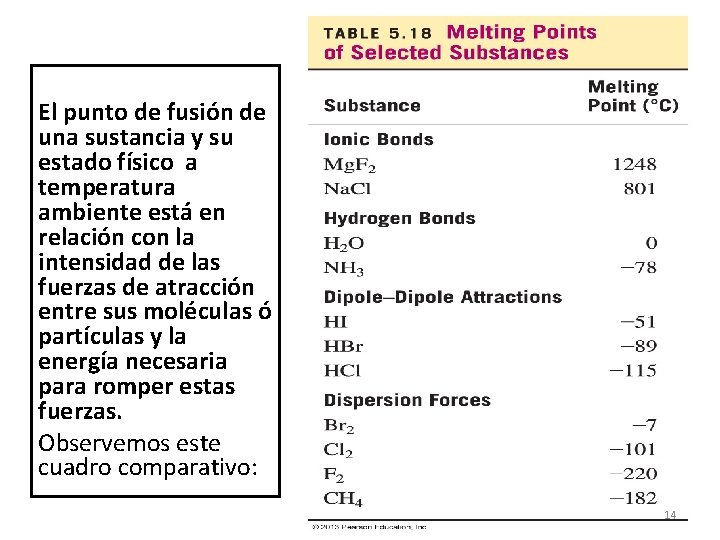
El punto de fusión de una sustancia y su estado físico a temperatura ambiente está en relación con la intensidad de las fuerzas de atracción entre sus moléculas ó partículas y la energía necesaria para romper estas fuerzas. Observemos este cuadro comparativo: 14
 Fuerzas intermoleculares
Fuerzas intermoleculares Momento dipolo dipolo
Momento dipolo dipolo Fuerzas intermoleculares
Fuerzas intermoleculares Fuerzas intermoleculares so4
Fuerzas intermoleculares so4 Dipolo instantâneo
Dipolo instantâneo Que son pares
Que son pares Diferencia entre fuerza de contacto y a distancia
Diferencia entre fuerza de contacto y a distancia Fuerzas dipolo-dipolo ejemplos
Fuerzas dipolo-dipolo ejemplos Forcas intermoleculares
Forcas intermoleculares Magnitud
Magnitud Macrolocalizacion
Macrolocalizacion Principio de los trabajos virtuales
Principio de los trabajos virtuales Universidad de las fuerzas armadas espe
Universidad de las fuerzas armadas espe Sistemas equivalentes de fuerzas
Sistemas equivalentes de fuerzas Como saber si un elemento es polar o apolar
Como saber si un elemento es polar o apolar