FUERZAS INTERMOLECULARES Y PROPIEDADES DE SUSTANCIAS FUERZAS INTERMOLECULARES







- Slides: 14

FUERZAS INTERMOLECULARES Y PROPIEDADES DE SUSTANCIAS

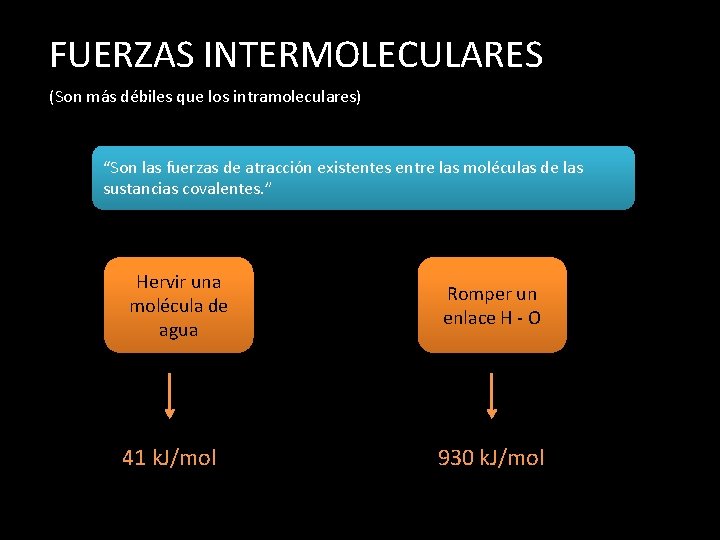
FUERZAS INTERMOLECULARES (Son más débiles que los intramoleculares) “Son las fuerzas de atracción existentes entre las moléculas de las sustancias covalentes. ” Hervir una molécula de agua 41 k. J/mol Romper un enlace H - O 930 k. J/mol

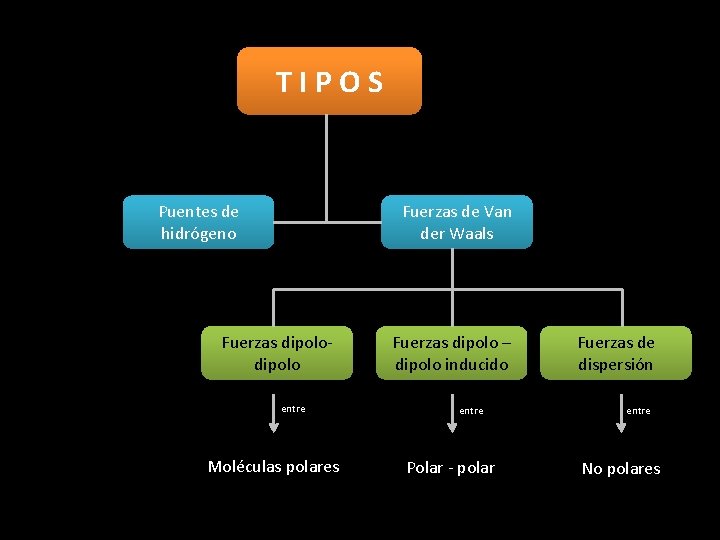
TIPOS Puentes de hidrógeno Fuerzas de Van der Waals Fuerzas dipolo entre Moléculas polares Fuerzas dipolo – dipolo inducido entre Polar - polar Fuerzas de dispersión entre No polares

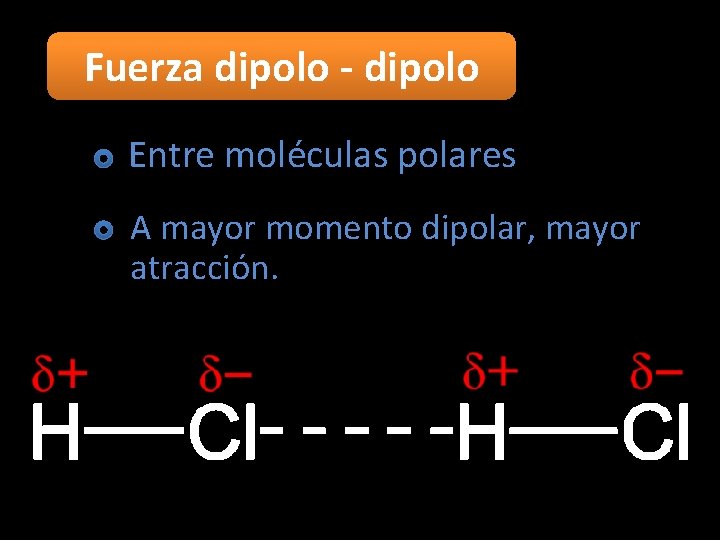
Fuerza dipolo - dipolo Entre moléculas polares A mayor momento dipolar, mayor atracción.

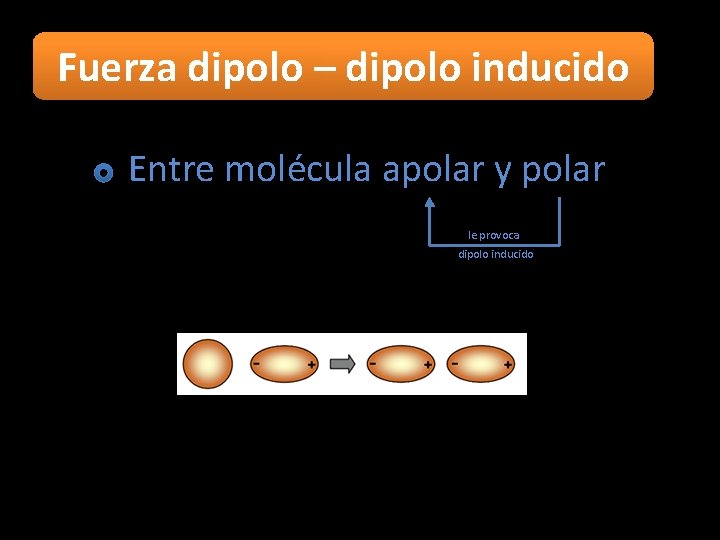
Fuerza dipolo – dipolo inducido Entre molécula apolar y polar le provoca dipolo inducido

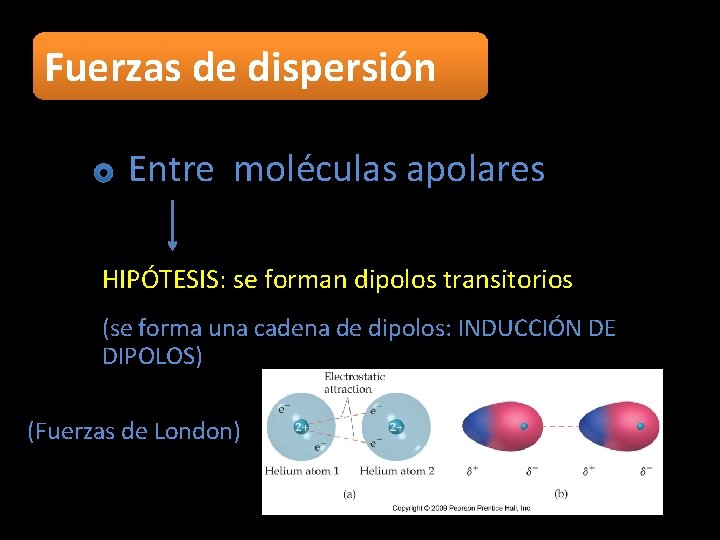
Fuerzas de dispersión Entre moléculas apolares HIPÓTESIS: se forman dipolos transitorios (se forma una cadena de dipolos: INDUCCIÓN DE DIPOLOS) (Fuerzas de London)

Puentes de Hidrógeno Dipolo – dipolo pero con átomo de H implicado CONDICIÓN: suficiente diferencia de electronegatividad H 2 O ; NH 3 ; HF


Para hacer problemas: Cuanto mayor sea la fuerza del enlace intermolecular, más altos serán el punto de fusión y ebullición. Cuanto mayor sea el volumen del átomo de la molécula, más intensas serán las fuerzas de dispersión

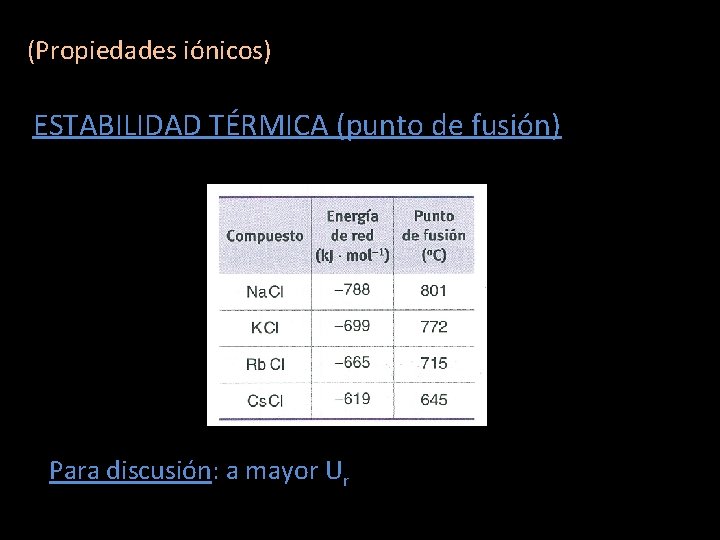
PROPIEDADES SUSTANCIAS IÓNICAS Magnitud clave: Para discusión: a mayor Ur mayor pº fusión

(Propiedades iónicos) ESTABILIDAD TÉRMICA (punto de fusión) Para discusión: a mayor Ur

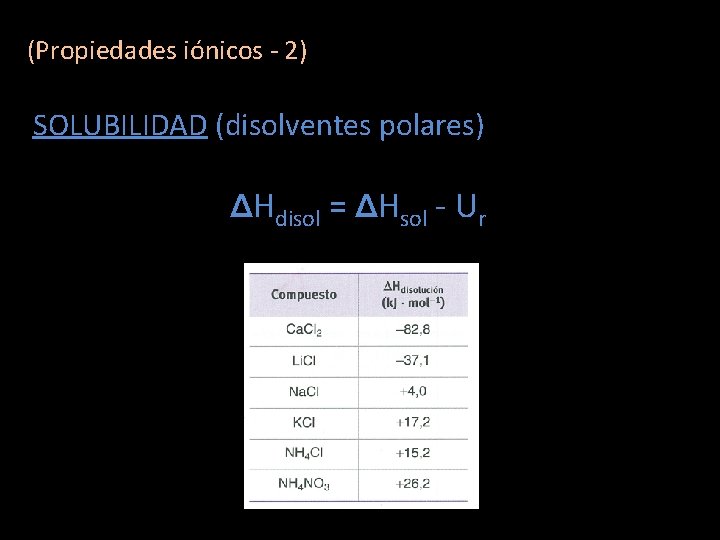
(Propiedades iónicos - 2) SOLUBILIDAD (disolventes polares) (Un enlace iónico es un enlace polar llevado al límite) Consumida: Ur (romper el cristal) ENERGÍAS Desprendida: ΔH solvatación (estabilidad)

(Propiedades iónicos - 2) SOLUBILIDAD (disolventes polares) ΔHdisol = ΔHsol - Ur

SUSTANCIAS COVALENTE ATÓMICAS Redes de átomos unidos por enlaces covalentes. Ejemplo: diamante, Si. O 2, Si. C, grafito Punto de fusión muy elevado. No son conductores de la electricidad Son insolubles
 Dipolo instantâneo
Dipolo instantâneo Estructura de valencia
Estructura de valencia Calor molar de sublimacion
Calor molar de sublimacion Fuerzas intermoleculares
Fuerzas intermoleculares Fuerzas intermoleculares
Fuerzas intermoleculares Clases de fuerzas intermoleculares
Clases de fuerzas intermoleculares Propiedades de las sustancias puras
Propiedades de las sustancias puras Cengel
Cengel Que son las fuerzas a distancia
Que son las fuerzas a distancia Que son fuerzas intramoleculares
Que son fuerzas intramoleculares Mapa mental polaridade das moleculas
Mapa mental polaridade das moleculas Cuales son las sustancias simples
Cuales son las sustancias simples Metodos de separacion de mezclas homogeneas
Metodos de separacion de mezclas homogeneas Sustancias inertes
Sustancias inertes Sustancias nacivas
Sustancias nacivas