SEMANA 3 ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES






- Slides: 20

SEMANA 3 ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES QUÍMICA 2021 1

SEMANA 03 ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES Estructuras de Lewis - Compuestos terciarios, cuaternarios e iones poli atómicos. - Excepciones a regla del octeto: - Incompleto ejemplos: NO, BCl 3, Be. Cl 2, Cl. O 2 - Expandido ejemplos: PCl 5, SF 6 Principales Fuerzas intermoleculares - Dipolo-dipolo - Dispersión - Puentes de hidrógeno Aplicación de los conceptos en la salud y el ambiente. 2

Estructuras de Lewis o fórmulas de electrón punto de compuestos De los átomos: muestra los electrones de valencia, según su # de columna. De los compuestos: muestra los electrones compartidos ó pares de enlace y los electrones libres ó pares no enlazados. Para dibujarlas se asume que los símbolos está rodeado 4 lados donde se colocan 2 e- como máximo por lado). Se utilizan principalmente en los compuestos covalentes para determinar si sus enlaces covalentes son simples, dobles, triples ó dativos (coordinado). 3

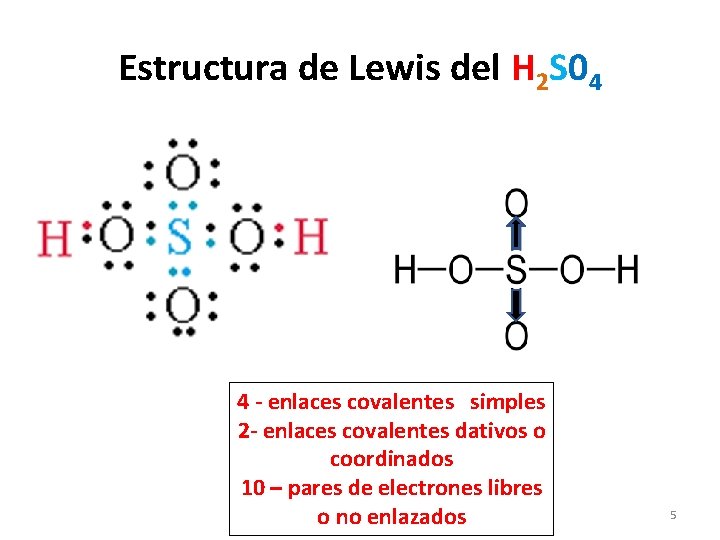
Como armar estructuras de Lewis Ej: H 2 S 04 (ácido sulfúrico) 1. Al centro se escribe el símbolo del no-metal central de la fórmula (S). (Siempre habrá solo uno) 2. Rodearlo con el no-metal de subíndice mayor. ( 4 0 x) 3. El H o Metales siempre se unen a los Oxígenos. (2 H) 4. Colocar los electrones de valencia) de cada átomo, (ver su columna), tratando de queden electrones que puedan formar enlace con otro átomo. 5. Verificar que se completan los octetos de cada átomo. 6. Si no se completan octetos, trasladar pares de electrones libres hacia el enlace para completar. (El H se llena con 2 electrones, no cumple octeto) 4

Estructura de Lewis del H 2 S 04 4 - enlaces covalentes simples 2 - enlaces covalentes dativos o coordinados 10 – pares de electrones libres o no enlazados 5

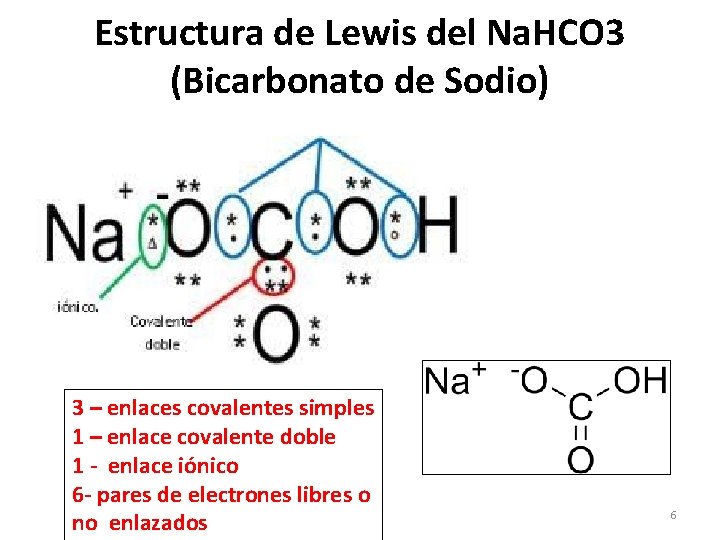
Estructura de Lewis del Na. HCO 3 (Bicarbonato de Sodio) 3 – enlaces covalentes simples 1 – enlace covalente doble 1 - enlace iónico 6 - pares de electrones libres o no enlazados 6

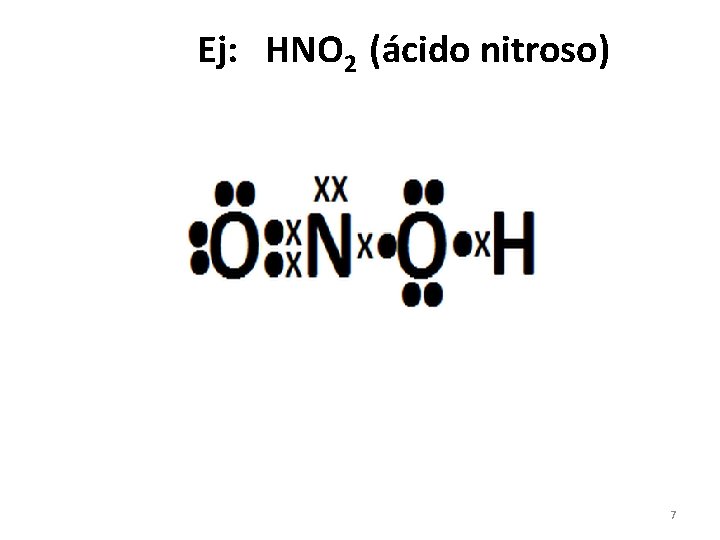
Ej: HNO 2 (ácido nitroso) 7

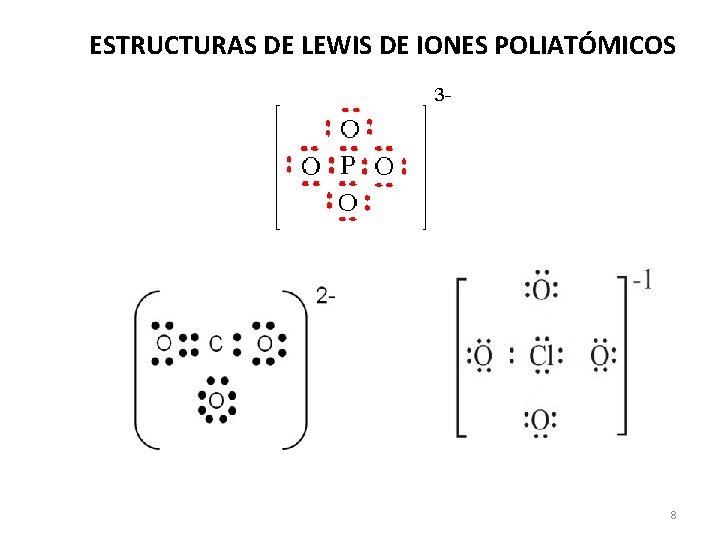
ESTRUCTURAS DE LEWIS DE IONES POLIATÓMICOS 8

Ejercicio. Qué tipos de enlaces presentan los siguientes compuestos? Elaborar las estructuras de Lewis para identificar el tipo de enlace covalente y algunos iónicos. O 2 Ba. F 2 HCl Si. H 4 K 2 SO 4 HCO 3 - H 2 O CO Sb. H 3 HNO 3 Na 2 CO 3 Cl 2 SO 2 CO 2 Al 2 O 3 H 3 PO 4 Na. HCO 3 Br 2 SO 3 NO HOCl PO 4 -3 CF 4 NH 3 NO 2 H 2 SO 4 K 3 PO 4 PCl 5 SO 4 -2 H 2 CO 3 CH 4 9

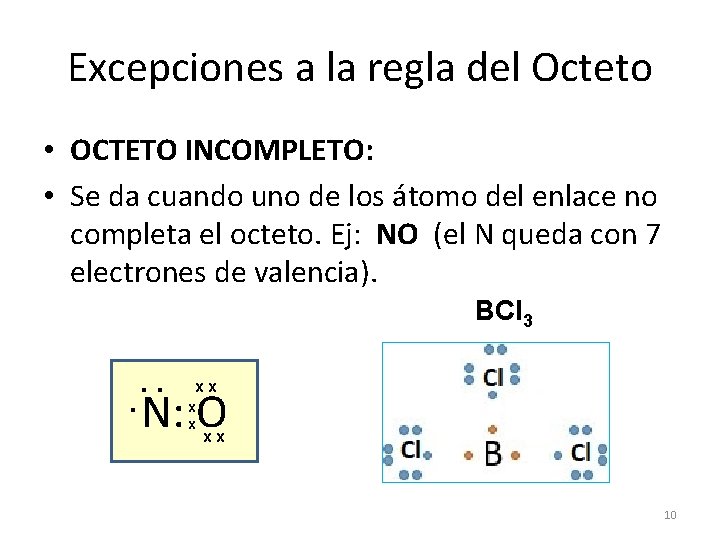
Excepciones a la regla del Octeto • OCTETO INCOMPLETO: • Se da cuando uno de los átomo del enlace no completa el octeto. Ej: NO (el N queda con 7 electrones de valencia). BCl 3. . . xx N: O x x xx 10

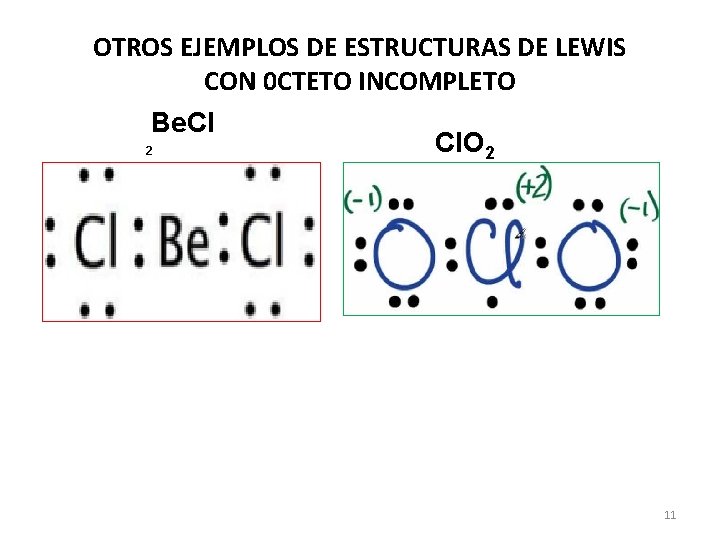
OTROS EJEMPLOS DE ESTRUCTURAS DE LEWIS CON 0 CTETO INCOMPLETO Be. Cl 2 Cl. O 2 11

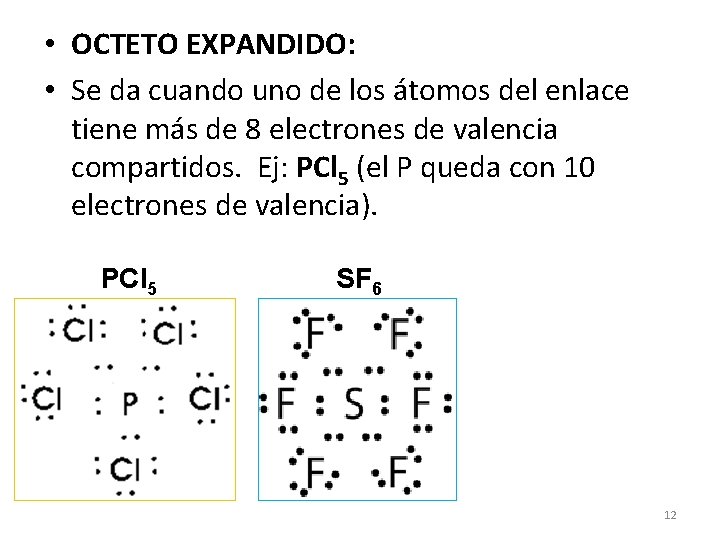
• OCTETO EXPANDIDO: • Se da cuando uno de los átomos del enlace tiene más de 8 electrones de valencia compartidos. Ej: PCl 5 (el P queda con 10 electrones de valencia). PCl 5 SF 6 12

FUERZAS ó ATRACCIONES INTERMOLECULARES también llamadas Fuerzas de Van der Walls (son atracciones entre moléculas ó compuestos) • Fuerzas de dispersión (ó de London) • Fuerzas dipolares (dipolo-dipolo) • Puentes de hidrógeno Los enlaces iónico y covalente son interatómicos (unen átomos). Las fuerzas de dispersión, dipolares y de hidrógeno son intermoleculares (atraen moléculas). Son más débiles pero contribuyen a determinar las propiedades físicas de los compuestos. 13

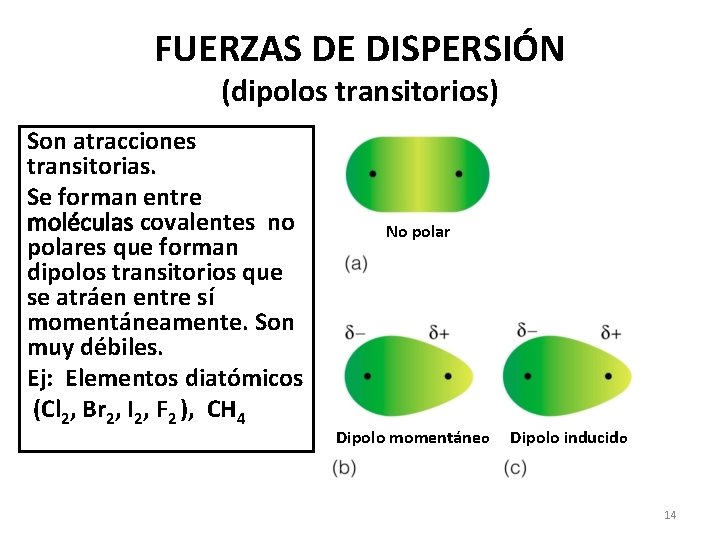
FUERZAS DE DISPERSIÓN (dipolos transitorios) Son atracciones transitorias. Se forman entre moléculas covalentes no polares que forman dipolos transitorios que se atráen entre sí momentáneamente. Son muy débiles. Ej: Elementos diatómicos (Cl 2, Br 2, I 2, F 2 ), CH 4 No polar Dipolo momentáneo Dipolo inducido 14

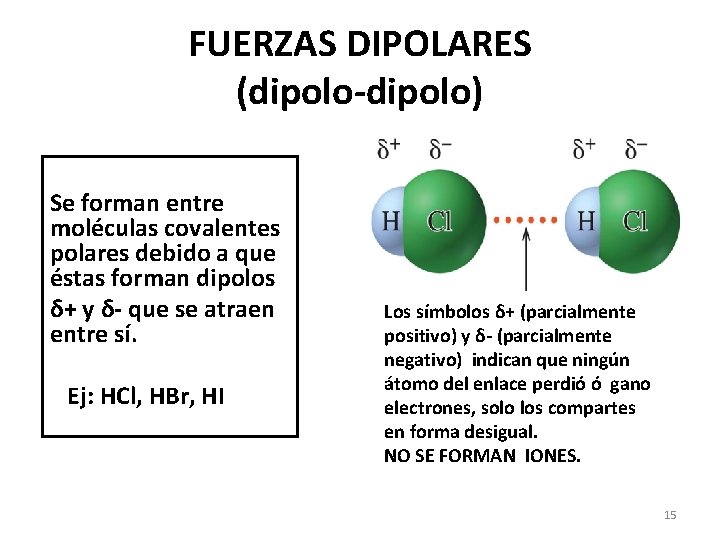
FUERZAS DIPOLARES (dipolo-dipolo) Se forman entre moléculas covalentes polares debido a que éstas forman dipolos δ+ y δ- que se atraen entre sí. Ej: HCl, HBr, HI Los símbolos δ+ (parcialmente positivo) y δ- (parcialmente negativo) indican que ningún átomo del enlace perdió ó gano electrones, solo los compartes en forma desigual. NO SE FORMAN IONES. 15

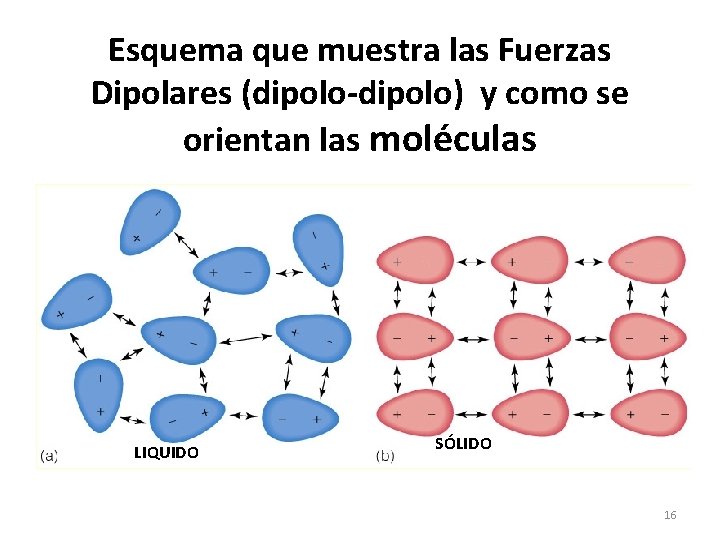
Esquema que muestra las Fuerzas Dipolares (dipolo-dipolo) y como se orientan las moléculas LIQUIDO SÓLIDO 16

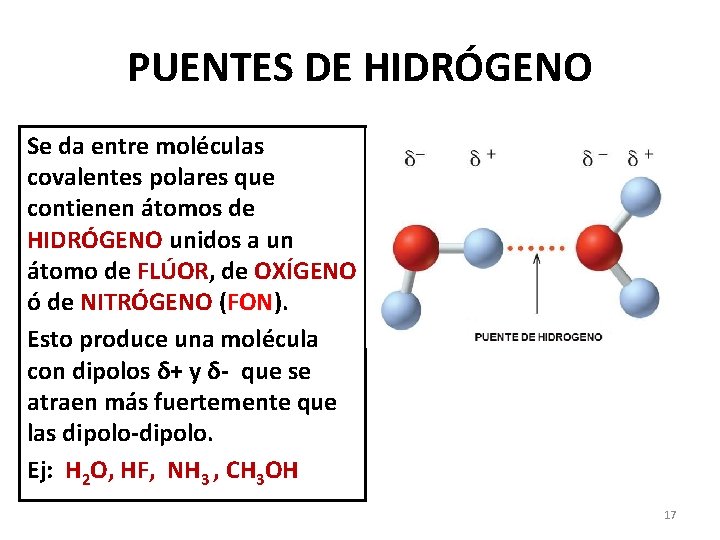
PUENTES DE HIDRÓGENO Se da entre moléculas covalentes polares que contienen átomos de HIDRÓGENO unidos a un átomo de FLÚOR, de OXÍGENO ó de NITRÓGENO (FON). Esto produce una molécula con dipolos δ+ y δ- que se atraen más fuertemente que las dipolo-dipolo. Ej: H 2 O, HF, NH 3 , CH 3 OH 17

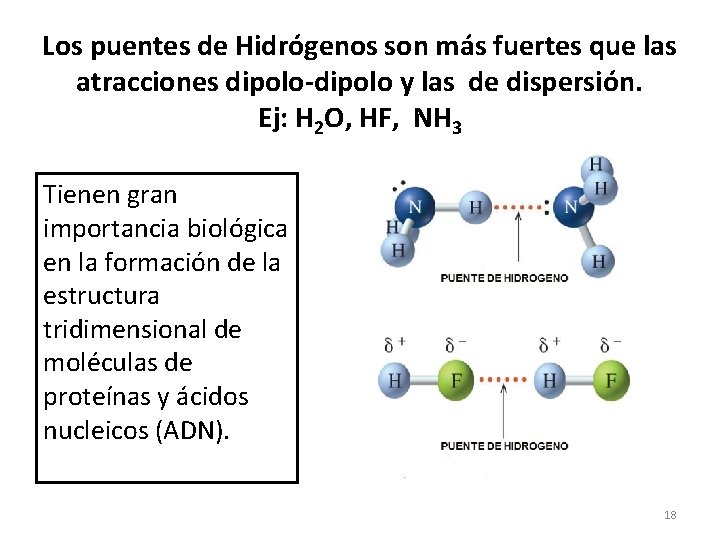
Los puentes de Hidrógenos son más fuertes que las atracciones dipolo-dipolo y las de dispersión. Ej: H 2 O, HF, NH 3 Tienen gran importancia biológica en la formación de la estructura tridimensional de moléculas de proteínas y ácidos nucleicos (ADN). 18

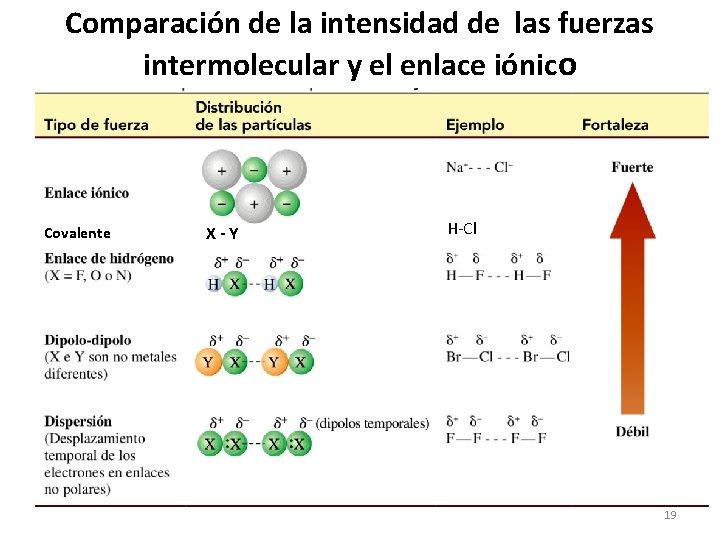
Comparación de la intensidad de las fuerzas intermolecular y el enlace iónico Covalente X-Y H-Cl 19

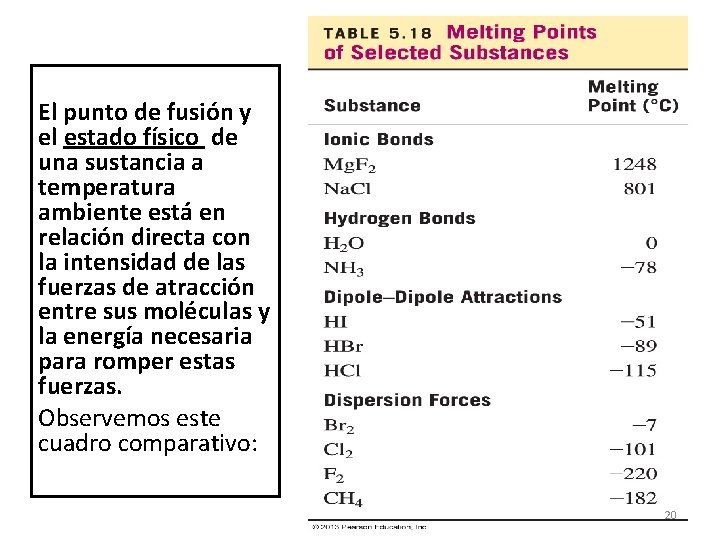
El punto de fusión y el estado físico de una sustancia a temperatura ambiente está en relación directa con la intensidad de las fuerzas de atracción entre sus moléculas y la energía necesaria para romper estas fuerzas. Observemos este cuadro comparativo: 20
 Otro lado
Otro lado Argon punto de fusion y ebullicion
Argon punto de fusion y ebullicion Fuerzas intermoleculares
Fuerzas intermoleculares Ch2fcooh nombre
Ch2fcooh nombre Fuerzas intermoleculares so4
Fuerzas intermoleculares so4 Fuerzas intermoleculares ejemplos
Fuerzas intermoleculares ejemplos Fuerzas por contacto y fuerzas a distancia ejemplos
Fuerzas por contacto y fuerzas a distancia ejemplos Mapa mental polaridade das moleculas
Mapa mental polaridade das moleculas Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Unidades de medida para fuerza
Unidades de medida para fuerza Friccion
Friccion Ion dipolo
Ion dipolo Tercera ley de newton
Tercera ley de newton Fuerzas por contacto
Fuerzas por contacto Direccion de la fuerza neta
Direccion de la fuerza neta Magnitud
Magnitud Macrolocalizacion
Macrolocalizacion Universidad de las fuerzas armadas espe
Universidad de las fuerzas armadas espe Sistemas equivalentes de fuerzas
Sistemas equivalentes de fuerzas 10 ejemplos fuerzas de van der waals ejemplos
10 ejemplos fuerzas de van der waals ejemplos Aplicaciones del principio del trabajo virtual
Aplicaciones del principio del trabajo virtual