REPASO DE CONTENIDOS Enlace qumico fuerzas intermoleculares y











- Slides: 21

REPASO DE CONTENIDOS Enlace químico, fuerzas intermoleculares y geometría molecular.

¿Qué es un enlace químico? O Es la unión entre dos o más átomos, a través de los electrones de valencia. Para lograr estabilidad (bajar su energía). Entre los enlaces químicos, encontramos el enlace covalente, iónico y metálico.

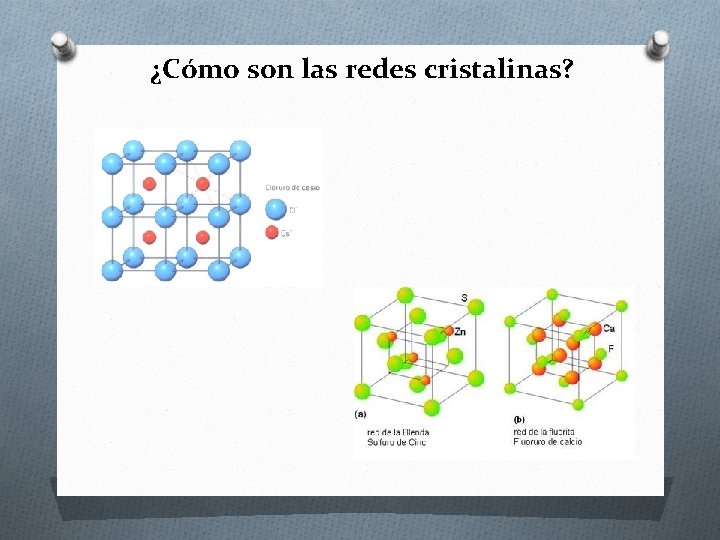
¿Cuáles son las características y propiedades del enlace iónico? Características del enlace Propiedades de los compuestos • Se define como la fuerza electroestática que une los átomos de un metal (catión) y un no metal (anión), a través de iones. • Se forma entre elementos de los grupos IA o IIA con elementos de los grupos VIA o VIIA. • Diferencia de electronegatividad ≥ 1, 7 • Forman redes cristalinas. • Son sólidos con puntos de fusión y ebullición altos. • Son solubles en disolventes polares, pero insolubles en disolventes apolares. • Conducen la corriente eléctrica en disolución acuosa. • Son malos conductores térmicos.

¿Cómo son las redes cristalinas?

¿Cómo se representa el enlace iónico?

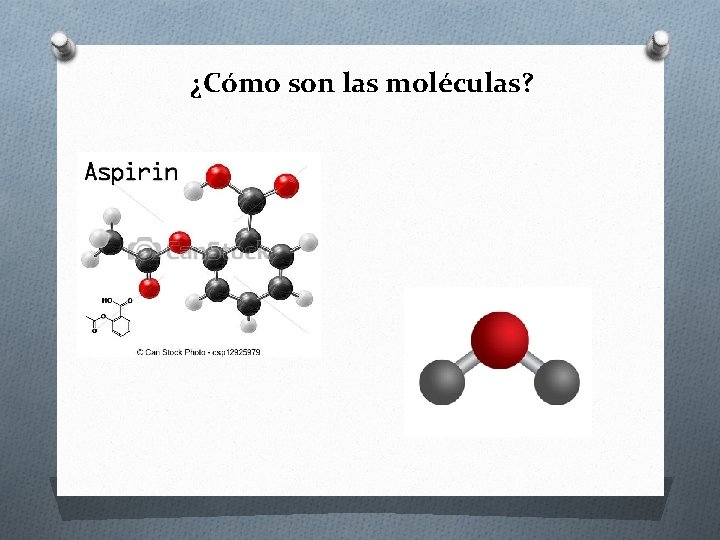
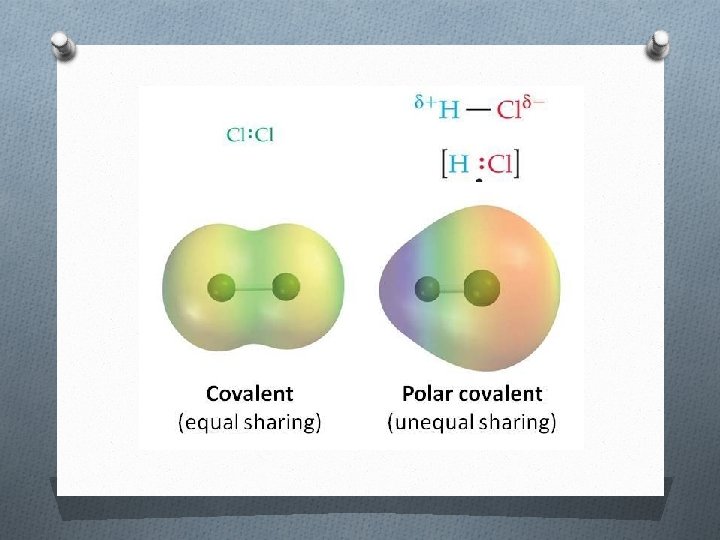
¿Cuáles son las características y propiedades del enlace covalente? Características del enlace Propiedades de los compuestos • Se forma cuando dos o más átomos no metálicos, comparten sus electrones. • Diferencia de electronegatividad< 1, 7. • Existen enlaces covalentes polar, apolar y coordinado o dativo. • Los enlaces covalentes puedes ser: simple, doble o triple. • Presentan temperaturas de ebullición y fusión bajas. • A CNPT, pueden ser sólidos, líquidos o gaseosos. • Son aislantes de corriente eléctrica y calor. • Son solubles en solventes polares (como el agua) cuando presentan polaridad y en solventes apolares (como el benceno) cuando no la tienen. • Forman moléculas.

¿Cómo son las moléculas?


¿Cómo se representa el enlace covalente?

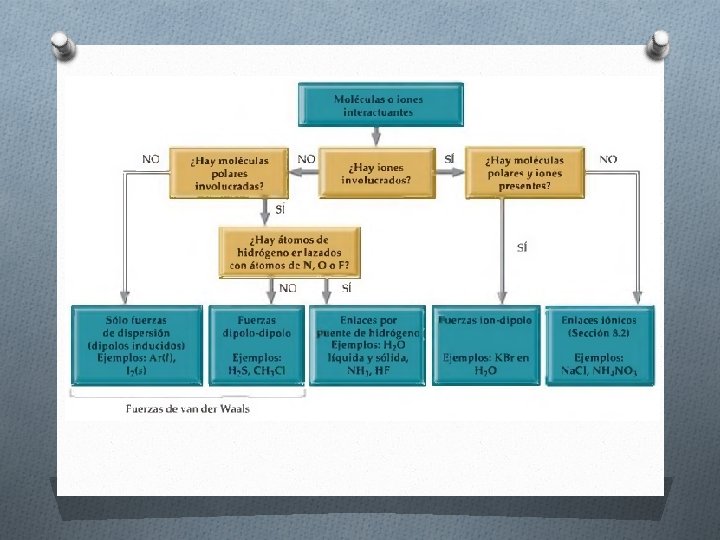
¿Cómo se puede determinar el tipo de enlace? O

O

¿Cuáles son las características y propiedades del enlace metálico? Características enlace del • Enlace que se forma entre átomos metálicos. • Es un enlace fuerte, que se forma entre elementos de la misma especie, de electronegatividades bajas y similares. • Se forma una nube electrónica con los electrones deslocalizados. Propiedades de los compuestos • Son dúctiles y maleables. • Son buenos conductores de la electricidad. • Conducen el calor. • Tienen puntos de fusión y ebullición variables. • La mayoría son sólidos a T ambiente (excepto el mercurio). • Son, generalmente, insolubles en cualquier tipo de disolvente. • Tienen un brillo característico, debido a que absorben energía de cualquier longitud de onda.

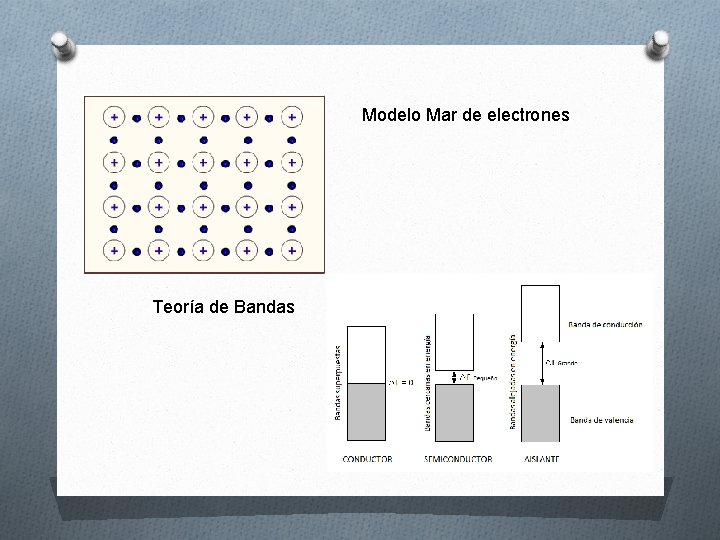
Modelo Mar de electrones Teoría de Bandas

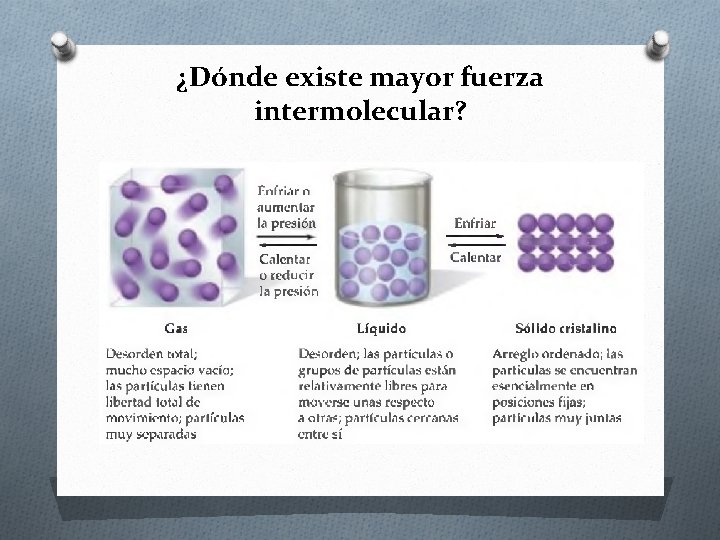
¿Qué son las fuerzas intermoleculares? Son las fuerzas de atracción entre las moléculas. Estas fuerzas son las responsables de las propiedades macroscópica de la materia ( por ejemplo, punto de fusión y ebullición) Las fuerzas intermoleculares son más débiles que las fuerzas intramoleculares (enlace químico).

¿Dónde existe mayor fuerza intermolecular?

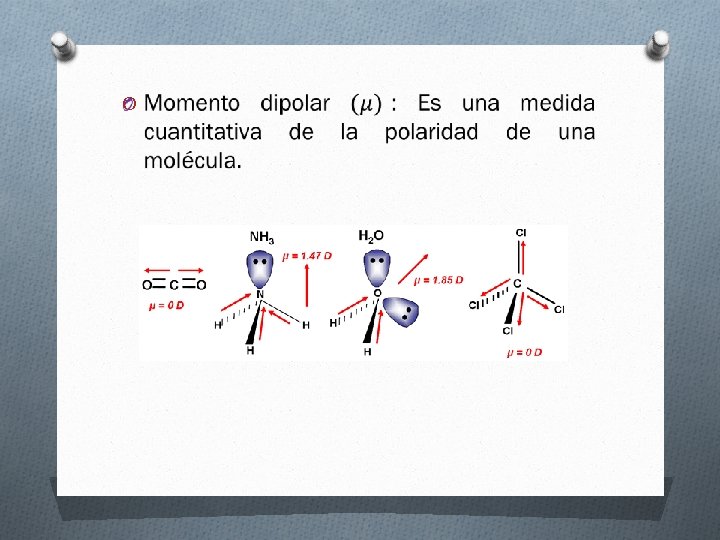
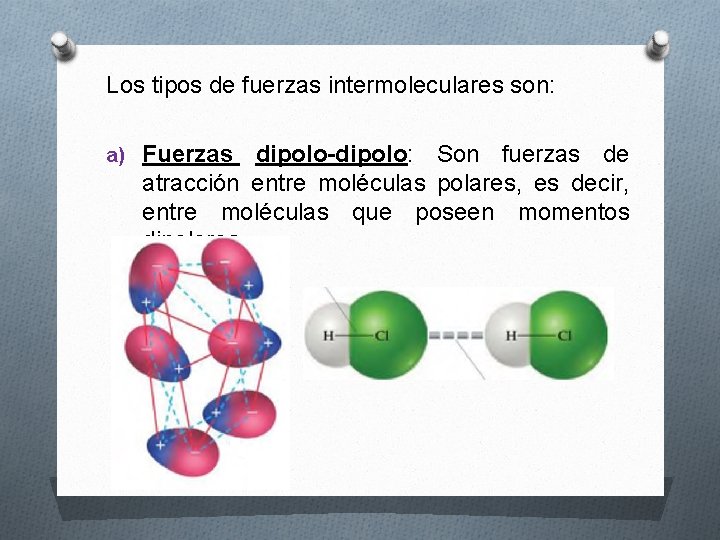
Los tipos de fuerzas intermoleculares son: a) Fuerzas dipolo-dipolo: Son fuerzas de atracción entre moléculas polares, es decir, entre moléculas que poseen momentos dipolares.

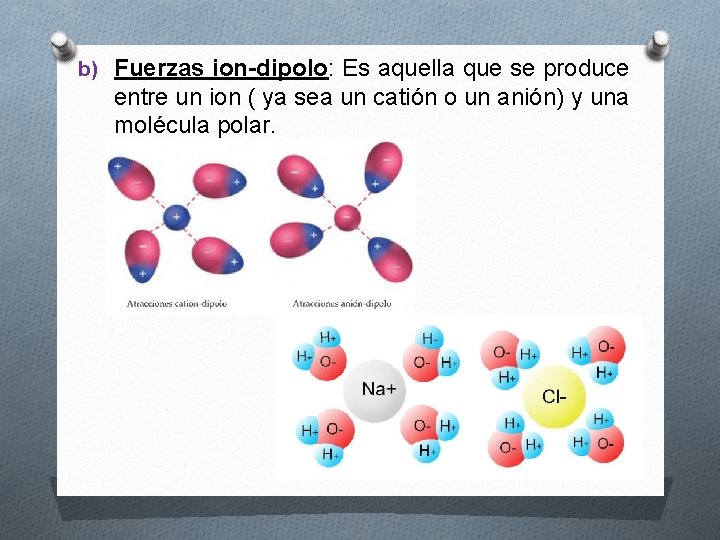
b) Fuerzas ion-dipolo: Es aquella que se produce entre un ion ( ya sea un catión o un anión) y una molécula polar.

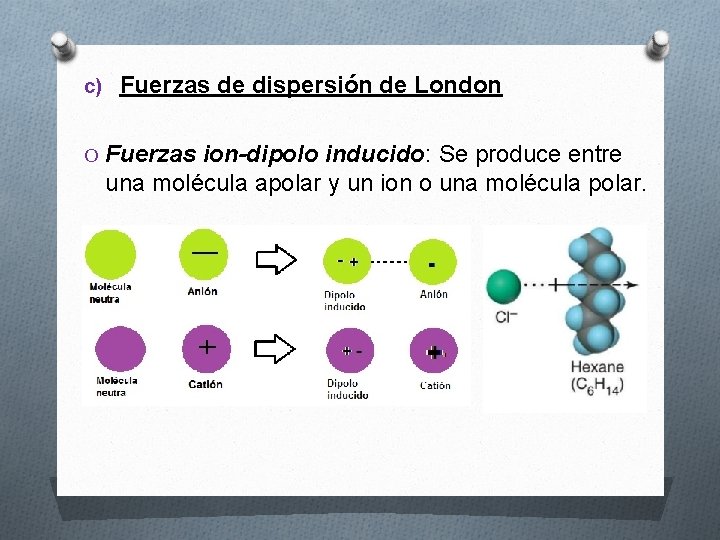
c) Fuerzas de dispersión de London O Fuerzas ion-dipolo inducido: Se produce entre una molécula apolar y un ion o una molécula polar.

O Fuerzas dipolo-dipolo inducido: Se produce entre una molécula polar y una molécula apolar (dipolo inducido).

O
