SEMANA 2 UNIONES Y ENLACES QUMICOS QUMICA 2016




















- Slides: 26

SEMANA 2 UNIONES Y ENLACES QUÍMICOS QUÍMICA 2016 1

Semana 2 UNIONES Y ENLACES QUÍMICOS Uniones y enlaces químicos. Definición de electronegatividad. Ejercicio sobre su variación en los grupos y periodos y diferencias de electronegatividad en compuestos binarios. Regla del Octeto. Estructura de Lewis (iones y elementos) Clasificación de enlaces: - Enlace iónico - Enlace covalente: - Polar y No polar - Simple, doble, triple y coordinado Comparación de propiedades físicas de compuestos iónicos y covalentes. Aplicación de los conceptos en la salud y el ambiente. Laboratorio: Equipo básico de laboratorio de química. 2

ENLACE QUÍMICO ES LA UNIÓN DE DOS O MÁS ÁTOMOS PARA FORMAR COMPUESTOS. • Tipos de Enlaces: Iónico y Covalente • Los átomos libres son poco estables. Por esto tienden a formar enlaces con otros átomos, formando compuestos y así ganar estabilidad. • Cumplen la REGLA DEL OCTETO. 3

REGLA DEL OCTETO Los átomos tienden llenar con 8 electrones su último nivel para que su configuración electrónica se parezca a la del gas nobles mas cercano en la tabla periódica. • Los gases nobles se encuentran en la columna VIII A, son estables porque tiene 8 electrones de valencia (octeto) en su último nivel. • No tienen que formar compuestos para llegar a ser estables. 4

OCTETOS DE LOS GASES NOBLES 5

Para cumplir la regla del octeto, los átomo que se enlazan deben: • ganar o perder electrones (enlace iónico) ó • compartir electrones (enlace covalente). Esto dependerá de la ELECTRONEGATIVIDAD. 6


ELECTRONEGATIVIDAD Es la medida de la capacidad que tiene un átomo para atraer los electrones de enlace. • El átomo menos electronegativo es el Francio y el más electronegativo el Flúor. • En la tabla periódica aumenta de izquierda a derecha en los períodos y disminuye de arriba hacia abajo en las columnas. 8



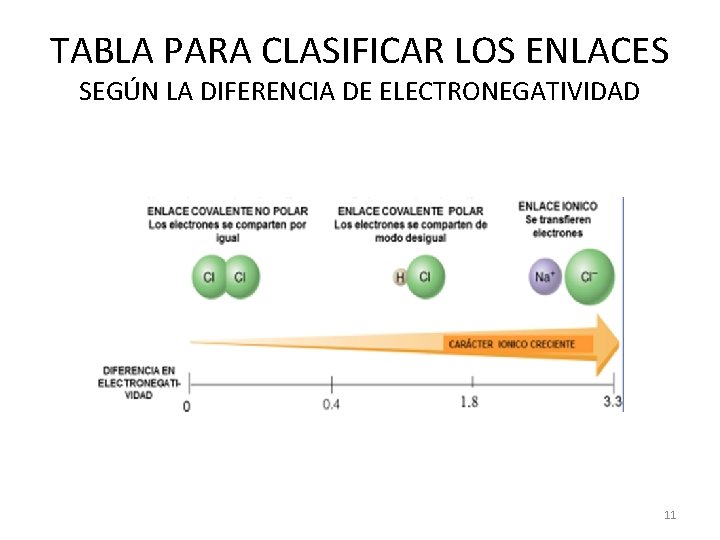
TABLA PARA CLASIFICAR LOS ENLACES SEGÚN LA DIFERENCIA DE ELECTRONEGATIVIDAD 11

TIPOS DE ENLACES Según la diferencia de electronegatividad de los átomos del enlace se clasifican en: Enlace iónico y Enlace covalente • ENLACE COVALENTE PURO: Diferencia de 0 • ENLACE COVALENTE APOLAR: de 0 a 0. 4 • ENLACE COVALENTE POLAR: de mayor de 0. 4 a menor de 1. 8 • ENLACE IÓNICO: De 1. 8 en adelante 12

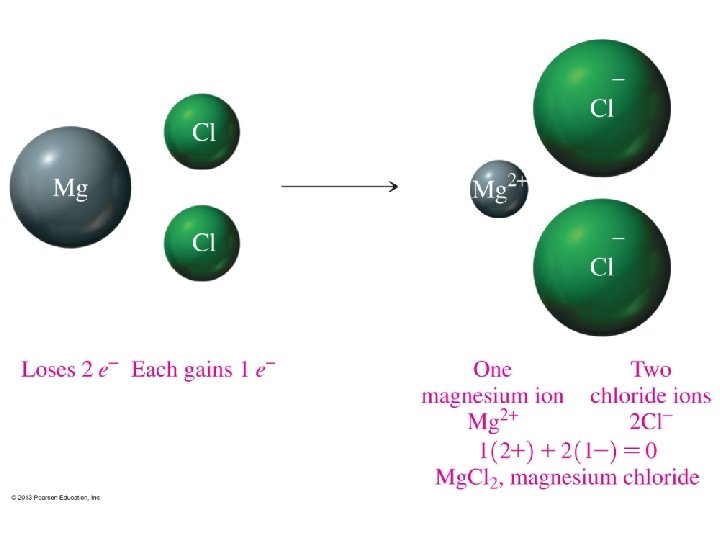
ENLACE IÓNICO Diferencia de electronegatividad 1. 8 o más. Hay transferencia de electrones. Se forman iones + (catión) y iones - (anión). Las cargas eléctricas opuestas se atraen y forman el enlace. • Generalmente se forma entre Metal y Nometal. • Forma COMPUESTOS IÓNICOS. • • 13



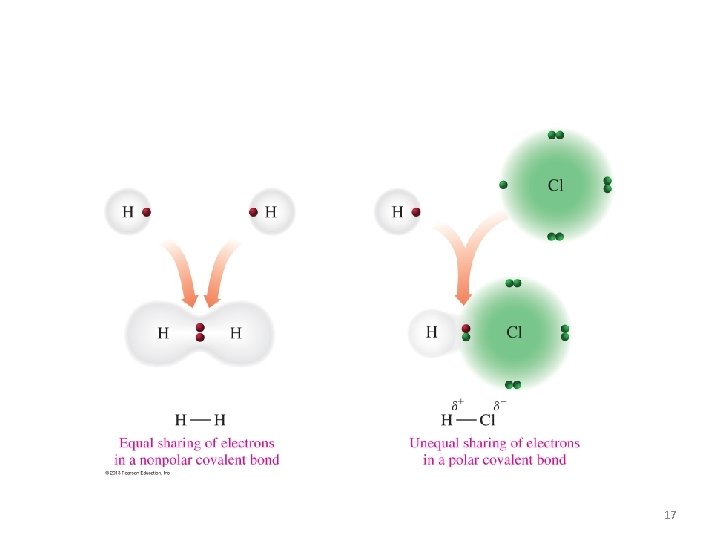
ENLACE COVALENTE • Diferencia de electronegatividad: 0 a menor de 1. 8. • Se comparten electrones. • Generalmente se forma entre dos Nometales ó Hidrógeno con Nometal. • Se forman MOLÉCULAS. • Forma COMPUESTOS COVALENTES. 16

17

Forma las moléculas covalentes polares y apolares 18

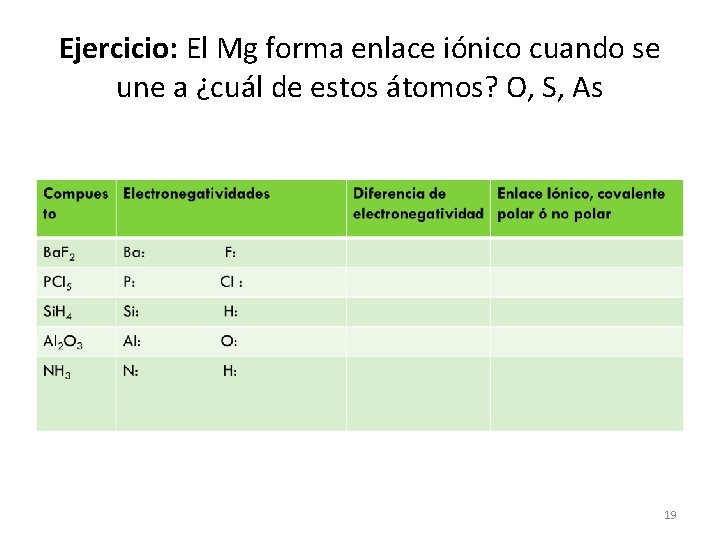
Ejercicio: El Mg forma enlace iónico cuando se une a ¿cuál de estos átomos? O, S, As 19

Clasificación de ENLACE COVALENTE • COVALENTE PURO: Diferencia de 0 • COVALENTE APOLAR: de 0 a 0. 4 • COVALENTE POLAR: de mayor de 0. 4 a menor de 1. 8 • COVALENTE SIMPLE • COVALENTE DOBLE • COVALENTE TRIPLE • COVALENTE DATIVO o COORDINADO 20

ESTRUCTURAS DE LEWIS • Diagrama utilizado para representa los electrones de valencia de los átomos. • Se escribe el símbolo del átomo con sus electrones de valencia con figuras. • Permite representar el tipo de enlace covalente que formarán los átomos en los compuestos. 21

Ejemplos de Estructuras de Lewis para algunos elementos representativos 22

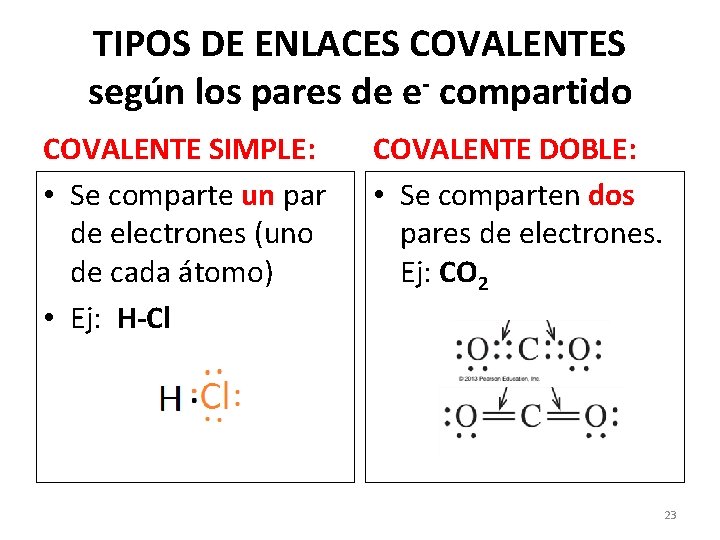
TIPOS DE ENLACES COVALENTES según los pares de e- compartido COVALENTE SIMPLE: • Se comparte un par de electrones (uno de cada átomo) • Ej: H-Cl COVALENTE DOBLE: • Se comparten dos pares de electrones. Ej: CO 2 23

COVALENTE TRIPLE: Se comparten tres pares de electrones. Ej: N 2 • COVALENTE DATIVO O COORDINADO: El par de electrones del enlace los aporta un solo átomo. Ej: SO 3 24

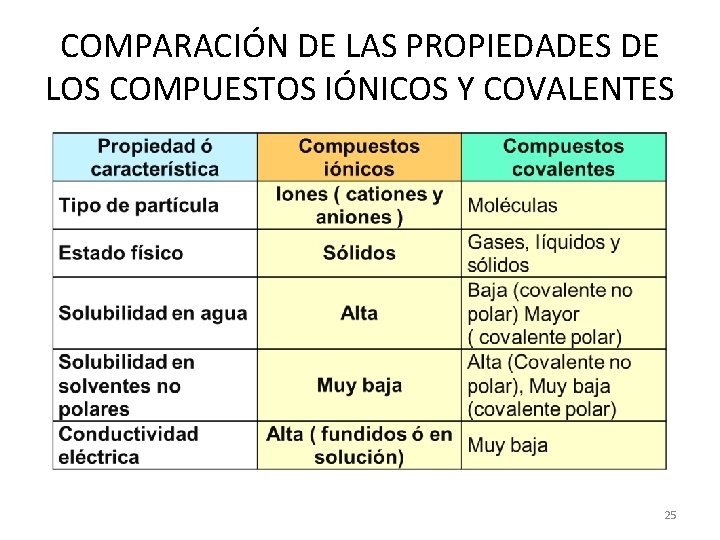
COMPARACIÓN DE LAS PROPIEDADES DE LOS COMPUESTOS IÓNICOS Y COVALENTES 25

FIN 26
 Enlaces sigma y pi en compuestos organicos
Enlaces sigma y pi en compuestos organicos Uniones estrechas
Uniones estrechas Uniones de filete
Uniones de filete Qué son las fuerzas intramoleculares
Qué son las fuerzas intramoleculares Uniones y conexiones wan
Uniones y conexiones wan Depurinacion
Depurinacion Tipos de uniones de soldadura
Tipos de uniones de soldadura Uniones de holliday
Uniones de holliday Desmosoma
Desmosoma Uniones fijas y desmontables
Uniones fijas y desmontables Union celula celula
Union celula celula Enlace covalente heteronuclear
Enlace covalente heteronuclear Tipos de redes cristalinas
Tipos de redes cristalinas Uniones quimicas entre atomos
Uniones quimicas entre atomos Uniones sinoviales
Uniones sinoviales Epitelio intestino delgado
Epitelio intestino delgado Uniones traslapadas
Uniones traslapadas Uniones en hendidura
Uniones en hendidura Zonula adherente
Zonula adherente Ate disoluciones coloides y suspensiones
Ate disoluciones coloides y suspensiones Integrinas
Integrinas Soldadura tipo filete
Soldadura tipo filete Qumica
Qumica Qumica
Qumica Qumica
Qumica Geometria sp2
Geometria sp2 Cintica
Cintica