QUIMICA n n Ciencia que estudia los materiales











































- Slides: 61

QUIMICA n n Ciencia que estudia los materiales que constituyen el universo, su composición, estructura, propiedades y los cambios que sufren. Ciencia que trata de la naturaleza, composición de la materia y de los cambios que ésta experimenta, se rige de leyes y principios y grandes aplicaciones con la energía

LEUCIPO Y DEMÓCRITO n “La naturaleza no era continua sino discreta”, es decir: n n Si la materia se fragmenta en trozos mas pequeños llega u un punto donde no puede dividirse más. Esos trozos indivisibles llamaron átomos.

Física Relativista (Einstein) n n n La materia posee 4 manifestaciones : Masa, energía, espacio y tiempo. Newton explicó que toda la materia del universo obedece a una serie de leyes como son “El movimiento de los cuerpos y la gravedad”. La ley de la gravedad de Isaac Newton afirma que “todos los objetos del universo atraen a los demás objetos con una fuerza de impulso llamada gravedad.

¿Qué es materia? n Todo aquello que ocupa un lugar en el espacio, tiene masa y requiere energía para un cambio o transformación

CONSTITUCIÓN DE LA MATERIA SEGÙN LOS ALQUIMISTAS Siglo VI a. C se desarrolló en Grecia un movimiento filosóficocultural deseaban conocer como estaba constituida la materia.

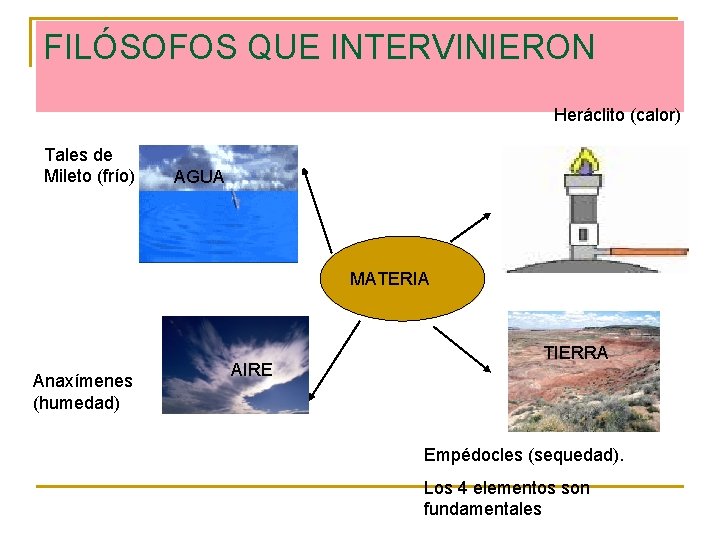
FILÓSOFOS QUE INTERVINIERON Heráclito (calor) Tales de Mileto (frío) AGUA MATERIA FUEGO Anaxímenes (humedad) AIRE TIERRA Empédocles (sequedad). Los 4 elementos son fundamentales

Materia y sus propiedades La química actúa sobre la materia, que es todo aquello que nos rodea, ocupa un lugar y un espacio en el universo, y que somos capaces de identificar y conocer. Propiedades fundamentales Forma: Depende de su naturaleza o fenómenos externos. Volumen: Sus dimensiones. Tipos de propiedades: Físicas * Extensivas. * Intensivas. Químicas: Todas las reacciones Ejp: combinación, reacción, oxidación, sabor, olor, reducción, combustión, etc.

Propiedades de la materia Extensivas: se relacionan con la estructura química externa; es decir, aquellas que podemos medir y que dependen de la cantidad y forma de la materia. Ejemplo: peso, volumen, longitud, energía potencial, calor, etcétera. Intensivas: se relacionan con la estructura química interna de la materia. Ejemplo: temperatura, punto de fusión, punto de ebullición, calor específico o concentración (ver glosario para estos tres últimos términos), índice de refracción, entre otros aspectos.

PROPIEDADES DE LA MATERIA Es el conjunto de características que las identifican y les proporcionan una inconfundible identidad, dichas características se llaman propiedades.

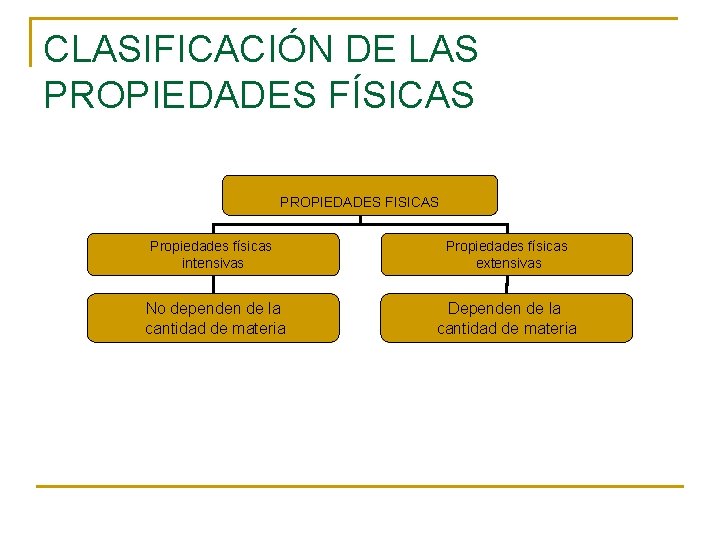
CLASIFICACIÓN DE LAS PROPIEDADES FÍSICAS PROPIEDADES FISICAS Propiedades físicas intensivas Propiedades físicas extensivas No dependen de la cantidad de materia Dependen de la cantidad de materia

Clasificación de las propiedades PROPIEDADES FISICAS: Son aquellas que pueden ser determinadas sin que ocurra ningún cambio en la composición del material n

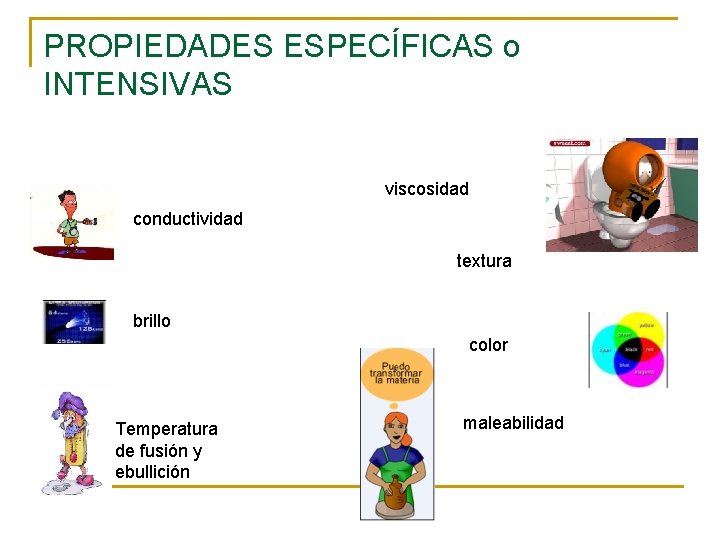
PROPIEDADES ESPECÍFICAS o INTENSIVAS viscosidad conductividad textura brillo color Temperatura de fusión y ebullición maleabilidad

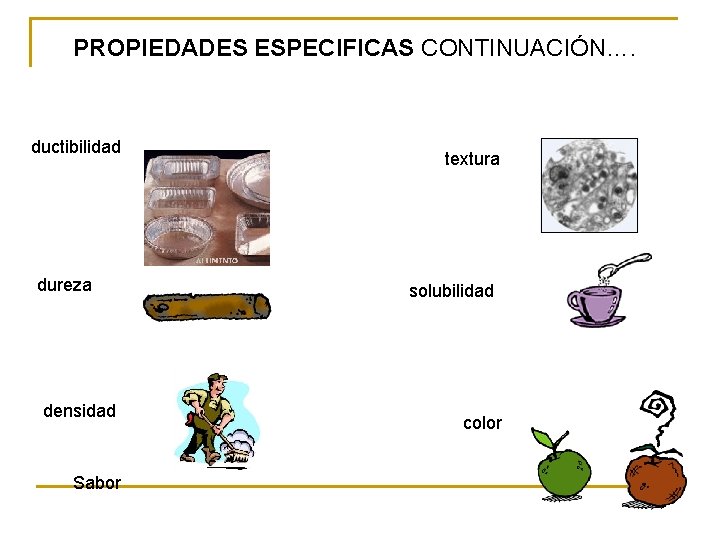
PROPIEDADES ESPECIFICAS CONTINUACIÓN…. ductibilidad dureza densidad Sabor textura solubilidad color

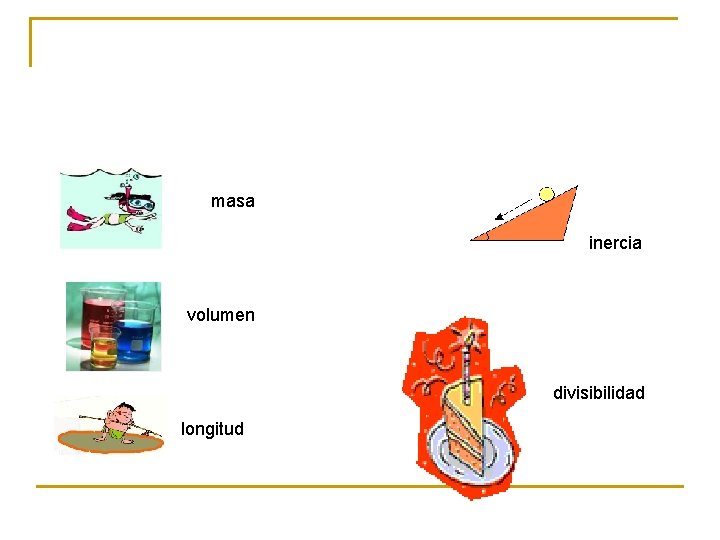
masa inercia volumen divisibilidad longitud

PROPIEDADES QUÍMICAS Son aquellas que se observan cuando la materia experimenta un cambio en su composición. Ejemplo: C(s) n + O 2(g) → CO 2 (g) + H 2 O(L) Carbono + Oxígeno → Bióxido de carbono + Agua

PROPIEDADES QUIMICAS n n n n Combustión, Digestión, Corrosión, combinación, reacción, oxidación, reducción.

Transformaciones de la Materia n Fenómeno: Cambio que experimenta la materia. n Fenómeno Químico: Cambio químico siempre altera composición de la materia. - sucesos observables. -Pueden ser medidos. Ejemplos: n n las reacciones de oxidación las reacciones de combustión la formación de una sal el fraguado del cemento

QUIMICA I CAMBIO FISICO Y QUIMICO

Fenómenos Físicos y Químicos n Fenómeno Físico: Cambios físicos sin que se produzca alteración en la composición de la materia. Ejp: n n la elasticidad de una barra de metal la fuerza ejercida por un cuerpo sobre otro una pelota rodando el agua hirviendo

Cambio físico y químico

FENOMENOS Cambios o modificaciones que experimentan las sustancias bajo la acción de las diferentes formas de energía

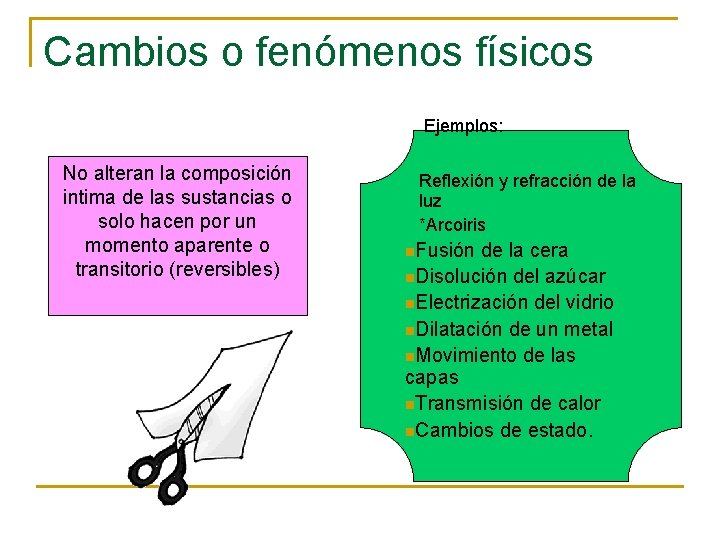
Cambios o fenómenos físicos Ejemplos: No alteran la composición intima de las sustancias o solo hacen por un momento aparente o transitorio (reversibles) Reflexión y refracción de la luz *Arcoiris n. Fusión de la cera n. Disolución del azúcar n. Electrización del vidrio n. Dilatación de un metal n. Movimiento de las capas n. Transmisión de calor n. Cambios de estado.

FENOMENOS QUÍMICOS Cambio experimentado donde se modifica permanentemente la naturaleza íntima de las sustancias y no es reversible. Ejemplos: –Digestión de los alimentos n n Corrosión de los metales Explosión de una bomba Acumulador n n Fenómenos de visión Revelado de una foto Encender un cerillo Fenómeno de Fotosíntesis Acción de los medicamentos

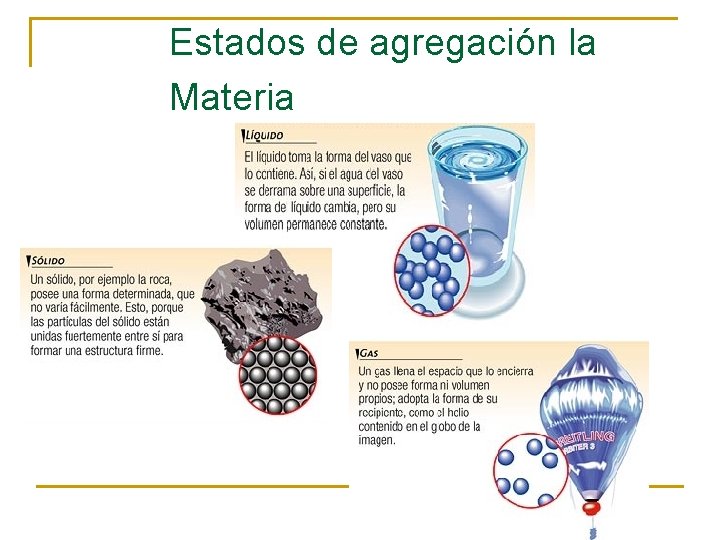
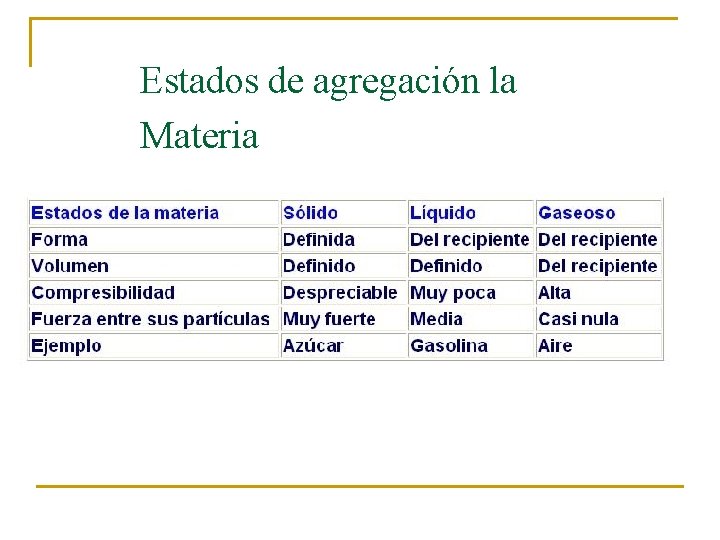
Estados de agregación la Materia

Estados de agregación la Materia


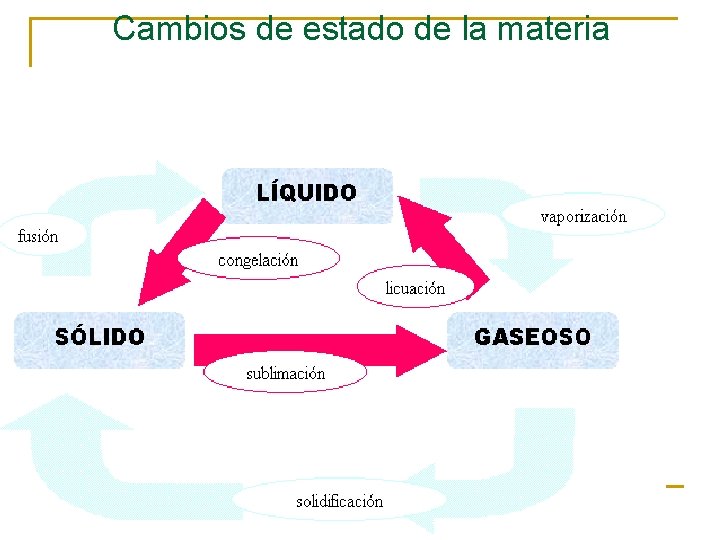
Cambios de estado de la materia


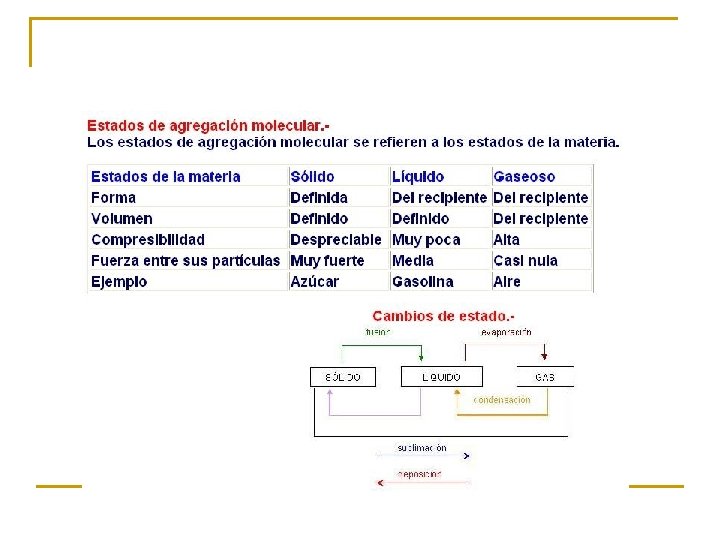
ESTADO SÓLIDO n n n Las sustancias ocupan un volumen definido. Tienen forma propia La movilidad de las partículas que las constituye es casi nula Existe una gran cohesión Son incompresibles (es decir que su volumen no se puede reducir)

ESTADO LIQUIDO n n n n Ocupa un volumen fijo, pero es necesario que se le coloque en un recipiente El volumen del líquido tomará la forma del recipiente en que se coloca. (no posee forma propia) La movilidad y las fuerzas de cohesión de sus partículas son intermedias. Pueden comprimirse solo bajo efectos de presiones altas Un liquido se dilata al calentarse y se contrae el enfriarlo Un liquido puede difundirse a través de otro, si hay miscibilidad entre ellos. Se transforma en gas al incrementar la temperatura Se transforma en sólido al bajar su temperatura

Estado gaseoso n n n n No tiene forma ni volumen definidos, por lo que se almacena en un recipiente cerrado. El gas tiende a ocupar todo el volumen del recipiente en que está confinado. Sus partículas poseen gran energía cinética, presentando movimientos desordenados. A volúmenes pequeños se pueden comprimir Llenan cualquier recipiente y se expanden fácilmente. Se difunden con rapidez en otro gas. en el recipiente que los contiene, ejercen una presión sobre sus paredes Conforme aumenta la temperatura , la presión del gas incrementa

PLASMA ESTADO DE LA MATERIA QUE SE CARACTERIZA POR HABER SIDO LOS ELECTRONES DE UN GAS ACELERADOS HASTA SEPARARSE DE LOS ATOMOS n En 1930 Langmuir introdujo el término de plasma (del griego moldeable). Para designar a los gases ionizados existentes en el universo. n compuesto por electrones y iones (+) a temperaturas mayores a 5000º C. * Cuando la materia se calienta a estas temp las colisiones entre las partículas son violentas que se pueden desprender electrones de los atomos. El plasma se forma en un reactor nuclear al mezclar isótopos de H 2, Deuterio y Titrio + calor a 100 millones de grados centígrados produce una fusión. *La mayoría del universo esta compuesto de plasma. EL ESTUDIO DEL PLASMA SE LE CONOCE COMO: Magnetohidrodinámica (MHD) Gas Caliente comprimido Magnéticamente Los Científicos esperan emplear el plasma como fuente de energía al obtenerla de las reacciones nucleares de fusión. * Ejemplo: estrellas, espacio sideral, propulsión de vehículos espaciales.




los compuestos químicos utilizados en el hogar en cualquier sitio se conocen con un nombre vulgar pero sin lugar a duda tienen un nombre científico estos son algunos ejemplos: NOMBRE COMUN NOMBRE CIENTIFICO FORMULA PARA QUE SE UTILIZA Sal Cloruro de sodio Na. Cl Sazonador Amoniaco NH 3 Desinfectante Leche de magnesia Hidróxido de magnesio Mg(OH)2 Antiácido y laxante Hielo seco Dióxido de carbono CO 2 Extinguidor de fuego Sosa cáustica Hidróxido de sodio Na. OH Fabricación de jabón Mármol, piedra caliza. Carbonato de calcio Ca. CO 3 En la industria del cemento, antiácido, prevenir diarrea Agua pura H 2 O Beber, lavar. Ácido de batería Ácido sulfúrico H 2 SO 4 Limpiador de metales. Cuarzo Óxido de silicio (IV) Si. O 2 Arena para construcción Anestesia Dióxido de nitrógeno N 2 O Anestésico Polvo de hornear Carbonato ácido de sodio o bicarbonato de sodio Na. HCO 3 Antiácido, extinguidor de fuego

Soluciones Solución: Se compone de soluto y solvente Soluto: Es el componente que se encuentra en menor cantidad. Ej. : una solución de salmuera (sal en agua) tendría como soluto la sal y el solvente sería el agua. n


Mezclas Las mezclas también se clasifican según el tamaño de sus partículas, considerando el “diámetro” de estas. Estos tipos de mezclas son: a) Solución: en este tipo de mezclas, las partículas son INVISIBLES a simple vista y al microscopio y estas no sedimentan. El tamaño de las partículas es a escala de átomos, moléculas e iones (menores a 10 -8 cm). Las partículas mezcladas pueden separarse por EVAPORACIÓN

Mezclas b) Suspensión: es la dispersión de partículas finas en agua u otro liquido, y que después de un tiempo sedimentan depositándose en el fondo del recipiente que la contiene. El tamaño de las particulas va desde 1 cm a 10 -5 cm de diámetro. Son visibles y se pueden separar por FILTRACIÓN. Ej. : arena con agua, agua con tiza, etc.

Mezclas Coloides: su tamaño va desde los 10 -5 a los 10 -6 cm. En algunos aspectos las partículas de un coloide son como las soluciones, ya que sus componentes no se distinguen a simple vista, pero pueden hacerse visibles a través de un efecto denominado “Tyndall” n

mezclas Los coloides a su vez se clasifican en: a) Sol: solido disperso en líquido: las pinturas, leche de magnesia (Mg(OH)2 disperso en agua) b) Gel: solido disperso en semisólido: Jaleas, gelatinas c) Aerosol: Líquido disperso en gas. Ej: espumas de jabón. También sólido o líquido disperso en gas. Ej. : humo, niebla, lluvia ácida. d) Emulsión: Cuando un liquido se dispersa en otro y ambos son INMISCIBLES. Ej: . Aceite y agua, mayonesa, petróleo en agua

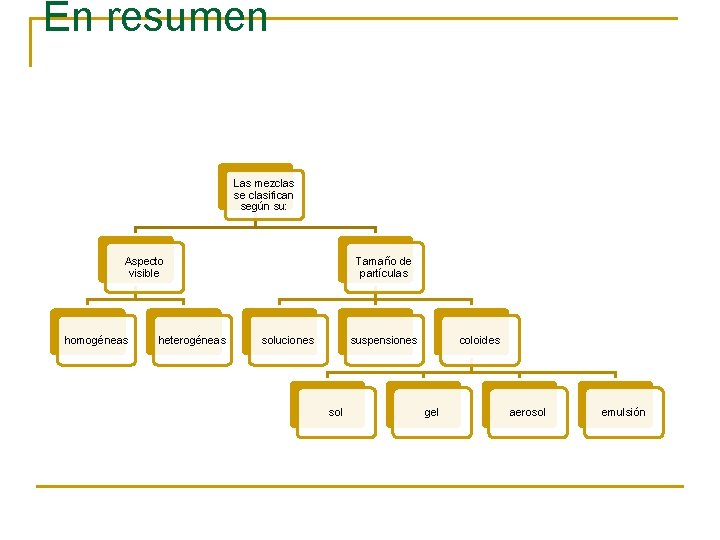
En resumen Las mezclas se clasifican según su: Aspecto visible homogéneas heterogéneas Tamaño de partículas soluciones suspensiones sol coloides gel aerosol emulsión

Métodos de Separación de Mezclas

Destilación Procedimiento: para la separación y purificación de líquidos, y es el que se utiliza siempre que se pretende separar un líquido de sus impurezas no volátiles.

Evaporación Ejp: Las Salinas. Del agua de mar se obtiene sales: cloruro de sólido, de potasio, etc…

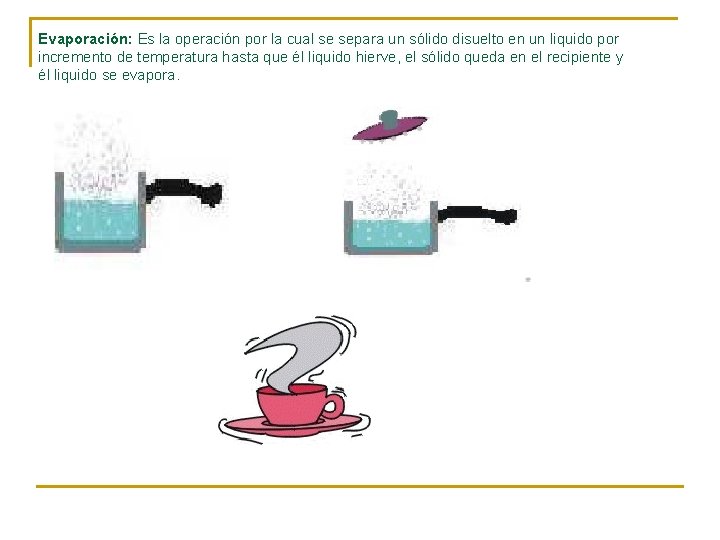
Evaporación: Es la operación por la cual se separa un sólido disuelto en un liquido por incremento de temperatura hasta que él liquido hierve, el sólido queda en el recipiente y él liquido se evapora.

Centrifugación Procedimiento que acelera la sedimentación. Mediante un movimiento de rotación constante y rápido, lográndo que las partículas de mayor densidad, se vayan al fondo y las más livianas

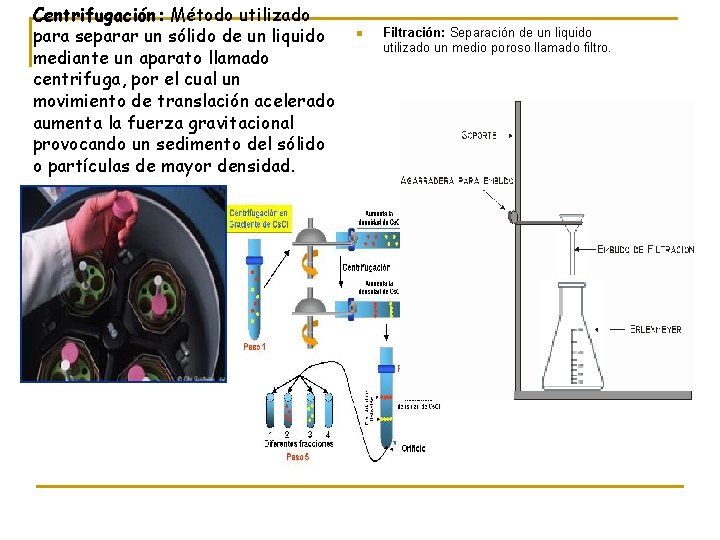
Centrifugación: Método utilizado para separar un sólido de un liquido mediante un aparato llamado centrifuga, por el cual un movimiento de translación acelerado aumenta la fuerza gravitacional provocando un sedimento del sólido o partículas de mayor densidad. n Filtración: Separación de un liquido utilizado un medio poroso llamado filtro.

Filtración Paso de la mezcla por medio de paoeles filtros de distintos tamaños. Método sencillo y barato. No altera las propiedades de las sustancias

n Cristalización: consiste en separar un sólido que esta disuelto en una solución, finalmente el sólido queda como cristal. n. Sublimación: Cuando una sustancia pasa del estado sólido al gaseoso por incremento de temperatura, sin pasar por él liquido.

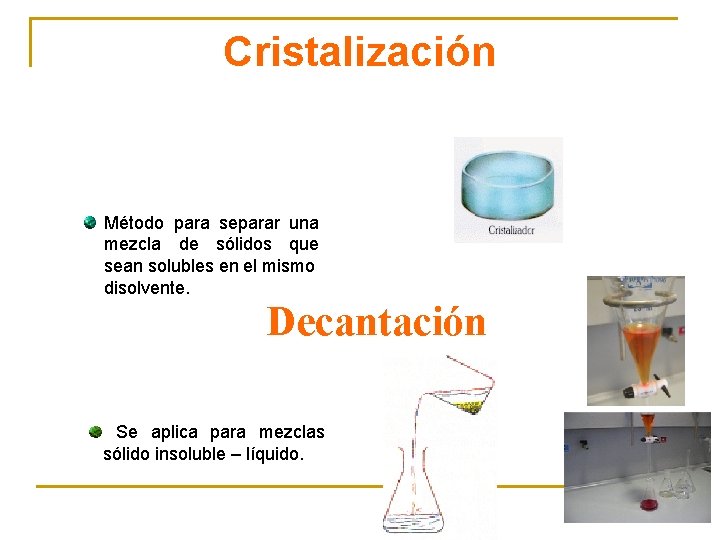
Cristalización Método para separar una mezcla de sólidos que sean solubles en el mismo disolvente. Decantación Se aplica para mezclas sólido insoluble – líquido.

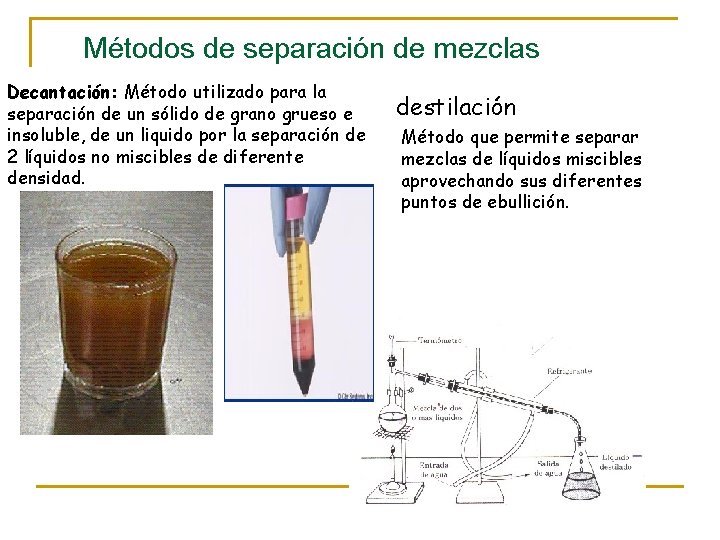
Métodos de separación de mezclas Decantación: Método utilizado para la separación de un sólido de grano grueso e insoluble, de un liquido por la separación de 2 líquidos no miscibles de diferente densidad. destilación Método que permite separar mezclas de líquidos miscibles aprovechando sus diferentes puntos de ebullición.

Magnetismo Se vale de las propiedades magnéticas de algunos materiales. Se emplea para separar mezclas en donde uno de sus componentes es

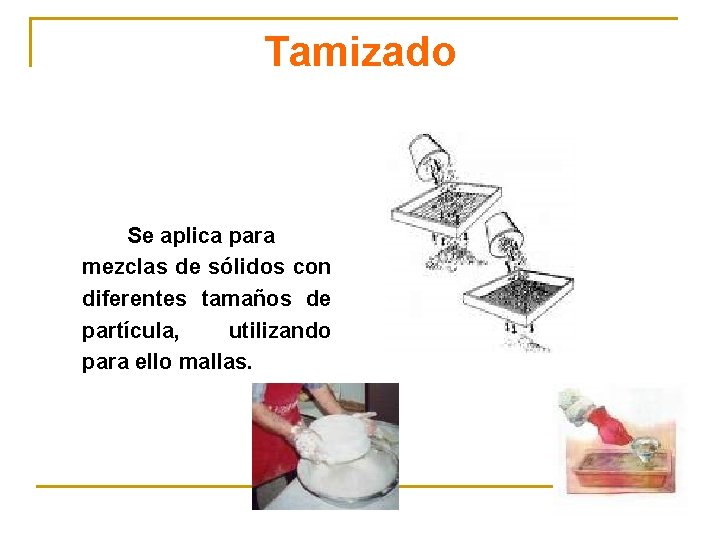
Tamizado Se aplica para mezclas de sólidos con diferentes tamaños de partícula, utilizando para ello mallas.

Sublimación Es la separación de componentes de la mezcla heterogénea, donde sus componentes son sólidos y uno de ellos se evapora por aumento de la temperatura.

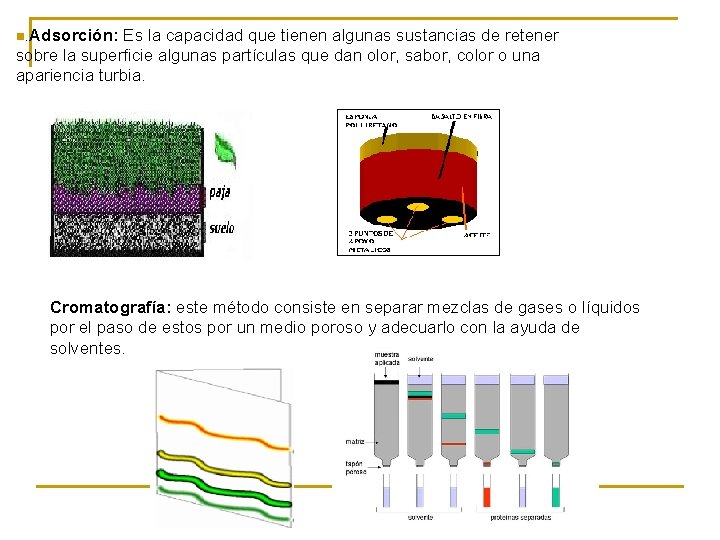
n. Adsorción: Es la capacidad que tienen algunas sustancias de retener sobre la superficie algunas partículas que dan olor, sabor, color o una apariencia turbia. Cromatografía: este método consiste en separar mezclas de gases o líquidos por el paso de estos por un medio poroso y adecuarlo con la ayuda de solventes.

La energía El término energía tiene diversas acepciones y definiciones, relacionadas con la idea de una capacidad para obrar, transformar, poner en movimiento. En física, Energía es la capacidad de obrar, transformar y poner en movimiento. En tecnología y economía, energía (tecnología) se refiere a un recurso natural y la tecnología asociada para explotarla y hacer un uso industrial o económico del mismo.

Tipos de la energía Energía sonora: fuerzas surgidas de la vibración mecánica. Energía radiante: La existente en un medio físico, causada por ondas electromagnéticas, mediante las cuales se propaga directamente sin desplazamiento de la materia La energía permite que un cuerpo se mueva o se desplace o bien que cambie sus propiedades. Hay diferentes tipos de energía: Energía eléctrica: Si las fuerzas son de naturaleza eléctrica. Energía atómica o nuclear: fuerza nuclear fuerte

La energía Energías renovables: Energía eólica Energía geotérmica Energía hidráulica Energía mareomotriz Energía solar Energía cinética Biomasa Gradiente térmico oceánico Fuentes de Energías no renovables (o nuclear-fósil): Carbón Centrales nucleares Gas Natural Petróleo

n n n n n n Cuáles son los tipos de Energía? Los tipos de energía son: Energía Mecánica Energía Potencial Energía Cinética Energía Química Energía Calórica Energía Eléctrica Energía Nuclear Energía Solar* Energía Geotérmica* 10 - Energía eólica* 11 -Energía Hidráulica* 12 - Fuentes de energía renovables 13 - Fuentes de energía no renovable 14 - Energía Mareomotriz* Energía Calórica ejemplo: Tostadora Refrigerador Ventilador Plancha Tetera eléctrica
 Energía química
Energía química Tejidos animales
Tejidos animales Ciencia que estudia los suelos
Ciencia que estudia los suelos Ciencia que estudia los documentos
Ciencia que estudia los documentos Cinco magnitudes escalares
Cinco magnitudes escalares Características de la ley científica
Características de la ley científica Que es la silvicultura
Que es la silvicultura La ciencia que estudia las bacterias
La ciencia que estudia las bacterias Propiedades de la materia intensivas y extensivas
Propiedades de la materia intensivas y extensivas Tipos de folclor
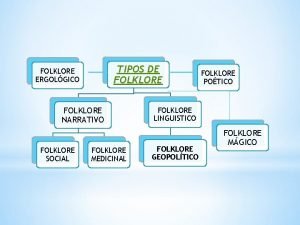
Tipos de folclor Características de los alquinos
Características de los alquinos Variacion libre y distribucion complementaria
Variacion libre y distribucion complementaria Que materiales expulsan los volcanes
Que materiales expulsan los volcanes Propiedad de los materiales
Propiedad de los materiales Propiedades de la materia resistencia
Propiedades de la materia resistencia Propiedades de los materiales cromoactivos
Propiedades de los materiales cromoactivos Qué es un sistema material
Qué es un sistema material Ejemplo de materiales que no tienen forma ni dureza
Ejemplo de materiales que no tienen forma ni dureza Solido masa
Solido masa Los dentistas usan materiales de relleno que se expanden
Los dentistas usan materiales de relleno que se expanden Nombre de los primeros 10 alcanos
Nombre de los primeros 10 alcanos Que estudia la microeconomía
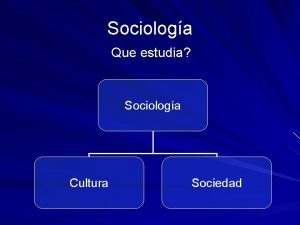
Que estudia la microeconomía Que estudia la sociologia
Que estudia la sociologia Que estudia la sinecologia
Que estudia la sinecologia Msculos
Msculos En que consiste el frotamiento para electrizar un cuerpo
En que consiste el frotamiento para electrizar un cuerpo Que estudia la sinecologia
Que estudia la sinecologia Qué estudia la gramática
Qué estudia la gramática Antropologia trabajo social
Antropologia trabajo social Que estudia la hidrostática
Que estudia la hidrostática Perspectiva intermedia del comportamiento organizacional
Perspectiva intermedia del comportamiento organizacional Como se llama la carrera que estudia la biblia
Como se llama la carrera que estudia la biblia Filogenia botanica
Filogenia botanica Que estudia la termologia
Que estudia la termologia Que estudia la qu
Que estudia la qu Características de un hecho social
Características de un hecho social Lógica informal
Lógica informal Modo de articulación
Modo de articulación Que es el sistema fonologico
Que es el sistema fonologico Poros nucleares
Poros nucleares Probabilidad de color de ojos
Probabilidad de color de ojos Unidades decisorias individuales
Unidades decisorias individuales Etica segun la real academia española
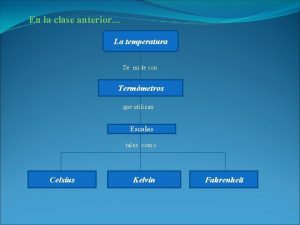
Etica segun la real academia española Que estudia la termometria
Que estudia la termometria Que estudia la qu
Que estudia la qu Que estudia la sigilografia
Que estudia la sigilografia Que estudia la paleontografía
Que estudia la paleontografía Los seres vivos
Los seres vivos Palabras terminadas en ciente o cente
Palabras terminadas en ciente o cente Que es variable independiente en ciencia y tecnologia
Que es variable independiente en ciencia y tecnologia Como se manifiesta el don de ciencia
Como se manifiesta el don de ciencia Que es ciencia
Que es ciencia Las 4 etapas de la filosofía
Las 4 etapas de la filosofía Que es la ciencia
Que es la ciencia Una ciencia que incomoda bourdieu
Una ciencia que incomoda bourdieu Unidad derivada del sistema internacional
Unidad derivada del sistema internacional Importancia de la ciencia
Importancia de la ciencia Que estudian las ciencias sociales
Que estudian las ciencias sociales De que se ocupa la geografía como ciencia
De que se ocupa la geografía como ciencia Qué entiendes por ciencia
Qué entiendes por ciencia 5 materiales solidos
5 materiales solidos La degradación de los materiales inorgánicos
La degradación de los materiales inorgánicos