UNIDAD I FORMACIN DE COMPUESTOS ENLACE QUMICO Curso





- Slides: 13

UNIDAD I FORMACIÓN DE COMPUESTOS ENLACE QUÍMICO Curso : I medio Departamento de Ciencia, química Profesora: Dania Vásquez Correo: dvdqca. 20@gmail. com

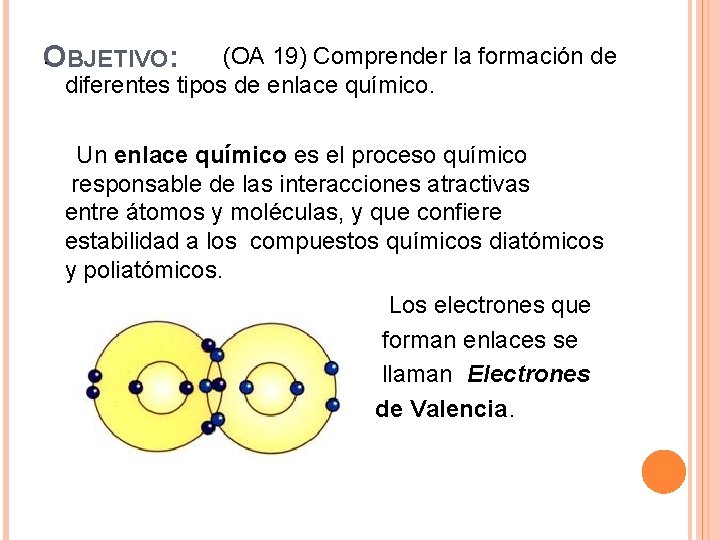
. (OA 19) Comprender la formación de O BJETIVO: diferentes tipos de enlace químico. Un enlace químico es el proceso químico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. Los electrones que forman enlaces se llaman Electrones de Valencia.

En química, un dato experimental importante es que sólo los gases nobles y los metales en estado de vapor se presentan en la naturaleza como átomos aislados, en la mayoría de los materiales que nos rodean los elementos están unidos por enlaces químicos, con un solo fin de alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel de energía.

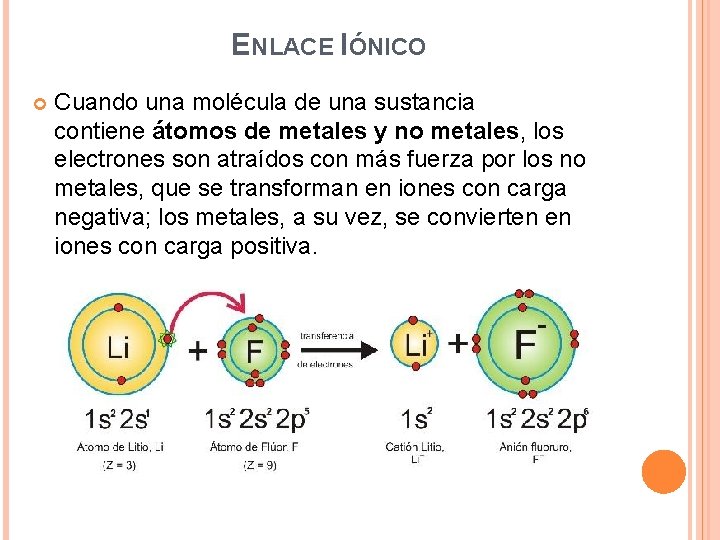
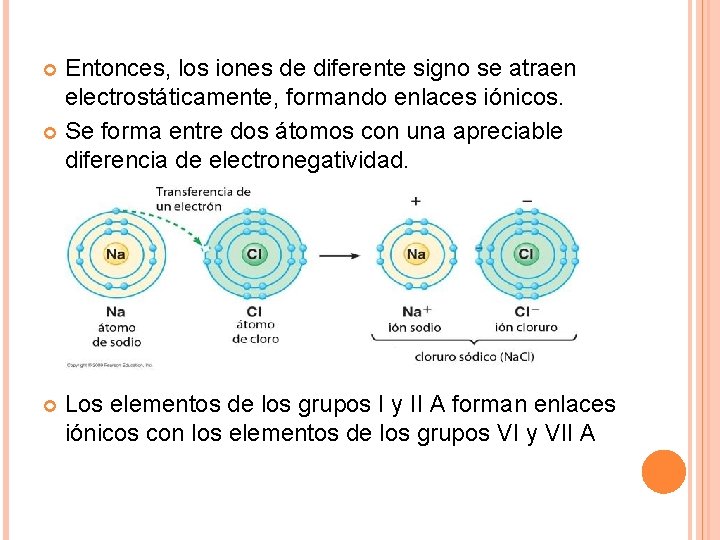
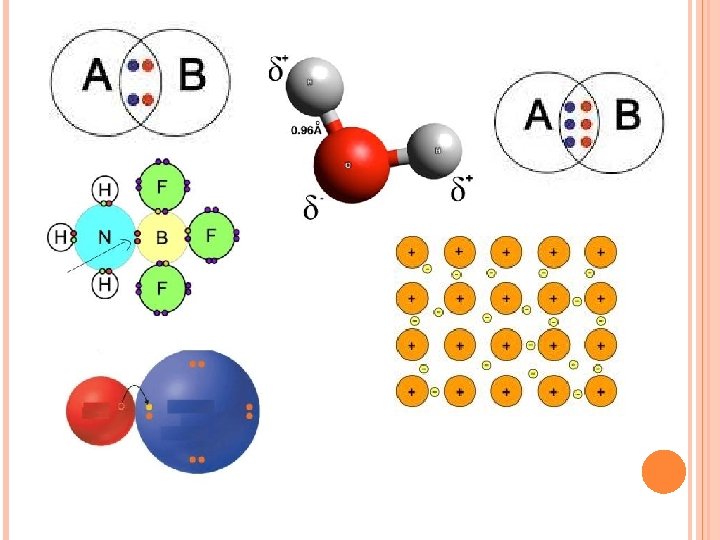
ENLACE IÓNICO Cuando una molécula de una sustancia contiene átomos de metales y no metales, los electrones son atraídos con más fuerza por los no metales, que se transforman en iones con carga negativa; los metales, a su vez, se convierten en iones con carga positiva.

Entonces, los iones de diferente signo se atraen electrostáticamente, formando enlaces iónicos. Se forma entre dos átomos con una apreciable diferencia de electronegatividad. Los elementos de los grupos I y II A forman enlaces iónicos con los elementos de los grupos VI y VII A

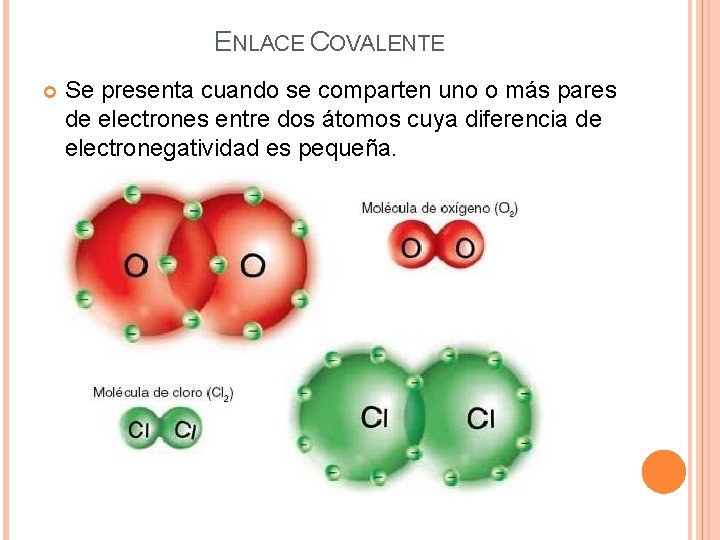
ENLACE COVALENTE Se presenta cuando se comparten uno o más pares de electrones entre dos átomos cuya diferencia de electronegatividad es pequeña.

ENLACE COVALENTE APOLAR Si los átomos enlazados son no metales e idénticos (como en N 2 o en O 2 ), los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente apolar. Se establece entre átomos con igual electronegatividad. Átomos del mismo elemento presentan este tipo de enlace. Si comparten un par de electrones se llama Covalente Apolar Simple

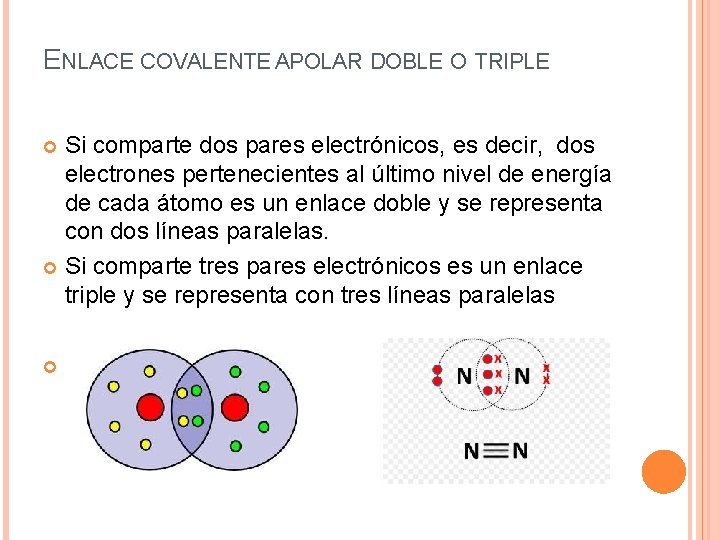
ENLACE COVALENTE APOLAR DOBLE O TRIPLE Si comparte dos pares electrónicos, es decir, dos electrones pertenecientes al último nivel de energía de cada átomo es un enlace doble y se representa con dos líneas paralelas. Si comparte tres pares electrónicos es un enlace triple y se representa con tres líneas paralelas

ENLACE COVALENTE POLAR Si los átomos comparten electrones en forma desigual , el enlace se llama covalente polar (polar porque la molécula tiene un polo eléctrico positivo y otro negativo, y covalente porque los átomos comparten los electrones, aunque sea en forma desigual). Se establece entre átomos con similar electronegatividad.

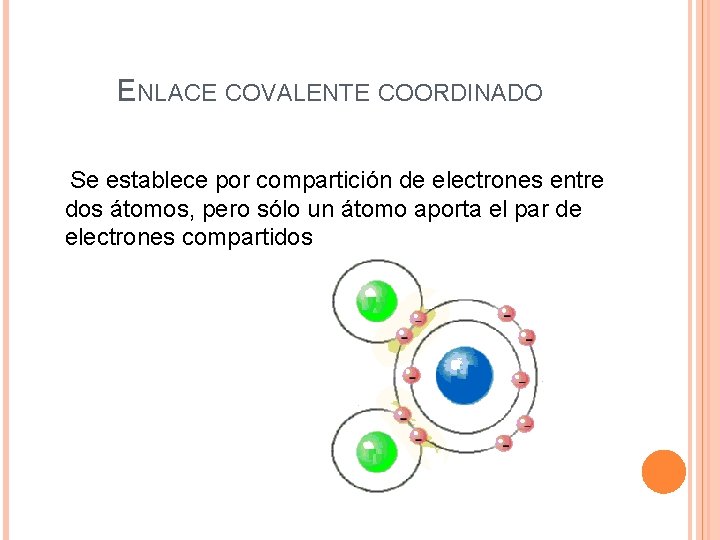
ENLACE COVALENTE COORDINADO Se establece por compartición de electrones entre dos átomos, pero sólo un átomo aporta el par de electrones compartidos

ENLACE METÁLICO Se forma entre átomos de elementos metálicos Los electrones son compartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad.

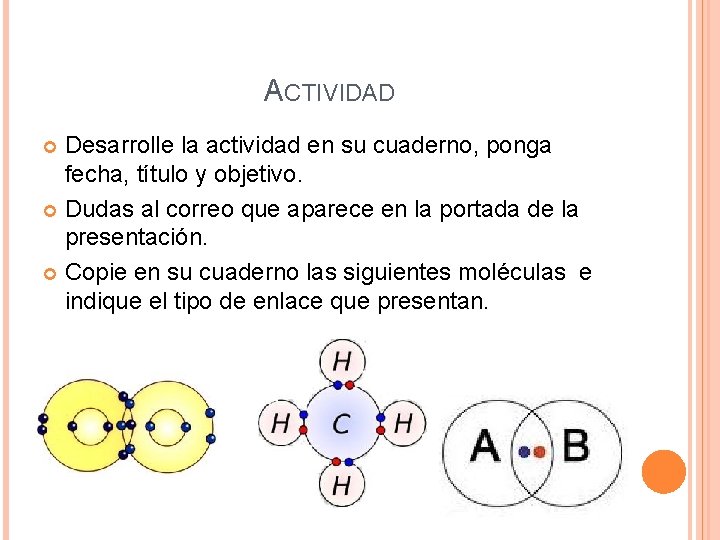
ACTIVIDAD Desarrolle la actividad en su cuaderno, ponga fecha, título y objetivo. Dudas al correo que aparece en la portada de la presentación. Copie en su cuaderno las siguientes moléculas e indique el tipo de enlace que presentan.
