ENLACE QUMICO Aprendizajes esperados Conocer la estructura de








- Slides: 25

ENLACE QUÍMICO

Aprendizajes esperados • Conocer la estructura de Lewis. • Identificar los diferentes tipos de enlace químico. • Conocer las propiedades fisicoquímicas de los distintos tipos de compuestos (iónicos, covalentes y metálicos). • Determinar la geometría molecular de distintos compuestos químicos e iones.

Pregunta oficial PSU De acuerdo con la siguiente representación de Lewis se puede afirmar que el elemento X I) pertenece al grupo II A de la tabla periódica. II) puede formar una molécula X 2 III) tiene 4 electrones de valencia. Es (son) correcta(s) A) B) C) D) E) solo III. solo I y II. solo II y III. Fuente : DEMRE - U. DE CHILE, PSU 2010.

1. Enlace químico 2. Estructura de Lewis 3. Tipos de enlace 4. Geometría molecular

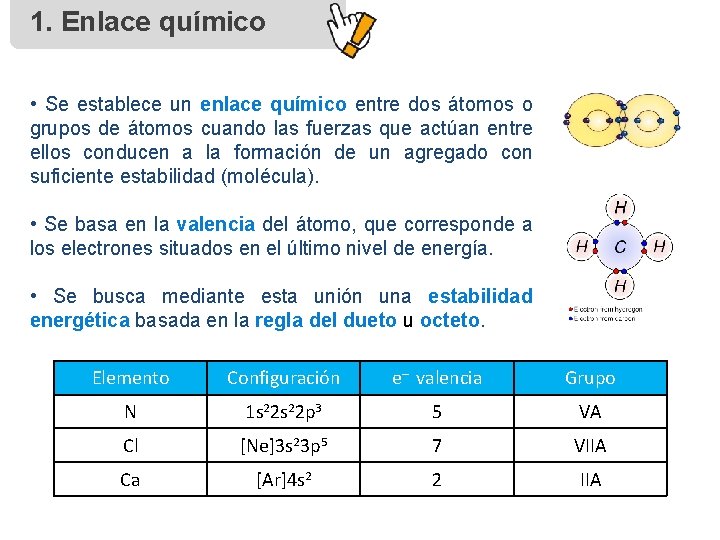
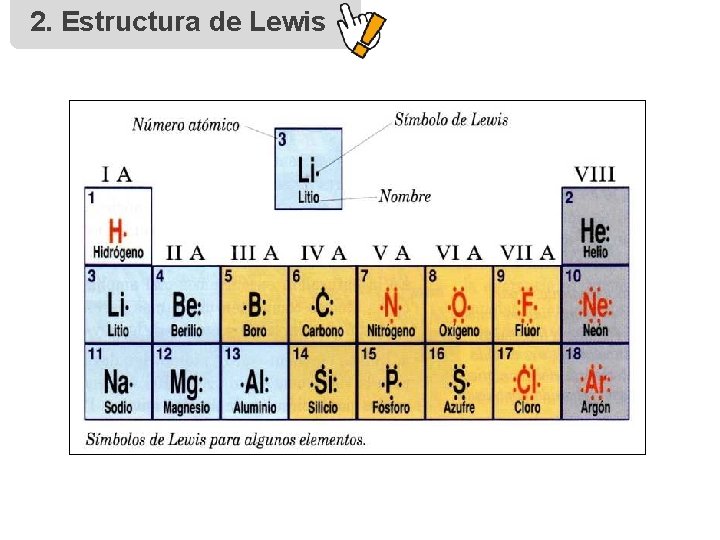
1. Enlace químico • Se establece un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas que actúan entre ellos conducen a la formación de un agregado con suficiente estabilidad (molécula). • Se basa en la valencia del átomo, que corresponde a los electrones situados en el último nivel de energía. • Se busca mediante esta unión una estabilidad energética basada en la regla del dueto u octeto. Elemento Configuración e– valencia Grupo N 1 s 22 p 3 5 VA Cl [Ne]3 s 23 p 5 7 VIIA Ca [Ar]4 s 2 2 IIA

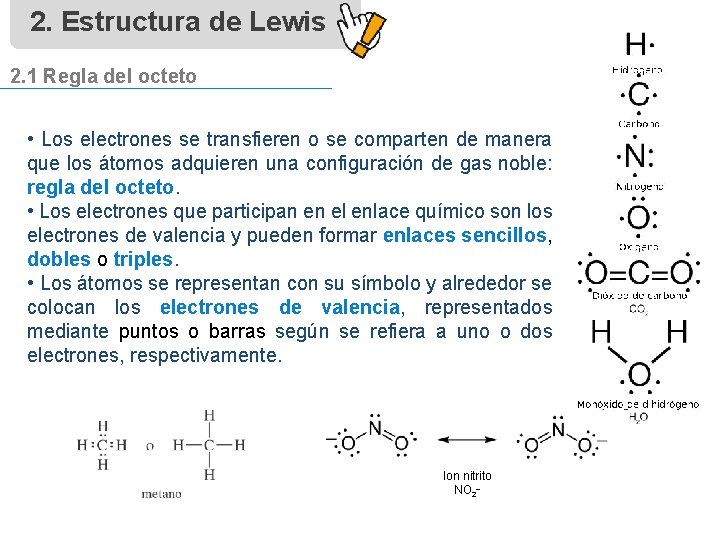
2. Estructura de Lewis 2. 1 Regla del octeto • Los electrones se transfieren o se comparten de manera que los átomos adquieren una configuración de gas noble: regla del octeto. • Los electrones que participan en el enlace químico son los electrones de valencia y pueden formar enlaces sencillos, dobles o triples. • Los átomos se representan con su símbolo y alrededor se colocan los electrones de valencia, representados mediante puntos o barras según se refiera a uno o dos electrones, respectivamente. Ion nitrito NO 2–

2. Estructura de Lewis

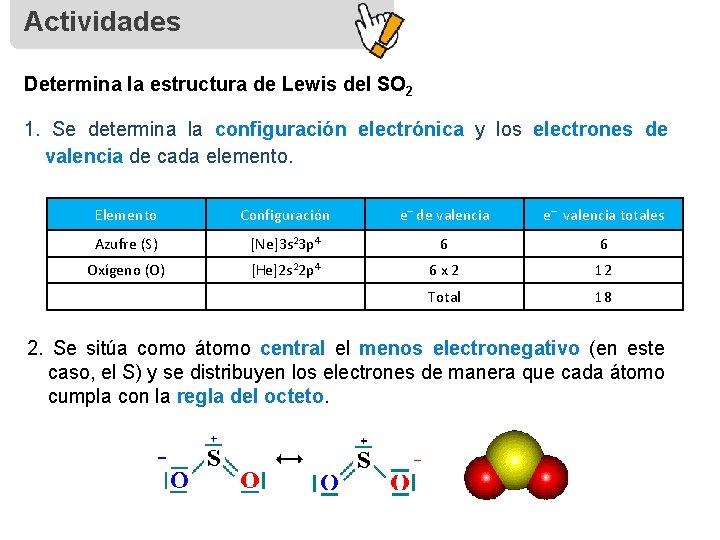
Actividades Determina la estructura de Lewis del SO 2 1. Se determina la configuración electrónica y los electrones de valencia de cada elemento. Elemento Configuración e– de valencia e– valencia totales Azufre (S) [Ne]3 s 23 p 4 6 6 Oxígeno (O) [He]2 s 22 p 4 6 x 2 12 Total 18 2. Se sitúa como átomo central el menos electronegativo (en este caso, el S) y se distribuyen los electrones de manera que cada átomo cumpla con la regla del octeto.

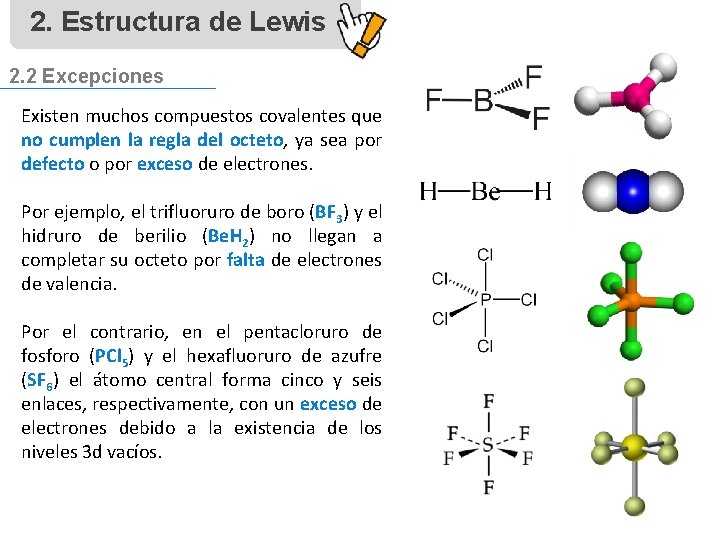
2. Estructura de Lewis 2. 2 Excepciones Existen muchos compuestos covalentes que no cumplen la regla del octeto, ya sea por defecto o por exceso de electrones. Por ejemplo, el trifluoruro de boro (BF 3) y el hidruro de berilio (Be. H 2) no llegan a completar su octeto por falta de electrones de valencia. Por el contrario, en el pentacloruro de fosforo (PCl 5) y el hexafluoruro de azufre (SF 6) el átomo central forma cinco y seis enlaces, respectivamente, con un exceso de electrones debido a la existencia de los niveles 3 d vacíos.

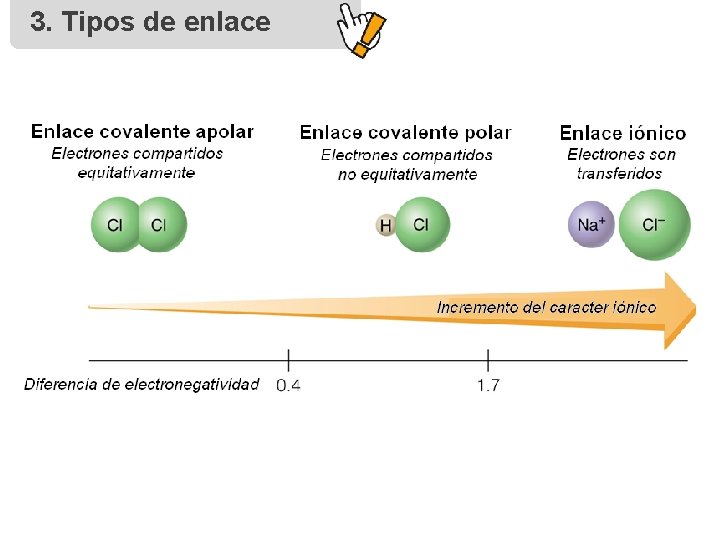
3. Tipos de enlace 3. 1 Enlace iónico Características del enlace Propiedades de los compuestos • Se produce cuando entran en contacto un elemento muy electropositivo y uno muy electronegativo produciéndose una TRANSFERENCIA de electrones desde el primero hacia el segundo. • Se forma entre elementos de los grupos IA o IIA con elementos de los grupos VIA o VIIA. • Diferencia de electronegatividad ≥ 1, 7 • Forman redes cristalinas. • Son sólidos con puntos de fusión y ebullición altos. • Son solubles en disolventes polares. • Conducen la corriente eléctrica en disolución acuosa. • No conducen la corriente en estado sólido. • Son malos conductores térmicos. Cs. Cl

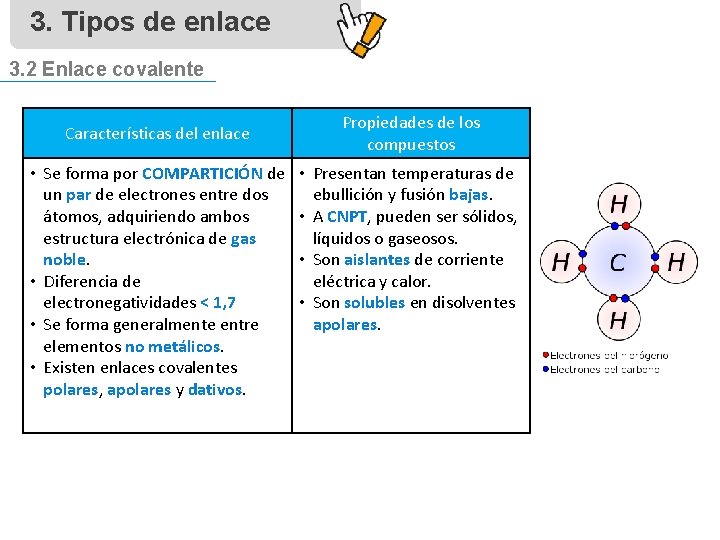
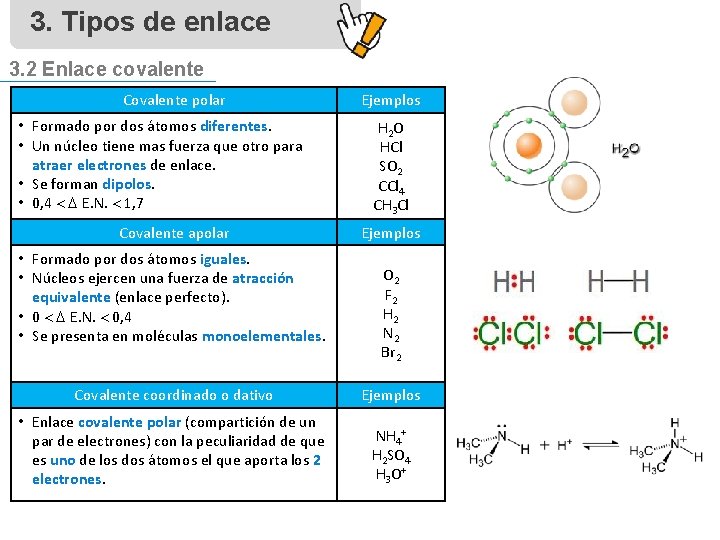
3. Tipos de enlace 3. 2 Enlace covalente Características del enlace • Se forma por COMPARTICIÓN de un par de electrones entre dos átomos, adquiriendo ambos estructura electrónica de gas noble. • Diferencia de electronegatividades < 1, 7 • Se forma generalmente entre elementos no metálicos. • Existen enlaces covalentes polares, apolares y dativos. Propiedades de los compuestos • Presentan temperaturas de ebullición y fusión bajas. • A CNPT, pueden ser sólidos, líquidos o gaseosos. • Son aislantes de corriente eléctrica y calor. • Son solubles en disolventes apolares.

3. Tipos de enlace 3. 2 Enlace covalente Covalente polar • Formado por dos átomos diferentes. • Un núcleo tiene mas fuerza que otro para atraer electrones de enlace. • Se forman dipolos. • 0, 4 E. N. 1, 7 Covalente apolar • Formado por dos átomos iguales. • Núcleos ejercen una fuerza de atracción equivalente (enlace perfecto). • 0 E. N. 0, 4 • Se presenta en moléculas monoelementales. Ejemplos H 2 O HCl SO 2 CCl 4 CH 3 Cl Ejemplos O 2 F 2 H 2 N 2 Br 2 Covalente coordinado o dativo Ejemplos • Enlace covalente polar (compartición de un par de electrones) con la peculiaridad de que es uno de los dos átomos el que aporta los 2 electrones. NH 4+ H 2 SO 4 H 3 O +

3. Tipos de enlace 3. 3 Enlace metálico Características del enlace • Característico de los metales. • Es un enlace fuerte, que se forma entre elementos de la misma especie, de electronegatividades bajas y similares. • Se forma una nube electrónica con los electrones deslocalizados. Propiedades de los compuestos • Son dúctiles y maleables. • Son buenos conductores de la electricidad. • Conducen el calor. • Tienen puntos de fusión y ebullición variables. • La mayoría son sólidos a T ambiente (excepto el mercurio). • Son, generalmente, insolubles en cualquier tipo de disolvente. • Tienen un brillo característico, debido a que absorben energía de cualquier longitud de onda. Nuestro cobre chileno. Gran conductor de la electricidad.

3. Tipos de enlace

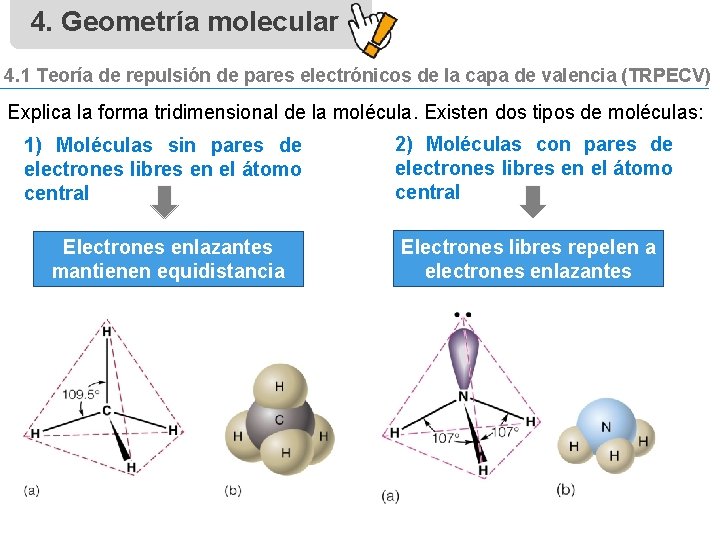
4. Geometría molecular 4. 1 Teoría de repulsión de pares electrónicos de la capa de valencia (TRPECV) Explica la forma tridimensional de la molécula. Existen dos tipos de moléculas: 1) Moléculas sin pares de electrones libres en el átomo central 2) Moléculas con pares de electrones libres en el átomo central Electrones enlazantes mantienen equidistancia Electrones libres repelen a electrones enlazantes

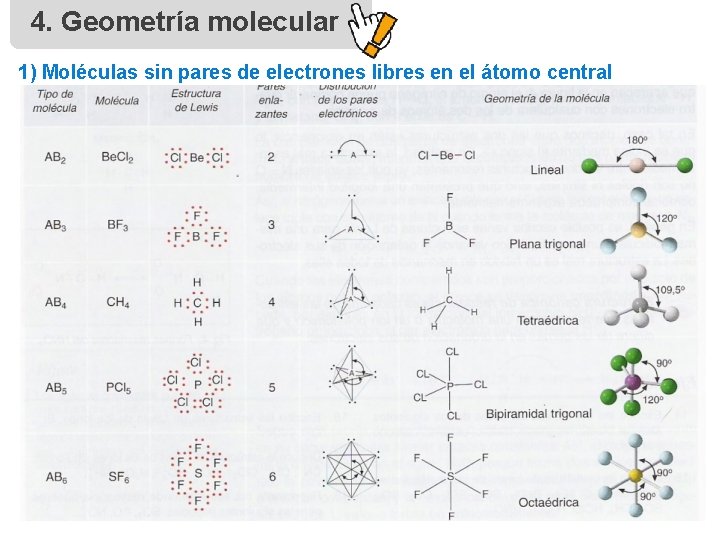
4. Geometría molecular 1) Moléculas sin pares de electrones libres en el átomo central

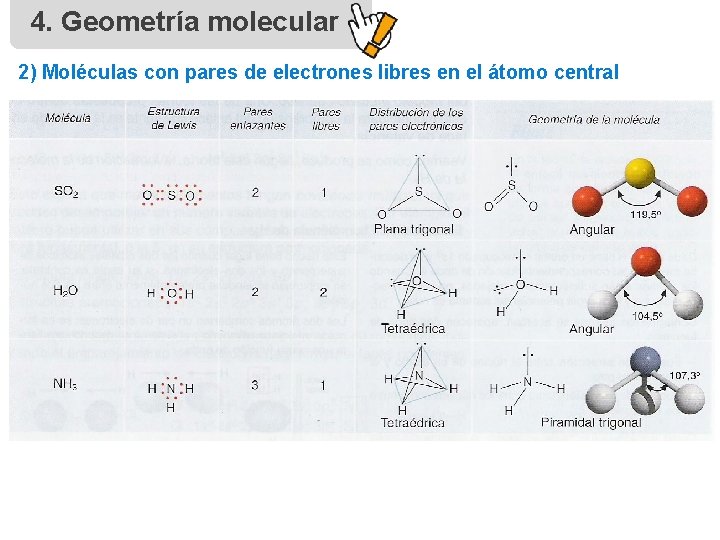
4. Geometría molecular 2) Moléculas con pares de electrones libres en el átomo central

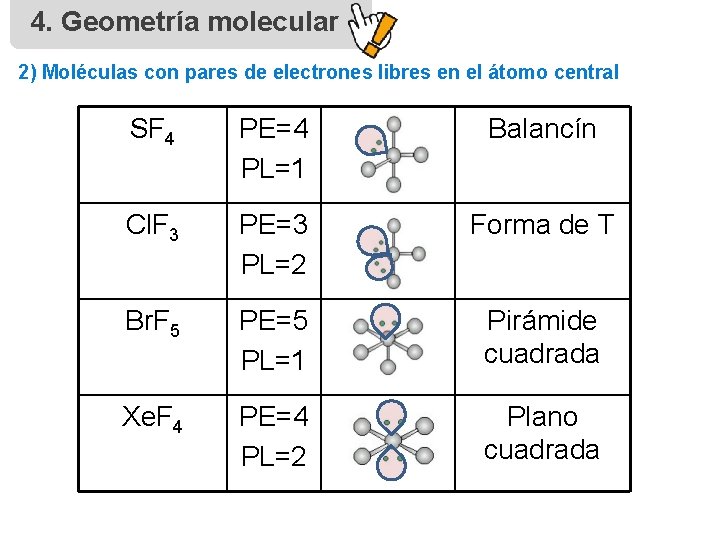
4. Geometría molecular 2) Moléculas con pares de electrones libres en el átomo central SF 4 PE=4 PL=1 Balancín Cl. F 3 PE=3 PL=2 Forma de T Br. F 5 PE=5 PL=1 Pirámide cuadrada Xe. F 4 PE=4 PL=2 Plano cuadrada

Actividades Determina estructura de Lewis y geometría molecular del CO 32– Paso 1. C es menos electronegativo que O, coloca C en el centro. Paso 2. Cuenta los electrones de valencia, sumando los electrones que dan la carga al ion. Elemento Configuración e– de valencia e– valencia totales Carbono (C) [He]2 s 22 p 2 4 4 Oxígeno (O) [He]2 s 22 p 4 6 x 3 18 + 2 (cargas negativas) Total 24 Paso 3. Dibuja enlaces sencillos entre los átomos de C y O y completa los octetos.

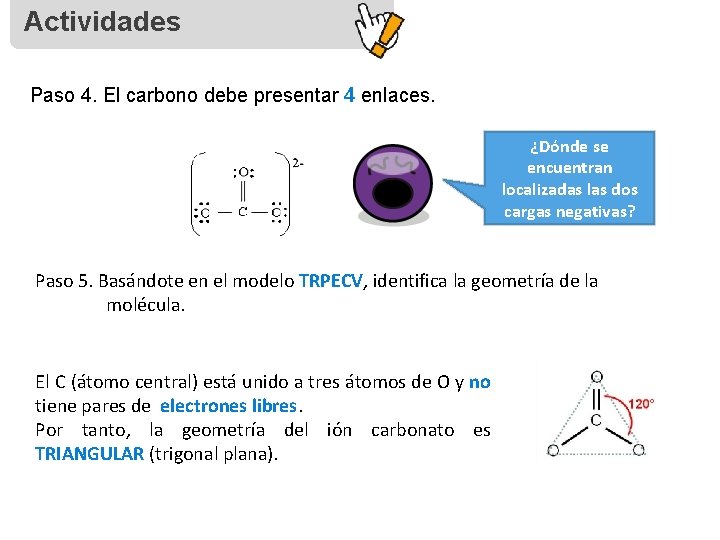
Actividades Paso 4. El carbono debe presentar 4 enlaces. ¿Dónde se encuentran localizadas las dos cargas negativas? Paso 5. Basándote en el modelo TRPECV, identifica la geometría de la molécula. El C (átomo central) está unido a tres átomos de O y no tiene pares de electrones libres. Por tanto, la geometría del ión carbonato es TRIANGULAR (trigonal plana).

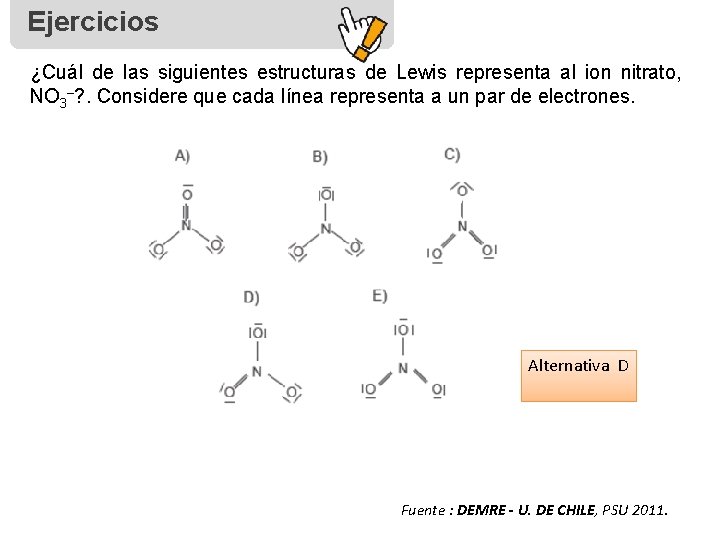
Ejercicios ¿Cuál de las siguientes estructuras de Lewis representa al ion nitrato, NO 3–? . Considere que cada línea representa a un par de electrones. Alternativa D Fuente : DEMRE - U. DE CHILE, PSU 2011.

Pregunta oficial PSU De acuerdo con la siguiente representación de Lewis se puede afirmar que el elemento X I) pertenece al grupo II A de la tabla periódica. II) puede formar una molécula X 2 III) tiene 4 electrones de valencia. Es (son) correcta(s) A) B) C) D) E) solo III. solo I y II. solo II y III. B Comprensión Fuente : DEMRE - U. DE CHILE, PSU 2010.

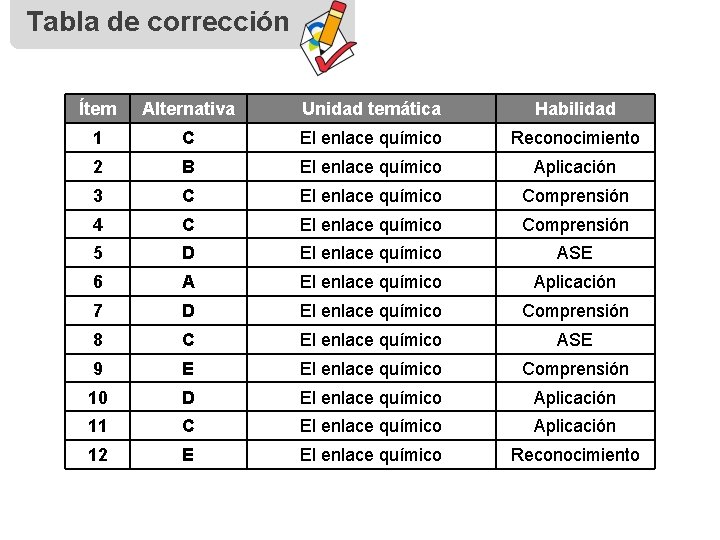
Tabla de corrección Ítem Alternativa Unidad temática Habilidad 1 C El enlace químico Reconocimiento 2 B El enlace químico Aplicación 3 C El enlace químico Comprensión 4 C El enlace químico Comprensión 5 D El enlace químico ASE 6 A El enlace químico Aplicación 7 D El enlace químico Comprensión 8 C El enlace químico ASE 9 E El enlace químico Comprensión 10 D El enlace químico Aplicación 11 C El enlace químico Aplicación 12 E El enlace químico Reconocimiento

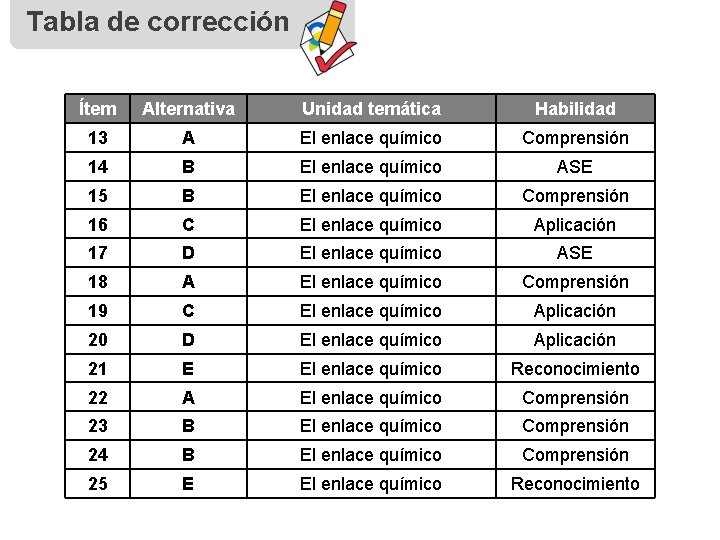
Tabla de corrección Ítem Alternativa Unidad temática Habilidad 13 A El enlace químico Comprensión 14 B El enlace químico ASE 15 B El enlace químico Comprensión 16 C El enlace químico Aplicación 17 D El enlace químico ASE 18 A El enlace químico Comprensión 19 C El enlace químico Aplicación 20 D El enlace químico Aplicación 21 E El enlace químico Reconocimiento 22 A El enlace químico Comprensión 23 B El enlace químico Comprensión 24 B El enlace químico Comprensión 25 E El enlace químico Reconocimiento

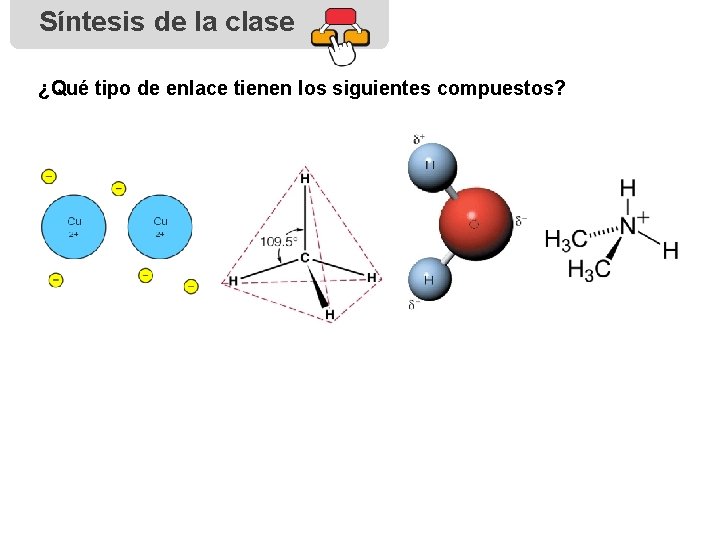
Síntesis de la clase ¿Qué tipo de enlace tienen los siguientes compuestos?
 Aprendizajes esperados de arte
Aprendizajes esperados de arte Aprendizajes esperados de los poemas
Aprendizajes esperados de los poemas Aprendizajes esperados de las operaciones basicas
Aprendizajes esperados de las operaciones basicas Enfoque pedagogico de conocimiento del medio primaria
Enfoque pedagogico de conocimiento del medio primaria Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Qumica
Qumica Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlaces signa
Enlaces signa Resultados esperados de um projeto exemplo
Resultados esperados de um projeto exemplo Resultados esperados de um projeto exemplo
Resultados esperados de um projeto exemplo Objetivos generales ejemplos
Objetivos generales ejemplos Resultados esperados de um projeto exemplo
Resultados esperados de um projeto exemplo Resultados esperados de um projeto exemplo
Resultados esperados de um projeto exemplo Resultados esperados de un proyecto ejemplo
Resultados esperados de un proyecto ejemplo Cronograma projeto de intervenção
Cronograma projeto de intervenção Enfoque competencial aprendizajes clave
Enfoque competencial aprendizajes clave Implicar a los alumnos en sus aprendizajes y su trabajo
Implicar a los alumnos en sus aprendizajes y su trabajo Uno de los mayores y mas valiosos aprendizajes
Uno de los mayores y mas valiosos aprendizajes Dua aprendizajes clave
Dua aprendizajes clave Tipos de aprendizajes
Tipos de aprendizajes Reforzamos nuestros aprendizajes
Reforzamos nuestros aprendizajes Estilos de aprendizajes de kolb
Estilos de aprendizajes de kolb Aprendizajes fundamentales
Aprendizajes fundamentales Reflexionando sobre nuestros aprendizajes aprendemos mejor
Reflexionando sobre nuestros aprendizajes aprendemos mejor