TALLER Evaluacin de la eficacia Tipos de ensayos


















































































- Slides: 117

TALLER Evaluación de la eficacia Tipos de ensayos y calidad Expresión de resultados Francesc Puigventós y Leonor del Mar Periáñez Servei de Farmàcia. Hospital Universitari Son Dureta. Palma de Mallorca VII CURSO Evaluación y selección de medicamenos Sevilla, 13 de Mayo de 2009

TALLER teoría 1 Tipos de ensayos, tipos de variables, tipos de resultados Francesc Puigventós y Leonor Periáñez Servei de Farmàcia. Hospital Universitari Son Dureta. Palma de Mallorca VII CURSO Evaluación y selección de medicamenos Sevilla, 13 de Mayo de 2009

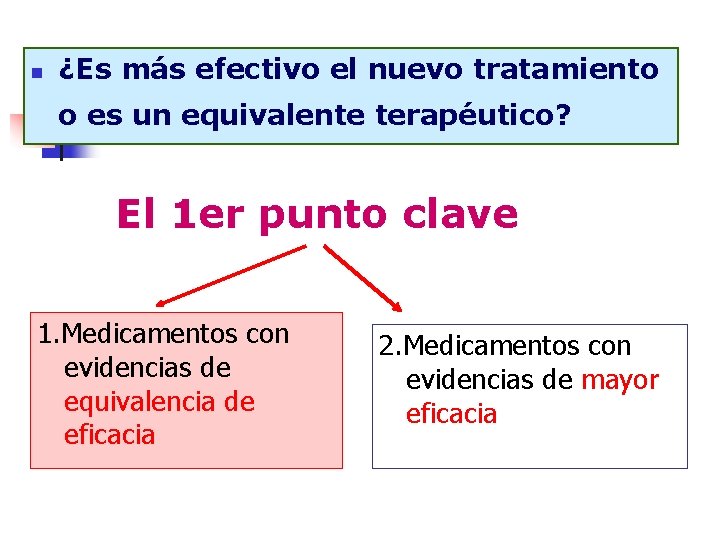
n ¿Es más efectivo el nuevo tratamiento o es un equivalente terapéutico? El 1 er punto clave 1. Medicamentos con evidencias de equivalencia de eficacia 2. Medicamentos con evidencias de mayor eficacia

Fase 1: evaluación de la eficacia Partiendo del/los ensayo/s clínico/ disponibles, determinar: n 1 -Magnitud y relevancia del resultado de eficacia n n Ensayo de Superioridad? Ensayo de Equivalencia o No. Inferioridad? 2 -Validez interna n 3 -Validez externa y aplicabilidad n

Fase 1: evaluación de la eficacia Se contemplan dos tipos de estrategias: A) MEDICAMENTOS DE APROBACIÓN RECIENTE (ULTIMOS 1 -2 AÑOS) Este tipo de medicamentos suelen tener unos pocos ensayos pivotales (máximo 2 ó 3) para una indicación determinada. Suelen haber sido aprobados de forma centralizada por la EMEA o la FDA. B) MEDICAMENTOS REGISTRADOS DESDE HACE AÑOS Suelen tener muchos ensayos publicados, además de revisiones y metanálisis. Suelen ser medicamentos que han sido aprobados por reconocimiento mutuo y no disponemos de los informes de las agencias EMEA, FDA.

Identificación de resultados del estudio de interés para la evaluación n Resultados principales o primarios n n Resultados secundarios n n n Resultados secundarios de relevancia clínica Resultados secundarios de seguridad Datos de subgrupos n n De interés es el resultado principal que responde al objetivo principal y al diseño del estudio. De existir en el ensayo clínico subgrupos de pacientes con una relación de eficacia diferente y ello es importante para estratificar y establecer un protocolo de indicación del fármaco. Análisis “post-hoc”, ir de pesca?



Forma de expresar los resultados en los ensayos clínicos Tipos de variables Cualitativas o categóricas Cuantitativas o continuas Time-to-Event


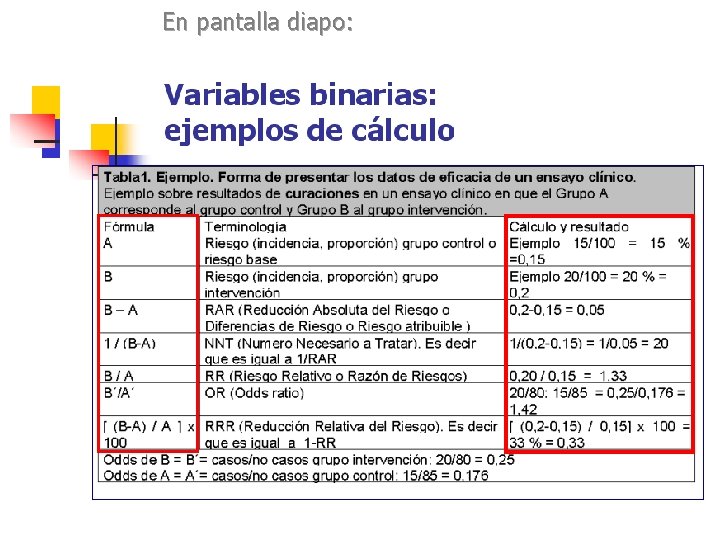
Variables binarias. Expresión de resultados en los ensayos clínicos: n Medidas absolutas: n n n Reducción Absoluta del Riesgo (RAR) NNT Medidas relativas: n n n Reducción Relativa del Riesgo (RRR) Riesgo Relativo (RR) Odds Ratio (OR)

Variables binarias: Lo más habitual


Variables binarias: Alerta con la forma de presentar los datos de eficacia: los % relativos n n Ejemplo: si un fármaco disminuye la mortalidad de un 6 % a un 2 %, podemos decir realmente que : En todos los casos decimos la verdad. Por ello es mejor hablar en términos de RAR (Reducción Absoluta del Riesgo) perqué todos lo entendemos de forma más clara y precisa. n n n Ha disminudo la mortalidad un 4 % en términos absolutos (6% -> 2%) (RAR). Ha disminudo la mortalidad un 66, 6 % en términos relativos (6% -> 2%) (RRR). Ha aumentado la supervivencia del 94% al 98%, és decir un 4, 2% en términos relativos (RRR)

Variables binarias: Alerta con la forma de presentar los datos de eficacia: los % relativos n n Ejemplo: si un fármaco disminuye la mortalidad de un 6 % a un 2 %, podemos decir realmente que : En todos los casos decimos la verdad. Por ello es mejor hablar en términos de RAR y NNT (Reducción Absoluta del Riesgo) perqué todos lo entendemos de forma más clara y precisa. n n Riesgo Relativo 2% / 6% = 0, 33 (RR) Odds Ratio: 0, 02/0, 98: 0. 06/0, 94=0, 31 (OR) NNT (1/RAR): Por cada 25 pacientes tratados uno más sobrevive

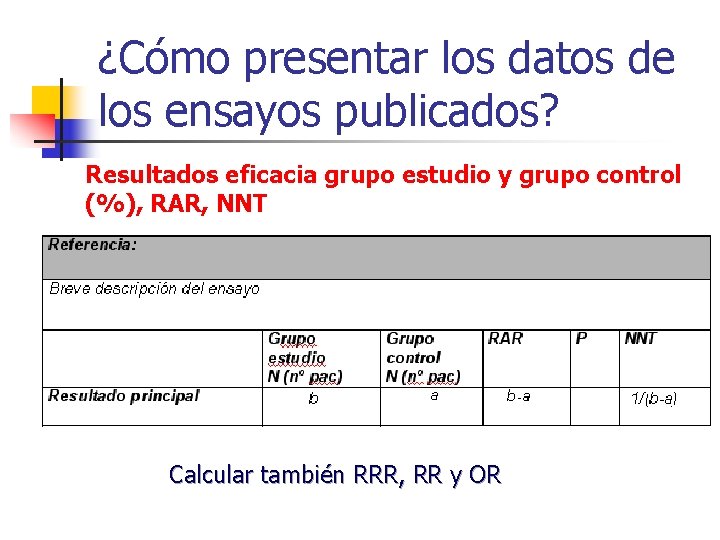
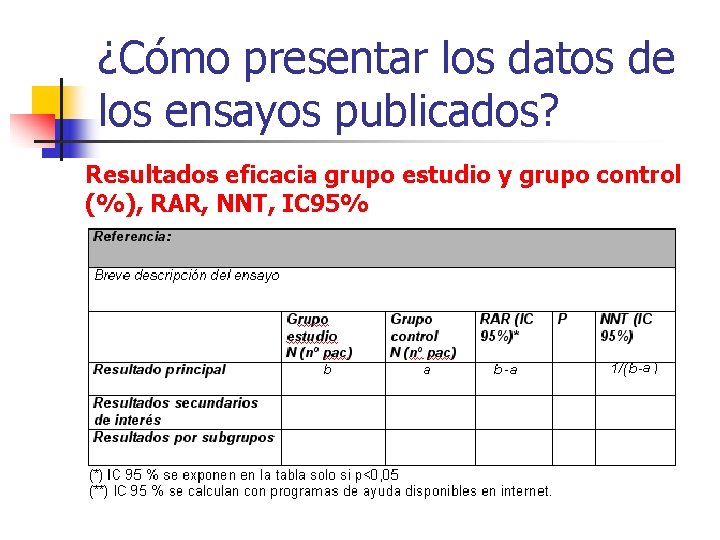
1 -Para valorar mejor la magnitud y relevancia clínica de los resultados de eficacia n Medidas relativas: n n n Riesgo Relativo (RR) Reducción Relativa del Riesgo ( RRR) Odds Ratio (OR) Hazard Ratio (HR) Medidas absolutas: n n Reducción Absoluta del Riesgo (RAR) Número Necesario a Tratar (NNT) n n n Resultados de eficacia grupo estudio y grupo control (%) RAR NNT La RAR (Reducción Absoluta del Riesgo o Diferencia de Riesgo o Riesgo atribuïble ) es la forma más simple de expresar la diferencia de eficacia entre los grupos estudiados. És la diferencia de proporciones de un acontecimiento entre el grup control y el grupo intervención. NNT=1/RAR


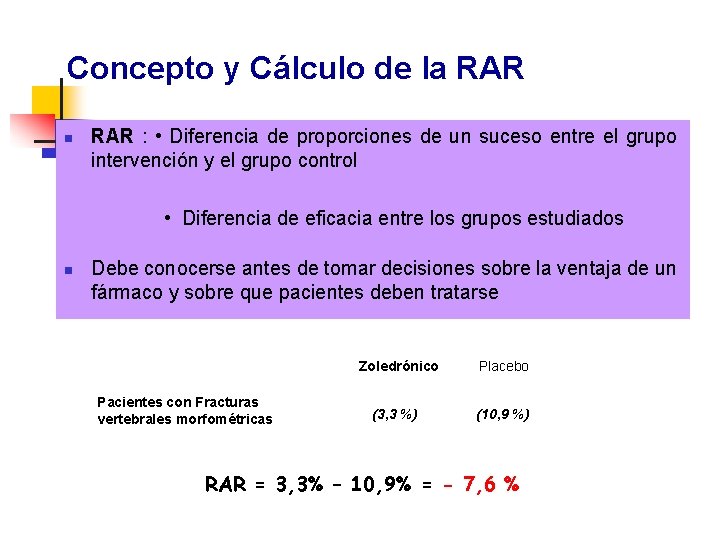
Concepto y Cálculo de la RAR n RAR : • Diferencia de proporciones de un suceso entre el grupo intervención y el grupo control • Diferencia de eficacia entre los grupos estudiados n Debe conocerse antes de tomar decisiones sobre la ventaja de un fármaco y sobre que pacientes deben tratarse Pacientes con Fracturas vertebrales morfométricas Zoledrónico Placebo (3, 3 %) (10, 9 %) RAR = 3, 3% – 10, 9% = - 7, 6 %

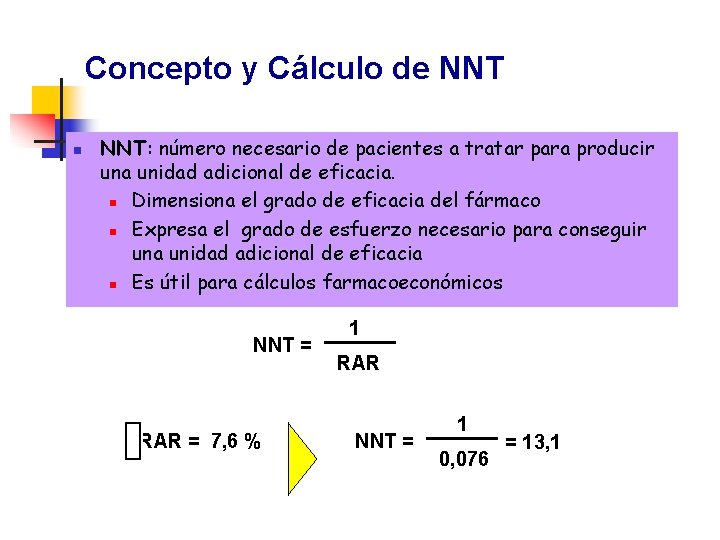
Concepto y Cálculo de NNT n NNT: número necesario de pacientes a tratar para producir una unidad adicional de eficacia. n Dimensiona el grado de eficacia del fármaco n Expresa el grado de esfuerzo necesario para conseguir una unidad adicional de eficacia n Es útil para cálculos farmacoeconómicos NNT = RAR = 7, 6 % 1 RAR NNT = 1 0, 076 = 13, 1

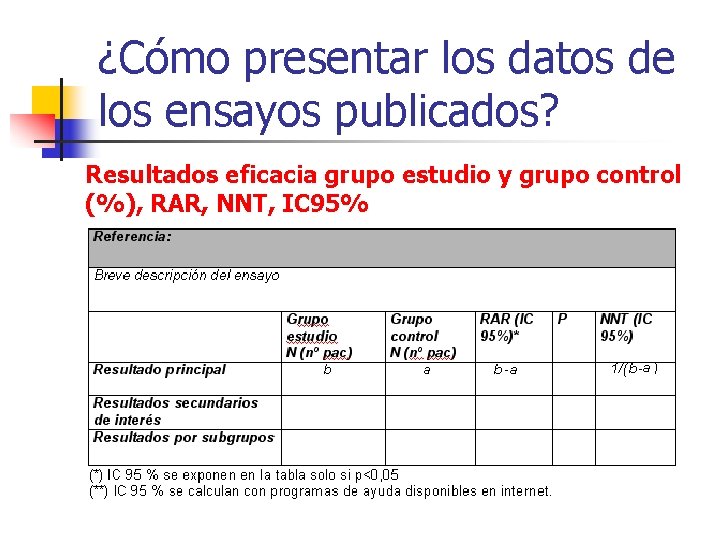
¿Cómo presentar los datos de los ensayos publicados? Resultados eficacia grupo estudio y grupo control (%), RAR, NNT, IC 95%

Medidas relativas: concepto de RRR n El RRR es la diferencia en las proporciones de sucesos entre el grupo tratamiento y el grupo control, dividido por la proporción de sucesos en el grupo control. RRR = [ (B-A) / A ] x 100 A=Riesgo (incidencia, proporción) grupo control o Riesgo base = 10, 9 % B= Riesgo (incidencia, proporción) grupo intervención = 3, 3 % RRR = ( 3, 3 -10, 9)/10, 9 x 100 = 7, 6/10, 9 = 70 % n Cuidado con forma de presentar los datos de eficacia Nota RRR = (RAR/A) x 100 RRR = 1 -RR




Medidas relativas: concepto de RR n El RR (Riesgo Relativo, Razón de Riesgos ) es una relación entre la proporción de sucesos del grupo intervención y del grupo control. RR = B/A A=Riesgo (incidencia, proporción) grupo control o Riesgo base = 10, 9 % B= Riesgo (incidencia, proporción) grupo intervención = 200/1000 = 3, 3 % RR = 3, 3/10, 9 = 0, 30 n Es una medida relativa de los resultados relacionada directamente con RRR (Reducción del Riesgo Relativo), de hecho RRR=(1 -RR)x 100.


Medidas relativas: concepto de RR n n n El RR toma valores entre 0 e infinito. El valor 1 es el valor neutro y significa que no hay diferencias entre los grupos comparados. Cuando nos acercamos al valor 0 o a un valor muy superior a 1, significa que la diferencia entre grupos és muy grande. Si toma un valor >1 significa que el grupo el resultado del cual ponemos en el numerador tiene una mayor proporción que el que ponemos en el denominador, al contrario si el RR és <1. Si =1 no hay diferencias (En general en la fórmula de cálculo del RR, el riesgo base ( “control event rate”) se situa en el denominador y el del grupo intervención en el numerador.

Odds y Riesgo o proporción El Sevilla gane al Mallorca: 80%: (100 -80)% 80: 20 Odds 4: 1 = 4 El Sevilla gane al Betis: 60 % 60%: (100 -60)% Odds: 6: 4 = 1, 5 60: 40

Medidas relativas: concepto de Odds ratio (OR) n n L'Odds. Es la razón en la cual el numerador es la probabilidad de que ocurra un suceso y el denominador es la probabildad de que éste no ocurra. Odds = p/(1 -p) La división de una odds por otra odds es una razón de odds. La fórmula de cálculo es: OR = p 1/ (1 -p 1) : p 2/(1 -p 2). n Cálculo de Odds ratio a partir de una tabla 2 x 2

Medidas relativas: concepto de Odds ratio (OR) 3, 3% vs 10, 9% n n L'Odds. Es la razón en la cual el numerador es la probabilidad de que ocurra un suceso y el denominador es la probabildad de que éste no ocurra. Odds = p/(1 -p) 3, 3 / 96, 7 = 0, 0341 10, 9 / 89, 1 = 0, 1223 La división de una odds por otra odds es una razón de odds. La fórmula de cálculo es: OR = p 1/ (1 -p 1) : p 2/(1 -p 2) 0, 0341/0, 1223 = 0, 28 n Cálculo de Odds ratio a partir de una tabla 2 x 2

Relación entre RR y OR n n El RR es un cociente o relación de proporciones y la OR es un cociente o relación de dos odds. Tanto las proporciones como las odds expresan lo mismo, pero usan dos escalas numéricas diferentes, las proporciones oscilan entre 0 i 1 y las odds entre 0 e infinito. En general los resultados expresados en OR seran mucho más aparentes, es decir , con valores más extremos (más cercano de 0 o más cercano a infinito) que los expresados en RR, especialmente n n Cuando la incidència del suceso en uno de los 2 grupos es superior al 10% y/o las diferencias entre ellos son grandes. Los IC de las OR también suelen ser más amplias que las de los RR

Resumen n n Relación entre medidas absolutas y relativas Un RR o un OR pueden ser difíciles de interpretar si no se traducen en medidas de diferencia absoluta de riesgos. La RAR y el NNT se puede calcular a partir del RR si se conoce la incidencia del acontecimiento en el grupo control. También existen fórmulas para calcular el NNT derivadas de los resultados de un EECC a partir del OR.

¿Cómo extraer los datos de los Ensayos clínicos? n Medidas relativas: n n n Riesgo Relativo (RR) Reducción Relativa del Riesgo ( RRR) Odds Ratio (OR) Hazard Ratio (HR) Medidas absolutas: n n Reducción Absoluta del Riesgo (RAR) Número Necesario a Tratar (NNT) n n n Resultados de eficacia grupo estudio y grupo control (%) RAR NNT La RAR (Reducción Absoluta del Riesgo o Diferencia de Riesgo o Riesgo atribuïble ) es la forma más simple de expresar la diferencia de eficacia entre los grupos estudiados. És la diferencia de proporciones de un acontecimiento entre el grup control y el grupo intervención. NNT=1/RAR

n Práctica 1 n Ensayo Record 1 (ya preparado)

¿Cómo presentar los datos de los ensayos publicados? Resultados eficacia grupo estudio y grupo control (%), RAR, NNT Calculartambién. RRR, RR RRyy. OR OR

En pantalla diapo:

n Práctica 2. n Ensayo Record 3 (copia publicación)

¿Cómo presentar los datos de los ensayos publicados? Resultados eficacia grupo estudio y grupo control (%), RAR, NNT, IC 95%

TALLER teoría 2 Eficacia: IC 95% p Programas de cálculo Francesc Puigventós y Leonor Periáñez Servei de Farmàcia. Hospital Universitari Son Dureta. Palma de Mallorca VII CURSO Evaluación y selección de medicamenos Sevilla, 13 de Mayo de 2009

Significación estadística p

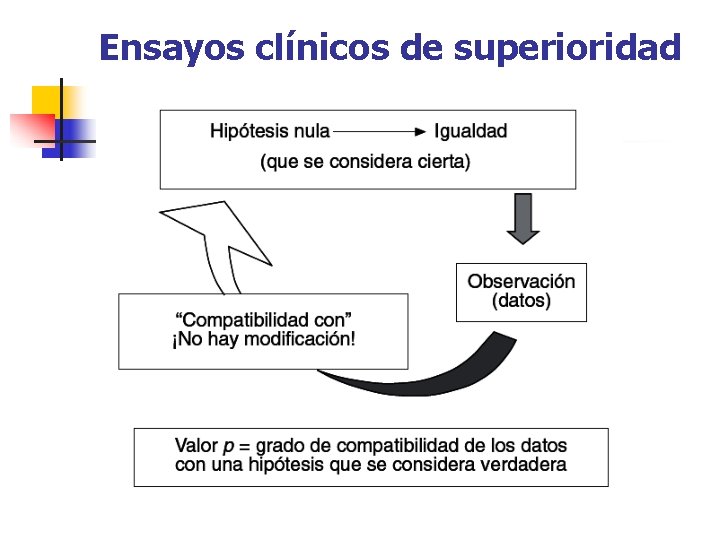
Ensayos clínicos de superioridad

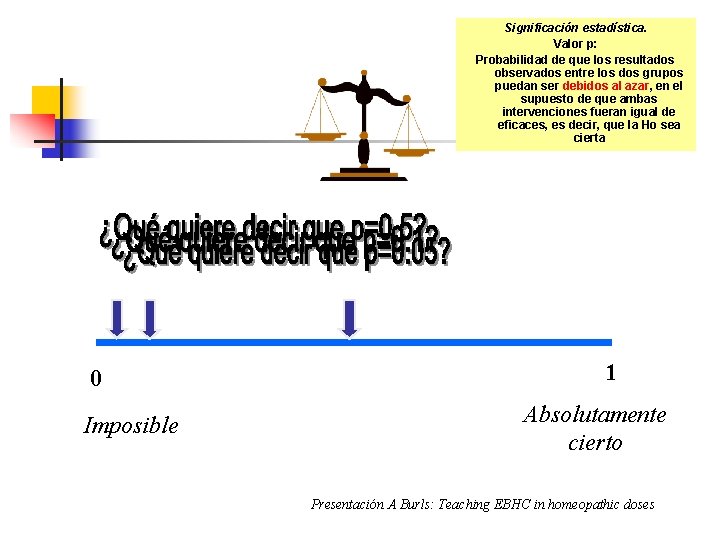
Significación estadística. Valor p: Probabilidad de que los resultados observados entre los dos grupos puedan ser debidos al azar, en el supuesto de que ambas intervenciones fueran igual de eficaces, es decir, que la Ho sea cierta 0 Imposible 1 Absolutamente cierto Presentación A Burls: Teaching EBHC in homeopathic doses

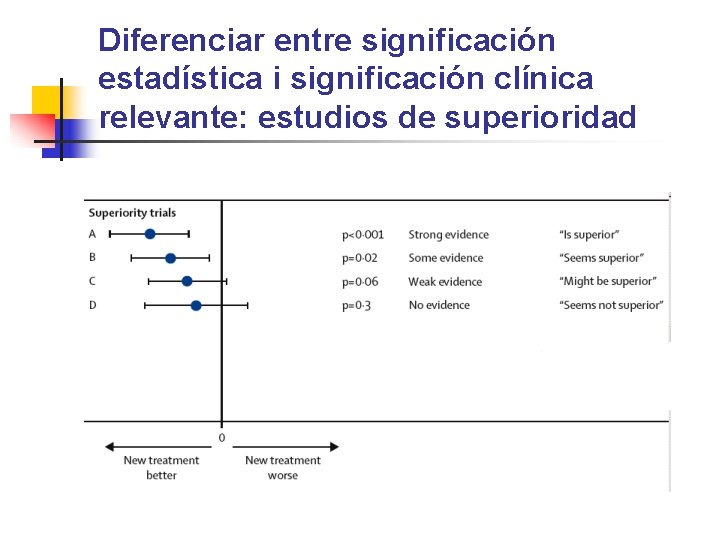
Valor de p en estudios de superioridad n Si p ≤ 0, 05 , rechazaremos la Ho. Es decir, e resultado es estadíst. significativo. n n “Las dos intervenciones no son igual de eficaces” Si p > 0, 05 , no rechazaremos la Ho. Es decir, el resultado no es estadíst. significativo.

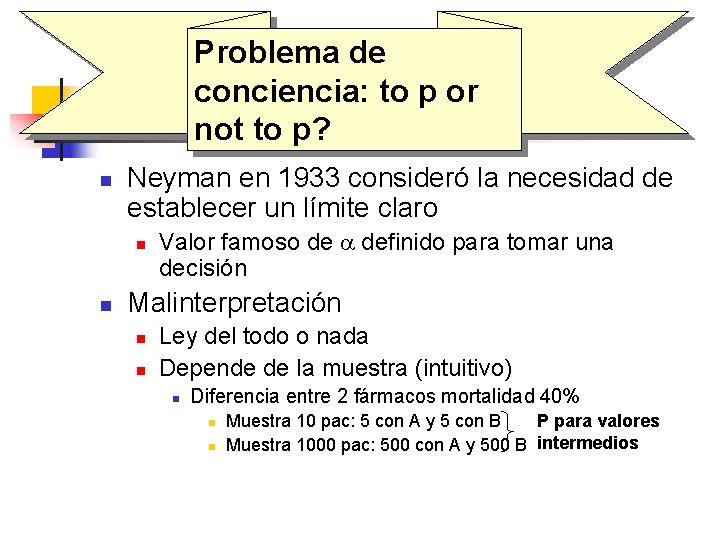
Problema de conciencia: to p or not to p? n Neyman en 1933 consideró la necesidad de establecer un límite claro n n Valor famoso de a definido para tomar una decisión Malinterpretación n n Ley del todo o nada Depende de la muestra (intuitivo) n Diferencia entre 2 fármacos mortalidad 40% n n P para valores Muestra 10 pac: 5 con A y 5 con B Muestra 1000 pac: 500 con A y 500 B intermedios


intervalos de confianza IC Los resultados de las variables vienen dados por el valor medio que se ha obtenido del ensayo y por un intervalo de confianza (IC)

Intervalos de Confianza 2 1 El Intervalo de Confianza es el rango en que se encuentra el verdadero valor del efecto), con un determinado grado de certeza. El Intervalo de Confianza al 95% (IC 95%). Es el intervalo que incluye el verdadero valor con un 95 % de certeza. El Intervalo de Confianza se basa en la asunción que los resultados de un ensayo son la observación de una muestra de toda una serie de posibles observaciones que se obtendrían si el estudio se repitiera muchas veces. El Intervalo de Confianza del 95 % (IC 95%). Si el experimento se repitiera muchas veces en el 95 % de las ocasiones el resultado se encontraría dentro del intervalo

Significación estadística (p) e intervalos de confianza (IC 95%) n n p Probabilidad de que sea cierto IC Magnitud del resultado y el intervalo en que se encuentra

Significación estadística (p) e intervalos de confianza (IC 95%) Intervalo de Confianza : n n Permite conocer entre qué límites tenemos un determinado nivel de confianza o certeza de que encuentre la magnitud verdadera, y ver si incluye o excluye el mínimo valor considerado de relevancia clínica. Pero además. . . El Intervalo de Confianza (IC 95%): Nos informa sobre si el resultado es o no es estadísticamente significativo para p<0. 05

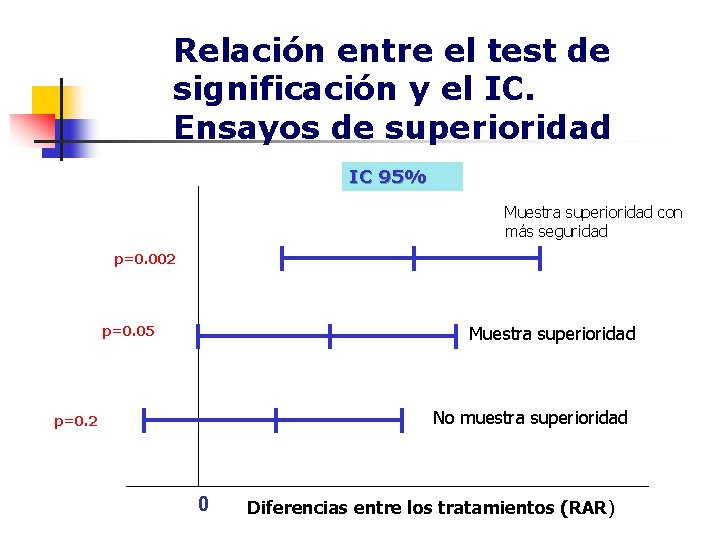
Relación entre el test de significación y el IC. Ensayos de superioridad IC 95% Muestra superioridad con más seguridad p=0. 002 Muestra superioridad p=0. 05 No muestra superioridad p=0. 2 0 Diferencias entre los tratamientos (RAR)

Significación estadística. Valor p: Probabilidad de que los resultados observados entre los dos grupos puedan ser debidos al azar, en el supuesto de que ambas intervenciones fueran igual de eficaces, es decir, que la Ho sea cierta ¿Qué quiere decir que p=0, 06? ¿Qué quiere decir que p=0, 05? 0 Imposible 1 Absolutamente cierto Presentación A Burls: Teaching EBHC in homeopathic doses


http: //www. theshakespeares. com/Free_statistical_software. html Shakespeare TP, Gebski VJ, Veness MJ, Simes J. Improving the interpretation of clinical studies by use of confidence levels, clinical significance curves, and risk-benefit contours. Lancet 2001; 357: 1349 -1353.


Calculadoras disponibles Ventajas e inconvenientes

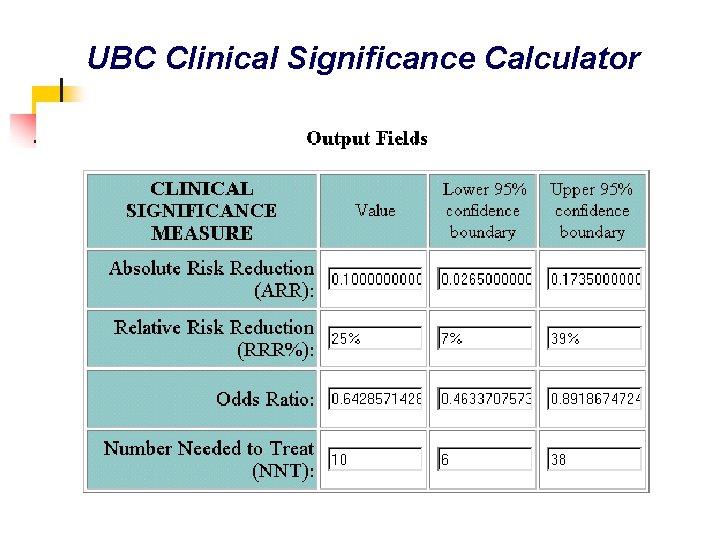
UBC Clinical Significance Calculator

UBC Clinical Significance Calculator

Risk Reduction Calculator

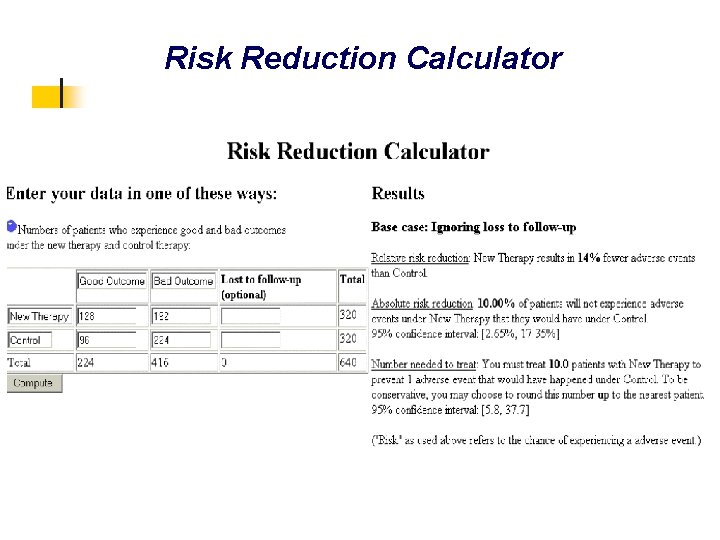
Risk Reduction Calculator

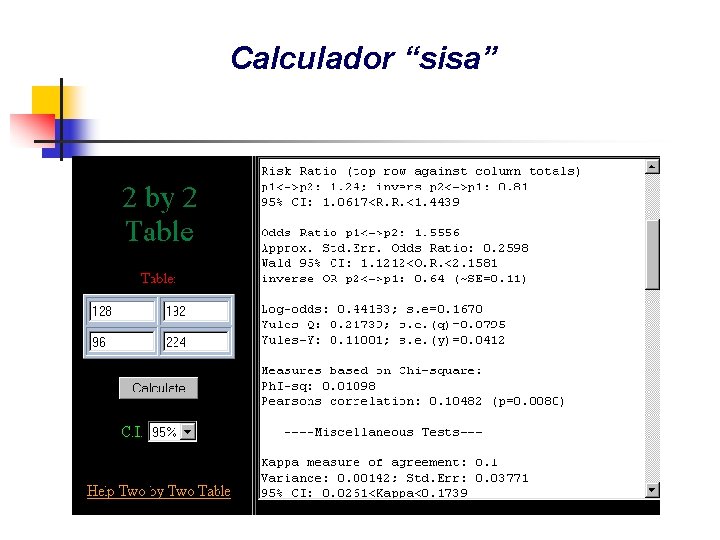
Calculador “sisa”

Con Caspe n Práctica 3 Con datos de práctica 2 (Record 3) n

¿Cómo presentar los datos de los ensayos publicados? Resultados eficacia grupo estudio y grupo control (%), RAR, NNT, IC 95%

Variables continuas

Variables continuas: IC 95% para diferencias de medias No NNT

TALLER teoría 3 Magnitud de las diferencias: Relevancia clínica y significación estadística Como interpretar resultados en Estudios de equivalencia y no inferioridad: Fundamentos. Valor delta. Francesc Puigventós y Leonor Periáñez Servei de Farmàcia. Hospital Universitari Son Dureta. Palma de Mallorca VII CURSO Evaluación y selección de medicamenos Sevilla, 13 de Mayo de 2009

Magnitud de las diferencias n Diferencias clínicamente relevantes n n 1 -Valorar la magnitud del efecto, si hay evidencias de superioridad y si esta es de relevancia clínica. 2 -Valorar si hay evidencias de equivalencia terapéutica.

Valorar si la magnitud del efecto del tratamiento es de relevancia clínica. n El definir un valor como clínicamente relevante, debe considerarse desde el punto de vista clínico y desde el punto de vista estadístico.

Valorar si la magnitud del efecto del tratamiento es de relevancia clínica. Desde el punto de vista clínico No es sencillo pero nos pueden ayudar algunos criterios: Es importante la opinión del clínico y nuestro propio criterio y valoración de lo que es relevante en el contexto del tipo de variable (intermedia, final), riesgo basal y del proceso patológico determinado. n n En los estudios de no inferioridad y de equivalencia, se define el llamado valor “delta” o el valor de la media de diferencias mínimas consideradas clínicamente relevantes. En los estudios de superioridad podemos orientarnos en base a la estimación de diferencias de eficacia mínimas para el que se ha calculado el tamaño muestral del ensayo.

¿Cuánta diferencia es irrelevante? Tema clínico Ejemplo: El antirretroviral “A” produce un 70% de cargas virales indetectables a las 48 semanas. Opiniones de los clínicos de que valor de RAR consideran relevante para concluir que el tratamiento B es mejor. Lugar Barcelona-1 Valencia Zaragoza Málaga Madrid S. Sebastian Sevilla Delta 6% 5% 5% 5% 10%

¿Cuánta diferencia es irrelevante? Estudios n Expósito J et al: Informe 2/2003, Agencia Evaluación Tecnologias Sanitarias Andalucía: “. . . mejora de la Mediana de Supervivencia (SM) de, al menos, 3 ó 4 meses a un mínimo del 20 % de los enfermos tratados. “


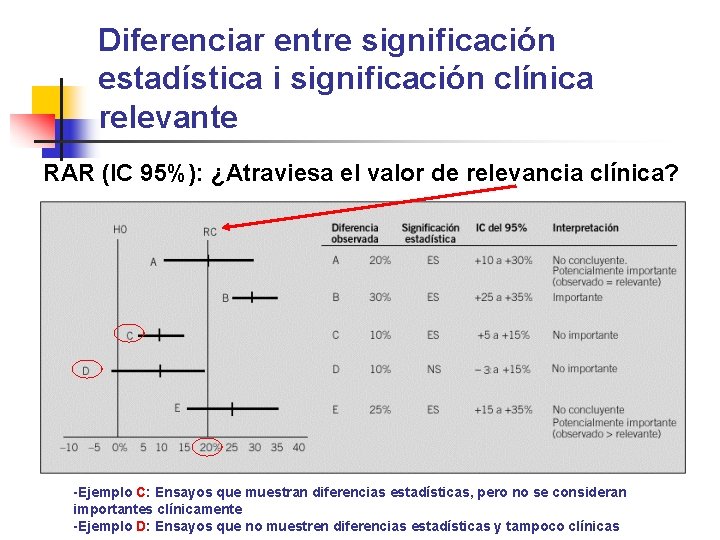
Diferenciar entre significación estadística i significación clínica relevante RAR (IC 95%): ¿Atraviesa el valor de relevancia clínica? - -Ejemplo C: Ensayos que muestran diferencias estadísticas, pero no se consideran importantes clínicamente -Ejemplo D: Ensayos que no muestren diferencias estadísticas y tampoco clínicas

Diferenciar entre significación estadística i significación clínica relevante: estudios de superioridad

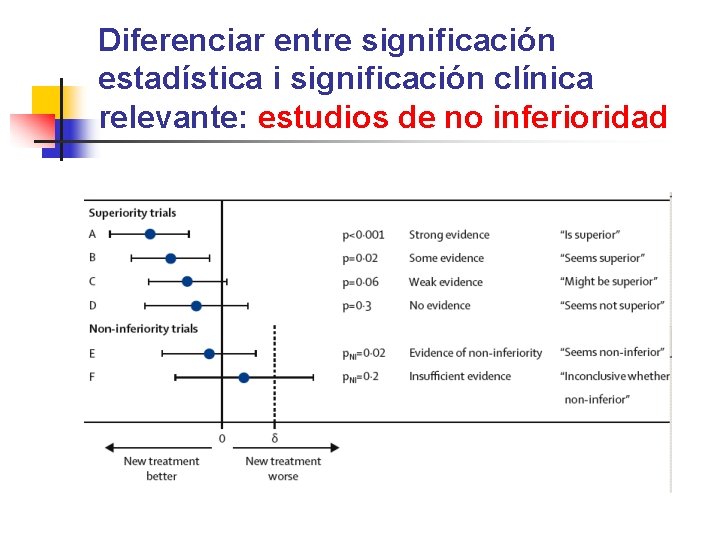
Diferenciar entre significación estadística i significación clínica relevante: estudios de no inferioridad

Valor delta • Este margen de irrelevancia clínica se denomina delta, y se puede definir como la máxima diferencia entre los tratamientos que vamos a considerar clínicamente irrelevante

n Practica 4 Interpretar un estudio de no inferioridad

TALLER teoría 4 Validez interna y externa Francesc Puigventós y Leonor Periáñez Servei de Farmàcia. Hospital Universitari Son Dureta. Palma de Mallorca VII CURSO Evaluación y selección de medicamenos Sevilla, 13 de Mayo de 2009

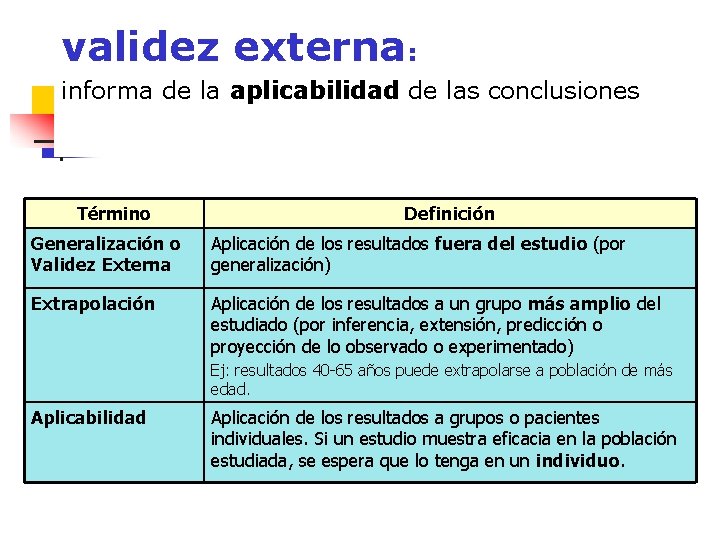
Validez de ensayo clínico n La validez interna se plantea si los resultados obtenidos proporcionan una respuesta correcta a la pregunta planteada en el objetivo del estudio, con ausencia de sesgos en los proceso de diseño, ejecución y análisis. n La validez externa de un estudio nos informa sobre la aplicabilidad de las conclusiones del mismo a otros pacientes distintos de los que participaron.

VALIDEZ INTERNA DE UN ENSAYO CLÍNICO Podemos decir que un ensayo clínico es válido si permite asegurar que el efecto observado es debido a la diferente intervención que han recibido el grupo intervención y el grupo control y no a otros factores que puedan haber conducido a una falsa conclusión n n A)ASPECTOS BÁSICOS Se consideran tres aspectos básicos para que un ensayo clínico tenga un buen nivel de validez interna: n n n 1 -Asignación aleatoria 2 -Seguimiento exhaustivo de todos los sujetos 3 -Análisis por intención de tratar.

1 -Asignación aleatoria n n La característica metodológica clave de un ensayo clínico es la asignación aleatoria de los sujetos a los grupos de estudio: grupo control y grupo intervención. Al intervenir sólamente el azar en la asignación, se tiende a asegurar que se produce una distribución equilibrada de todas las variables, tanto conocidas como desconocidas. n En estudios con un tamaño de muestra reducido, pueden emplearse las técnicas de asignación estratificada o por bloques que permiten aumentar la probabilidad de formar grupos equilibrados.

2 -Seguimiento exhaustivo de todos los sujetos n Se trata de responder a dos cuestiones: n n ¿se ha tenido en cuenta a todos los pacientes en los resultados ? , y ¿se ha realizado un seguimiento completo de los pacientes ? .

Seguimiento exhaustivo de todos los sujetos n n n De todas formas en la práctica siempre existe un número de pacientes que no pueden ser seguidos. Para poder evaluar este aspecto, es importante que en la publicación del ensayo clínico se proporcione información sobre los abandonos o pérdidas (dropouts) o pacientes que interrumpen el seguimiento y sobre las retiradas (withdrawals) o sujetos que deben abandonar por la aparición de reacciones adversas u otros sucesos que obligan a su exclusión. Si sus características son diferentes de la de los sujetos que finalizan el estudio, o si se han producido por motivos relacionados con las intervenciones del estudio, su exclusión del análisis podría invalidar las conclusiones.

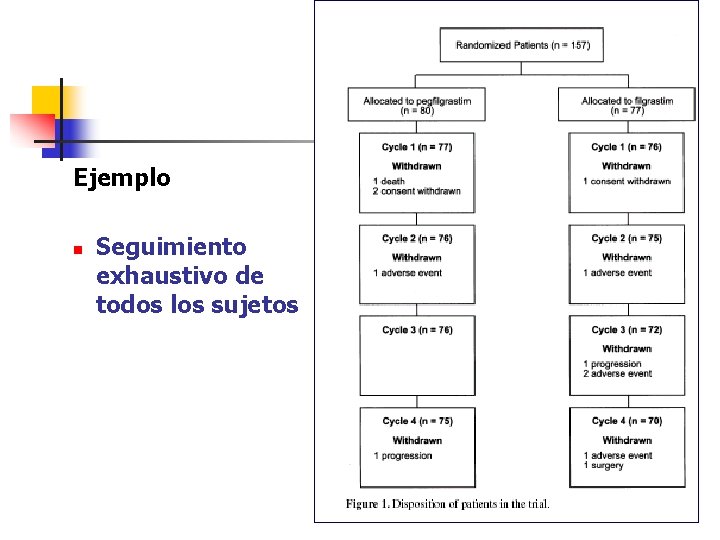
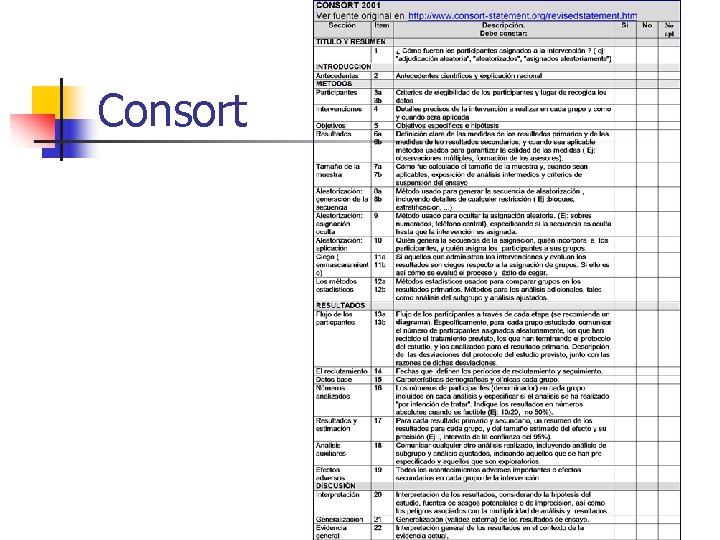
Seguimiento exhaustivo de todos los sujetos Actualmente las normas de publicación en revistas científicas siguen las recomendaciones del grupo CONSORT, y suelen presentar un diagrama de flujo donde constan las pérdidas de pacientes de cada fase del ensayo n n 1 -Reclutamiento, 2 -Asignación, 3 -Seguimiento, 4 -Análisis

Ejemplo n Seguimiento exhaustivo de todos los sujetos

3 -Análisis por intención de tratar. "Intention-to-treat analyses" (ITT). n n Según la definición más ampliamente aceptada es el análisis que incluye "a todos los pacientes en los grupos a los que fueron aleatoriamente asignados, independientemente de que cumplieran o no los criterios de inclusión, independientemente del tratamiento que realmente recibieran e independientemente de que abandonaran el tratamiento o se desviaran del protocolo". Algunos ensayos utilizan un concepto un poco más restrictivo, ejemplo: "Análisis que se realiza sobre los pacientes reclutados y aleatorizados que han recibido al menos una dosis del medicamento correcto segun aleatorización

-Análisis por intención de tratar modificado. "Modified Intention-to-treat analyses" (MITT): n Muchos ensayos definen en la metodología que se realiza MITT. n n n Por ejemplo el estudio (Herbrecht R et al N Eng J Med 2002; 347: 408 -15) se asigna tratamiento antifúngico ( Voriconazol o Anfotericina B) cuando hay sospecha de infección por hongos. El MITT se analizan los pacientes que cumplen los criterios del análisis "por intención de tratar" y además presentan diagnóstico confirmado definitivo o probable de infección fúngica realizado por un grupo independiente. Este tipo de análisis debe estar previsto y descrito en el método. Los análisis post-hoc tienen un valor muy limitado.

-Análisis "per protocol" (PP). n Estudian sólo los pacientes de ambos grupos que han seguido totalmente el protocolo. n n (Ejemplo, se tienen sólo en cuenta los pacientes sin violaciones del protocolo, que cumplen todos los criterios de inclusión y exclusión, que han recibido el tratamiento correspondiente, adecuada evaluación al final del tratamiento, cumplimiento del tratamiento correcto). En ocasiones se presentan análisis de tipo PP adaptados como por ejemplo los llamados "análisis de pacientes con criterios de evaluación" definidos en la sección de método del ensayo.

Análisis ITT y análisis PP en estudios de superioridad y en estudios de no inferioridad n En estudios de superioridad n n En general los resultados ITT serán más similares a los que podemos esperar cuando se aplica el fármaco en clínica que los análisis MITT y los PP. El ITT refleja lo que ocurre realmente en la práctica clínica, permite obtener del ensayo clínico información más próxima a la efectividad del tratamiento (efecto más cercano a las condiciones reales), en que se dan circunstancias como diagnóstico incorrecto, falta de adhesión al tratamiento, etc. Es importante desde nuestro punto de vista , en que nos interesa estimar la efectividad del fármaco cuando lo empleemos en nuestros pacientes. En estudios de no inferioridad n Ocurre lo contrario. Hay que hacer análisis PP, además de los ITT

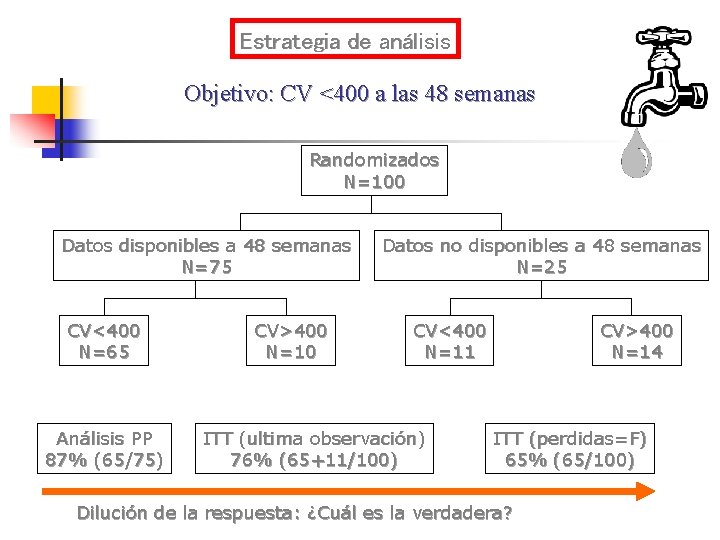
Estrategia de análisis Objetivo: CV <400 a las 48 semanas Randomizados N=100 Datos disponibles a 48 semanas N=75 CV<400 N=65 Análisis PP 87% (65/75) CV>400 N=10 Datos no disponibles a 48 semanas N=25 CV<400 N=11 ITT (ultima observación) 76% (65+11/100) CV>400 N=14 ITT (perdidas=F) 65% (65/100) Dilución de la respuesta: ¿Cuál es la verdadera?

Validez interna n Aspectos secundarios n n Enmascaramiento Comparibilidad inicial de los grupos Comparibilidad mantenida a lo largo del seguimiento Variables intermedias y variables finales

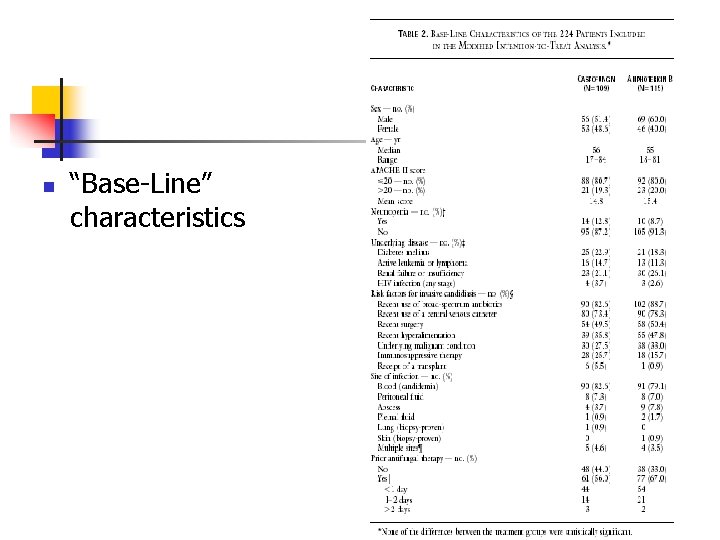
n “Base-Line” characteristics


Consort

Validez interna: prácticas Ensayo de superioridad Ensayo de equivalencia O de no inferioridad

validez externa: informa de la aplicabilidad de las conclusiones Término Definición Generalización o Validez Externa Aplicación de los resultados fuera del estudio (por generalización) Extrapolación Aplicación de los resultados a un grupo más amplio del estudiado (por inferencia, extensión, predicción o proyección de lo observado o experimentado) Ej: resultados 40 -65 años puede extrapolarse a población de más edad. Aplicabilidad Aplicación de los resultados a grupos o pacientes individuales. Si un estudio muestra eficacia en la población estudiada, se espera que lo tenga en un individuo.

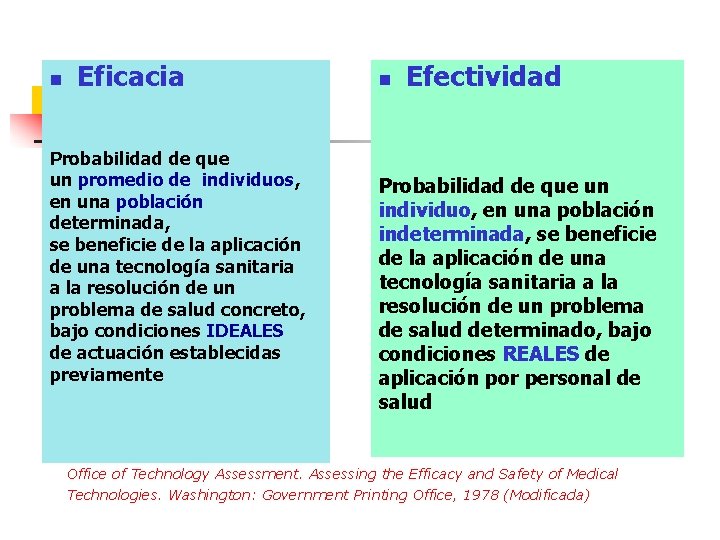
n Eficacia Probabilidad de que un promedio de individuos, en una población determinada, se beneficie de la aplicación de una tecnología sanitaria a la resolución de un problema de salud concreto, bajo condiciones IDEALES de actuación establecidas previamente n Efectividad Probabilidad de que un individuo, en una población indeterminada, se beneficie de la aplicación de una tecnología sanitaria a la resolución de un problema de salud determinado, bajo condiciones REALES de aplicación por personal de salud Office of Technology Assessment. Assessing the Efficacy and Safety of Medical Technologies. Washington: Government Printing Office, 1978 (Modificada)

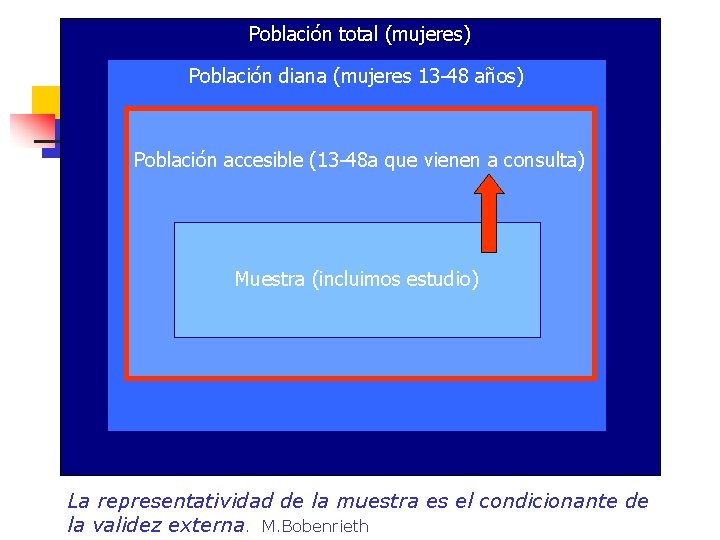
Población total (mujeres) Población diana (mujeres 13 -48 años) Población accesible (13 -48 a que vienen a consulta) Muestra (incluimos estudio) La representatividad de la muestra es el condicionante de la validez externa. M. Bobenrieth

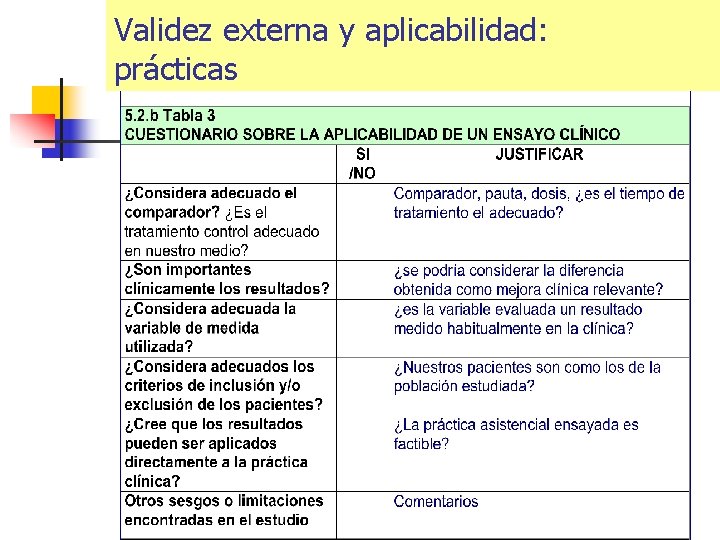
Validez externa: Principales problemas en la utilidad de los ensayos para la incorporación de fármacos a la práctica clínica. n n 1. Población estudiada: Características basales de los pacientes o indicaciones ensayadas que no coinciden con la los que se les va a aplicar 2. Comparador adecuado: elección del comparador no coincidente con el tratamiento estándar. Posología. Duración del tratamienti 3. Variables de resultado. Variables subrogadas, variables no estandarizadas, variables de interés marginal. 4. Aplicabilidad a un centro concreto. Disponibilidad de tecnologías para la aplicación del fármaco

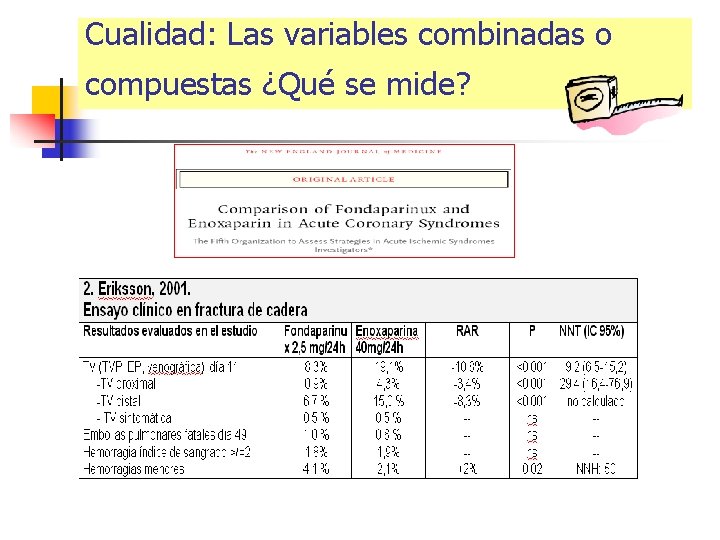
Variables ¿son importantes? Cualidad: ¿Qué se mide? Cantidad: ¿Cúal es la magnitud? Riesgo basal: ¿En que pacientes? n Variables subrogadas n n Subclínicas intermedias orientadas a la enfermedad (“disease-oriented”) n Variables clínicas finales orientadas al paciente (“patient-oriented”)

Cualidad: Las variables combinadas o compuestas ¿Qué se mide?

Validez externa y aplicabilidad: prácticas

n Practica 5 Evaluar validez interna y externa Ensayos Record 3 y Remodel

TALLER teoría 5 Ensayos de supervivenca HR Francesc Puigventós y Leonor Periáñez Servei de Farmàcia. Hospital Universitari Son Dureta. Palma de Mallorca VII CURSO Evaluación y selección de medicamenos Sevilla, 13 de Mayo de 2009

Time-to-Event Hazard Ratio

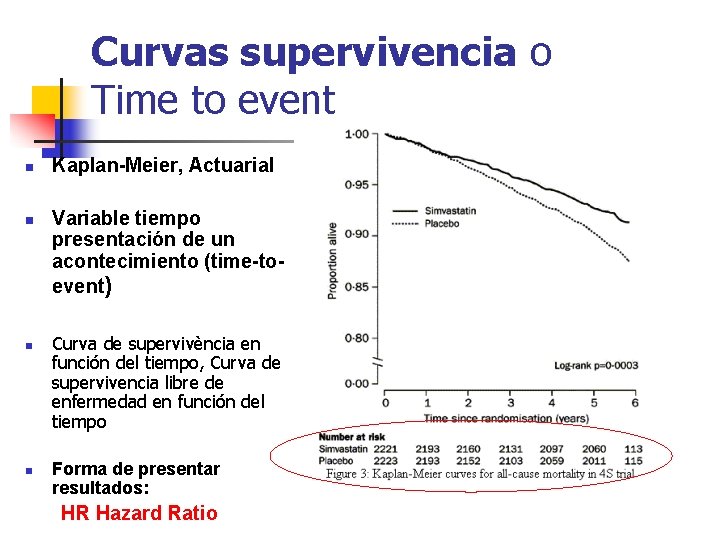
Curvas supervivencia o Time to event n n Kaplan-Meier, Actuarial Variable tiempo presentación de un acontecimiento (time-toevent) Curva de supervivència en función del tiempo, Curva de supervivencia libre de enfermedad en función del tiempo Forma de presentar resultados: HR Hazard Ratio

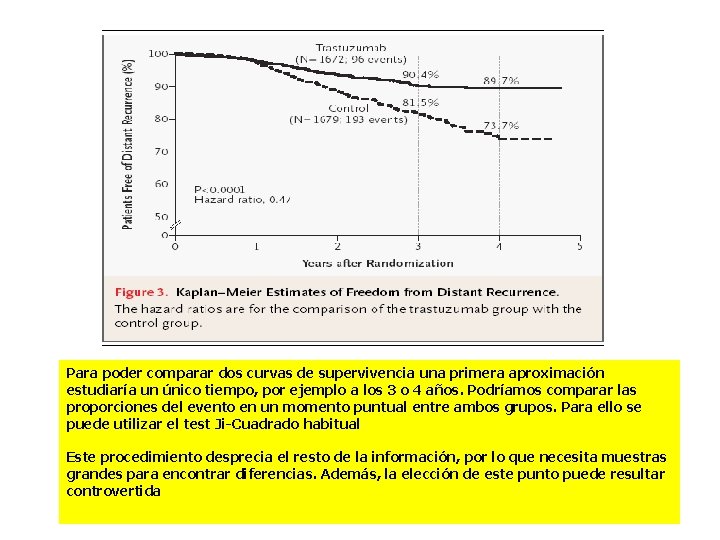
Para poder comparar dos curvas de supervivencia una primera aproximación estudiaría un único tiempo, por ejemplo a los 3 o 4 años. Podríamos comparar las proporciones del evento en un momento puntual entre ambos grupos. Para ello se puede utilizar el test Ji-Cuadrado habitual Este procedimiento desprecia el resto de la información, por lo que necesita muestras grandes para encontrar diferencias. Además, la elección de este punto puede resultar controvertida

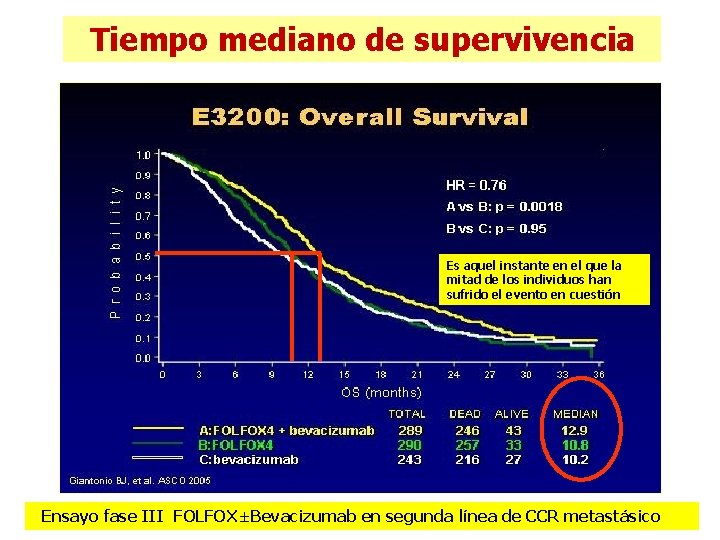
Tiempo mediano de supervivencia Es aquel instante en el que la mitad de los individuos han sufrido el evento en cuestión Ensayo fase III FOLFOX±Bevacizumab en segunda línea de CCR metastásico

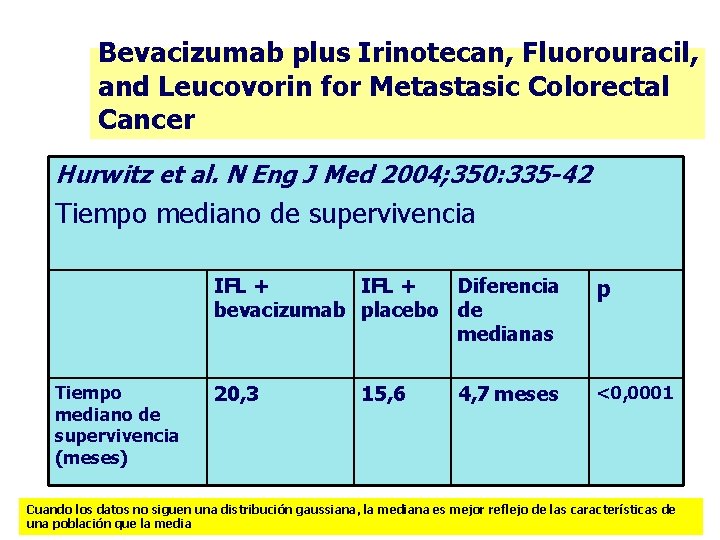
Bevacizumab plus Irinotecan, Fluorouracil, and Leucovorin for Metastasic Colorectal Cancer Hurwitz et al. N Eng J Med 2004; 350: 335 -42 Tiempo mediano de supervivencia (meses) IFL + Diferencia bevacizumab placebo de medianas p 20, 3 <0, 0001 15, 6 4, 7 meses Cuando los datos no siguen una distribución gaussiana, la mediana es mejor reflejo de las características de una población que la media

Interpretación del tiempo mediano de supervivencia n ¿Cuáles de las siguientes afirmaciones son falsas? n n 1) Bevacizumab + IFL incrementa la mediana de supervivencia 4, 7 meses vs IFL 2) Los pacientes asignados a Beva + IFL viven de media 4, 7 meses más 3) En el grupo con Bevacizumab se tardan 4, 7 meses más en que fallezcan la mitad de los pacientes 4) La NNT es 100/4, 7= 21, 2

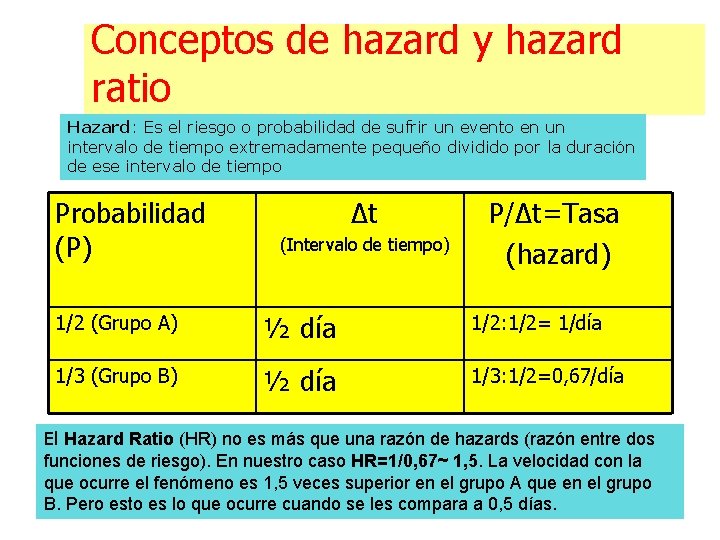
Conceptos de hazard y hazard ratio Hazard: Es el riesgo o probabilidad de sufrir un evento en un intervalo de tiempo extremadamente pequeño dividido por la duración de ese intervalo de tiempo Probabilidad (P) Δt (Intervalo de tiempo) P/Δt=Tasa (hazard) 1/2 (Grupo A) ½ día 1/2: 1/2= 1/día 1/3 (Grupo B) ½ día 1/3: 1/2=0, 67/día El Hazard Ratio (HR) no es más que una razón de hazards (razón entre dos funciones de riesgo). En nuestro caso HR=1/0, 67~ 1, 5. La velocidad con la que ocurre el fenómeno es 1, 5 veces superior en el grupo A que en el grupo B. Pero esto es lo que ocurre cuando se les compara a 0, 5 días.

Hazard ratio: concepto n Es una expresión de la diferencia entre dos curvas de supervivencia, representando la reducción del riesgo de muerte (o evento) del grupo tratamiento comparado con el grupo control, durante el tiempo de seguimiento n n Hazard Ratio = hazard de grupo A hazard de grupo B Expresa la relación de eventos entre los dos grupos comparados, no en un punto particular del estudio, sino como una medida final que sintetiza esta relación a través de los diferentes intervalos de seguimiento el estudio. Es una medida relativa expresiva de todo el tiempo de seguimiento Asume que la relación es constante en el tiempo (proporcional Hazards)

¿Equivale HR a RR? n n n Se interpreta como un riesgo relativo pero…. Un RR de 0, 5 en un año significa que el riesgo de que un paciente muera antes de acabar el año es la mitad con el tratamiento que con el control Un HR de 0, 5 implica que, en cualquier momento del año, el riesgo de morir de un paciente es la mitad con el tratamiento que con el control ¡PARECE LO MISMO PERO NO LO ES!

Interpretación del HR n n El Hazard Ratio (HR) se interpreta de forma similar al riesgo relativo (RR), con sus fortalezas y debilidades (es una comparación relativa del riesgo). El intervalo de confianza al 95% se considera significativo si no incluye al 1. Ej: HR= 0, 76 (IC 95%: 0, 63 -092). La p se considera significativa si es <0, 05 (5%): la probabilidad de que la diferencia sea por azar es menor del 5%.

Interpretación del HR n Tratamiento A vs tratamiento estandar B n HR = 0, 65 n n n 1 - 0, 65 = 0, 35 -> 35 % El tratamiento experimental A disminuye el riesgo relativo de muerte en un 35% con respecto al tratamiento estandar en cualquier momento del periodo de seguimiento. ¡No interpretar como que el tratamiento A disminuye la mortalidad un 35% en términos absolutos! ¡No interpretar como que el tratamiento A aumenta un 35% en términos absolutos la duración media de la supervivencia!

Entonces. . . ¿qué. . . es el “Hazard Ratio”? EL HAZARD RATIO ES EL HAZARD RATIO ¡¡y no le des más vueltas!! Ref: Emilio Alegre (Curso Genesis Abril 2008)

n Practica 6 Calcular mediana del tiempo de supervivencia Interpretar HR

 Tipos de ensayos clinicos
Tipos de ensayos clinicos Tipos de ensayos
Tipos de ensayos Tipos de ensayo
Tipos de ensayo Que es el ensayo
Que es el ensayo Tipos de ensayos
Tipos de ensayos Un ensayo argumentativo con sus partes
Un ensayo argumentativo con sus partes Que es la heteroevaluacion
Que es la heteroevaluacion Evaluacin
Evaluacin Definición de evaluación educativa
Definición de evaluación educativa Evaluacin
Evaluacin Evaluacin
Evaluacin Evaluacin
Evaluacin Evaluacin
Evaluacin Que es evaluacion financiera
Que es evaluacion financiera Paradigmas de interacción
Paradigmas de interacción Produtividade eficiência eficácia e efetividade
Produtividade eficiência eficácia e efetividade Potência e eficácia
Potência e eficácia Eficacia social
Eficacia social Eficacia
Eficacia Metodo de la baraja
Metodo de la baraja Eficacia
Eficacia Teoria cientifica de la administracion caracteristicas
Teoria cientifica de la administracion caracteristicas Eficacia do casamento
Eficacia do casamento Anticonceptivos florence engordan
Anticonceptivos florence engordan Eficacia
Eficacia Eficacia externa
Eficacia externa Ejemplos de ensayos con conectores
Ejemplos de ensayos con conectores Que es un ensayo y como se hace
Que es un ensayo y como se hace Formato mla ensayo ejemplo
Formato mla ensayo ejemplo Como hacer una introduccion
Como hacer una introduccion Ensayos fase iii clinicaltrials.gov
Ensayos fase iii clinicaltrials.gov Ensayos literarios
Ensayos literarios Ensayos temas
Ensayos temas Site:slidetodoc.com
Site:slidetodoc.com Ensayos destructivos definicion
Ensayos destructivos definicion Ideal portaliano
Ideal portaliano Un estudiante realiza diferentes ensayos
Un estudiante realiza diferentes ensayos Color 130579
Color 130579 Cual es el concepto de un ensayo
Cual es el concepto de un ensayo Abdicación de o'higgins
Abdicación de o'higgins Ensayos constitucionales de chile entre 1823 y 1830
Ensayos constitucionales de chile entre 1823 y 1830 Bibliografia de un ensayo apa
Bibliografia de un ensayo apa Caracteristicas del ensayo literario
Caracteristicas del ensayo literario Como citar a un autor en un ensayo
Como citar a un autor en un ensayo Haber o a ver
Haber o a ver An emu that measures 60 inches in height
An emu that measures 60 inches in height Taller de emprendedores aiep
Taller de emprendedores aiep Exciting superlative degree
Exciting superlative degree Taller explicativo
Taller explicativo Taller pistola e hijos
Taller pistola e hijos Taller 1
Taller 1 Taller
Taller Alabanza
Alabanza Proclamadores de la palabra
Proclamadores de la palabra Taller de multimedia
Taller de multimedia La gratitud es la memoria del corazón
La gratitud es la memoria del corazón Taller de esi para padres
Taller de esi para padres Mfc nacional capacitaciones
Mfc nacional capacitaciones Taller younger sister shorter older brother
Taller younger sister shorter older brother Taller de base de datos
Taller de base de datos Taller comunicacion
Taller comunicacion Taller
Taller Objetivos de la solidaridad
Objetivos de la solidaridad Anexos para taller
Anexos para taller Taller estilos de aprendizaje
Taller estilos de aprendizaje Rasgos de una persona
Rasgos de una persona Aiep contabilidad
Aiep contabilidad Taller
Taller Ser unico e irrepetible
Ser unico e irrepetible La ilada
La ilada Taller sobre el clima
Taller sobre el clima Competencia en el taller history
Competencia en el taller history Taller sobre aplicaciones en la administración
Taller sobre aplicaciones en la administración Estructura de un taller educativo
Estructura de un taller educativo Taller 1
Taller 1 Taller uhpc
Taller uhpc Taller
Taller Expectativas del taller
Expectativas del taller Taller de textos: leer, escribir y comentar en el aula
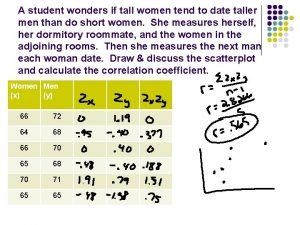
Taller de textos: leer, escribir y comentar en el aula A student wonders if tall women tend to date taller men
A student wonders if tall women tend to date taller men Taller de literatura 3 medio
Taller de literatura 3 medio Ejercicios entidad relacion resueltos
Ejercicios entidad relacion resueltos Que es una relacion interpersonal
Que es una relacion interpersonal Taller
Taller Taller de reclutamiento y selección de personal
Taller de reclutamiento y selección de personal Algoritmo logico
Algoritmo logico Definicion de narracion
Definicion de narracion Taller de contabilidad financiera
Taller de contabilidad financiera Taller de administración del tiempo
Taller de administración del tiempo Imagenes taller de lectura y redaccion
Imagenes taller de lectura y redaccion Taller de logica proposicional
Taller de logica proposicional Taller vocacional
Taller vocacional Taller manejo de emociones para padres
Taller manejo de emociones para padres Taller de tilde diacrítica
Taller de tilde diacrítica Ejercicios para colocar la coma
Ejercicios para colocar la coma Fantastic comparative and superlative adjectives
Fantastic comparative and superlative adjectives Texto recreativo para niños
Texto recreativo para niños Taller matematicas
Taller matematicas Ejercicios de sufijo
Ejercicios de sufijo Arbol de habitos taller intensivo
Arbol de habitos taller intensivo Taller marco para la buena enseñanza
Taller marco para la buena enseñanza Taller de uso responsable de las redes sociales
Taller de uso responsable de las redes sociales Younger shorter older old
Younger shorter older old Are you taller lying down or standing
Are you taller lying down or standing Radios matra
Radios matra Estudios para evangelizar
Estudios para evangelizar Foda sunat
Foda sunat Taller uso seguro del internet
Taller uso seguro del internet Enfoque de contingencia
Enfoque de contingencia Moldeamiento
Moldeamiento Taller de lectura y redaccion
Taller de lectura y redaccion Taller de bases de datos
Taller de bases de datos Taller de liderazgo cristiano
Taller de liderazgo cristiano Talleres para padres con hijos discapacitados
Talleres para padres con hijos discapacitados Taller de editores
Taller de editores Seminario taller de competencias
Seminario taller de competencias Comparative taller
Comparative taller Que es neologismo en taller de lectura y redaccion
Que es neologismo en taller de lectura y redaccion