Regulacin de Ensayos Clnicos en Chile Seccin Ensayos























- Slides: 31

Regulación de Ensayos Clínicos en Chile Sección Ensayos Clínicos Agencia Nacional de Medicamentos Instituto de Salud Pública de Chile 11/mayo/2012

Marco legal y normativa • Constitución Política del Estado 1980 • Código Sanitario (art. 102). • D. S. N° 3/2010 (art 20 -21 letra c y 23). • Norma Técnica N° 57/2001. • Ley 20. 120/2006 (Reglamento).

Marco legal y normativa • Reglamento para la realización de Estudios Clínicos con Productos Farmacéuticos. /2011 (ANAMED del ISP). • Circular N° 4 del ISP (requisitos para solicitud). • Resolución N° 441 del ISP (notificación de eventos adversos).

Requisitos para solicitar importación y uso de medicamentos en investigación (Circular N° 4 /2009 Anamed/ISP) 1 Carta aprobación del Comité de Ética para cada Centro presentado. 2 Carta derivación del Director del Servicio al Comité (si corresponde). 3 Formulario de Consentimiento informado y asentimiento, cada hoja fechada, firmada y timbrada por el Comité de Ética.

Requisitos para solicitar importación y uso de medicamentos en investigación (Circular N° 4 /2009 Anamed/ISP) 4 5 6 en idioma Inglés y Protocolo en 4. Protocolo idioma Inglés y Castellano. 5. Manual del Investigador en idioma Inglés y Castellano 6. GMP vigente del Fabricante y GMP vigente del Fabricante. 7 Proceso de Manufactura (producto biológico). 8 Copia de la carta al PNI (En caso de vacunas).

Requisitos para solicitar importación y uso de medicamentos en investigación (Circular N° 4 /2009 Anamed/ISP) 9 Delegación de funciones del Patrocinador, si corresponde. 10 Declaración simple del solicitante indicando que toda la información entregada corresponde a la realidad. 11 Proyecto de Rotulado.

Modificación de autorización • Ampliación Cantidad de producto a importar. • Cambio o ampliación de bodega de almacenamiento. • Enmienda que afecta al medicamento de investigación.

Modificación de autorización • Cambio de titular. • Cambio o ampliación de procedencia. • Incorporación de un nuevo ítem en productos a importar.

Notificaciones al ISP • Enmienda que no afecta al Medicamento en investigación. • Incorporación de un Nuevo centro de Investigación. • Cambio de Investigador. • Actualización del Manual del Investigador. • Actualización del Formulario de Consentimiento Informado.

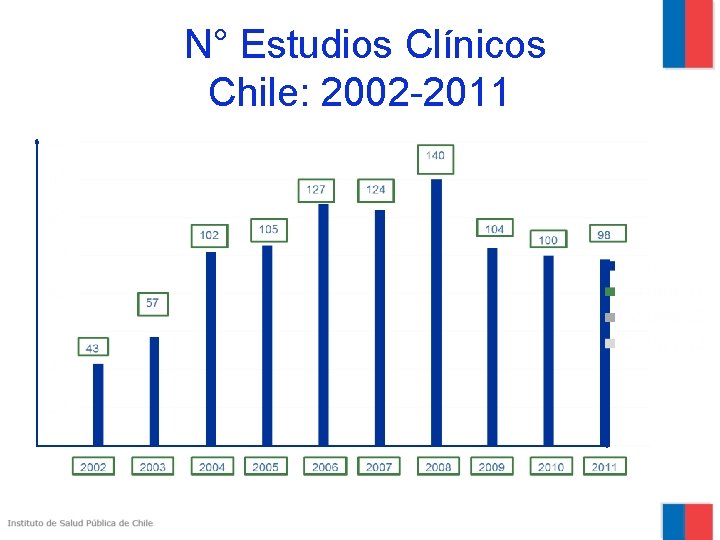
N° Estudios Clínicos Chile: 2002 -2011

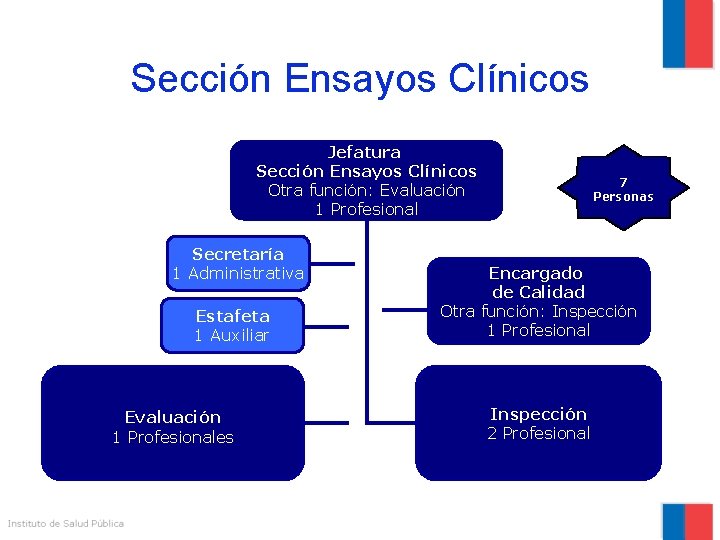
Sección Ensayos Clínicos Jefatura Sección Ensayos Clínicos Otra función: Evaluación 1 Profesional Secretaría 1 Administrativa Estafeta 1 Auxiliar Evaluación 1 Profesionales 7 Personas Encargado de Calidad Otra función: Inspección 1 Profesional Inspección 2 Profesional

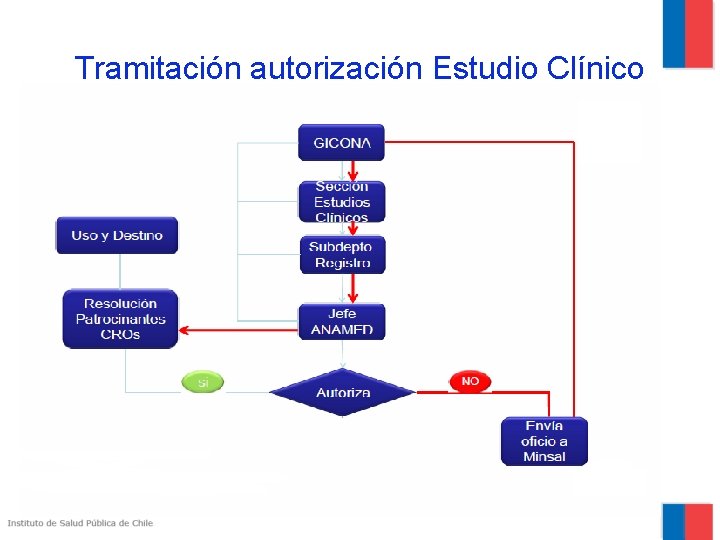
Tramitación autorización Estudio Clínico

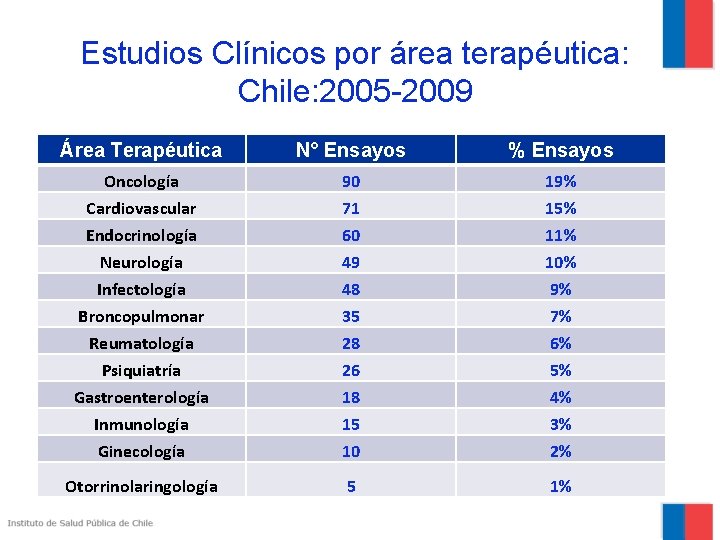
Estudios Clínicos por área terapéutica: Chile: 2005 -2009 Área Terapéutica N° Ensayos % Ensayos Oncología Cardiovascular Endocrinología Neurología Infectología Broncopulmonar 90 71 60 49 48 35 19% 15% 11% 10% 9% 7% Reumatología Psiquiatría Gastroenterología Inmunología Ginecología 28 26 18 15 10 6% 5% 4% 3% 2% Otorrinolaringología 5 1%

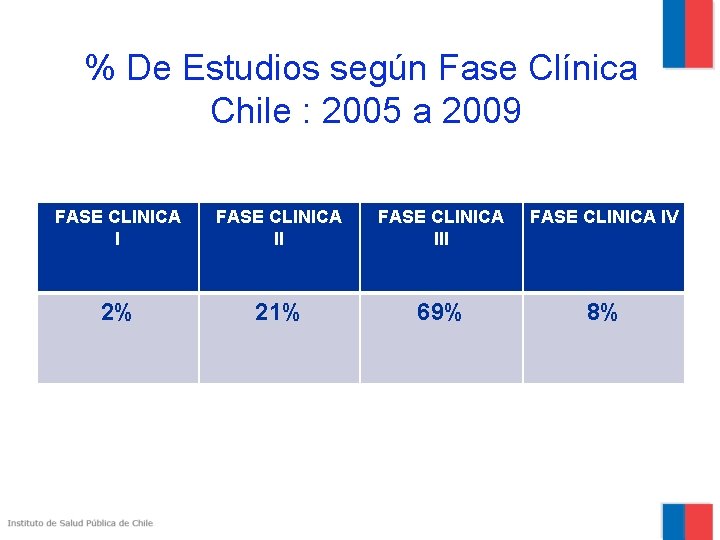
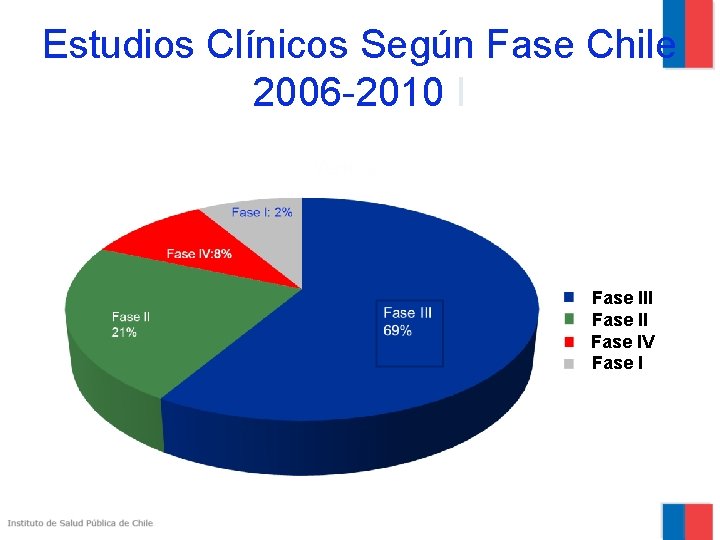
% De Estudios según Fase Clínica Chile : 2005 a 2009 FASE CLINICA III FASE CLINICA IV 2% 21% 69% 8%

Estudios Clínicos Según Fase Chile 2006 -2010 I Fase II Fase IV Fase I

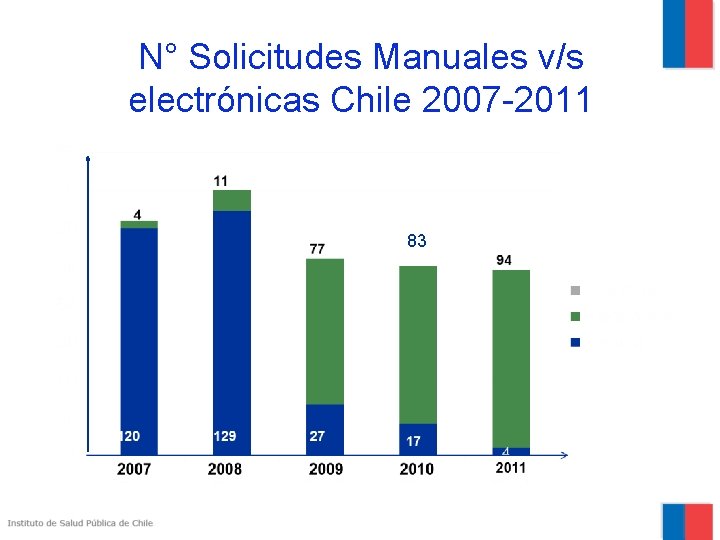
N° Solicitudes Manuales v/s electrónicas Chile 2007 -2011 83

Inspección (según ICH GCP E 6) La acción de la Autoridad Regulatoria de realizar una revisión oficial de: 1 Documentos 2 Instalaciones 3 Registros

Inspección (según ICH GCP E 6) 4 Cualquier otro recurso que la autoridad considere esté relacionado con el estudio clínico y que pueda estar localizado en el sitio donde se realiza el estudio, en las instalaciones del patrocinador y/o de la Organización de Investigación por Contrato (CRO) o en otros sitios que la Autoridad Regulatoria considere apropiado.

Objetivo de la Inspección • Determinar el cumplimiento de las acciones comprometidas por resolución emanada del Instituto de Salud Pública de Chile, para el uso provisional sin registro sanitario del producto farmacéutico de investigación utilizado en el estudio clínico. • Determinar la adherencia a las Buenas Prácticas Clínicas en la conducción del ensayo clínico autorizado.

Bases Legales Circular Nº 4 ISP – “Aclara y actualiza los requisitos y condiciones de autorizaciones de uso de productos farmacéuticos sin registro sanitario para fines de investigación científica y sus modificaciones” , (2009). Punto 2. 2. 4: “La autorización de(los) producto(s) señalado(s) en la resolución podrá(n) ser verificadas por funcionarios de esta Institución, en cualquier momento, desde el inicio del ensayo, entendiéndose facultados para requerir cualquier antecedente adicional, relativo al(los) producto(s) farmacéutico(s)”.

Bases Legales Resolución Exenta ISP N° 334/2011 – “Crea el Departamento Agencia Nacional de Medicamentos, determina su estructura interna y delega facultades y establece orden de subrogación que indica”. Artículo Seis, punto 3 (Funciones Sección Estudios Clínicos): “Efectuar un seguimiento, de las actividades de los centros y laboratorios que realizan dichos estudios en seres humanos. ”

Inspección - Estadísticas 123 centros de investigación inspeccionados, desde el año 2008 a Diciembre del 2011.

Inspección - Estadísticas Año % de Estudios a Inspeccionar 2008 2009 2010 Estudios inspeccionados de carácter ordinario Estudios Inspeccionados de carácter extraordinario Centros Inspeccionados 13% (de 124 estudios autorizados el año 2007) 16 2 38 20% (de 140 estudios autorizados el año 2008) 28 4 42 21% (de 101 estudios autorizados el año 2009) 21 0 21

Inspección - Estadísticas Año % de Estudios a Inspeccionar 2011 22% (de 98 estudios autorizados el año 2010) Estudios inspeccionados de carácter ordinario Estudios Inspeccionados de carácter extraordinario Centros Inspeccionados 22 0 22

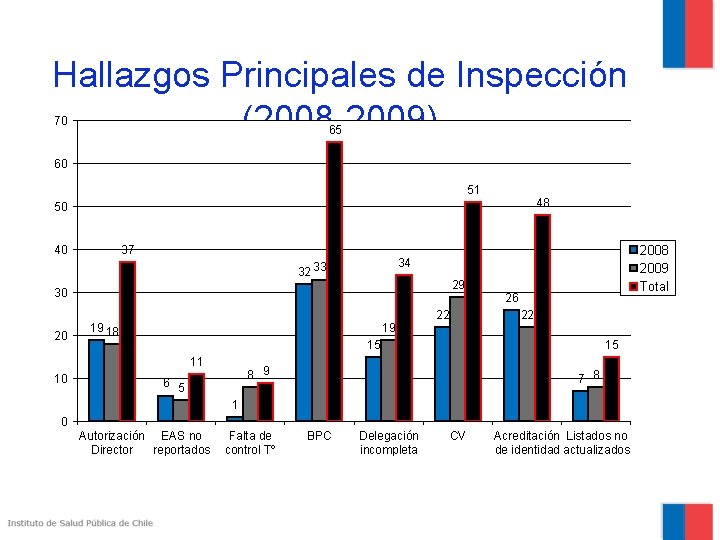
Hallazgos Principales de Inspección (2008 -2009) 70 65 60 51 48 50 40 37 32 33 29 30 20 19 18 19 22 26 22 15 11 10 2008 2009 Total 34 15 8 9 6 5 7 8 1 0 Autorización EAS no Director reportados Falta de control Tº BPC Delegación incompleta CV Acreditación Listados no de identidad actualizados

Documentos a revisar: Algunos de los documentos que se solicitan en cada centro a inspeccionar son: • Protocolo. • Manual del Investigador (I. Brochure). • Formulario de Consentimiento Informado. • Aprobaciones de Comité de Ética. • Autorización de Director del centro.

Documentos a revisar: • Registro de control de temperatura y contabilidad de producto en investigación. • Visitas de monitoreo y seguimiento. • Certificación de Laboratorio Clínico empleado en el estudio. • Reporte de Eventos Adversos Serios. • Listado de sujetos enrolados. • Ficha clínica de sujeto enrolado.

Principales hallazgos en Inspección de Centros 1 No presentan carta de autorización del Director del centro. (Ley 20. 120, art. 10) 2 EAS no son reportados o son notificados fuera de plazo por el investigador al Comité de Ética. 3 Falta de registro de control almacenamiento en el centro. de temperatura de 4 No hay acreditación de entrenamiento formal en BPC del investigador y su equipo.

Principales hallazgos en Inspección de Centros 5 Formulario de Delegación de Funciones incompleto, no actualizado y/o funciones mal asignadas. 6 CV de investigadores y equipo sin firma ni fecha, no actualizados, sin copias de certificado de título, especialidad. 7 En las fichas clínicas no existe documento que acredite la identidad y edad de los sujetos. 8 Ausencia o no actualización de listado de selección, aleatorización e identificación de sujetos.

Gracias

 Ensayos constitucionales de chile entre 1823 y 1830
Ensayos constitucionales de chile entre 1823 y 1830 Seccin 4
Seccin 4 Seccin 4
Seccin 4 Ligamento periodontal
Ligamento periodontal Seccin 4
Seccin 4 Seccin 4
Seccin 4 Seccin 4
Seccin 4 Seccin 1
Seccin 1 Seccin
Seccin Seccin 1
Seccin 1 Seccin 1
Seccin 1 Seccin
Seccin Atributos tangibles e intangibles de un producto
Atributos tangibles e intangibles de un producto Ensayos temas
Ensayos temas Tesis del ensayo
Tesis del ensayo Ensayos fase iii clinicaltrials.gov
Ensayos fase iii clinicaltrials.gov Ensayos de redes sociales
Ensayos de redes sociales Características de ensayo
Características de ensayo Ejemplos de ensayos con conectores
Ejemplos de ensayos con conectores Elementos del ensayo argumentativo
Elementos del ensayo argumentativo Es un tipo de ensayo
Es un tipo de ensayo Ejemplo de introduccion
Ejemplo de introduccion Tipos de ensayos clinicos
Tipos de ensayos clinicos Bibliografia de un ensayo apa
Bibliografia de un ensayo apa El ensayo concepto
El ensayo concepto Tipos de ensayos
Tipos de ensayos Apa ensayos
Apa ensayos Un estudiante realiza diferentes ensayos
Un estudiante realiza diferentes ensayos Ensayos destructivos definicion
Ensayos destructivos definicion Ensayos constitucionales
Ensayos constitucionales Como se hace un ensayo
Como se hace un ensayo Elementos de un ensayo
Elementos de un ensayo