TALLER 3 QUIMICA 1 Un estudiante propone la


















- Slides: 21

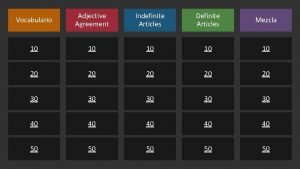
TALLER 3 QUIMICA

1. Un estudiante propone la siguiente ecuación para la combustión del metano (CH 4): CH 4 + O 2 CO 2 + H 2 O Reactivos Productos El estudiante no está seguro de si la ecuación está balanceada, por lo que le pide a su profesor explicarle una de las razones por la cual la ecuación está o no balanceada. ¿Qué debería responderle el profesor? A. B. C. D. No está balanceada, porque en los reactivos no había agua reactivos como en los productos reactivos y 2 átomos de hidrógeno en los productos producen 1 mol de H 2 O y de CO 2

2. El gas natural metano (CH 4) es un combustible ampliamente utilizado que entra en combustión de acuerdo con la siguiente reacción: CH 4 + 2 O 2 CO 2 + 2 H 2 O Si en un experimento se quieren obtener exactamente 4 moles de agua (H 2 O), es correcto afirmar que se debe partir de A. B. C. D. 1 mol de CH 4 y suficiente cantidad de O 2 4 moles de CH 4 y suficiente cantidad de O 2 ½ mol de CH 4 y suficiente cantidad de O 2 2 moles de CH 4 y suficiente cantidad de O 2

3. Un átomo Q neutro tiene 13 electrones, 13 protones y 13 neutrones. Este átomo neutro tiene una de las siguientes configuraciones electrónicas y su ión, la otra: Configuración I: 1 s 2 2 p 6 3 s 2 3 p 1 Configuración II: 1 s 2 2 p 6 Teniendo en cuenta que un ión se forma cuando se carga eléctricamente de forma positiva o negativa, ¿cuál de las anteriores configuraciones electrónicas corresponden a un ión positivo del átomo Q? A. configuración La porque configuración esta I, electrones tiene 3 más que el átomo Q neutro B, La configuración II, porque esta configuración tiene 3 electrones menos que el átomo Q neutro C. La configuración porque configuración esta II, protón menos tiene 1 que el átomo Q neutro D. La configuración I, porque esta configuración tiene 1 protón más que el átomo Q neutro

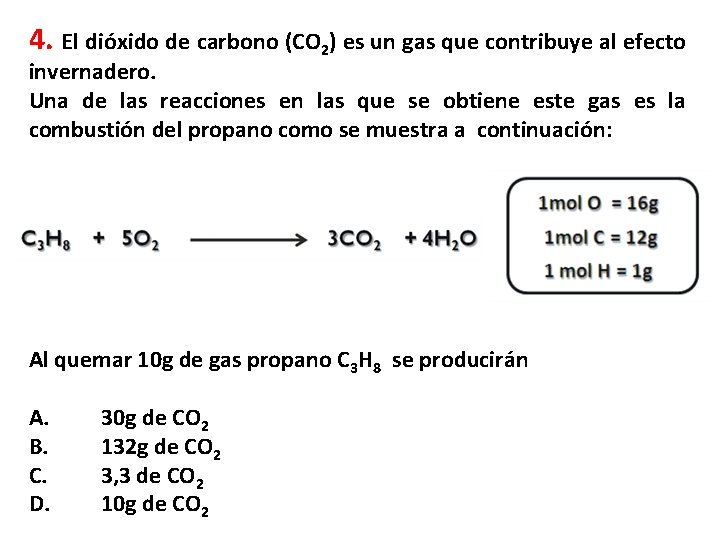
4. El dióxido de carbono (CO 2) es un gas que contribuye al efecto invernadero. Una de las reacciones en las que se obtiene este gas es la combustión del propano como se muestra a continuación: Al quemar 10 g de gas propano C 3 H 8 se producirán A. B. C. D. 30 g de CO 2 132 g de CO 2 3, 3 de CO 2 10 g de CO 2

5. En una reacción química la cantidad de sustancia producida depende, entre otros factores, del reactivo límite. El reactivo límite es aquel que se encuentra en menor proporción estequiometrica y su cantidad es insuficiente para reaccionar con la totalidad de otro reactivo. De acuerdo con la ecuación química , si el jugo gástrico de un adulto contiene 0, 2 moles de Hcl en un momento determinado, e ingiere 0, 15 moles de Mg(OH) 2 para neutralizar la acidez, el reactivo límite de la reacción es A. B. C. D. HCl Mg(OH)2 Mg. Cl 2 H 2 O

5. En una planta de producción de amoníaco (NH 3) quieren realizar el proceso a gran escala. La reacción de síntesis que utilizan es: N 2+ 3 H 2 2 NH 3 Teniendo en cuenta la información anterior, si se dispone de 5 moles de N 2 y 9 moles de H 2 para la reacción, puede afirmarse que A. B. C. D. el N 2 limita la reacción y quedan 7 moles de H 2 en exceso el N 2 limita la reacción y quedan 2 moles de H 2 en exceso el H 2 limita la reacción y quedan 2 moles de N 2 en exceso el H 2 limita la reacción y quedan 7 moles de N 2 en exceso

Información para las preguntas 7 y 8 Lluvia en Medellín Este problema ambiental característico de las ciudades industriales se produce cuando la humedad del aire se combina con los óxidos de nitrógeno y el dióxido de azufre emitidos por las fábricas, centrales eléctricas y vehículos queman hidrocarburos fósiles. Algunas de estas reacciones son las siguientes. 1. SO 2 + O 2 → 2 SO 3 2. SO 3 + H 2 O → H 2 SO 4 3. N 2 + O 2 → 2 NO 2 4. 2 NO + O 2 → 2 NO 2 5. 3 NO 2 + H 2 O → 2 HNO 3 + NO

7. De acuerdo con la quinta ecuación química, en la formación de la lluvia ácida ocurre una reacción de A. agua para producir HNO 3 y NO B. oxidación reducción, – porque número el de oxidación del oxígeno cambia al reaccionar amiento, e C. desplaza al hidrógeno para formar el ácido D. descomposición, porque el HNO 3 se descompone en NO 2 y H 2 O

8. Los estados de oxidación comunes del nitrogeno son + 3, + 4, + 5. De acuerdo con la tercera ecuación es correcto afirmar que el nitrógeno A. B. C. D. se oxida y se reduce, porque su estado de oxidación aumenta y disminuye aumenta su número de oxidación disminuye su número de oxidación reaccionar

9. De acuerdo con la ecuación química, El valor 22, 08 kcal al final de la ecuación química corresponde acuerdo con la ecuación química cantidad A. la reactivos obtención de la sobra que en del amoniaco B. la masa de un producto en exceso que permite balancear la ecuación C. reacción espontánea D. la reacción es exotérmica

10. Los minerales de hierro que por lo general son óxidos, se convierten al metal puro por reacción en altos hornos con carbón (coque). El carbón reacciona primero con el aire para formar monóxido de carbono que a su vez reacciona con los óxidos de hierro como sigue: El cambio de coloración cuando sucede la reacción se debe a que A. B. C. D. el hierro se reduce de +3 a 0 el hierro se oxida de +3 a 0 el carbono se oxida de +4 a +2 el oxígeno oxida al hierro

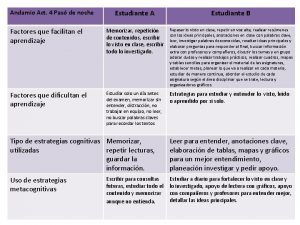
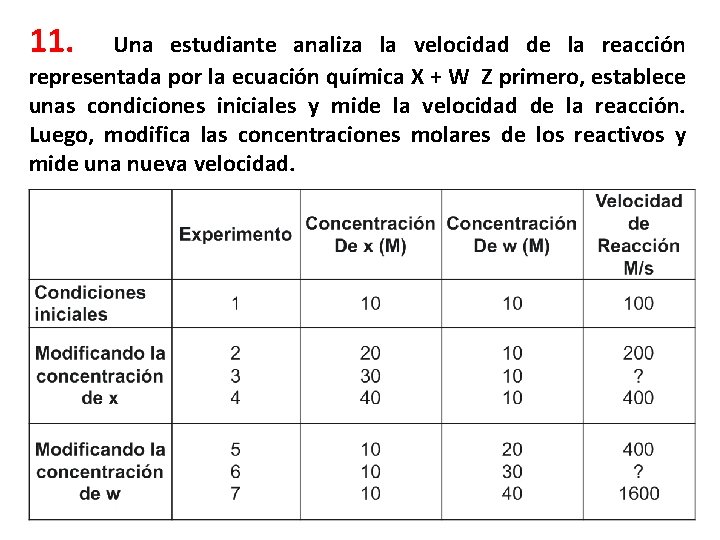
11. Una estudiante analiza la velocidad de la reacción representada por la ecuación química X + W Z primero, establece unas condiciones iniciales y mide la velocidad de la reacción. Luego, modifica las concentraciones molares de los reactivos y mide una nueva velocidad.

Teniendo en cuenta la información anterior y las tendencias observadas, al comparar los experimentos 3 y 6, ¿en cuál de los dos se obtendrá una mayor velocidad de reacción? A. En el experimento 3, porque un cambio en la concentración de x produce un mayor cambio B. En el experimento 6, porque un cambio en la concentración de w produce un mayor cambio C. En el experimento 6, porque la velocidad de reacción concentración de w. D. En el experimento 3, porque la velocidad de reacción aumenta si la concentración de x aumenta

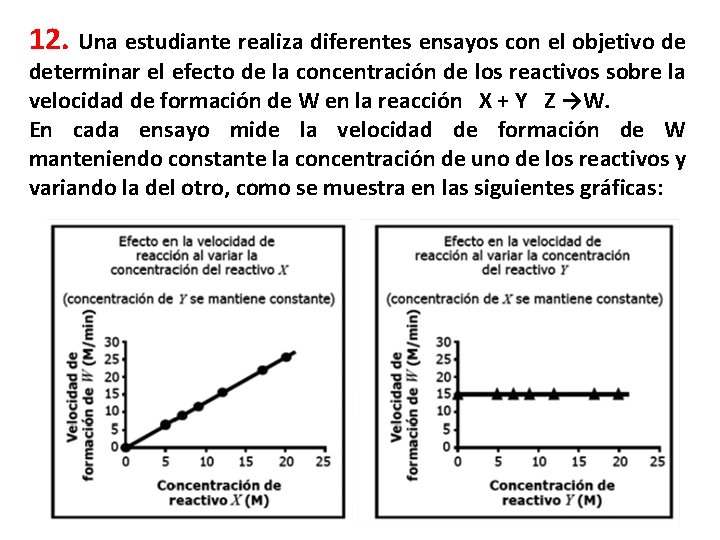
12. Una estudiante realiza diferentes ensayos con el objetivo de determinar el efecto de la concentración de los reactivos sobre la velocidad de formación de W en la reacción X + Y Z →W. En cada ensayo mide la velocidad de formación de W manteniendo constante la concentración de uno de los reactivos y variando la del otro, como se muestra en las siguientes gráficas:

Con base en estos resultados se puede concluir que el cambio en la velocidad de formación de W A. no depende de la concentración de los reactivos B. depende de la concentración de ambos reactivos depende C. concentración solamente la de de X depende D. concentración solamente la de de Y

13. Cuando se tiene una reacción química y se realizan ciertos cambios en las condiciones del sistema, la reacción se desplaza hacia la izquierda o hacia la derecha con el objetivo de volver al equilibrio. A continuación se presentan los efectos de cambios de temperatura sobre el equilibrio de reacción:

Usando la tabla anterior y teniendo en cuenta que el sistema siempre busca el equilibrio, ¿hacia dónde se desplaza la reacción de M + N ↔ Z + W si se aumenta la temperatura del sistema? a librio El A. a librio El B. C. producción de M y N, porque en este sentido se absorbe calor producción de Z y W, porque en este sentido se libera calor producción de M y N, porque en este sentido se libera calor D. producción de Z y W, porque en este sentido se absorbe el calor


14. Como se indica en el esquema, la sustancia U se obtiene a partir de una serie de reacciones, en las que inicialmente se tiene como reactivos los elementos P y Q. Es muy probable que la sustancia U sea A. B. C. D. un hidróxido básico una sal un ácido

15. Si la sustancia P reacciona con el oxígeno, es muy probable que A. D. C. D. se obtenga un hidróxido se forme un óxido ácido no se forme ningún compuesto se obtenga un óxido básico
 Index per l inclusione
Index per l inclusione Reflexiones para estudiantes
Reflexiones para estudiantes Objetivo del estudiante
Objetivo del estudiante De secundaria
De secundaria Diagrama de clase
Diagrama de clase Oracion de fortaleza
Oracion de fortaleza Estudiante.ie cristobal toro
Estudiante.ie cristobal toro Foda software
Foda software Como ser un estudiante exitoso
Como ser un estudiante exitoso Xxx coso
Xxx coso Blank eres estudiante
Blank eres estudiante áreas de mejora de un estudiante
áreas de mejora de un estudiante El estudiante francisco oller
El estudiante francisco oller De secundaria
De secundaria A esteban le gusta tocar la guitarra translation
A esteban le gusta tocar la guitarra translation Debilidades de un adolescente
Debilidades de un adolescente Debilidades de estudiantes
Debilidades de estudiantes Bienvenidos estimados estudiantes
Bienvenidos estimados estudiantes Un estudiante realiza diferentes ensayos
Un estudiante realiza diferentes ensayos Diario de emociones y autocuidado para el estudiante
Diario de emociones y autocuidado para el estudiante Plan de inversión ejemplo
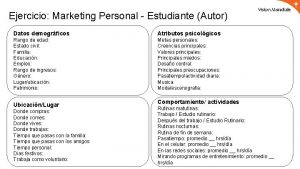
Plan de inversión ejemplo Atributos de un estudiante
Atributos de un estudiante