SORAFENIB Y FRMACOS ANTIANGIOGNICOS bevacizumab aflibercept y otros

SORAFENIB Y FÁRMACOS ANTIANGIOGÉNICOS (bevacizumab, aflibercept y otros) EN CÁNCER RENAL AVANZADO. Begoña Pérez-Valderrama Sº Oncología Médica HH. UU. Virgen del Rocío (Sevilla)

Yuuujuuuuu…. . ¿Quién va a salir conmigo esta noche?

Esquema presentación • SORAFENIB • BEVACIZUMAB • AFLIBERCEPT • OTROS FÁRMACOS ANTIANGIOGÉNICOS. Y ESTO EN 20 MINS…

Esquema presentación • SORAFENIB • BEVACIZUMAB • AFLIBERCEPT • OTROS FÁRMACOS ANTIANGIOGÉNICOS.
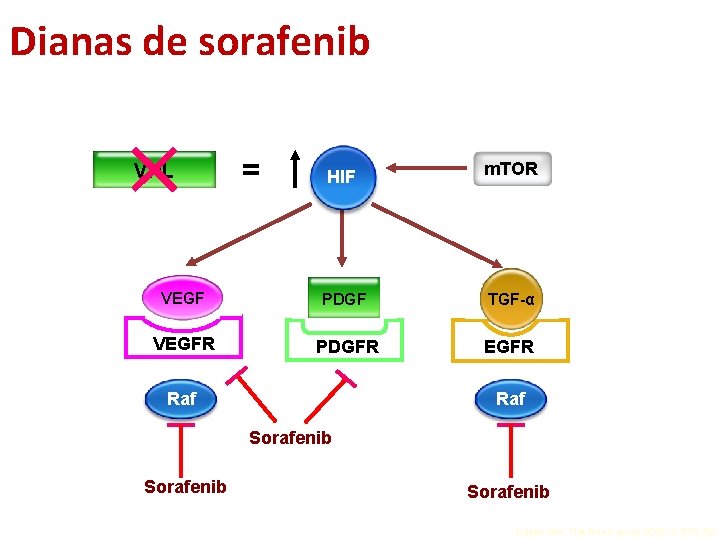
Dianas de sorafenib VHL VEGFRR = HIF m. TOR PDGF TGF-α PDGFR EGFR Raf Sorafenib Kaelin WG. Nat Rev Cancer 2002; 2: 673– 82.
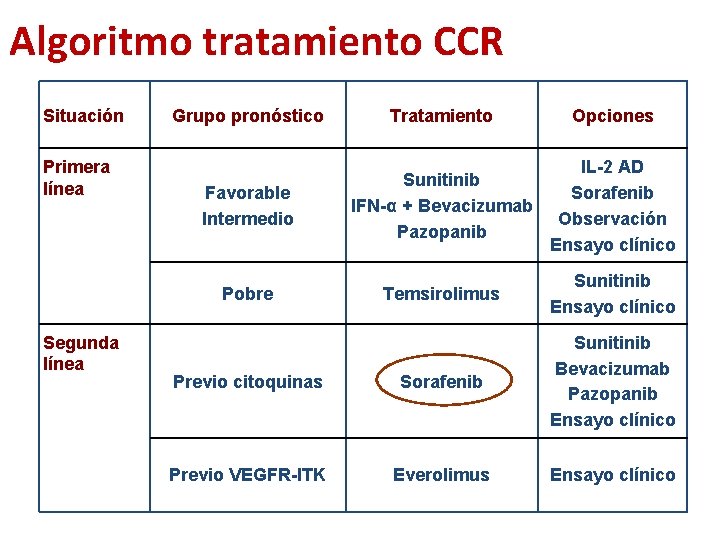
Algoritmo tratamiento CCR Situación Primera línea Segunda línea Grupo pronóstico Tratamiento Opciones Favorable Intermedio Sunitinib IFN-α + Bevacizumab Pazopanib IL-2 AD Sorafenib Observación Ensayo clínico Pobre Temsirolimus Sunitinib Ensayo clínico Previo citoquinas Sorafenib Sunitinib Bevacizumab Pazopanib Ensayo clínico Previo VEGFR-ITK Everolimus Ensayo clínico
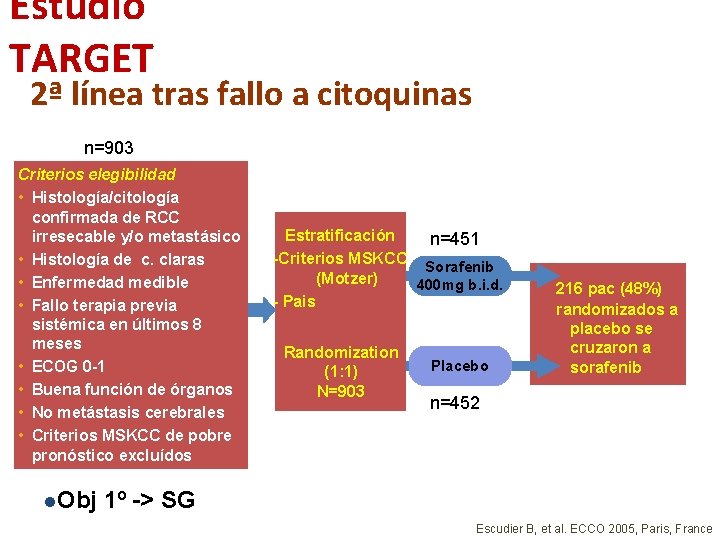
Estudio TARGET 2ª línea tras fallo a citoquinas n=903 Criterios elegibilidad • Histología/citología confirmada de RCC irresecable y/o metastásico • Histología de c. claras • Enfermedad medible • Fallo terapia previa sistémica en últimos 8 meses • ECOG 0 -1 • Buena función de órganos • No metástasis cerebrales • Criterios MSKCC de pobre pronóstico excluídos l. Obj Estratificación n=451 -Criterios MSKCC Sorafenib (Motzer) 400 mg b. i. d. - Pais Randomization (1: 1) N=903 Placebo 216 pac (48%) randomizados a placebo se cruzaron a sorafenib n=452 1º -> SG Escudier B, et al. ECCO 2005, Paris, France
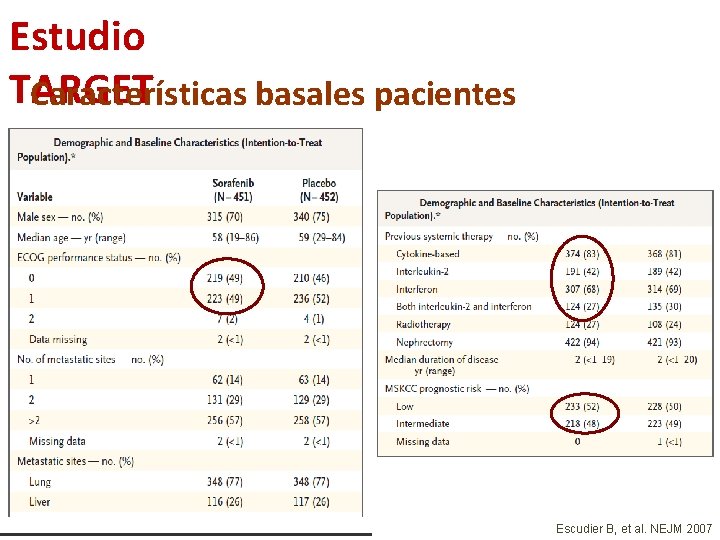
Estudio TARGET Características basales pacientes Escudier B, et al. NEJM 2007

Estudio TARGET Tasas de respuesta Escudier B, et al. NEJM 2007
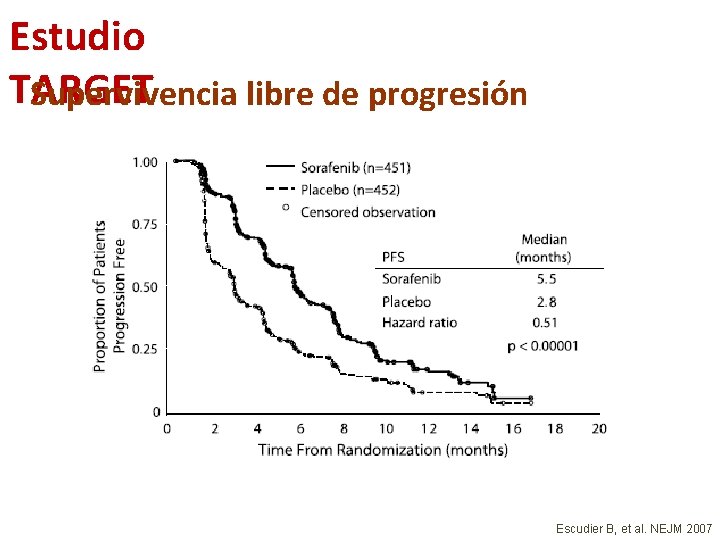
Estudio TARGET Supervivencia libre de progresión Escudier B, et al. NEJM 2007

Estudio TARGET Supervivencia libre de progresión Escudier B, et al. NEJM 2007
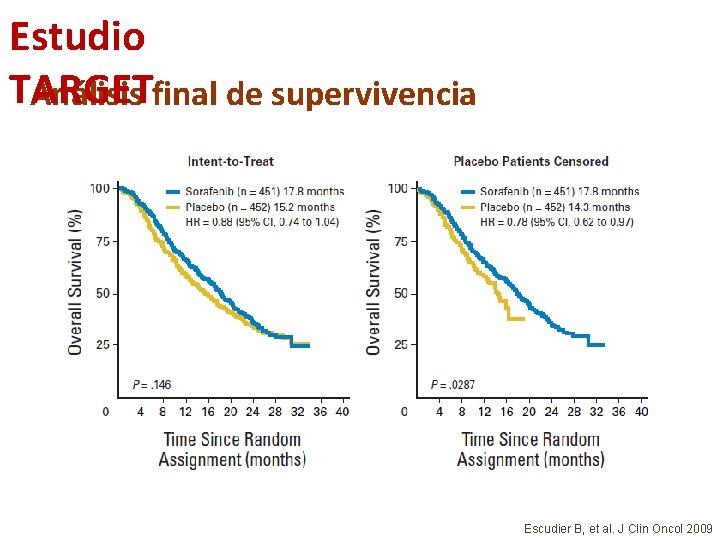
Estudio TARGET Análisis final de supervivencia Escudier B, et al. J Clin Oncol 2009
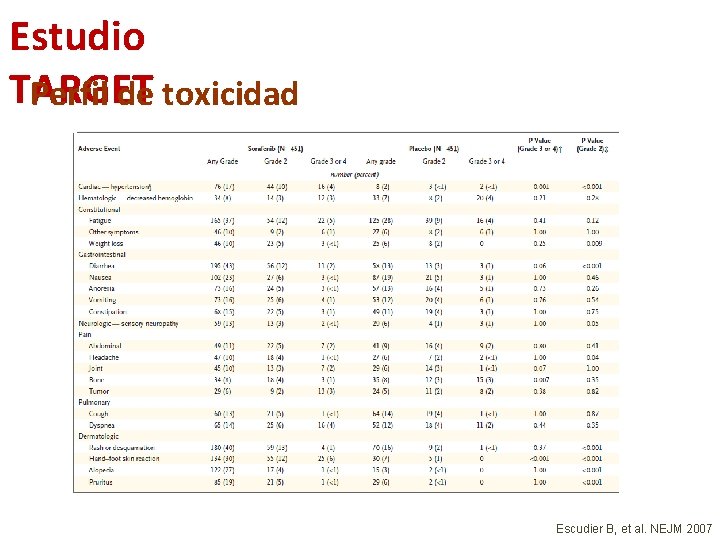
Estudio TARGET Perfil de toxicidad Escudier B, et al. NEJM 2007
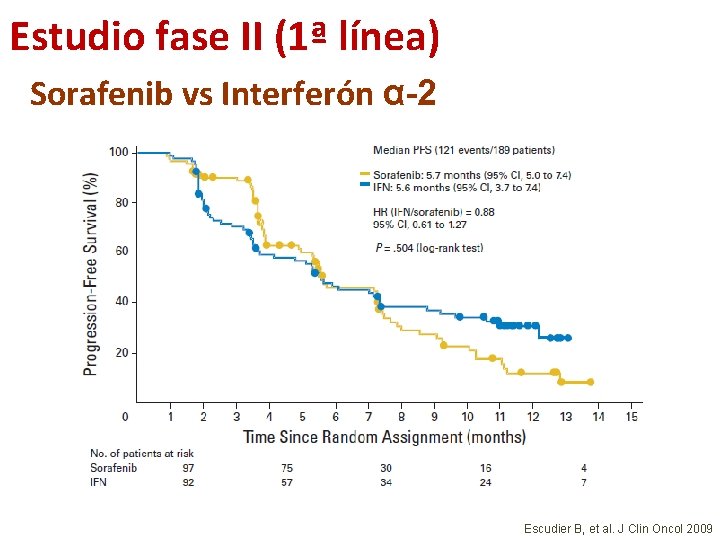
Estudio fase II (1ª línea) Sorafenib vs Interferón α-2 Escudier B, et al. J Clin Oncol 2009
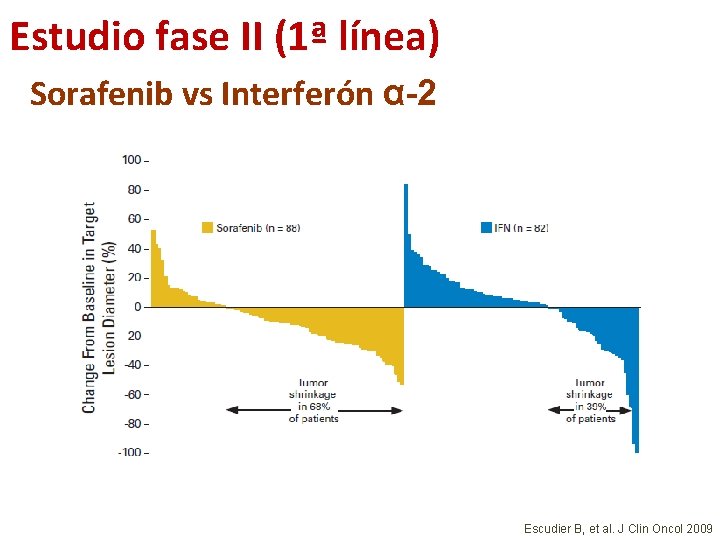
Estudio fase II (1ª línea) Sorafenib vs Interferón α-2 Escudier B, et al. J Clin Oncol 2009
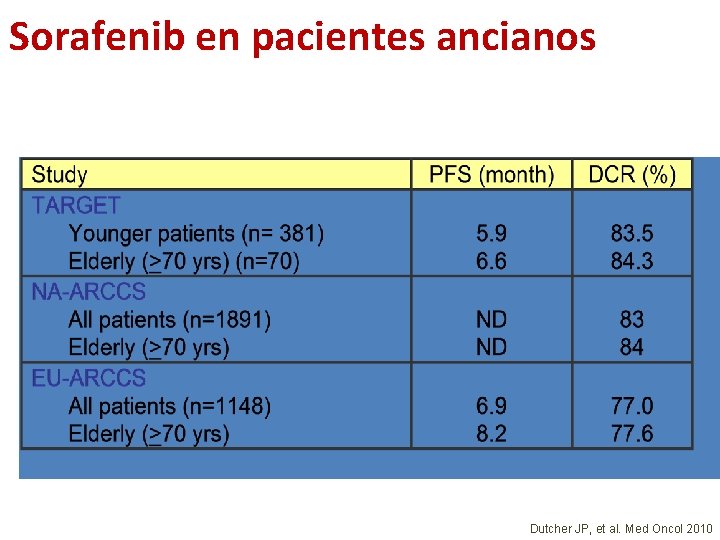
Sorafenib en pacientes ancianos Dutcher JP, et al. Med Oncol 2010
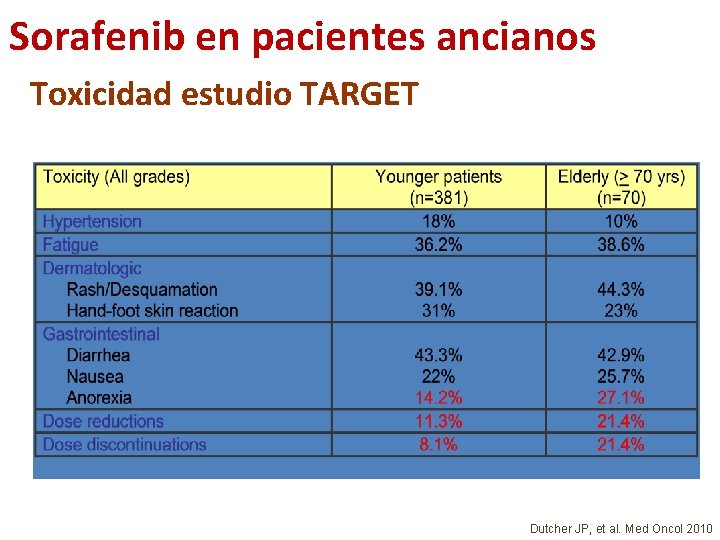
Sorafenib en pacientes ancianos Toxicidad estudio TARGET Dutcher JP, et al. Med Oncol 2010
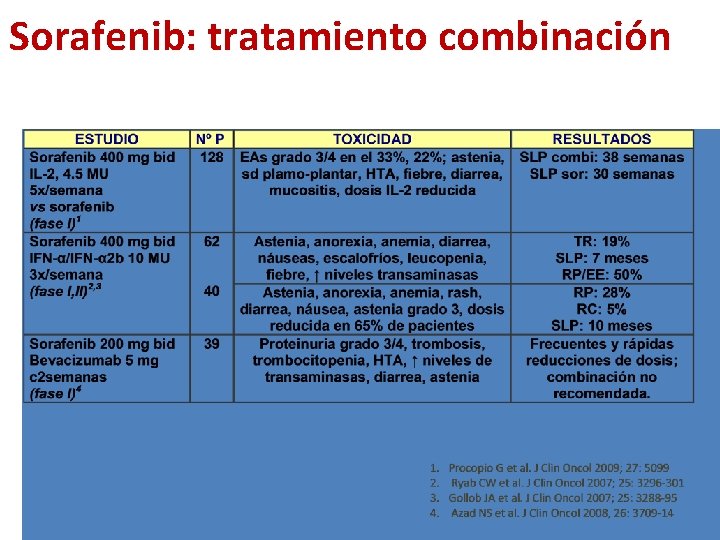
Sorafenib: tratamiento combinación
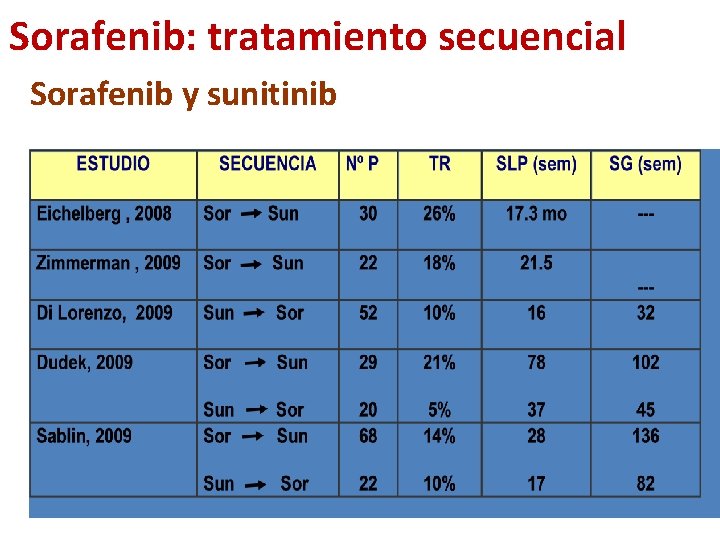
Sorafenib: tratamiento secuencial Sorafenib y sunitinib
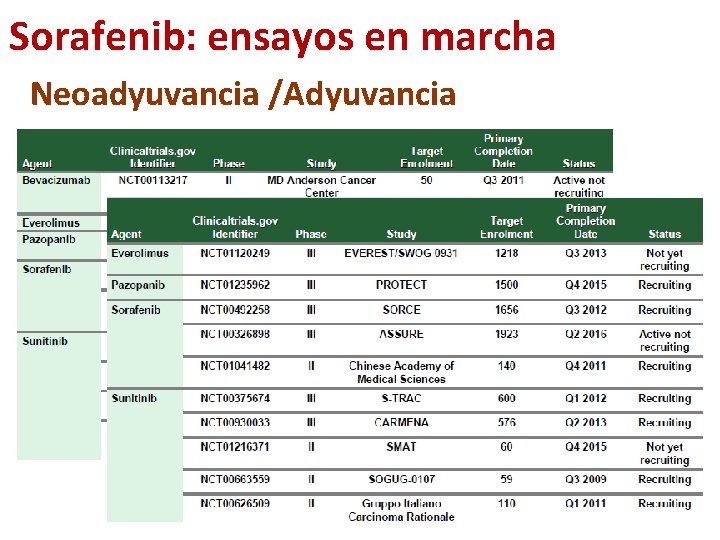
Sorafenib: ensayos en marcha Neoadyuvancia /Adyuvancia
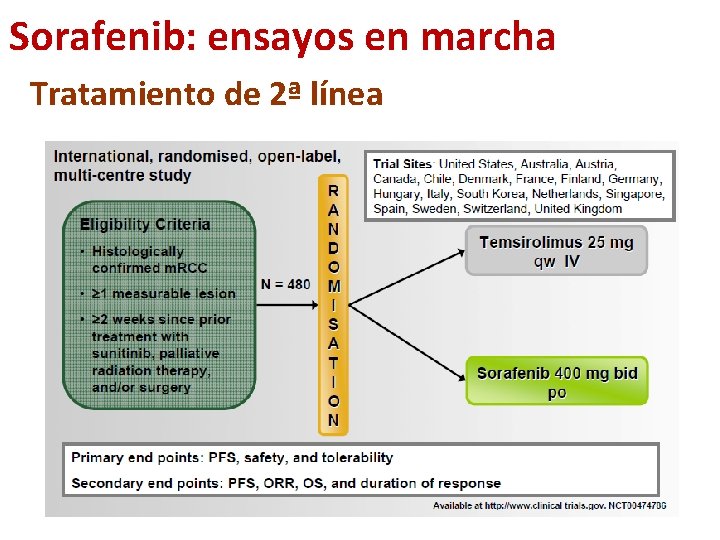
Sorafenib: ensayos en marcha Tratamiento de 2ª línea
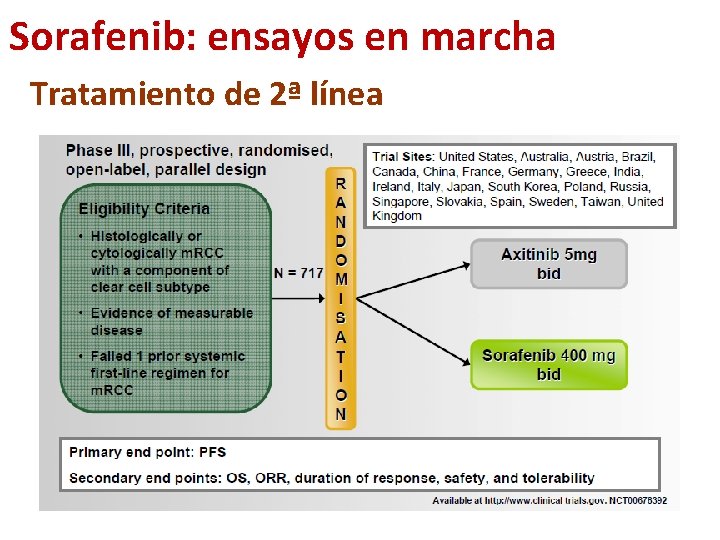
Sorafenib: ensayos en marcha Tratamiento de 2ª línea
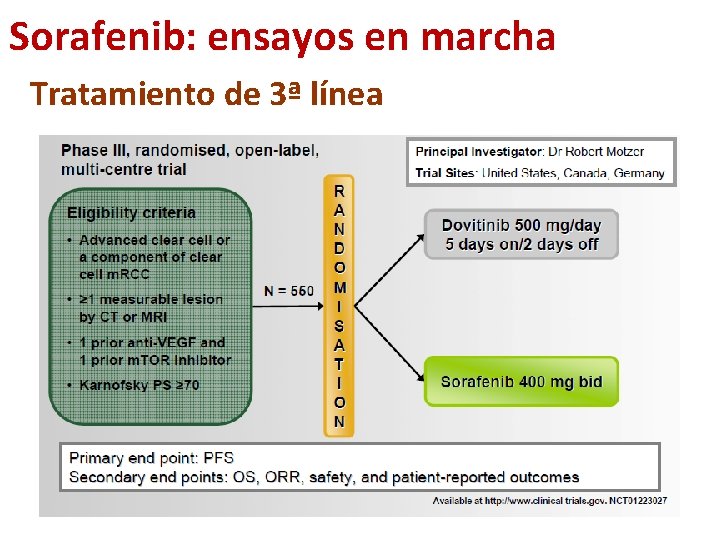
Sorafenib: ensayos en marcha Tratamiento de 3ª línea
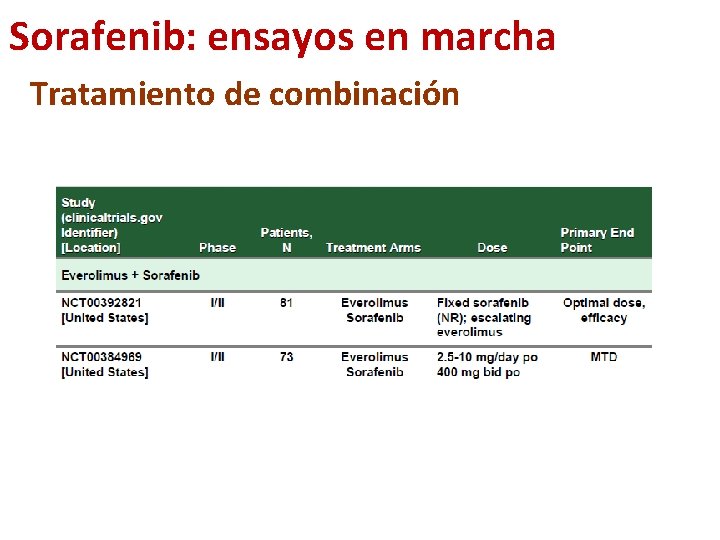
Sorafenib: ensayos en marcha Tratamiento de combinación
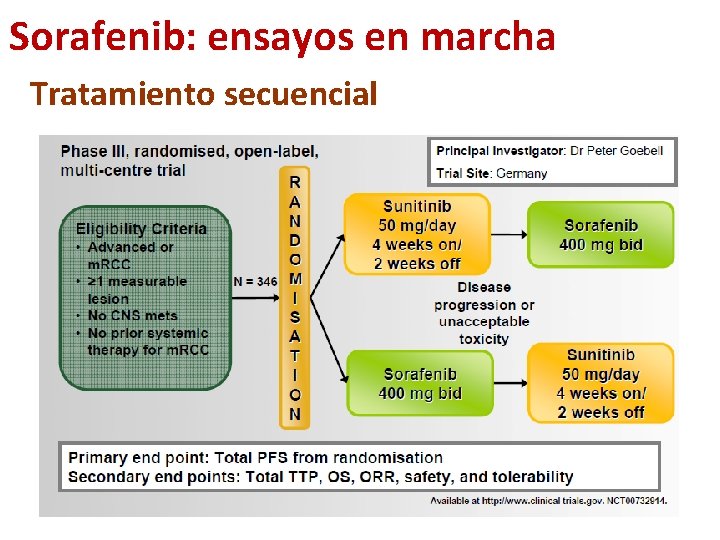
Sorafenib: ensayos en marcha Tratamiento secuencial

Esquema presentación • SORAFENIB • BEVACIZUMAB • AFLIBERCEPT • OTROS FÁRMACOS ANTIANGIOGÉNICOS.
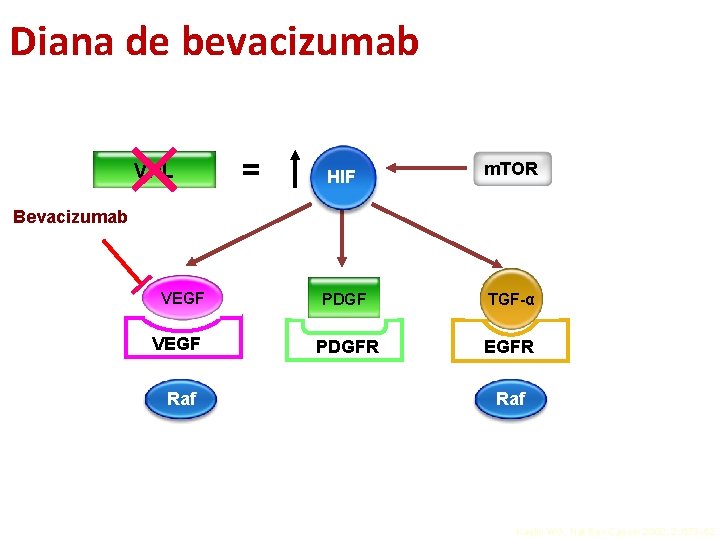
Diana de bevacizumab = HIF m. TOR VEGF PDGF TGF-α VEGFR PDGFR EGFR VHL Bevacizumab Raf Kaelin WG. Nat Rev Cancer 2002; 2: 673– 82.
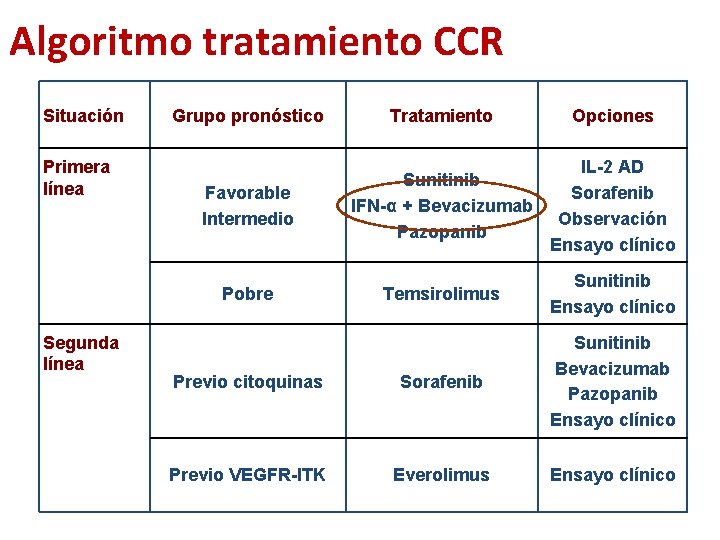
Algoritmo tratamiento CCR Situación Primera línea Segunda línea Grupo pronóstico Tratamiento Opciones Favorable Intermedio Sunitinib IFN-α + Bevacizumab Pazopanib IL-2 AD Sorafenib Observación Ensayo clínico Pobre Temsirolimus Sunitinib Ensayo clínico Previo citoquinas Sorafenib Sunitinib Bevacizumab Pazopanib Ensayo clínico Previo VEGFR-ITK Everolimus Ensayo clínico

Bevacizumab + IFN-α 1ª línea de tratamiento • 2 estudios fase III: • AVOREN – IFN-α +/- bevacizumab en primera línea de pacientes con carcinoma renal avanzado con nefrectomía previa 1, 2 • CALGB 90206 – IFN-a +/- bevacizumab en primera línea de pacientes con carcinoma renal avanzado 3, 4 • Obj 1º -> SG 1. Escudier B, et al. Lancet 2007 2. Escudier B, et al. ASCO 2009 3. Rini BI, et al. J Clin Oncol 2008 4. Rini BI, et al. ASCO 2009
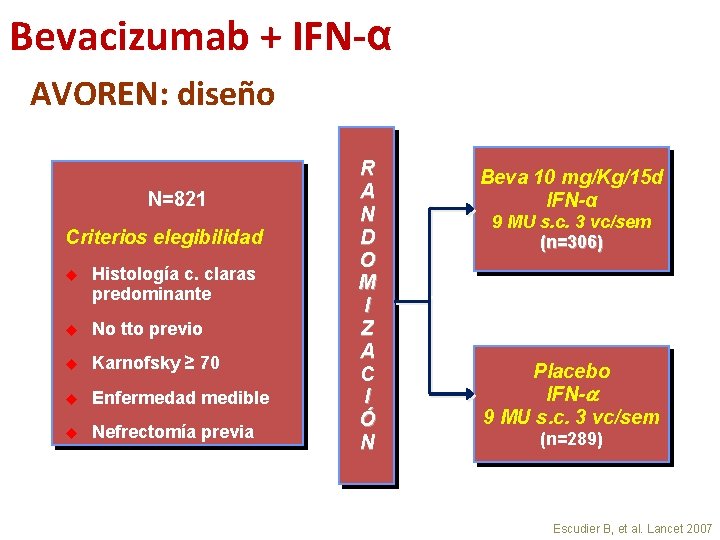
Bevacizumab + IFN-α AVOREN: diseño N=821 Criterios elegibilidad u Histología c. claras predominante u No tto previo u Karnofsky ≥ 70 u Enfermedad medible u Nefrectomía previa R A N D O M I Z A C I Ó N Beva 10 mg/Kg/15 d IFN-α 9 MU s. c. 3 vc/sem (n=306) Placebo IFN- 9 MU s. c. 3 vc/sem (n=289) Escudier B, et al. Lancet 2007
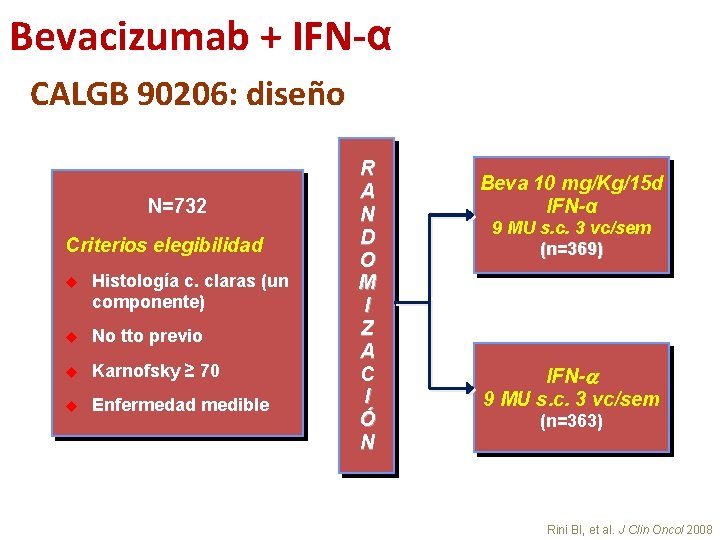
Bevacizumab + IFN-α CALGB 90206: diseño N=732 Criterios elegibilidad u Histología c. claras (un componente) u No tto previo u Karnofsky ≥ 70 u Enfermedad medible R A N D O M I Z A C I Ó N Beva 10 mg/Kg/15 d IFN-α 9 MU s. c. 3 vc/sem (n=369) IFN- 9 MU s. c. 3 vc/sem (n=363) Rini BI, et al. J Clin Oncol 2008
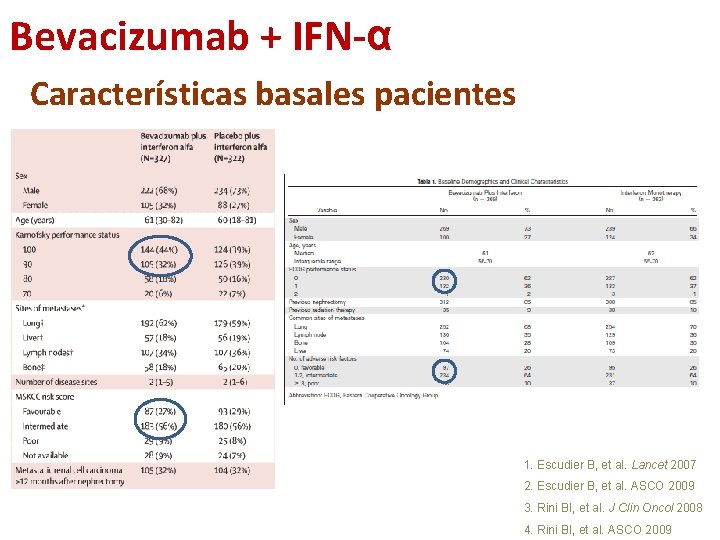
Bevacizumab + IFN-α Características basales pacientes 1. Escudier B, et al. Lancet 2007 2. Escudier B, et al. ASCO 2009 3. Rini BI, et al. J Clin Oncol 2008 4. Rini BI, et al. ASCO 2009

Bevacizumab + IFN-α Tasas de respuestas Estudio N TRO (%) vs IFN-a AVOREN 1, 2 649 31 vs 12 p<0. 0001 CALGB 902063, 4 732 25. 5 vs 13. 1 p<0. 0001 1. Escudier B, et al. Lancet 2007 2. Escudier B, et al. ASCO 2009 3. Rini BI, et al. J Clin Oncol 2008 4. Rini BI, et al. ASCO 2009
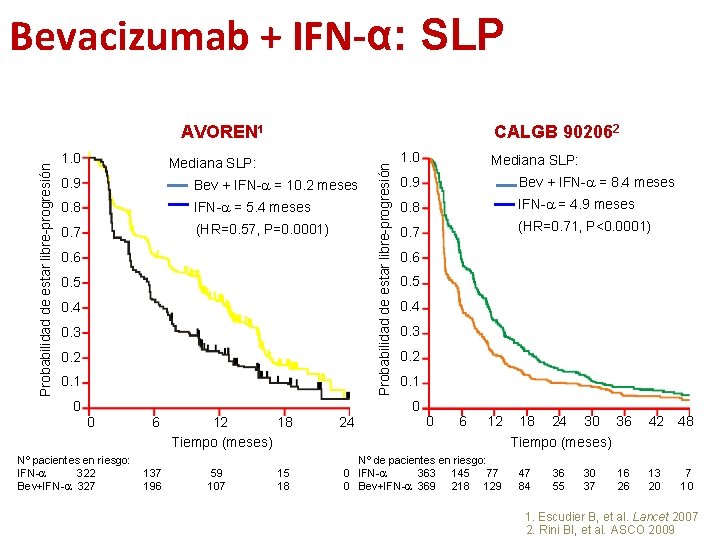
Bevacizumab + IFN-α: SLP 1. 0 CALGB 902062 Mediana SLP: 0. 9 Bev + IFN-a = 10. 2 meses 0. 8 IFN-a = 5. 4 meses 0. 7 (HR=0. 57, P=0. 0001) 0. 6 0. 5 0. 4 0. 3 0. 2 0. 1 Probabilidad de estar libre-progresión AVOREN 1 1. 0 Mediana SLP: 0. 9 Bev + IFN-a = 8. 4 meses 0. 8 IFN-a = 4. 9 meses 0. 7 (HR=0. 71, P<0. 0001) 0. 6 0. 5 0. 4 0. 3 0. 2 0. 1 0 0 0 Nº pacientes en riesgo: IFN-a 322 Bev+IFN-a 327 6 137 196 12 18 Tiempo (meses) 59 107 15 18 24 0 6 12 Nº de pacientes en riesgo: 0 IFN-a 363 145 77 0 Bev+IFN-a 369 218 129 18 24 30 36 Tiempo (meses) 47 84 36 55 30 37 16 26 42 48 13 20 7 10 1. Escudier B, et al. Lancet 2007 2. Rini BI, et al. ASCO 2009
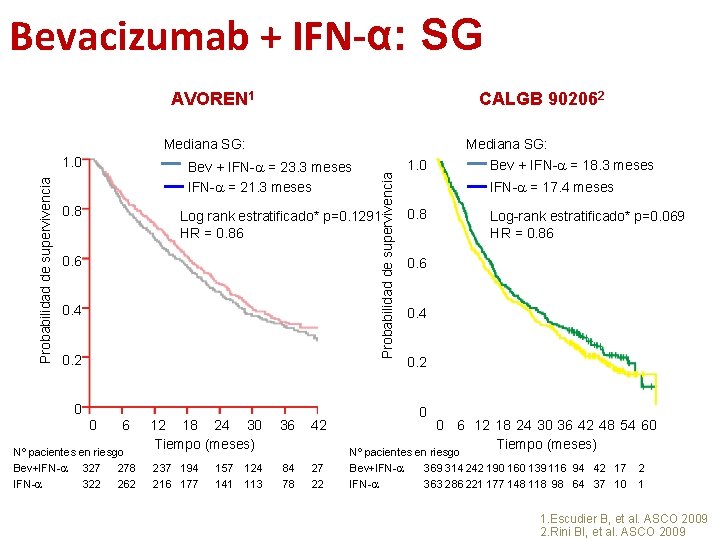
Bevacizumab + IFN-α: SG AVOREN 1 CALGB 902062 Probabilidad de supervivencia 1. 0 Bev + IFN-a = 23. 3 meses IFN-a = 21. 3 meses 0. 8 Probabilidad de supervivencia Mediana SG: Log rank estratificado* p=0. 1291 HR = 0. 86 0. 4 0. 2 0 0 6 Nº pacientes en riesgo Bev+IFN-a 327 278 IFN-a 322 262 12 18 24 30 Tiempo (meses) 237 194 216 177 157 124 141 113 36 84 78 42 27 22 1. 0 Mediana SG: Bev + IFN-a = 18. 3 meses IFN-a = 17. 4 meses 0. 8 Log-rank estratificado* p=0. 069 HR = 0. 86 0. 4 0. 2 0 0 6 12 18 24 30 36 42 48 54 60 Tiempo (meses) Nº pacientes en riesgo Bev+IFN-a 369 314 242 190 160 139 116 94 42 17 IFN-a 363 286 221 177 148 118 98 64 37 10 2 1 1. Escudier B, et al. ASCO 2009 2. Rini BI, et al. ASCO 2009
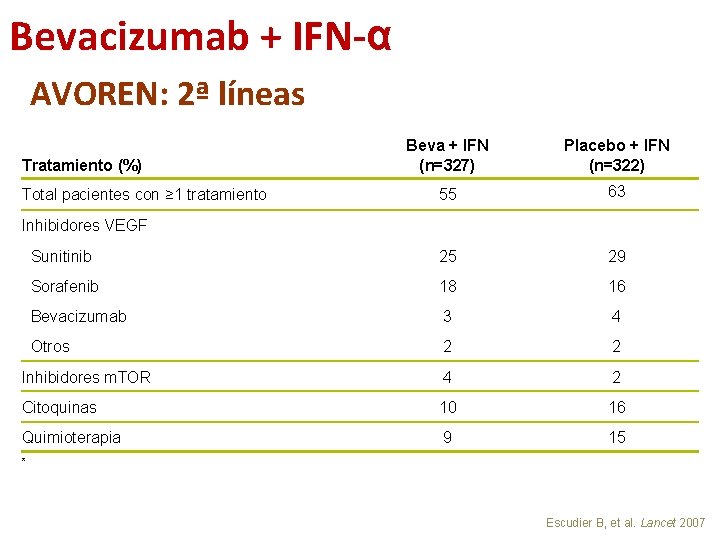
Bevacizumab + IFN-α AVOREN: 2ª líneas Beva + IFN (n=327) Placebo + IFN (n=322) 55 63 Sunitinib 25 29 Sorafenib 18 16 Bevacizumab 3 4 Otros 2 2 Inhibidores m. TOR 4 2 Citoquinas 10 16 Quimioterapia 9 15 Tratamiento (%) Total pacientes con ≥ 1 tratamiento Inhibidores VEGF * Escudier B, et al. Lancet 2007
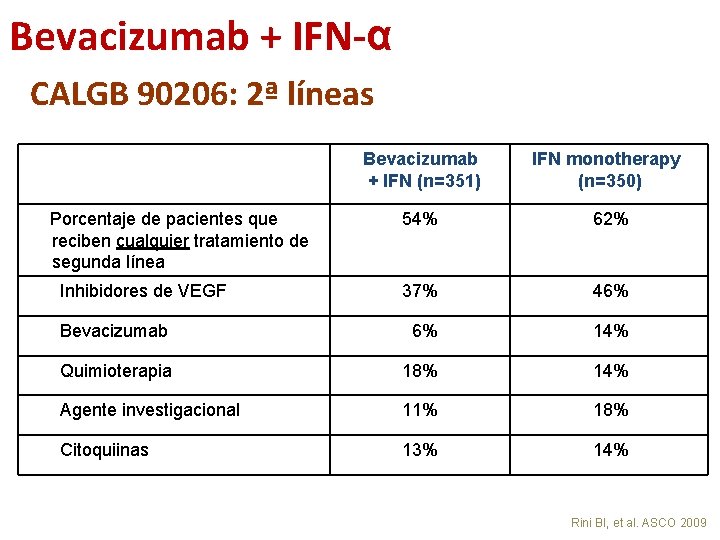
Bevacizumab + IFN-α CALGB 90206: 2ª líneas Bevacizumab + IFN (n=351) IFN monotherapy (n=350) 54% 62% 37% 46% Bevacizumab 6% 14% Quimioterapia 18% 14% Agente investigacional 11% 18% Citoquiinas 13% 14% Porcentaje de pacientes que reciben cualquier tratamiento de segunda línea Inhibidores de VEGF Rini BI, et al. ASCO 2009
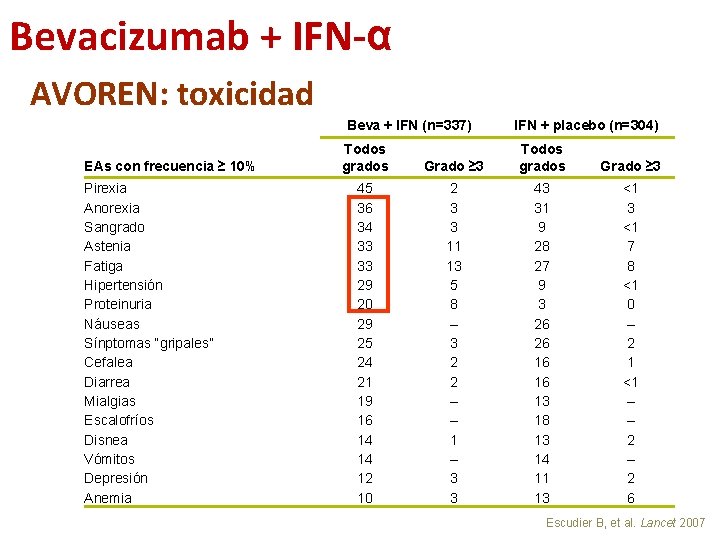
Bevacizumab + IFN-α AVOREN: toxicidad Beva + IFN (n=337) EAs con frecuencia ≥ 10% Pirexia Anorexia Sangrado Astenia Fatiga Hipertensión Proteinuria Náuseas Sínptomas “gripales” Cefalea Diarrea Mialgias Escalofríos Disnea Vómitos Depresión Anemia Todos grados 45 36 34 33 33 29 20 29 25 24 21 19 16 14 14 12 10 IFN + placebo (n=304) Grado ≥ 3 Todos grados Grado ≥ 3 2 3 3 11 13 5 8 – 3 2 2 – – 1 – 3 3 43 31 9 28 27 9 3 26 26 16 16 13 18 13 14 11 13 <1 7 8 <1 0 – 2 1 <1 – – 2 6 Escudier B, et al. Lancet 2007

Bevacizumab + IFN-α CALGB 90206: toxicidad Bev + IFN-a (n = 366) IFN-a (n = 352) 79% 61% Fatiga/astenia/malestar 37% 30% Anorexia 17% 8% Proteinuria 15% <1% Hipertensión 11% 0% Hemorragia 2% <1% Tromboembolismo venoso 2% 1% Perforación gastrointestinal <1% 0% Efectos adversos Cualquier grado 3/4 Isquemia arterial Rini BI, et al. ASCO 2009
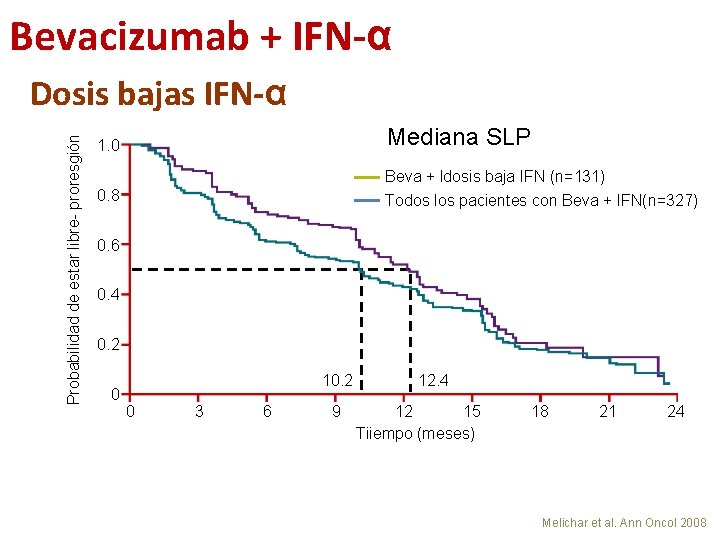
Bevacizumab + IFN-α Probabilidad de estar libre- proresgión Dosis bajas IFN-α 1. 0 Mediana SLP 0. 8 Beva + ldosis baja IFN (n=131) Todos los pacientes con Beva + IFN(n=327) 0. 6 0. 4 0. 2 0 10. 2 0 3 6 9 12. 4 12 15 Tiiempo (meses) 18 21 24 Melichar et al. Ann Oncol 2008
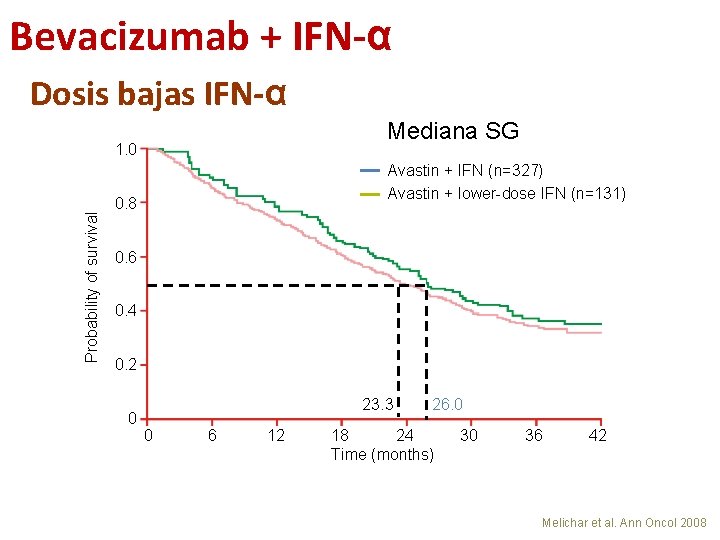
Bevacizumab + IFN-α Dosis bajas IFN-α Mediana SG Probability of survival 1. 0 Avastin + IFN (n=327) Avastin + lower-dose IFN (n=131) 0. 8 0. 6 0. 4 0. 2 0 23. 3 0 6 12 26. 0 18 24 Time (months) 30 36 42 Melichar et al. Ann Oncol 2008
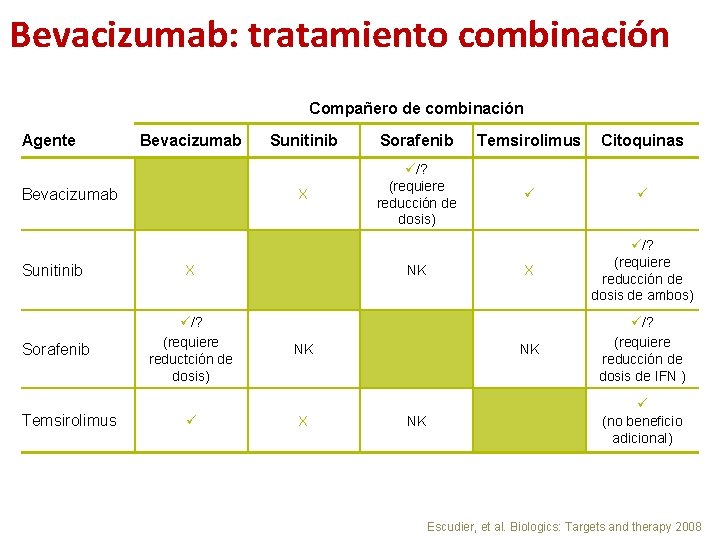
Bevacizumab: tratamiento combinación Compañero de combinación Agente Bevacizumab Sunitinib X Sorafenib /? (requiere reductción de dosis) Temsirolimus Sunitinib Sorafenib Temsirolimus Citoquinas X /? (requiere reducción de dosis) X /? (requiere reducción de dosis de ambos) NK /? (requiere reducción de dosis de IFN ) NK NK X NK (no beneficio adicional) Escudier, et al. Biologics: Targets and therapy 2008
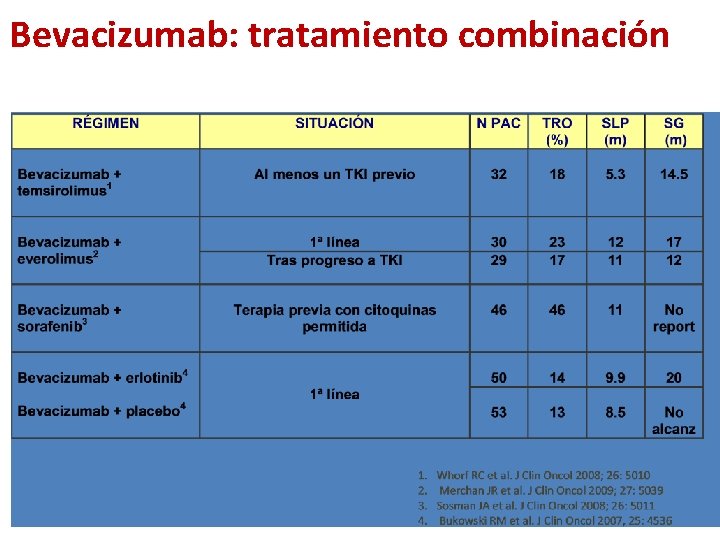
Bevacizumab: tratamiento combinación
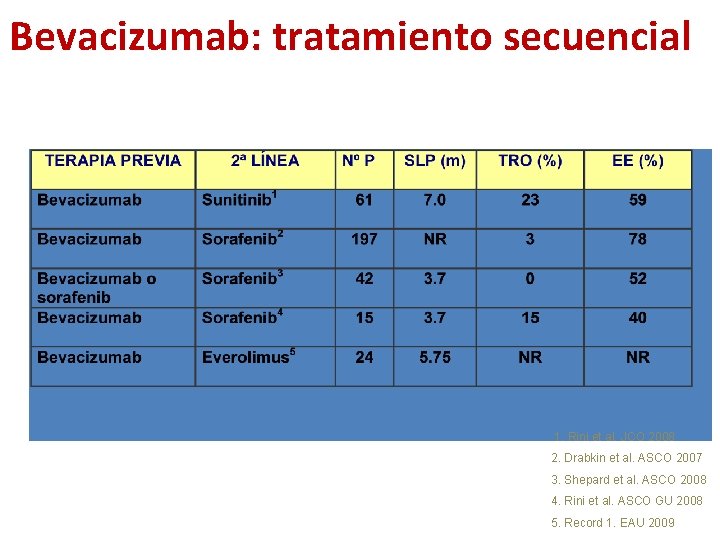
Bevacizumab: tratamiento secuencial 1. Rini et al. JCO 2008 2. Drabkin et al. ASCO 2007 3. Shepard et al. ASCO 2008 4. Rini et al. ASCO GU 2008 5. Record 1. EAU 2009
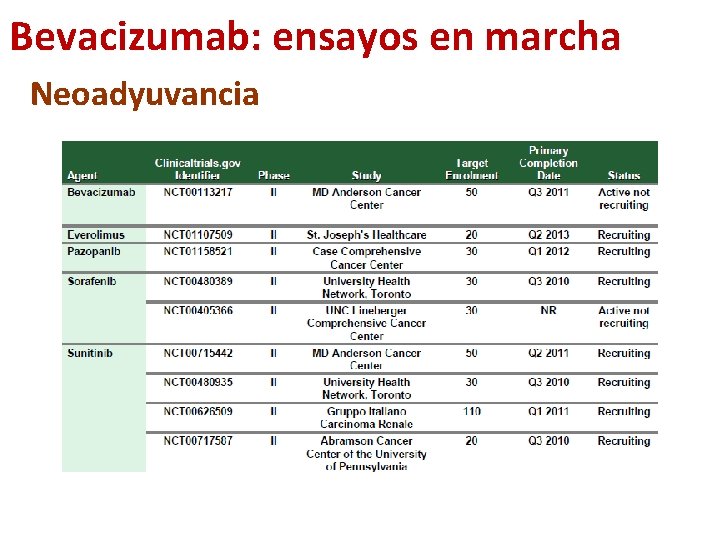
Bevacizumab: ensayos en marcha Neoadyuvancia
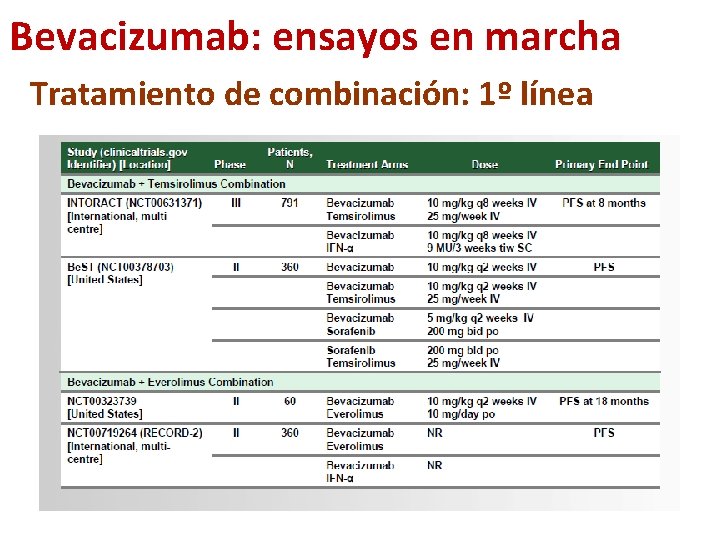
Bevacizumab: ensayos en marcha Tratamiento de combinación: 1º línea
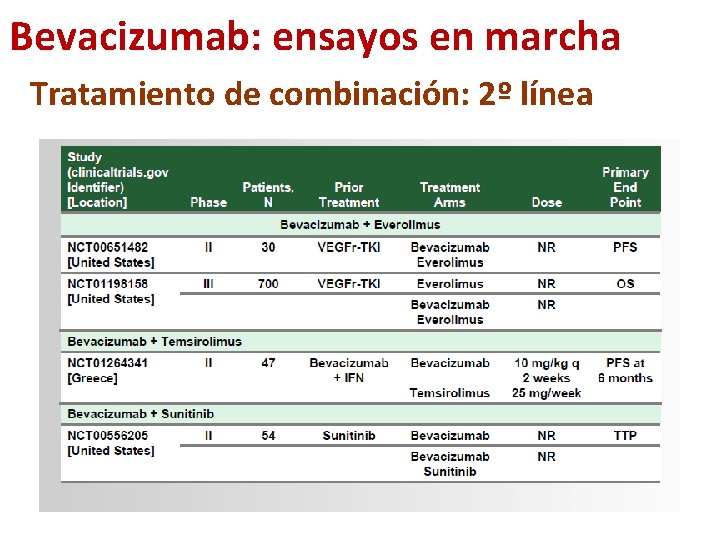
Bevacizumab: ensayos en marcha Tratamiento de combinación: 2º línea
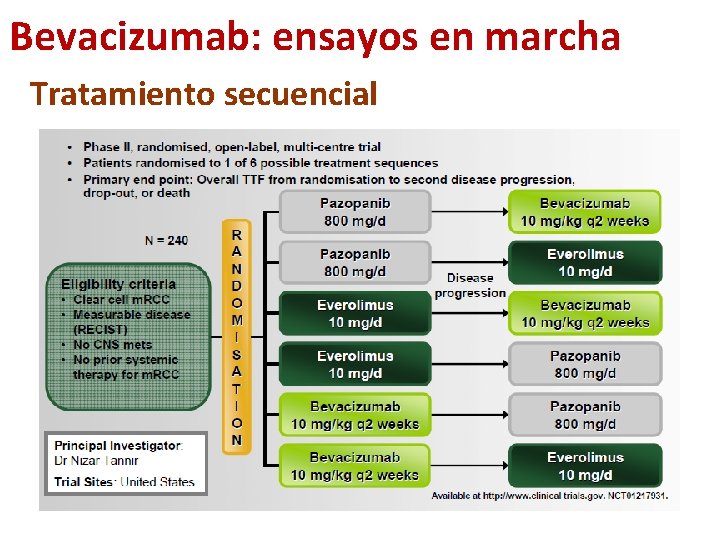
Bevacizumab: ensayos en marcha Tratamiento secuencial

Esquema presentación • SORAFENIB • BEVACIZUMAB • AFLIBERCEPT • OTROS FÁRMACOS ANTIANGIOGÉNICOS.
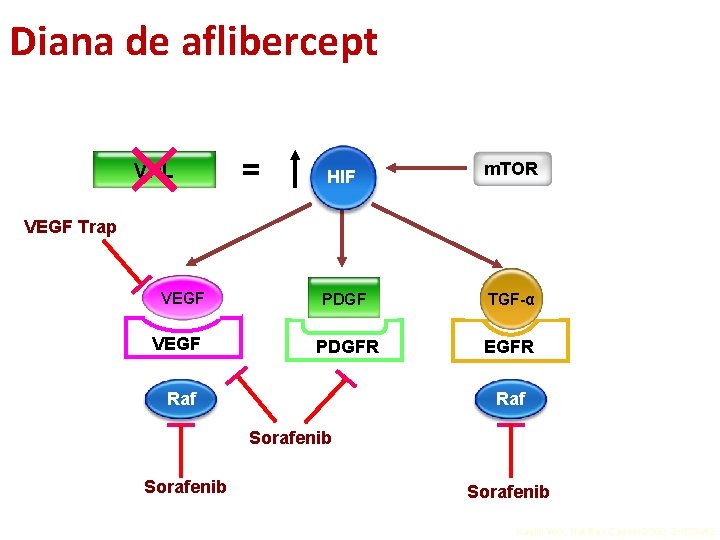
Diana de aflibercept = HIF m. TOR VEGF PDGF TGF-α VEGFR PDGFR EGFR VHL VEGF Trap Raf Sorafenib Kaelin WG. Nat Rev Cancer 2002; 2: 673– 82.
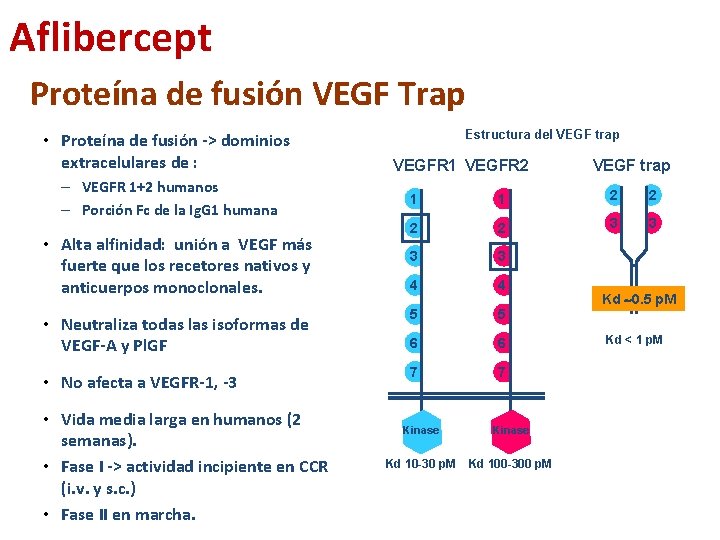
Aflibercept Proteína de fusión VEGF Trap • Proteína de fusión -> dominios extracelulares de : – VEGFR 1+2 humanos – Porción Fc de la Ig. G 1 humana Estructura del VEGF trap VEGFR 1 VEGFR 2 VEGF trap 1 1 2 2 3 3 4 4 • Neutraliza todas las isoformas de VEGF-A y Pl. GF 5 5 6 6 • No afecta a VEGFR-1, -3 7 7 • Alta alfinidad: unión a VEGF más fuerte que los recetores nativos y anticuerpos monoclonales. • Vida media larga en humanos (2 semanas). • Fase I -> actividad incipiente en CCR (i. v. y s. c. ) • Fase II en marcha. Kinase Kd 10 -30 p. M Kd 100 -300 p. M Kd 0. 5 p. M Kd < 1 p. M

Esquema presentación • SORAFENIB • BEVACIZUMAB • AFLIBERCEPT • OTROS FÁRMACOS ANTIANGIOGÉNICOS.

Otros antiangiogénicos Ensayos clínicos en marcha
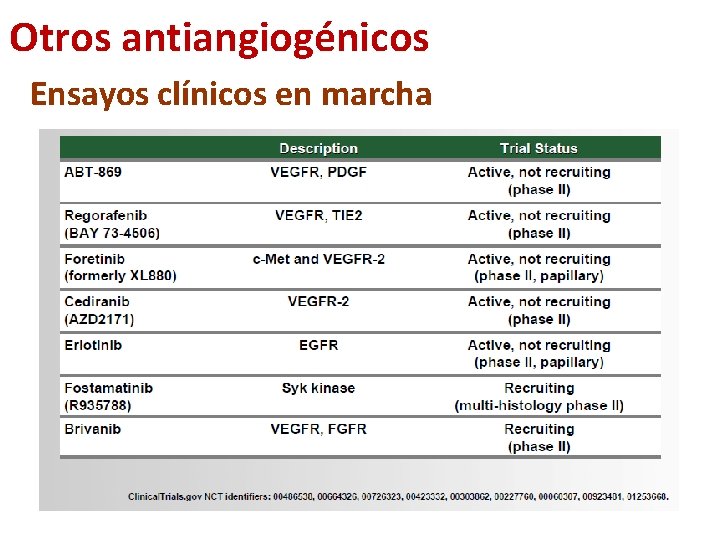
Otros antiangiogénicos Ensayos clínicos en marcha

Otros antiangiogénicos Ensayos clínicos en marcha

Conclusiones • SORAFENIB aumenta la SLP en pacientes con CCR avanzado que progresan a citoquinas • Estudios han encontrado actividad de sorafenib tras tratamiento previo con TKI-VEGF • BEVACIZUMAB aumenta la SLP en pacientes con CCR avanzado en primera línea de tratamiento. • Estudios interesantes de combinación con inhibidores de m. TOR • Estudios han encontrado actividad de TKI tras tratamiento previo con bevacizumab

Conclusiones • Estudios prospectivos fase III que definan ambos fármacos • Alta prioridad -> mecanismos de resistencia de agentes diana para definir el mejor esquema de tratamiento. • Actualmente en marcha estudios con nuevos fármacos antiangiogénicos: – AFLIBERCEPT – TIVOZANIB – DOVITINIB

MUCHAS GRACIAS
- Slides: 58