ENSAYOS CLNICOS EN MXICO RETOS Y OPORTUNIDADES Academia















- Slides: 24

ENSAYOS CLÍNICOS EN MÉXICO RETOS Y OPORTUNIDADES Academia Nacional de Medicina de México Julio 22, 2015

CONTENIDO Introducción Proceso de desarrollo de medicamentos Outsourcing de ensayos clínicos: requerimientos internacionales y criterios de evaluación Ensayos clínicos México Conclusiones Recomendaciones

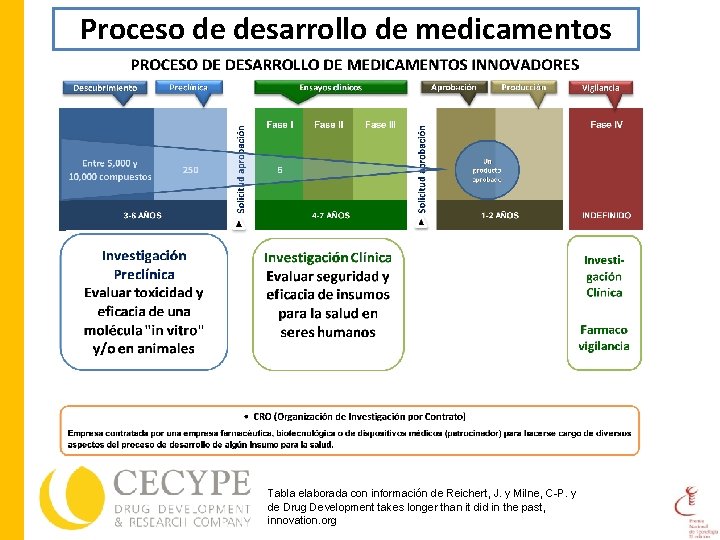
Proceso de desarrollo de medicamentos Tabla elaborada con información de Reichert, J. y Milne, C-P. y de Drug Development takes longer than it did in the past, innovation. org

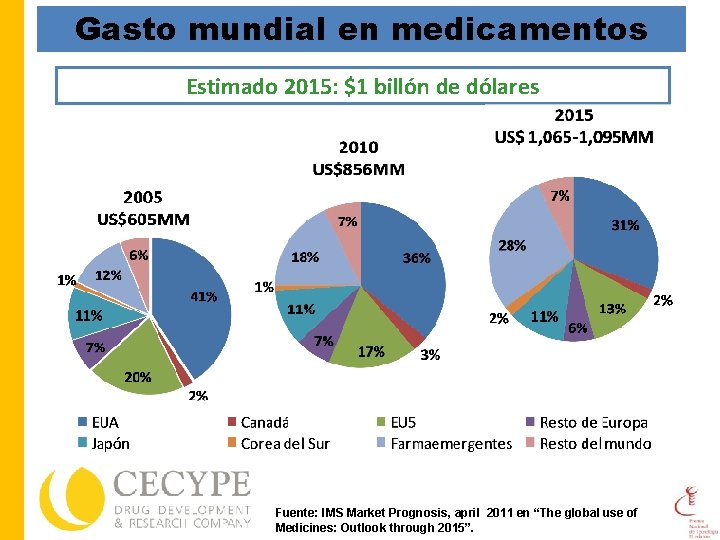
Gasto mundial en medicamentos Estimado 2015: $1 billón de dólares Fuente: IMS Market Prognosis, april 2011 en “The global use of Medicines: Outlook through 2015”.

Outsourcing de ensayos clínicos REQUERIMIENTOS INTERNACIONALES Y CRITERIOS DE EVALUACIÓN.

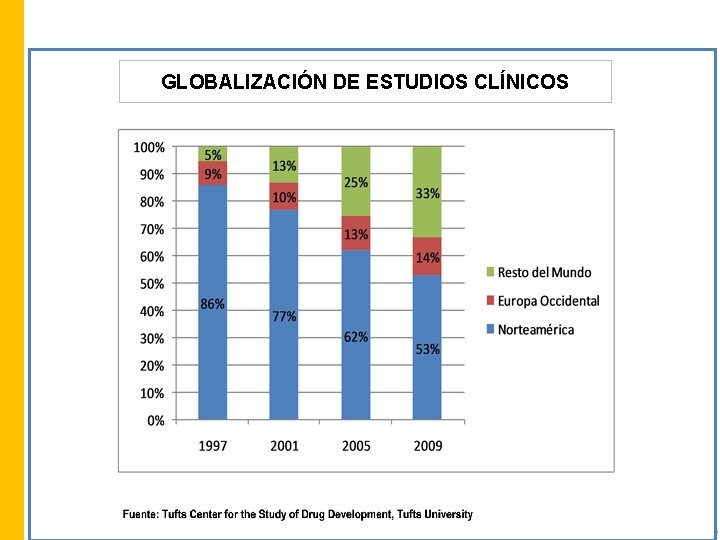
GLOBALIZACIÓN DE ESTUDIOS CLÍNICOS

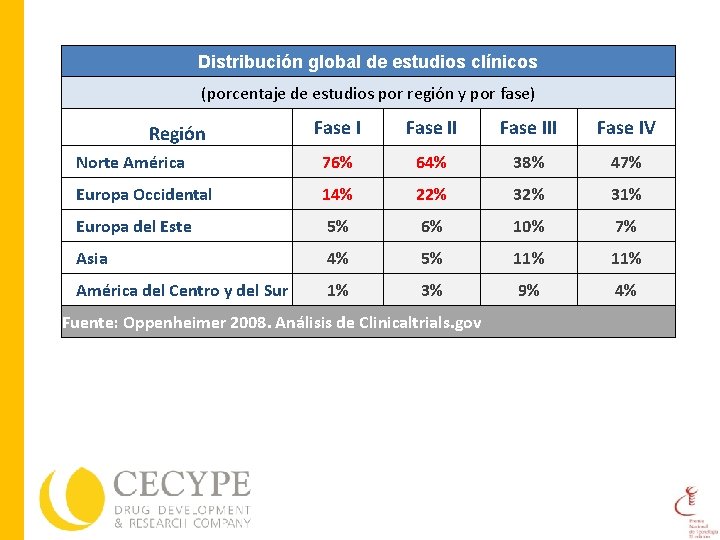
Distribución global de estudios clínicos (porcentaje de estudios por región y por fase) Fase III Fase IV Norte América 76% 64% 38% 47% Europa Occidental 14% 22% 31% Europa del Este 5% 6% 10% 7% Asia 4% 5% 11% América del Centro y del Sur 1% 3% 9% 4% Región Fuente: Oppenheimer 2008. Análisis de Clinicaltrials. gov

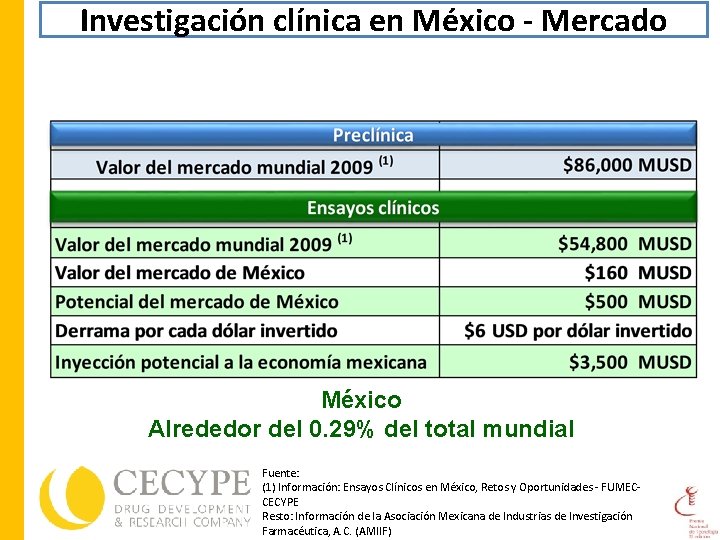
Investigación clínica en México - Mercado México Alrededor del 0. 29% del total mundial Fuente: (1) Información: Ensayos Clínicos en México, Retos y Oportunidades - FUMECCECYPE Resto: Información de la Asociación Mexicana de Industrias de Investigación Farmacéutica, A. C. (AMIIF)

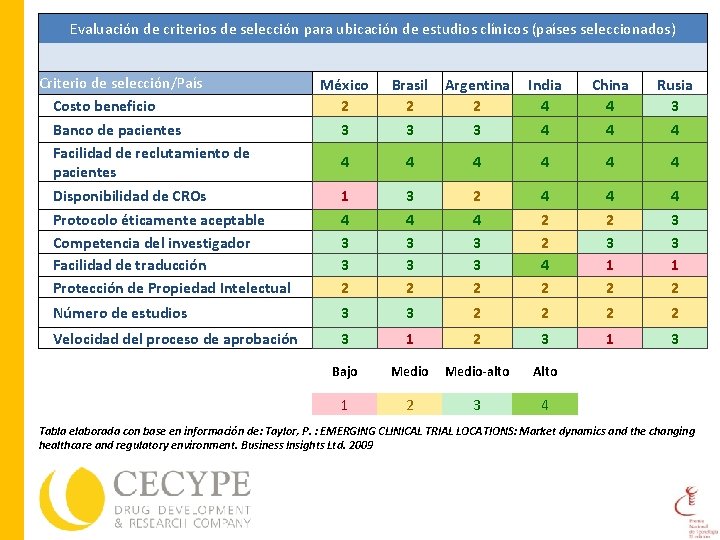
Evaluación de criterios de selección para ubicación de estudios clínicos (países seleccionados) Criterio de selección/País Costo beneficio México 2 Brasil Argentina India China Rusia 2 2 4 4 3 Banco de pacientes Facilidad de reclutamiento de pacientes Disponibilidad de CROs 3 3 3 4 4 4 4 4 1 3 2 4 4 4 Protocolo éticamente aceptable Competencia del investigador Facilidad de traducción Protección de Propiedad Intelectual 4 3 3 2 2 2 4 2 2 3 1 2 3 3 1 2 Número de estudios 3 3 2 2 Velocidad del proceso de aprobación 3 1 2 3 1 3 Bajo Medio-alto Alto 1 2 3 4 Tabla elaborada con base en información de: Taylor, P. : EMERGING CLINICAL TRIAL LOCATIONS: Market dynamics and the changing healthcare and regulatory environment. Business Insights Ltd. 2009

Modelo desarrollado por A. T. Kearney


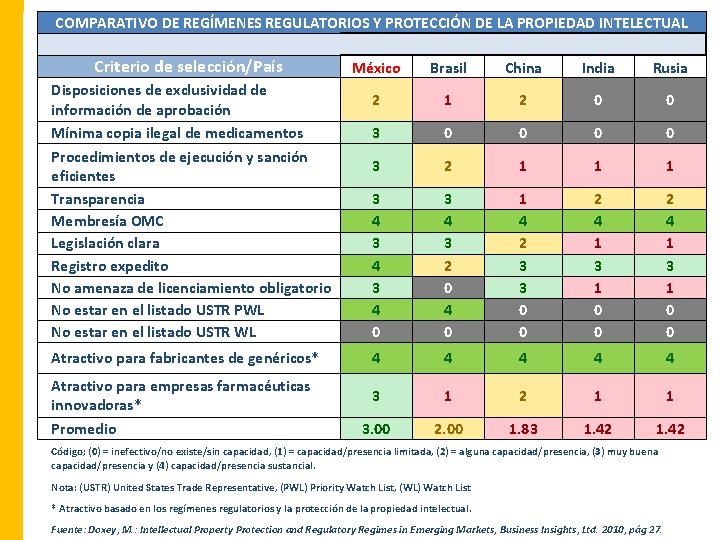
COMPARATIVO DE REGÍMENES REGULATORIOS Y PROTECCIÓN DE LA PROPIEDAD INTELECTUAL Criterio de selección/País México Brasil China India Rusia Disposiciones de exclusividad de 2 1 2 0 0 información de aprobación Mínima copia ilegal de medicamentos 3 0 0 Procedimientos de ejecución y sanción 3 2 1 1 1 eficientes Transparencia 3 3 1 2 2 Membresía OMC 4 4 4 Legislación clara 3 3 2 1 1 Registro expedito 4 2 3 3 3 No amenaza de licenciamiento obligatorio 3 0 3 1 1 No estar en el listado USTR PWL 4 4 0 0 0 No estar en el listado USTR WL 0 0 0 Atractivo para fabricantes de genéricos* Atractivo para empresas farmacéuticas innovadoras* Promedio 4 4 4 3 1 2 1 1 3. 00 2. 00 1. 83 1. 42 Código; (0) = inefectivo/no existe/sin capacidad, (1) = capacidad/presencia limitada, (2) = alguna capacidad/presencia, (3) muy buena capacidad/presencia y (4) capacidad/presencia sustancial. Nota: (USTR) United States Trade Representative, (PWL) Priority Watch List, (WL) Watch List * Atractivo basado en los regímenes regulatorios y la protección de la propiedad intelectual. Fuente: Doxey, M. : Intellectual Property Protection and Regulatory Regimes in Emerging Markets, Business Insights, Ltd. 2010, pág 27.

MÉXICO

Preclínica • Prácticamente no existe con enfoque a registro de medicamentos • Investigación básica en instituciones de educación superior e instituciones de salud • Está desarticulada y fragmentada • Enfoque asistencial o académico como prioridad • Estructuras operativas que no dan entrada a proyectos o empresas que puedan hacer investigación preclínica • Prácticamente no hay bioterios • No se siguen lineamientos internacionales ni buenas prácticas de laboratorio

Preclínica • Existen especialistas para transmitir conocimiento en investigación básica. • Orientación a la ciencia biomédica básica y no al desarrollo de tecnología e innovación porque se considera que esa ciencia es “de segunda” (no da créditos, no lleva al SNI) • Las instituciones privadas no forman científicos de posgrado o forman muy pocos porque no hay fuentes de trabajo. • Falta de empresas de investigación preclínica.

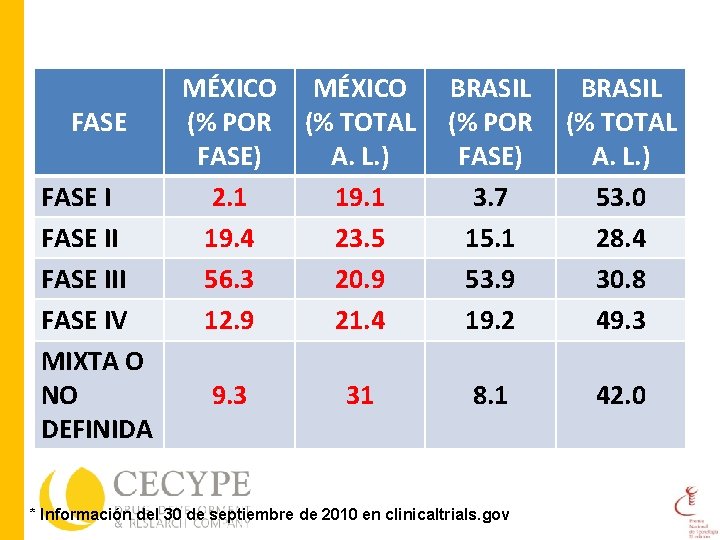
FASE III FASE IV MIXTA O NO DEFINIDA MÉXICO (% POR (% TOTAL FASE) A. L. ) 2. 1 19. 4 23. 5 56. 3 20. 9 12. 9 21. 4 9. 3 31 BRASIL (% POR FASE) 3. 7 15. 1 53. 9 19. 2 BRASIL (% TOTAL A. L. ) 53. 0 28. 4 30. 8 49. 3 8. 1 42. 0 * Información del 30 de septiembre de 2010 en clinicaltrials. gov

FODA

FUERZAS • Sistema regulatorio en evolución y competitivo – modificaciones recientes dan nivel satisfactorio de seguridad a las empresas. – el proceso de aprobación más rápido entre los principales países atractivos para hacer ensayos clínicos. – Legislación de avanzada en biotecnológicos. • Precios competitivos. • Velocidad de reclutamiento y tamaño de mercado atractivos. • Reconocimiento internacional en investigación básica (sobre todo en biológicos).

DEBILIDADES • No siempre se aplican las normas de protección intelectual ni se respeta la “exclusividad de información”. • México opera por debajo de su potencial en investigación (inversión, maquila, fases tempranas, CROs locales) – Desconocimiento de las normas internacionales, BPC, BPL, ICH, etc. por parte de los investigadores. – Normatividad y cultura limitante en instituciones públicas de salud e instituciones de educación superior. – Comités de ética e investigación con escaso apego a lineamientos internacionales, como ICH, por ejemplo. – Muy pocas empresas dedicadas a la investigación preclínica y clínica. • México compara desfavorablemente a nivel internacional en indicadores de investigación clínica (número de investigadores, patentes, inversión como % del PIB, educación, personal calificado)

OPORTUNIDADES • Altos costos y complejidad del proceso de desarrollo de nuevos medicamentos y presión para las empresas innovadoras sobre tiempos de entrada al mercado. • Estudios Fase I y Fase II. • La investigación preclínica, pues sólo hay dos grandes jugadores (China e India) y dos seguidores (Rusia y Brasil) y las barreras de entrada son mayores (México tiene el potencial en investigadores y regulación; faltan instalaciones y organizaciones que la lleven a cabo) • Investigación por parte de empresas farmacéuticas locales para desarrollar genéricos y biosimilares. • Desarrollo de patentes tanto en investigación (preclínica y clínica) así como en dispositivos médicos. • La nueva regulación para biológicos y biosimilares.

AMENZAS • Otros países, como Brasil están mejorando su legislación con mayor población y calidad similar. • China e India concentran el 34% de la población mundial. Muy atractivos por esa razón para las empresas farmacéuticas. Si mejoran su legislación serán una mayor amenaza. • La percepción internacional de inseguridad limita la inversión en investigación clínica.

RECOMENDACIONES DEL REPORTE jorge. herrera@cecype. com

PRINCIPALES RECOMENDACIONES jorge. herrera@cecype. com

 Nuevos retos nuevas oportunidades
Nuevos retos nuevas oportunidades Estadio azteca mapa virtual
Estadio azteca mapa virtual Pronomes do caso retos
Pronomes do caso retos O que e pronomes
O que e pronomes O que são pronomes
O que são pronomes Los retos escolares en la era digital
Los retos escolares en la era digital Tipos de pronomes
Tipos de pronomes Alberto aibar
Alberto aibar Formula para reponer potasio
Formula para reponer potasio Naturaleza y retos de las escuelas normales
Naturaleza y retos de las escuelas normales Quais são os pronomes pessoais
Quais são os pronomes pessoais Cuales son los retos de la convivencia
Cuales son los retos de la convivencia Uece considere mxyzw
Uece considere mxyzw Caldeiras elétricas vantagens e desvantagens
Caldeiras elétricas vantagens e desvantagens Retos y limites de las autoridades
Retos y limites de las autoridades Retos primarios y secundarios
Retos primarios y secundarios Retos de la lectura digital en mexico
Retos de la lectura digital en mexico Mário cortou a grama
Mário cortou a grama Oportunidades diferenciadas
Oportunidades diferenciadas Mis amenazas
Mis amenazas Cada dia senhor surgem oportunidades
Cada dia senhor surgem oportunidades Oportunidades valencia
Oportunidades valencia Oportunidades y amenazas de un estudiante
Oportunidades y amenazas de un estudiante Matriz de riesgos y oportunidades
Matriz de riesgos y oportunidades Dinamica sobre oportunidades
Dinamica sobre oportunidades