METODY ELEKTROANALITYCZNE POTENCJOMETRIA Potencjometria jest metoda analityczn w

































- Slides: 66

METODY ELEKTROANALITYCZNE



POTENCJOMETRIA

Potencjometria jest metoda analityczną, w której informacje analityczną uzyskuje się na podstawie pomiarów siły elektromotorycznej (SEM) ogniwa elektrochemicznego. Siła elektromotoryczna ogniwa (SEM) – graniczna wartość różnicy potencjałów elektrycznych ogniwa galwanicznego w warunkach, kiedy przez to ogniwo nie płynie prąd. Ogniwo galwaniczne – układ złożony z dwóch półogniw (elektrod) o takiej budowie, że po ich połączeniu przewodnikiem metalicznym na zewnątrz ogniwa następuje przepływ elektronów. Elektroda (półogniwo) – układ złożony z dwóch lub kilku faz przewodzących, z których przynajmniej jedną jest elektrolit, przy czym fazy te graniczą ze sobą tak, że możliwy jest przepływ elektronów lub jonów przez granice międzyfazowe. Potencjał elektrody (względny) – siła elektromotoryczna ogniwa zbudowanego z danej elektrody i elektrody porównawczej.

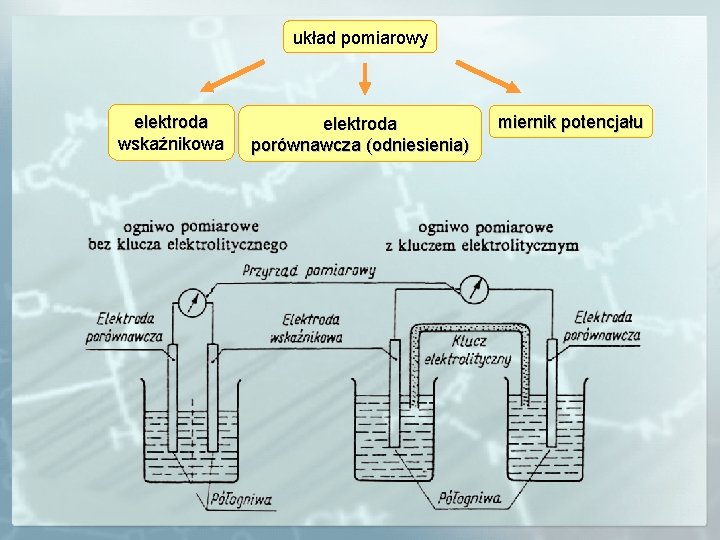
układ pomiarowy elektroda wskaźnikowa elektroda porównawcza (odniesienia) miernik potencjału

W elektrodzie zbudowanej z metalu zanurzonego w roztworze własnych jonów będą zachodziły przeciwstawne procesy elektrodowe: 1. utlenianie metalu i przechodzenie jonów do roztworu M Mz+ + ze 2. redukcja jonów i osadzanie metalu na elektrodzie Mz+ + ze M Reakcje będą przebiegać do momentu, kiedy nie zostanie osiągnięty stan równowagi opisany równaniem: M Mz+ + ze red utl + ze Elektroda wykaże wtedy określony potencjał E, który można opisać równaniem Nernsta: gdzie: Eo – potencjał standardowy układu red-ox, R – stała gazowa (8, 31 J·K-1·mol-1), T – temperatura bezwzględna, z – liczba elektronów biorąca udział w procesie red-ox, F – stała Faradaya 96 485 C·mol-1, autl, ared, a. Mz+, a. M– aktywność formy utlenionej i zredukowanej.

Dla temperatury 25 o. C, po podstawieniu wartości liczbowych stałych fizykochemicznych, uwzględnieniu faktu, że a. M=1 i przejściu na logarytm dziesiętny równanie Nernsta uzyskuje postać: W roztworach rozcieńczonych aktywność jonów równa jest ich stężeniu równowagowemu:

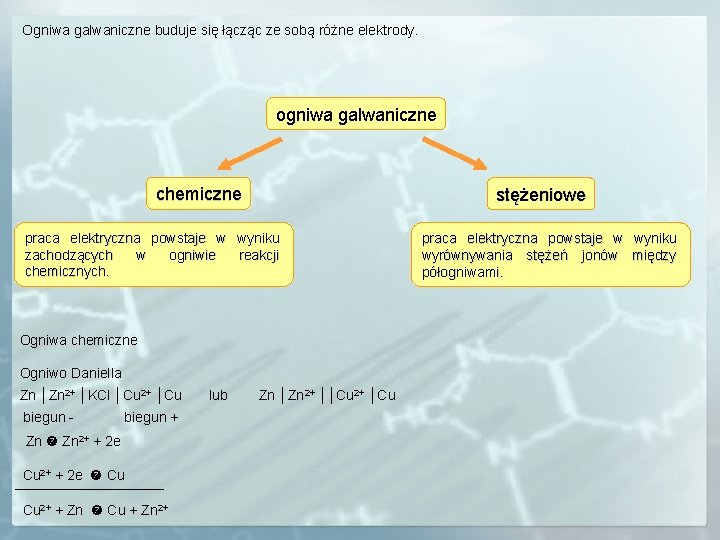
Ogniwa galwaniczne buduje się łącząc ze sobą różne elektrody. ogniwa galwaniczne chemiczne stężeniowe praca elektryczna powstaje w wyniku zachodzących w ogniwie reakcji chemicznych. Ogniwa chemiczne Ogniwo Daniella Zn │Zn 2+ │KCl │Cu 2+ │Cu biegun - biegun + Zn 2+ + 2 e Cu 2+ + 2 e Cu Cu 2+ + Zn Cu + Zn 2+ lub Zn │Zn 2+ ││Cu 2+ │Cu praca elektryczna powstaje w wyniku wyrównywania stężeń jonów między półogniwami.

SEM = Ered – Eutl = E+ - E-

Ogniwa stężeniowe Ag │Ag+ (a 1)│NH 4 NO 3 │Ag+ (a 2)│Ag anoda (-) katoda (+) a 1 < a 2 (a 1) Ag Ag+ + e (a 2) Ag+ + e Ag SEM = Ered – Eutl = Ea 1 – Ea 2

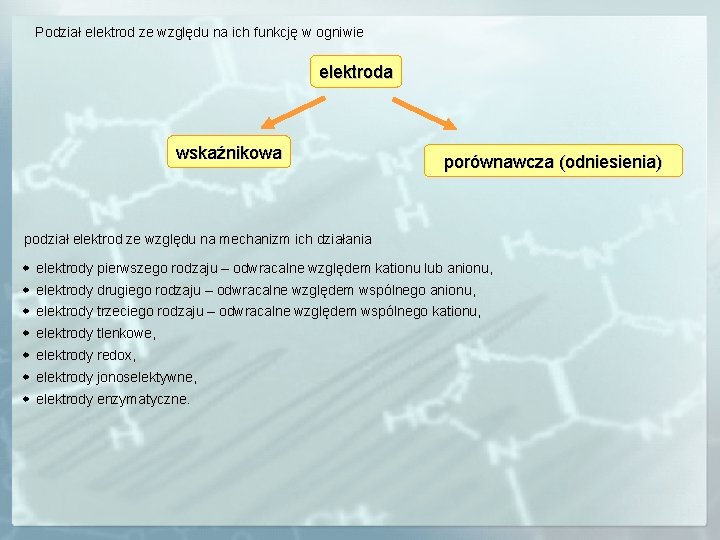
Podział elektrod ze względu na ich funkcję w ogniwie elektroda wskaźnikowa porównawcza (odniesienia) podział elektrod ze względu na mechanizm ich działania elektrody pierwszego rodzaju – odwracalne względem kationu lub anionu, elektrody drugiego rodzaju – odwracalne względem wspólnego anionu, elektrody trzeciego rodzaju – odwracalne względem wspólnego kationu, elektrody tlenkowe, elektrody redox, elektrody jonoselektywne, elektrody enzymatyczne.

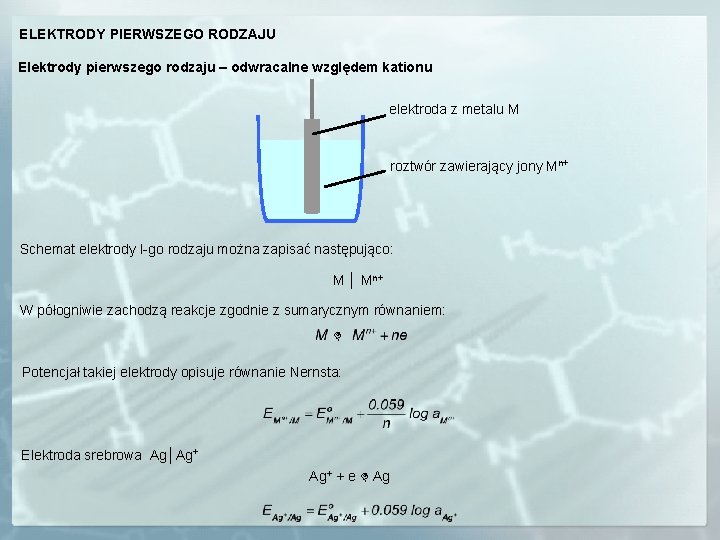
ELEKTRODY PIERWSZEGO RODZAJU Elektrody pierwszego rodzaju – odwracalne względem kationu elektroda z metalu M roztwór zawierający jony Mn+ Schemat elektrody I-go rodzaju można zapisać następująco: M │ Mn+ W półogniwie zachodzą reakcje zgodnie z sumarycznym równaniem: Potencjał takiej elektrody opisuje równanie Nernsta: Elektroda srebrowa Ag│Ag+ + e Ag

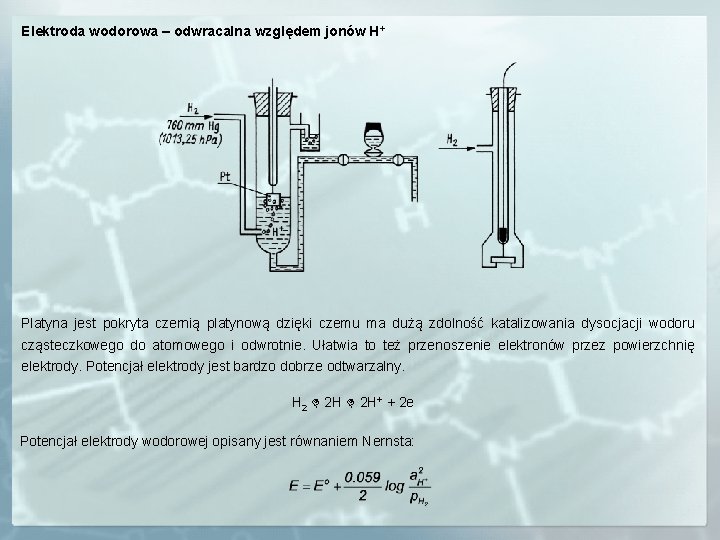
Elektroda wodorowa – odwracalna względem jonów H+ Platyna jest pokryta czernią platynową dzięki czemu ma dużą zdolność katalizowania dysocjacji wodoru cząsteczkowego do atomowego i odwrotnie. Ułatwia to też przenoszenie elektronów przez powierzchnię elektrody. Potencjał elektrody jest bardzo dobrze odtwarzalny. H 2 2 H+ + 2 e Potencjał elektrody wodorowej opisany jest równaniem Nernsta:

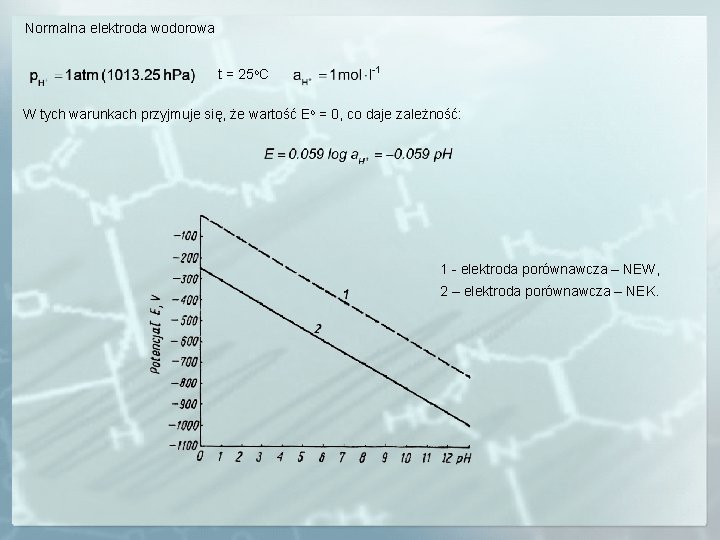
Normalna elektroda wodorowa t = 25 o. C W tych warunkach przyjmuje się, że wartość Eo = 0, co daje zależność: 1 - elektroda porównawcza – NEW, 2 – elektroda porównawcza – NEK.

Zastosowanie elektrody wodorowej: procesy badawcze, bezpośrednie pomiary p. H, sprawdzanie p. H roztworów wzorcowych. Elektrody pierwszego rodzaju odwracalne względem anionu Zasada działanie tego typu elektrod jest podobna jak elektrody wodorowej. Na powierzchni metalu zachodzi przejście gazowego pierwiastka w jony i odwrotnie. elektroda chlorowa Cl 2 + 2 e 2 Clelektroda tlenowa O 2 + 2 H 2 O + 4 e 4 OH-

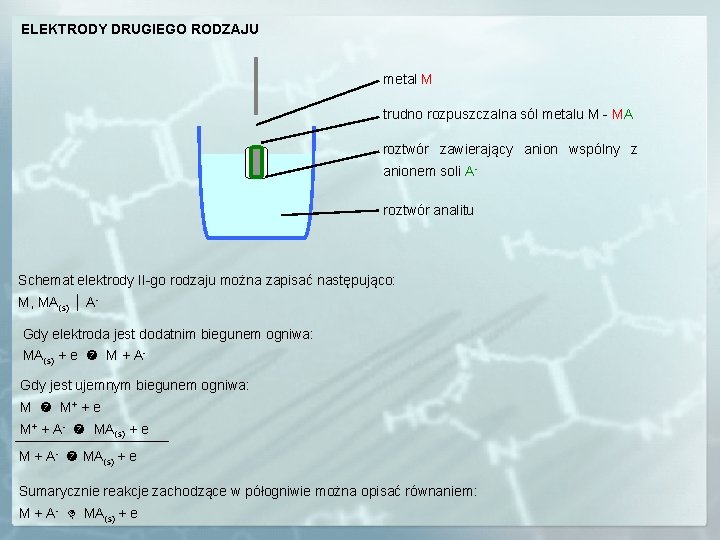
ELEKTRODY DRUGIEGO RODZAJU metal M trudno rozpuszczalna sól metalu M - MA roztwór zawierający anion wspólny z anionem soli Aroztwór analitu Schemat elektrody II-go rodzaju można zapisać następująco: M, MA(s) │ AGdy elektroda jest dodatnim biegunem ogniwa: MA(s) + e M + AGdy jest ujemnym biegunem ogniwa: M M+ + e M+ + A- MA(s) + e M + A- MA(s) + e Sumarycznie reakcje zachodzące w półogniwie można opisać równaniem: M + A- MA(s) + e

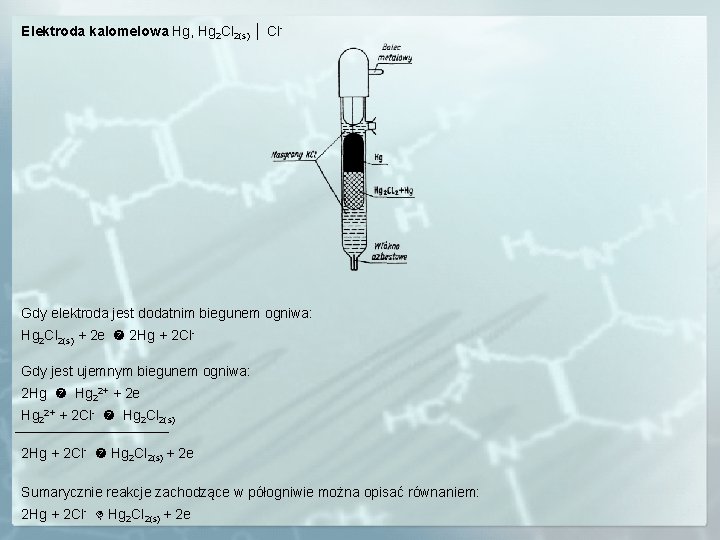
Elektroda kalomelowa Hg, Hg 2 Cl 2(s) │ Cl- Gdy elektroda jest dodatnim biegunem ogniwa: Hg 2 Cl 2(s) + 2 e 2 Hg + 2 Cl. Gdy jest ujemnym biegunem ogniwa: 2 Hg Hg 22+ + 2 e Hg 22+ + 2 Cl- Hg 2 Cl 2(s) 2 Hg + 2 Cl- Hg 2 Cl 2(s) + 2 e Sumarycznie reakcje zachodzące w półogniwie można opisać równaniem: 2 Hg + 2 Cl- Hg 2 Cl 2(s) + 2 e

Potencjał elektrody kalomelowej zależy od aktywności jonów Cl-: Potencjał elektrod drugiego rodzaju zależy od stężenia anionu trudno rozpuszczalnej soli.

Nasycona elektroda kalomelowa (NEK) Schemat NEK można zapisać następująco: Hg, Hg 2 Cl 2(s) │ KCl(nasycony) Gdy elektroda pracuje jako anoda przebiega reakcja: 2 Hg Hg 22+ + 2 e Powstałe jony reagują z jonami chlorkowymi obecnymi w roztworze: Hg 22+ + 2 Cl- Hg 2 Cl 2(s) Pobrane z roztworu jony Cl- uzupełniane są przez rozpuszczenie się pewnej ilości KCl, dzięki czemu ich stężenie ulega zmianie, a co za tym idzie i potencjał elektrody pozostaje niezmienny. Gdy elektroda pracuje jako katoda przebiega reakcja: Hg 2 Cl 2(s) + 2 e 2 Hg + 2 Cl. Do roztworu przechodzi pewna ilość jonów Cl-, powstaje równoważna ilość stałego KCl, dzięki czemu stężenie jonów pozostaje niezmienne, a zatem potencjał elektrody również nie ulega zmianie. Niezależnie czy elektroda będzie pracować jako katoda czy jako anoda jej potencjał będzie niezmienny. Elektroda taka jest stosowana jako elektroda porównawcza w pomiarach potencjometrycznych.

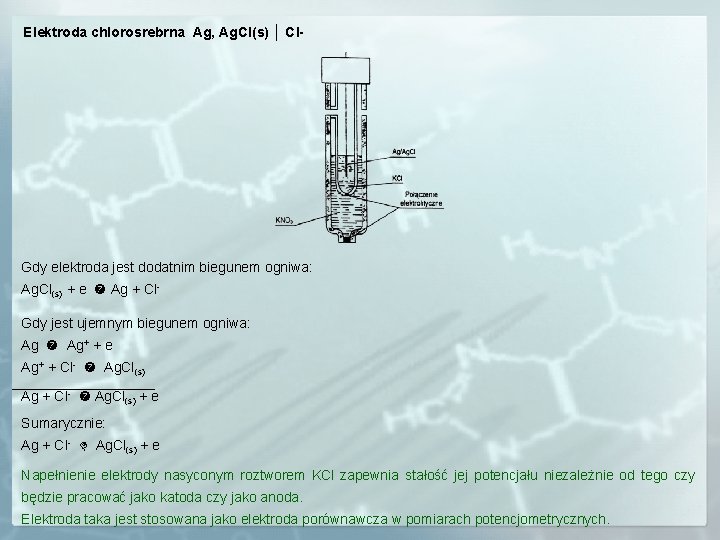
Elektroda chlorosrebrna Ag, Ag. Cl(s) │ Cl- Gdy elektroda jest dodatnim biegunem ogniwa: Ag. Cl(s) + e Ag + Cl. Gdy jest ujemnym biegunem ogniwa: Ag Ag+ + e Ag+ + Cl- Ag. Cl(s) Ag + Cl- Ag. Cl(s) + e Sumarycznie: Ag + Cl- Ag. Cl(s) + e Napełnienie elektrody nasyconym roztworem KCl zapewnia stałość jej potencjału niezależnie od tego czy będzie pracować jako katoda czy jako anoda. Elektroda taka jest stosowana jako elektroda porównawcza w pomiarach potencjometrycznych.

Elektroda siarczanowo-rtęciowa Schemat elektrody można zapisać następująco: Hg, Hg 2 SO 4(s) │ SO 42 Sumarycznie reakcje zachodzące w półogniwie można opisać równaniem: 2 Hg + SO 42 - Hg 2 SO 4(s) + 2 e Napełnienie elektrody nasyconym roztworem K 2 SO 4 zapewnia stałość jej potencjału niezależnie od tego czy będzie pracować jako katoda czy jako anoda. Elektroda taka jest stosowana jako elektroda porównawcza w pomiarach potencjometrycznych.

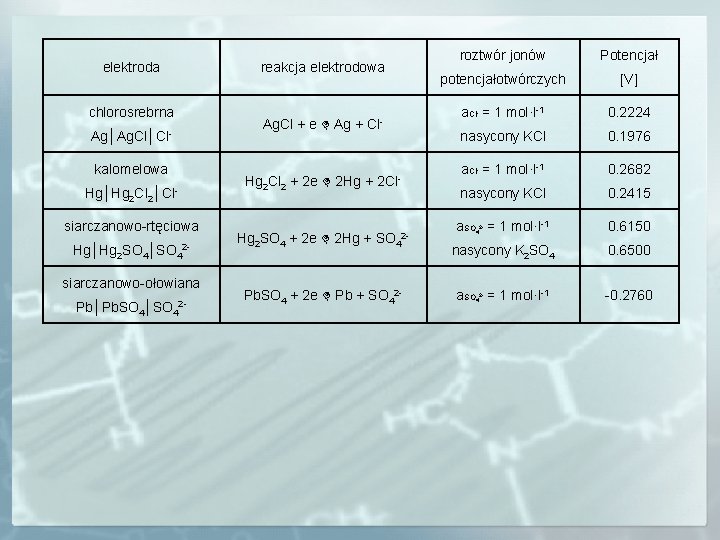
elektroda chlorosrebrna Ag│Ag. Cl│Clkalomelowa Hg│Hg 2 Cl 2│Clsiarczanowo-rtęciowa Hg│Hg 2 SO 4│SO 42 siarczanowo-ołowiana Pb│Pb. SO 4│SO 42 - reakcja elektrodowa roztwór jonów Potencjał potencjałotwórczych [V] a. Cl = 1 mol·l-1 0. 2224 nasycony KCl 0. 1976 a. Cl = 1 mol·l-1 0. 2682 nasycony KCl 0. 2415 a. SO = 1 mol·l-1 0. 6150 nasycony K 2 SO 4 0. 6500 a. SO = 1 mol·l-1 -0. 2760 - Ag. Cl + e Ag + Cl- - Hg 2 Cl 2 + 2 e 2 Hg + Hg 2 SO 4 + 2 e 2 Hg + 2 Cl- SO 42 - Pb. SO 4 + 2 e Pb + SO 42 - 24 24

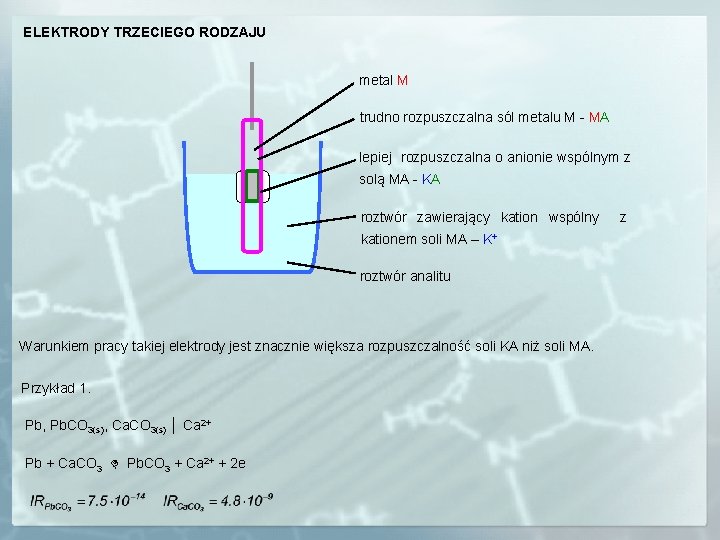
ELEKTRODY TRZECIEGO RODZAJU metal M trudno rozpuszczalna sól metalu M - MA lepiej rozpuszczalna o anionie wspólnym z solą MA - KA roztwór zawierający kation wspólny kationem soli MA – K+ roztwór analitu Warunkiem pracy takiej elektrody jest znacznie większa rozpuszczalność soli KA niż soli MA. Przykład 1. Pb, Pb. CO 3(s), Ca. CO 3(s) │ Ca 2+ Pb + Ca. CO 3 Pb. CO 3 + Ca 2+ + 2 e z

Potencjał elektrod trzeciego rodzaju zależy od stężenia kationu wspólnego z kationem lepiej rozpuszczalnej soli. Przykład 2. Pb, Pb. C 2 O 4(S), Ca. C 2 O 4(S) │ Ca 2+ Pb + Ca. C 2 O 4 Pb. C 2 O 4 + Ca 2+ + 2 e

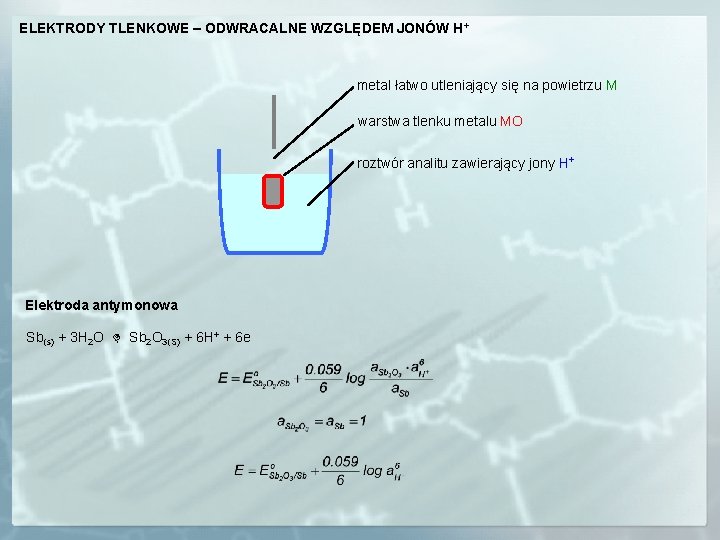
ELEKTRODY TLENKOWE – ODWRACALNE WZGLĘDEM JONÓW H+ metal łatwo utleniający się na powietrzu M warstwa tlenku metalu MO roztwór analitu zawierający jony H+ Elektroda antymonowa Sb(s) + 3 H 2 O Sb 2 O 3(S) + 6 H+ + 6 e

Elektroda antymonowa: może być stosowana w roztworach o p. H 3 -10, niezbyt dobrze odtwarzalny potencjał elektrody zależny od przygotowania powierzchni elektrody przed pomiarem, składu roztworu i szybkości mieszania, nie nadaje się do bezpośrednich precyzyjnych pomiarów p. H, dobrze spełnia swoje zadanie w miareczkowaniach potencjometrycznych (pomiar zmian potencjału), duża wytrzymałość mechaniczna elektrody daje możliwość jej wykorzystania w rutynowych pomiarach w przemyśle. Elektroda bizmutowa Bi(s) + 3 H 2 O Bi 2 O 3(S) + 6 H+ + 6 e Posiada prostoliniowa charakterystykę w zakresie p. H 7 -14 co daje możliwość jej wykorzystania w oznaczeniach w próbkach alkalicznych. Elektroda tantalowa i niobowa Zakres stosowania tych elektrod to p. H 1 -13.

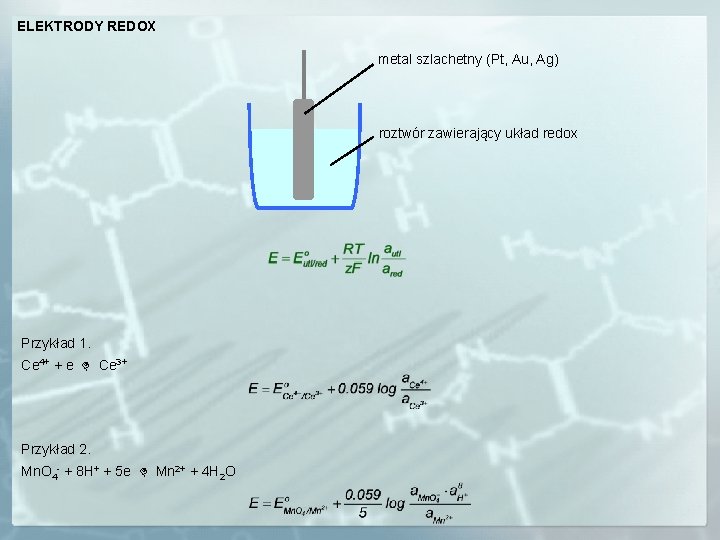
ELEKTRODY REDOX metal szlachetny (Pt, Au, Ag) roztwór zawierający układ redox Przykład 1. Ce 4+ + e Ce 3+ Przykład 2. Mn. O 4 - + 8 H+ + 5 e Mn 2+ + 4 H 2 O

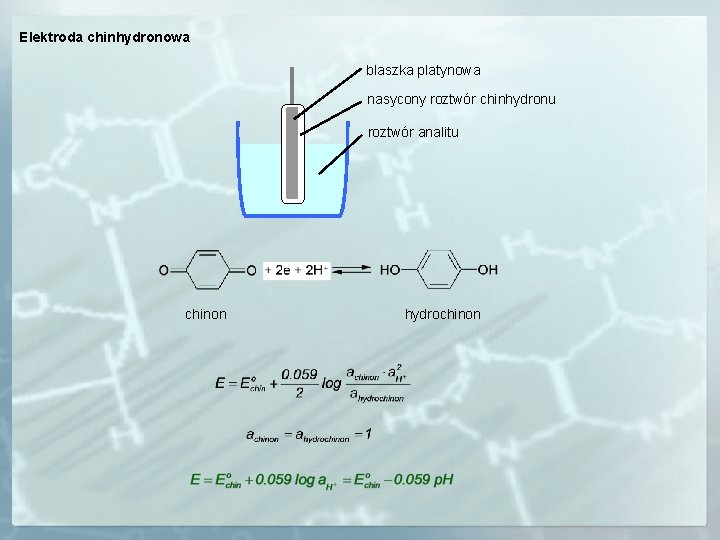
Elektroda chinhydronowa blaszka platynowa nasycony roztwór chinhydronu roztwór analitu chinon hydrochinon

MEMBRANOWE ELEKTRODY JONOSELEKTYWNE

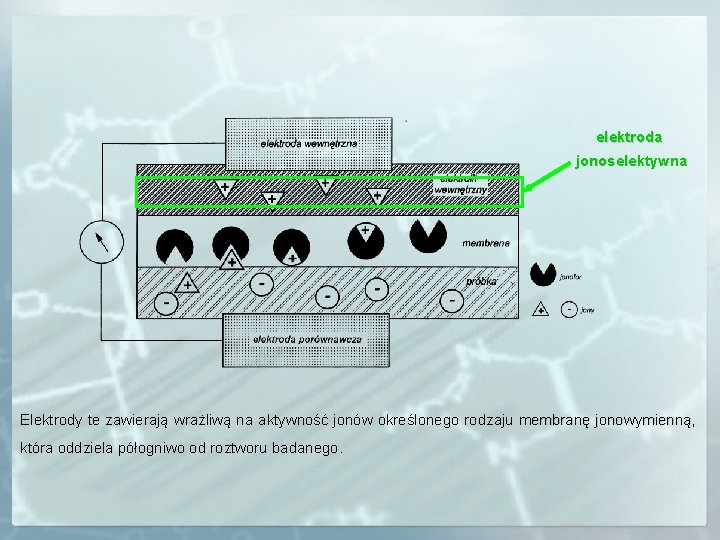
elektroda jonoselektywna Elektrody te zawierają wrażliwą na aktywność jonów określonego rodzaju membranę jonowymienną, jonowymienną która oddziela półogniwo od roztworu badanego.

MEMBRANA JONOSELEKTYWNA SKŁAD MEMBRANY jonofor (ionophore, ion carrier) – obojętny lub obdarzony ładunkiem związek lipofilowy, który odwracalnie wiąże jony i transportuje je przez membranę, sól lipofilowa poprawiająca parametry membrany, plastyfikator (rozpuszczalnik) – ok. 65%, PCV – ok. 30%. W zależności od udziału jonów w procesie przeniesienia ładunku można podzielić granice międzyfazowe na: selektywnie przepuszczalne – przechodzi tylko jeden rodzaj jonów, półprzepuszczalne – jeden typ jonów nie może przejść przez granicę, nieselektywne – każdy rodzaj jonów może przejść przez granicę.

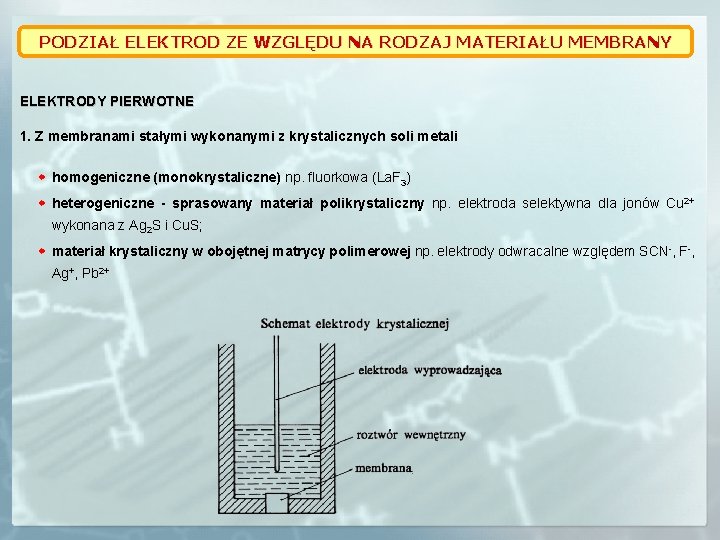
PODZIAŁ ELEKTROD ZE WZGLĘDU NA RODZAJ MATERIAŁU MEMBRANY ELEKTRODY PIERWOTNE 1. Z membranami stałymi wykonanymi z krystalicznych soli metali homogeniczne (monokrystaliczne) np. fluorkowa (La. F 3) heterogeniczne - sprasowany materiał polikrystaliczny np. elektroda selektywna dla jonów Cu 2+ wykonana z Ag 2 S i Cu. S; materiał krystaliczny w obojętnej matrycy polimerowej np. elektrody odwracalne względem SCN-, F-, Ag+, Pb 2+



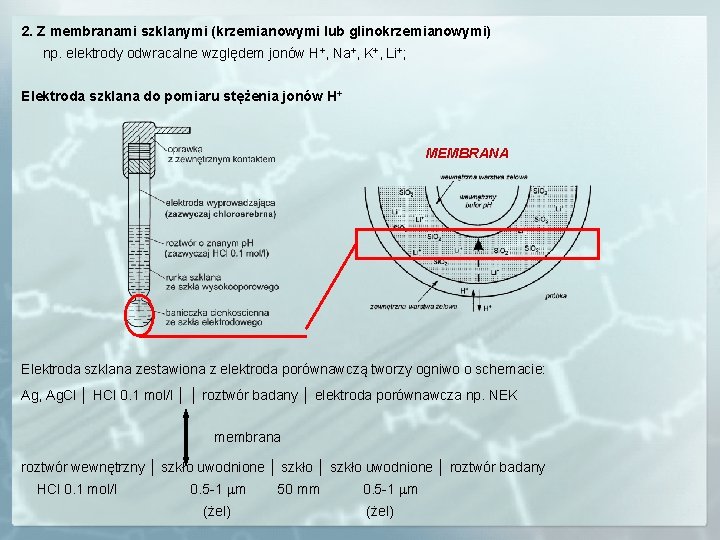
2. Z membranami szklanymi (krzemianowymi lub glinokrzemianowymi) np. elektrody odwracalne względem jonów H+, Na+, K+, Li+; Elektroda szklana do pomiaru stężenia jonów H+ MEMBRANA Elektroda szklana zestawiona z elektroda porównawczą tworzy ogniwo o schemacie: Ag, Ag. Cl │ HCl 0. 1 mol/l │ │ roztwór badany │ elektroda porównawcza np. NEK membrana roztwór wewnętrzny │ szkło uwodnione │ roztwór badany HCl 0. 1 mol/l 0. 5 -1 mm (żel) 50 mm 0. 5 -1 mm (żel)

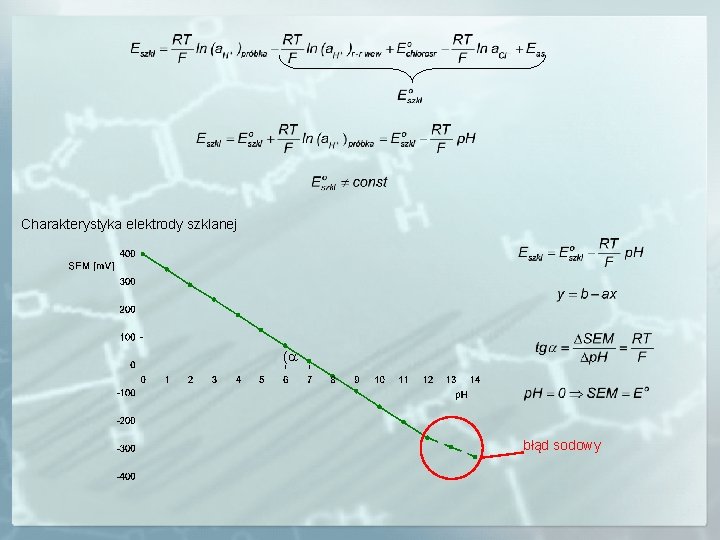
Potencjał membrany szklanej jest różnicą potencjałów międzyfazowych: 1. roztwór próbki – zewnętrzna warstwa szkła uwodnionego, 2. wewnętrzna warstwa szkła uwodnionego – wewnętrzny roztwór o znanym p. H. Całkowity potencjał elektrody szklanej zależy od: potencjału membrany Emembrany, potencjału elektrody wyprowadzającej Ewyp – może być stosowana elektroda chlorosrebrna, kalomelowa bądź chinhydronowa, potencjału asymetrii Eas – różnica potencjałów związana z różnicami we właściwościach obu stron membrany. Dla chlorosrebrnej elektrody wyprowadzającej otrzymamy zależność:

Charakterystyka elektrody szklanej ( błąd sodowy

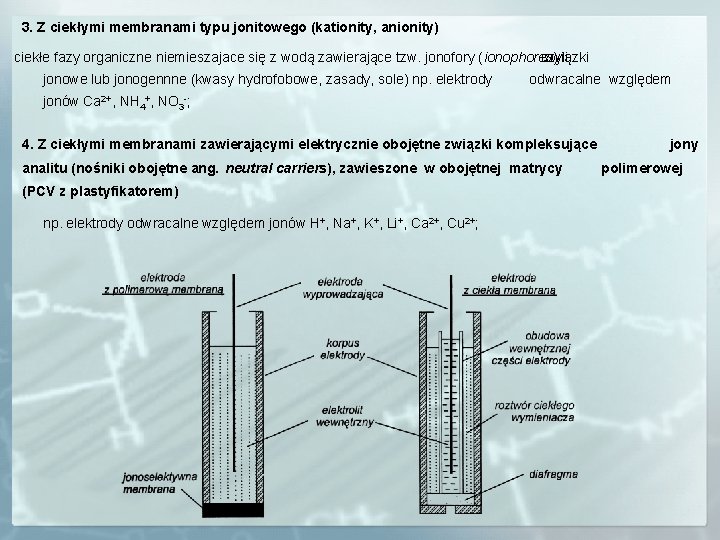
3. Z ciekłymi membranami typu jonitowego (kationity, anionity) ciekłe fazy organiczne niemieszajace się z wodą zawierające tzw. jonofory (ionophores) czyli związki jonowe lub jonogennne (kwasy hydrofobowe, zasady, sole) np. elektrody odwracalne względem jonów Ca 2+, NH 4+, NO 3 -; 4. Z ciekłymi membranami zawierającymi elektrycznie obojętne związki kompleksujące analitu (nośniki obojętne ang. neutral carriers), zawieszone w obojętnej matrycy (PCV z plastyfikatorem) np. elektrody odwracalne względem jonów H+, Na+, K+, Li+, Ca 2+, Cu 2+; jony polimerowej



SELEKTYWNE ELEKTRODY GAZOWE Oznaczany gaz dyfunduje przez półprzepuszczalną, hydrofobową membranę do roztworu elektrolitu wewnątrz elektrody powodując zmianę równowagi jonowej. Sygnałem analitycznym jest różnica potencjałów wywołana zmianą aktywności odpowiedniego jonu z elektrolitu wewnętrznego, będąca funkcją cząstkowego ciśnienia oznaczanego gazu w próbce.


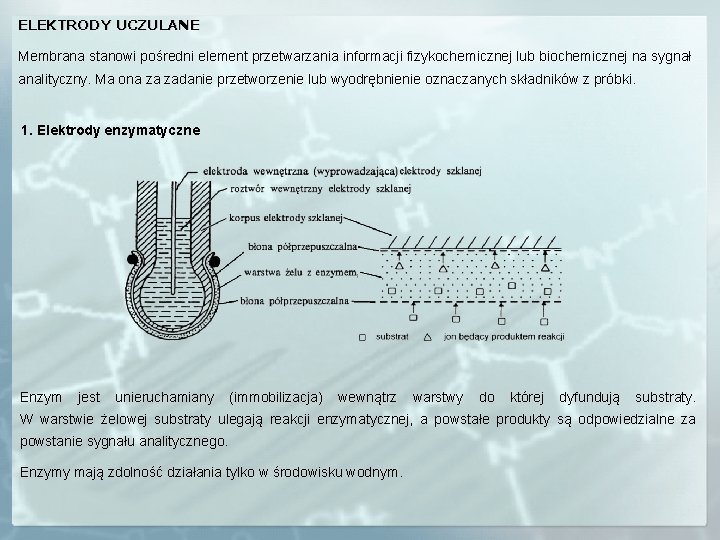
ELEKTRODY UCZULANE Membrana stanowi pośredni element przetwarzania informacji fizykochemicznej lub biochemicznej na sygnał analityczny. Ma ona za zadanie przetworzenie lub wyodrębnienie oznaczanych składników z próbki. 1. Elektrody enzymatyczne Enzym jest unieruchamiany (immobilizacja) wewnątrz warstwy do której dyfundują substraty. W warstwie żelowej substraty ulegają reakcji enzymatycznej, a powstałe produkty są odpowiedzialne za powstanie sygnału analitycznego. Enzymy mają zdolność działania tylko w środowisku wodnym.

CO(NH 2)2 + H 2 O + 2 H+ substrat mocznik C 6 H 12 O 6 + I 2 + 3 Na. OH substrat glukoza ureaza CO 2 + 2 NH 4+ produkty oksydaza glukozowa C 5 H 11 O 5 COONa + 2 H 2 O + 2 Na+ + 2 Iprodukty Odpowiednia elektroda jonoselektywna reaguje zmianą potencjału na jony będące produktem reakcji enzymatycznej

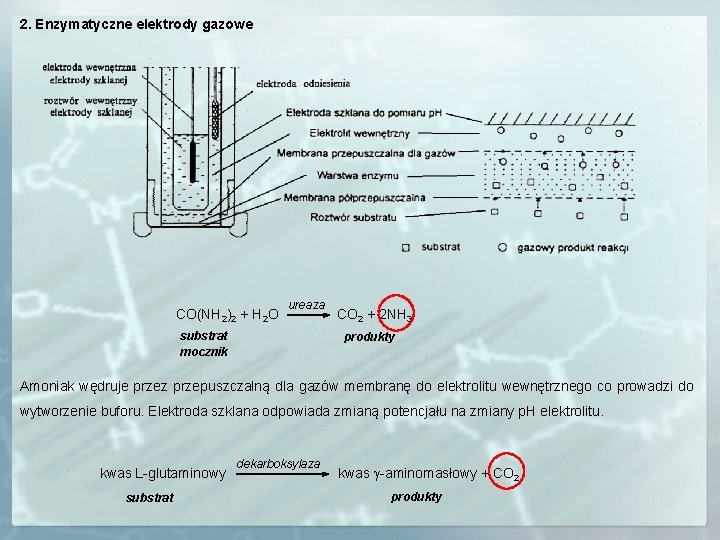
2. Enzymatyczne elektrody gazowe CO(NH 2)2 + H 2 O ureaza substrat mocznik CO 2 + 2 NH 3 produkty Amoniak wędruje przez przepuszczalną dla gazów membranę do elektrolitu wewnętrznego co prowadzi do wytworzenie buforu. Elektroda szklana odpowiada zmianą potencjału na zmiany p. H elektrolitu. kwas L-glutaminowy substrat dekarboksylaza kwas g-aminomasłowy + CO 2 produkty

metody potencjometryczne bezpośrednie miareczkowanie potencjometryczne oznaczanie analitu na podstawie pomiaru SEM zmian SEM ogniwa, podczas dodawania ogniwa złożonego wskaźnikowej i porównawczej z elektrody odczynnika miareczkującego

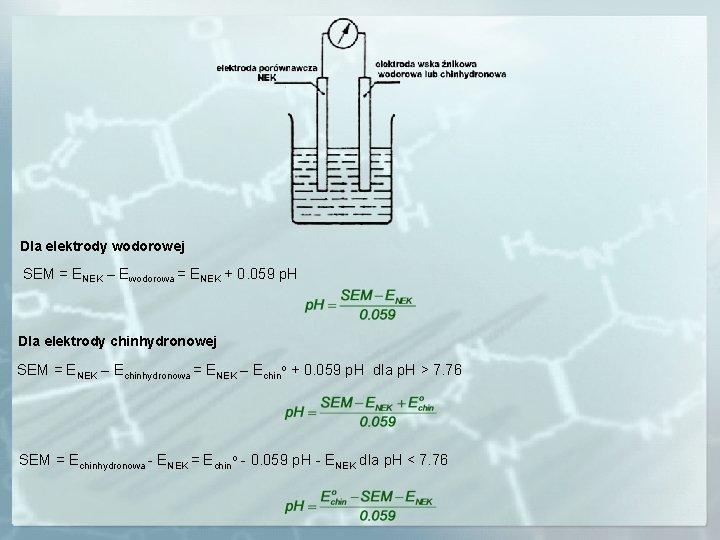
PEHAMETRIA – WYZNACZANIE p. H ROZTWORÓW Pehametria pozwala w sposób prosty, dokładny i nieinwazyjny wyznaczyć stężenie jonów H+ w różnego rodzaju analitach. Wyznaczenie p. H wymaga zastosowania jako elektrody wskaźnikowej elektrody, której potencjał zależy od stężenia jonów H+. BEZPOŚREDNIE WYZNACZANIE p. H ROZTWORÓW Potencjał elektrody wskaźnikowej musi zależeć bezpośrednio od stężenia jonów H+. Warunek ten spełniają: elektroda wodorowa, elektroda chinhydronowa.

Dla elektrody wodorowej SEM = ENEK – Ewodorowa = ENEK + 0. 059 p. H Dla elektrody chinhydronowej SEM = ENEK – Echinhydronowa = ENEK – Echino + 0. 059 p. H dla p. H > 7. 76 SEM = Echinhydronowa - ENEK = Echino - 0. 059 p. H - ENEK dla p. H < 7. 76

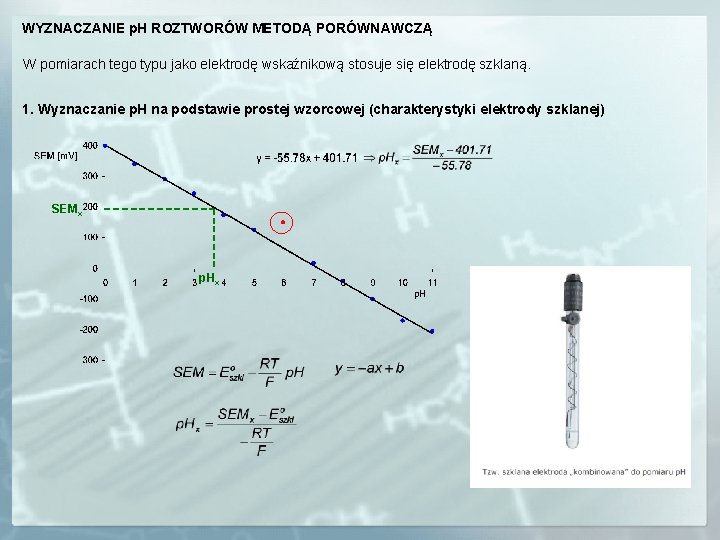
WYZNACZANIE p. H ROZTWORÓW METODĄ PORÓWNAWCZĄ W pomiarach tego typu jako elektrodę wskaźnikową stosuje się elektrodę szklaną. 1. Wyznaczanie p. H na podstawie prostej wzorcowej (charakterystyki elektrody szklanej) SEMx p. Hx

2. Kalibracja układu na dwa roztwory wzorcowe Wzorcami w pehametrii są roztwory buforowe o p. H wyznaczonym z dużą dokładnością.

3. Wyznaczanie p. H metodą porównania ze wzorcem – kalibracja układu na jeden roztwór buforowy Wynik jest tym dokładniejszy im wyrażenie ma wartość bliższą Wady metody 2 i 3: niemożność wykrycia błędu związanego z p. H buforów wzorcowych odbiegającym od deklarowanego, możliwość wystąpienia błędów przypadkowych.

MIARECZKOWANIE POTENCJOMETRYCZNE Miareczkowanie to polega na pomiarze SEM ogniwa zbudowanego z elektrody wskaźnikowej i elektrody odniesienia po dodaniu kolejnych porcji titranta. Inaczej jest to miareczkowanie klasyczne z potencjometryczną detekcją punktu koncowego. Warunkiem przeprowadzenia miareczkowania potencjometrycznego jest dobranie elektrody wskaźnikowej, której potencjał zależy od stężenia któregoś jonów biorących udział w oznaczeniu. Typy miareczkowań potencjometrycznych miareczkowanie alkacymetryczne, miareczkowanie strąceniowe, miareczkowanie redox, miareczkowanie kompleksometryczne. Sposoby przeprowadzenia miareczkowania potencjometrycznego miareczkowanie klasyczne, miareczkowanie do punktu zerowego, miareczkowanie różnicowe.

Miareczkowanie alkacymetryczne W miareczkowaniu tego typu zmienia się stężenie jonów H+. Jako elektrodę wskaźnikową można więc zastosować elektrodę, której potencjał zależy od stężenia tych jonów. Najczęściej stosuje się elektrodę szklaną. Miareczkowanie dwóch kwasów bądź zasad jest możliwe jeżeli różnią się one od siebie stałymi dysocjacji. Miareczkowanie strąceniowe Dobór elektrody zależy od rodzaju jonów, które biorą udział w miareczkowaniu. Miareczkowanie dwóch jonów obok siebie jeżeli produkty ich reakcji z titrantem różnią się od siebie iloczynami rozpuszczalności. Miareczkowanie redox Jako elektrodę wskaźnikową stosuje się elektrodę platynową. Potencjał tej elektrody zależy od logarytmu z ilorazu stężeń formy utlenionej i zredukowanej układu redox zgodnie z równaniem Nernsta.

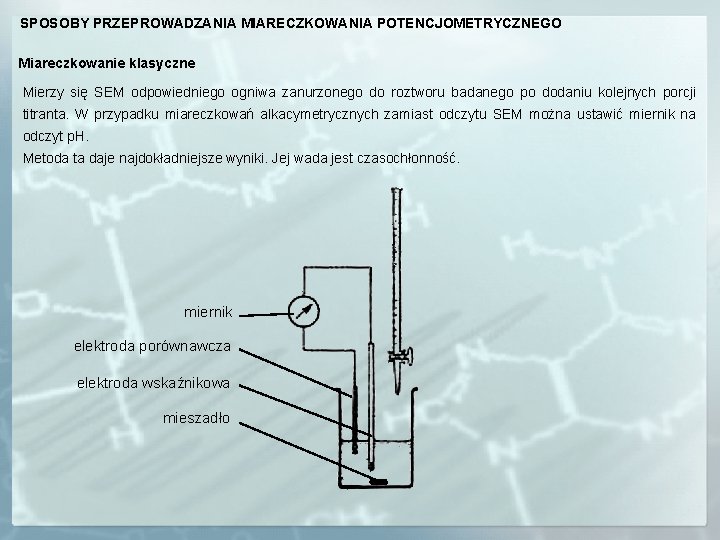
SPOSOBY PRZEPROWADZANIA MIARECZKOWANIA POTENCJOMETRYCZNEGO Miareczkowanie klasyczne Mierzy się SEM odpowiedniego ogniwa zanurzonego do roztworu badanego po dodaniu kolejnych porcji titranta. W przypadku miareczkowań alkacymetrycznych zamiast odczytu SEM można ustawić miernik na odczyt p. H. Metoda ta daje najdokładniejsze wyniki. Jej wada jest czasochłonność. miernik elektroda porównawcza elektroda wskaźnikowa mieszadło

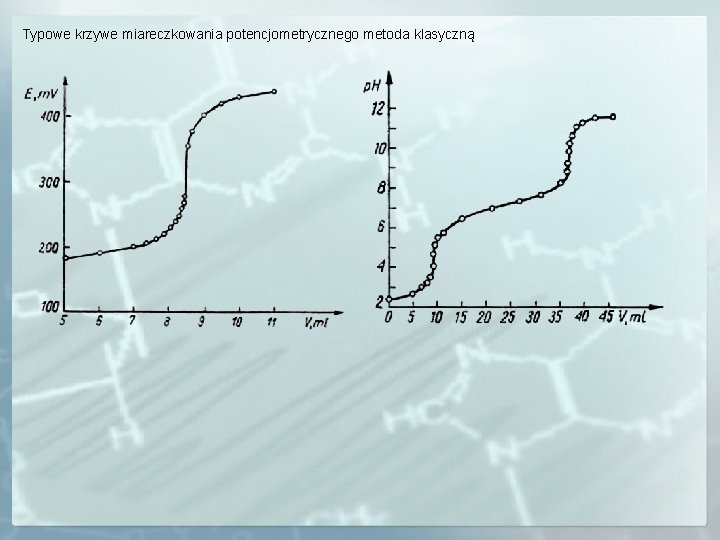
Typowe krzywe miareczkowania potencjometrycznego metoda klasyczną

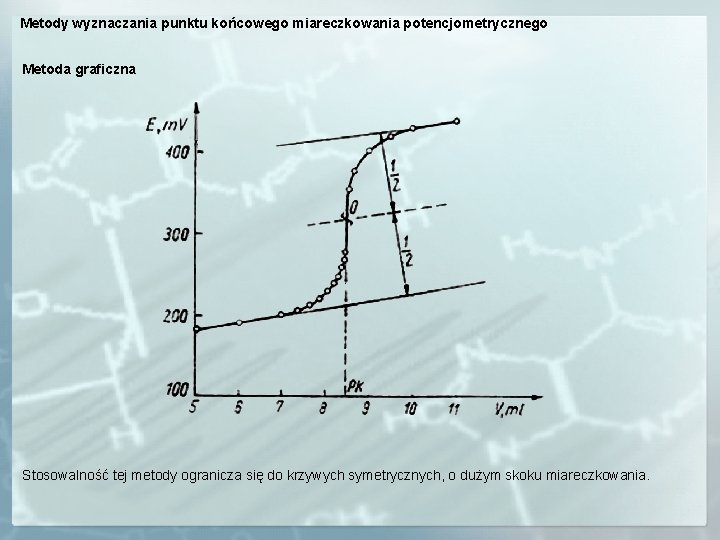
Metody wyznaczania punktu końcowego miareczkowania potencjometrycznego Metoda graficzna Stosowalność tej metody ogranicza się do krzywych symetrycznych, o dużym skoku miareczkowania.

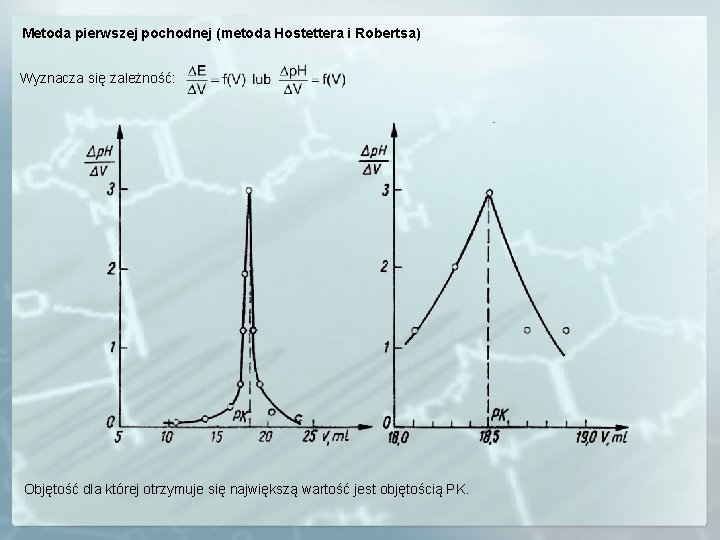
Metoda pierwszej pochodnej (metoda Hostettera i Robertsa) Wyznacza się zależność: Objętość dla której otrzymuje się największą wartość jest objętością PK.

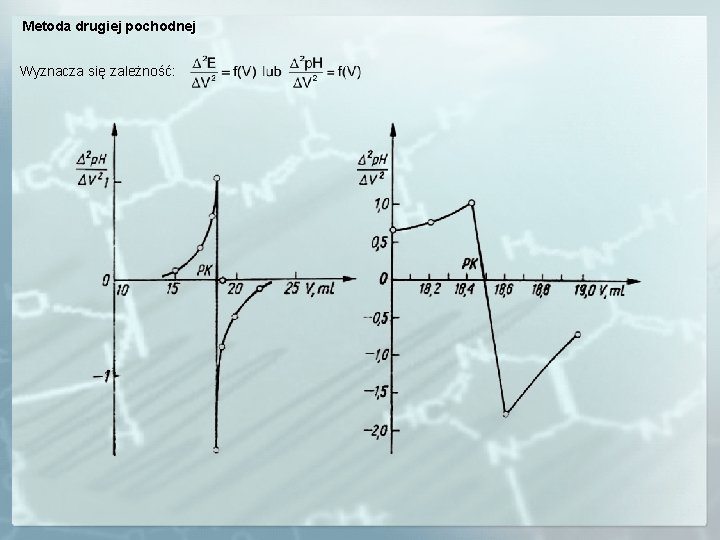
Metoda drugiej pochodnej Wyznacza się zależność:

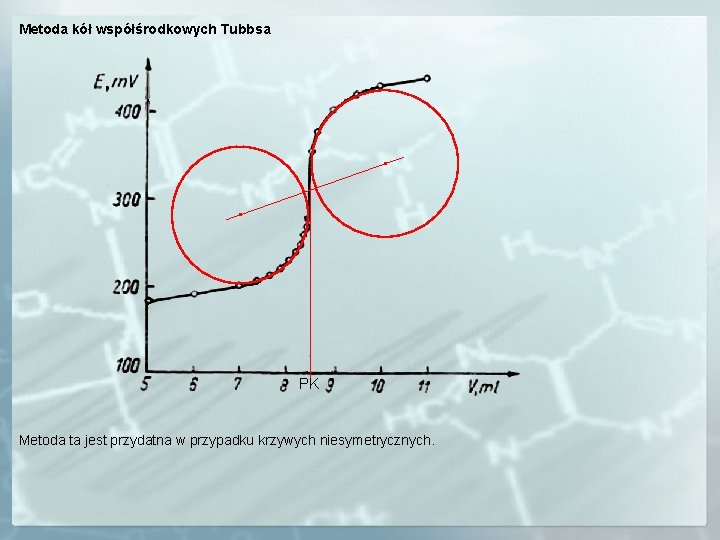
Metoda kół współśrodkowych Tubbsa PK Metoda ta jest przydatna w przypadku krzywych niesymetrycznych.

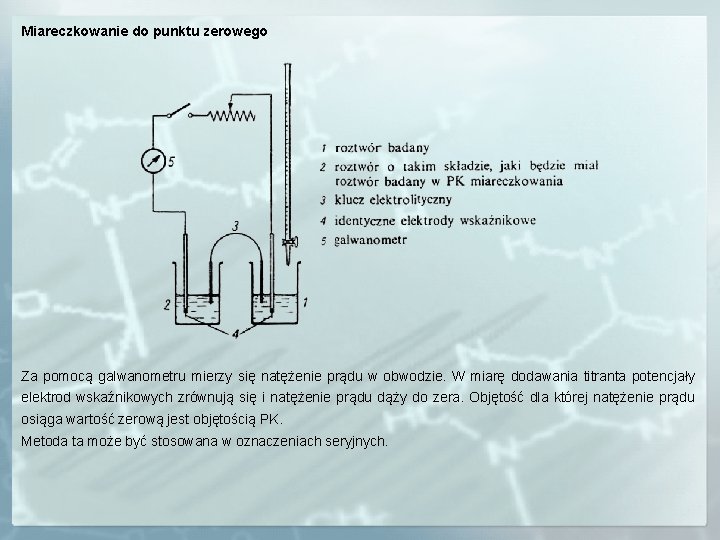
Miareczkowanie do punktu zerowego Za pomocą galwanometru mierzy się natężenie prądu w obwodzie. W miarę dodawania titranta potencjały elektrod wskaźnikowych zrównują się i natężenie prądu dąży do zera. Objętość dla której natężenie prądu osiąga wartość zerową jest objętością PK. Metoda ta może być stosowana w oznaczeniach seryjnych.

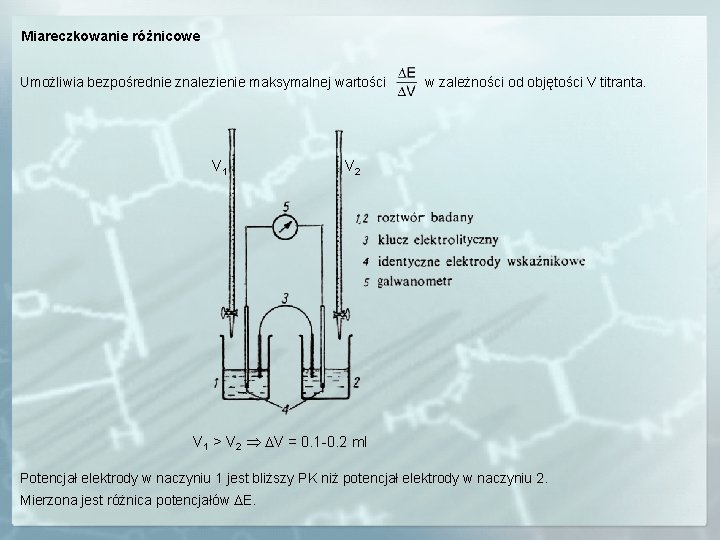
Miareczkowanie różnicowe Umożliwia bezpośrednie znalezienie maksymalnej wartości V 1 w zależności od objętości V titranta. V 2 V 1 > V 2 DV = 0. 1 -0. 2 ml Potencjał elektrody w naczyniu 1 jest bliższy PK niż potencjał elektrody w naczyniu 2. Mierzona jest różnica potencjałów DE.

WYZNACZANIE STAŁYCH FIZYKOCHEMICZNYCH Wyznaczanie stałej dysocjacji pehametryczne W roztworze dowolnego słabego kwasu HA ustala się stan równowagi opisany równaniem: HA H+ + AKtóry można opisać stałą równowagi zgodnie z równaniem: [H+] = [A-] Wyznacza się stężenie jonów H+ dla roztworu kwasu o znanym stężeniu.

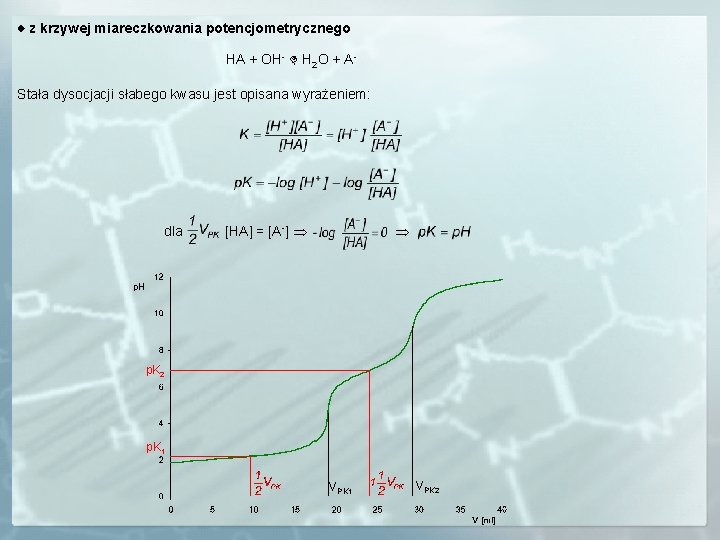
z krzywej miareczkowania potencjometrycznego HA + OH- H 2 O + AStała dysocjacji słabego kwasu jest opisana wyrażeniem: dla [HA] = [A-] p. K 2 p. K 1 VPK 2

Wyznaczanie iloczynu rozpuszczalności Trudno rozpuszczalna sól KA w wodzie dysocjuje na jony zgodnie z równaniem: KA K+ + AStężenie jonów obecnych w roztworze opisuje iloczyn rozpuszczalności: Jeżeli mamy ogniwo stężeniowe: (-) Ag │Ag. Clnasycony, Cl- ││Ag+ │Ag (+) (a 1) Ag Ag+ + e (a 2) SEM = Ea 2 – Ea 1 Ag+ + e Ag

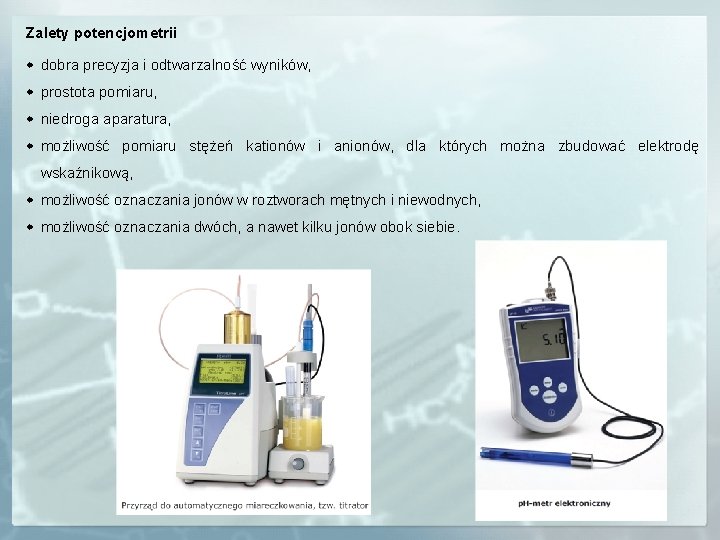
Zalety potencjometrii dobra precyzja i odtwarzalność wyników, prostota pomiaru, niedroga aparatura, możliwość pomiaru stężeń kationów i anionów, dla których można zbudować elektrodę wskaźnikową, możliwość oznaczania jonów w roztworach mętnych i niewodnych, możliwość oznaczania dwóch, a nawet kilku jonów obok siebie.
 Potencjometria
Potencjometria Jak ożywczy deszcz duchu święty przyjdź
Jak ożywczy deszcz duchu święty przyjdź Kody barwne stosowane w miejscu pracy to
Kody barwne stosowane w miejscu pracy to Matematyka jest jak kurz
Matematyka jest jak kurz Jaké metody používáme k odchytu vodních živočichů
Jaké metody používáme k odchytu vodních živočichů Heurystyczne metody prognozowania
Heurystyczne metody prognozowania Techniki efektywnego uczenia się prezentacja
Techniki efektywnego uczenia się prezentacja Metody badawcze w prawoznawstwie
Metody badawcze w prawoznawstwie Metody dyscyplinowania uczniów
Metody dyscyplinowania uczniów Spektrofluorymetr schemat
Spektrofluorymetr schemat Metody klasyfikacji danych
Metody klasyfikacji danych Metody radzenia sobie ze stresem psychologia
Metody radzenia sobie ze stresem psychologia Metody historyczne
Metody historyczne Pirometr fotoelektryczny
Pirometr fotoelektryczny Metody zarządzania ryzykiem walutowym w przedsiębiorstwie
Metody zarządzania ryzykiem walutowym w przedsiębiorstwie Talerz do podawania dań zasadniczych
Talerz do podawania dań zasadniczych Metody dyscyplinowania uczniów
Metody dyscyplinowania uczniów Metody aktywizujące przykłady
Metody aktywizujące przykłady Nefelometria i turbidymetria
Nefelometria i turbidymetria Trzy metody otrzymywania soli
Trzy metody otrzymywania soli Metody doboru pracowników
Metody doboru pracowników Semilongitudinální výzkum
Semilongitudinální výzkum Pedagogická diagnostika vzor
Pedagogická diagnostika vzor Metody optyczne
Metody optyczne Planowanie zatrudnienia
Planowanie zatrudnienia Anna zuch
Anna zuch Metoda rybi szkielet
Metoda rybi szkielet Biologiczne utrwalanie żywności
Biologiczne utrwalanie żywności Mapa pojeciowa
Mapa pojeciowa Metody jakościowe
Metody jakościowe Metody szybkiego uczenia się
Metody szybkiego uczenia się Metody aktywizujące podział
Metody aktywizujące podział Metody sieciowe
Metody sieciowe Drp ii
Drp ii Metody szacowania ryzyka
Metody szacowania ryzyka Stozek dale'a
Stozek dale'a Czujnik magnetosprężysty
Czujnik magnetosprężysty Metody utrwalania żywności
Metody utrwalania żywności Metody numeryczne
Metody numeryczne Graficzne metody prezentacji danych
Graficzne metody prezentacji danych Metody nauczania wg okonia
Metody nauczania wg okonia Główny harmonogram produkcji
Główny harmonogram produkcji Forma strumieniowa wf
Forma strumieniowa wf Weryfikacja części
Weryfikacja części Parametry retencyjne
Parametry retencyjne Tradycyjne metody nauczania
Tradycyjne metody nauczania Odimienna metoda nauki czytania ireny majchrzak prezentacja
Odimienna metoda nauki czytania ireny majchrzak prezentacja Janusz korczak
Janusz korczak Interaktywne metody nauczania
Interaktywne metody nauczania Metody, techniki i narzędzia badawcze
Metody, techniki i narzędzia badawcze Metaplan przykład
Metaplan przykład Metody pomiaru bezrobocia
Metody pomiaru bezrobocia Metódy nácviku čítania
Metódy nácviku čítania Metody pomiaru bezrobocia
Metody pomiaru bezrobocia Metody badawcze w psychologii
Metody badawcze w psychologii Fotografia dnia roboczego przykłady
Fotografia dnia roboczego przykłady Metodą ruchowej ekspresji twórczej przykłady
Metodą ruchowej ekspresji twórczej przykłady Metody kinezioterapie
Metody kinezioterapie Metoda fizyczna spulchniania ciast
Metoda fizyczna spulchniania ciast Stres karta pracy
Stres karta pracy Elektrografické vyšetřovací metody
Elektrografické vyšetřovací metody Wyobrażenia surogatowe
Wyobrażenia surogatowe Metody aktywizujące podział
Metody aktywizujące podział Oznaczanie białka metodą lowry'ego
Oznaczanie białka metodą lowry'ego Vuky
Vuky Rzeby
Rzeby Tlenek metalu + woda = wodorotlenek
Tlenek metalu + woda = wodorotlenek