METODY ELEKTROCHEMICZNE POTENCJOMETRIA KONDUKTOMETRIA KULOMETRIA POLAROGRAFIA WOLTAMPEROMETRIA AMPEROMETRIA











- Slides: 15

METODY ELEKTROCHEMICZNE POTENCJOMETRIA, KONDUKTOMETRIA, KULOMETRIA, POLAROGRAFIA, WOLTAMPEROMETRIA, AMPEROMETRIA

AMPEROMETRIA

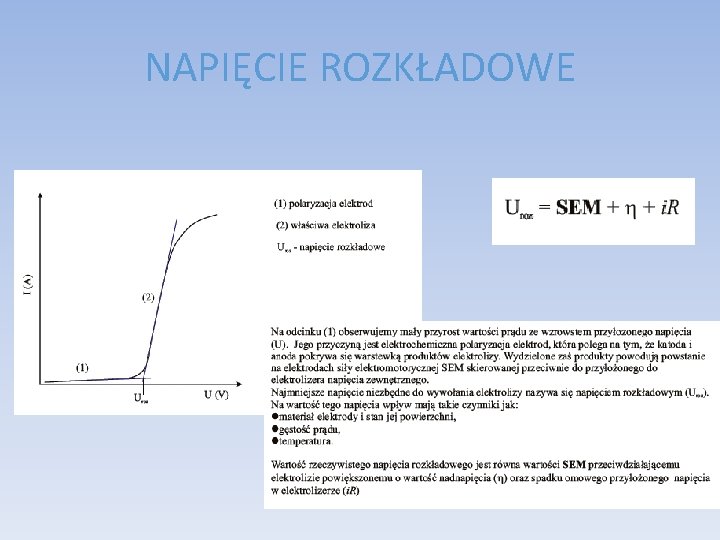
NAPIĘCIE ROZKŁADOWE



Miareczkowanie amperometryczne wykonuje się dwiema technikami: 1. przy użyciu jednej elektrody polaryzowanej (np. kroplowej elektrody rtęciowej lub wirującej elektrody platynowej), będącej elektrodą wskaźnikową, której potencjał ustala się względem elektrody porównawczej (np. nasyconej elektrody kalomelowej); technikę tę stosuje się w różnych przypadkach, np. : - gdy analit jest elektroaktywny, a titrant jest substancją nieelektroaktywną, - gdy analit nie jest elektroaktywny, a titrant jest substancją elektroaktywną, - gdy zarówno analit jak i titrant są substancjami elektroaktywnymi, - gdy jedna substancja ulega elektroutlenieniu, a druga elektroredukcji. 2. przy użyciu dwóch elektrod polaryzowanych (np. dwóch identycznych elektrody platynowych); miareczkowanie to nazywane jest też miareczkowaniem biamperometrycznym lub miareczkowaniem do martwego punktu.

przy użyciu jednej elektrody polaryzowanej


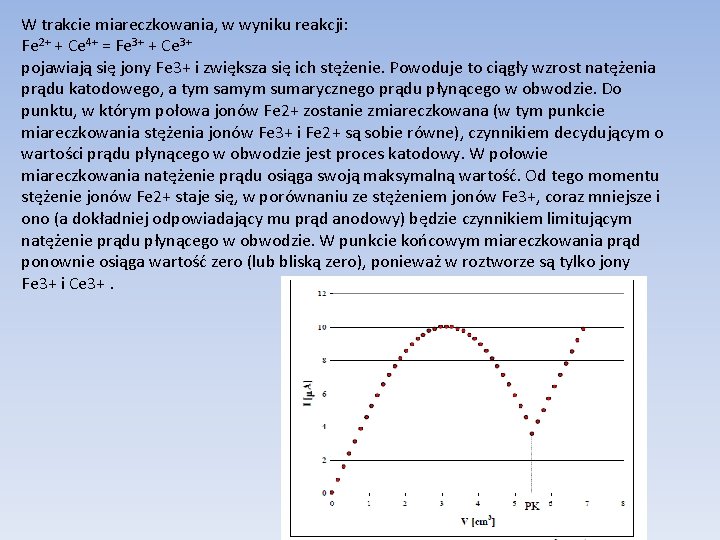
Miareczkowanie biamperometryczne (z dwoma elektrodami polaryzowalnymi) Np. substancja miareczkowana i titrant tworzą układy odwracalne Przykład dotyczy miareczkowania roztworu soli żelaza Fe(II) roztworem siarczanu(VI) ceru(IV). Załóżmy, jak poprzednio, że roztwór zawierający jony Fe 2+ jest miareczkowany roztworem zawierającym jony Ce 4+. Przed rozpoczęciem miareczkowania w roztworze są tylko jony Fe 2+. Brak jest układu odwracalnego. Dlatego na początku miareczkowania, jeżeli stężenie jonów Fe 3+ jest równe zeru, to zgodnie z równaniem: wartość prądu płynącego w obwodzie powinna być równa zero. Na ogół, przed przystąpieniem do miareczkowania obserwowany jest tzw. prąd szczątkowy.

W trakcie miareczkowania, w wyniku reakcji: Fe 2+ + Ce 4+ = Fe 3+ + Ce 3+ pojawiają się jony Fe 3+ i zwiększa się ich stężenie. Powoduje to ciągły wzrost natężenia prądu katodowego, a tym samym sumarycznego prądu płynącego w obwodzie. Do punktu, w którym połowa jonów Fe 2+ zostanie zmiareczkowana (w tym punkcie miareczkowania stężenia jonów Fe 3+ i Fe 2+ są sobie równe), czynnikiem decydującym o wartości prądu płynącego w obwodzie jest proces katodowy. W połowie miareczkowania natężenie prądu osiąga swoją maksymalną wartość. Od tego momentu stężenie jonów Fe 2+ staje się, w porównaniu ze stężeniem jonów Fe 3+, coraz mniejsze i ono (a dokładniej odpowiadający mu prąd anodowy) będzie czynnikiem limitującym natężenie prądu płynącego w obwodzie. W punkcie końcowym miareczkowania prąd ponownie osiąga wartość zero (lub bliską zero), ponieważ w roztworze są tylko jony Fe 3+ i Ce 3+.

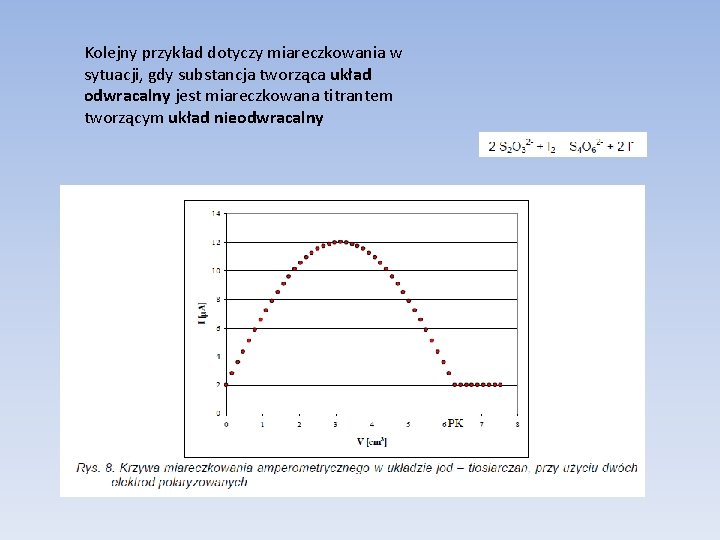
Kolejny przykład dotyczy miareczkowania w sytuacji, gdy substancja tworząca układ odwracalny jest miareczkowana titrantem tworzącym układ nieodwracalny

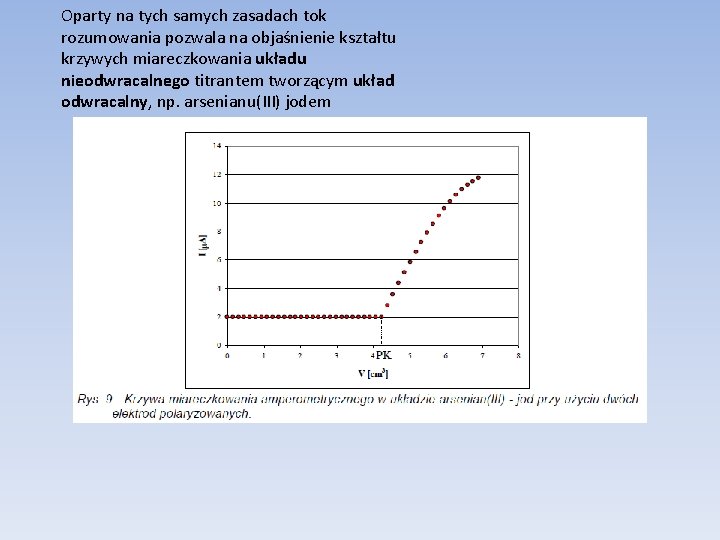
Oparty na tych samych zasadach tok rozumowania pozwala na objaśnienie kształtu krzywych miareczkowania układu nieodwracalnego titrantem tworzącym układ odwracalny, np. arsenianu(III) jodem



 Fala polarograficzna
Fala polarograficzna Polarografía fundamento
Polarografía fundamento Potencjometria bezpośrednia
Potencjometria bezpośrednia Konduktometria wzory
Konduktometria wzory Stala naczynka
Stala naczynka Graficzne metody prezentacji danych
Graficzne metody prezentacji danych Metody wyodrębniania kosztów stałych i zmiennych
Metody wyodrębniania kosztów stałych i zmiennych Pedagogická diagnostika v mš
Pedagogická diagnostika v mš Metody pedagogické diagnostiky
Metody pedagogické diagnostiky Serologicke metody
Serologicke metody Metody weryfikacji części
Metody weryfikacji części Metody pracy z uczniem zdolnym
Metody pracy z uczniem zdolnym Metody výuky
Metody výuky Burza mózgów wg gordona
Burza mózgów wg gordona Metody badawcze w prawoznawstwie
Metody badawcze w prawoznawstwie Jaké metody používáme k odchytu vodních živočichů
Jaké metody používáme k odchytu vodních živočichů


























