KONDUKTOMETRIA Konduktometria jest metod analityczn w ktrej informacje







![Każde naczynko charakteryzuje tzw. stała naczynka konduktometrycznego k: [cm-1] gdzie: l – odległość między Każde naczynko charakteryzuje tzw. stała naczynka konduktometrycznego k: [cm-1] gdzie: l – odległość między](https://slidetodoc.com/presentation_image_h/85b7ba248b4d278f6338860864432480/image-12.jpg)













- Slides: 36

KONDUKTOMETRIA

Konduktometria jest metodą analityczną, w której informacje analityczne uzyskuje się na podstawie pomiarów przewodności elektrycznej roztworów elektrolitów znajdujących się pomiędzy dwiema obojętnymi elektrodami. techniki konduktometryczne konduktometria klasyczna pomiar przewodności słupa cieczy między dwiema platynowymi elektrodami, do których przykłada się napięcie zmienne o częstotliwości poniżej 105 Hz (zazwyczaj 1 -10 k. Hz). konduktometria bezpośrednia miareczkowanie konduktometryczne konduktometria bezelektrodowa o małej częstotliwości konduktometria bezelektrodowa o wielkiej częstotliwości - oscylometria

Wielkość przewodności roztworu zależy od wszystkich jonów obecnych w roztworze i od reakcji między nimi zachodzących. Jeżeli jednak stężenia wszystkich soli (z wyjątkiem badanej) są niezmienne, to obserwowane zmiany przewodności można powiązać ze zmianami stężenia badanej soli. Na tej zasadzie opiera się analiza konduktometryczna. Zgodnie z prawem Ohma: gdzie: – opór właściwy [Ω·cm], l – długość przewodnika [cm], s – przekrój przewodnika [cm 2];

Dla elektrolitów zamiast oporu podaje się przewodność elektryczną (konduktancję). Jednostką jest SIMENS 1 S= 1Ω-1 Przewodność właściwa (odwrotność oporu właściwego) jest to przewodność słupa cieczy o długości l = 1 cm i przekroju s = 1 cm 2. [S · cm-1] stosunek l/s nazywa się stałą naczynka lub pojemnością oporową. Przewodność roztworu między elektrodami o powierzchni s umieszczonymi od siebie w odległości l będzie zatem wyrażona wzorem:

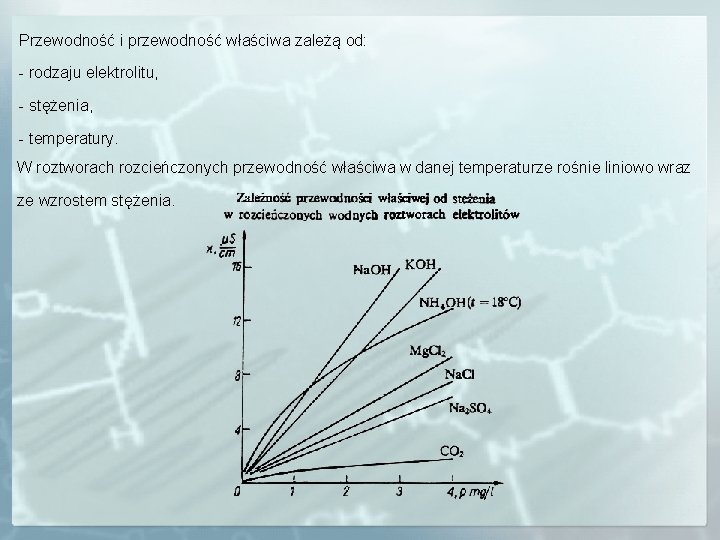
Przewodność i przewodność właściwa zależą od: - rodzaju elektrolitu, - stężenia, - temperatury. W roztworach rozcieńczonych przewodność właściwa w danej temperaturze rośnie liniowo wraz ze wzrostem stężenia.

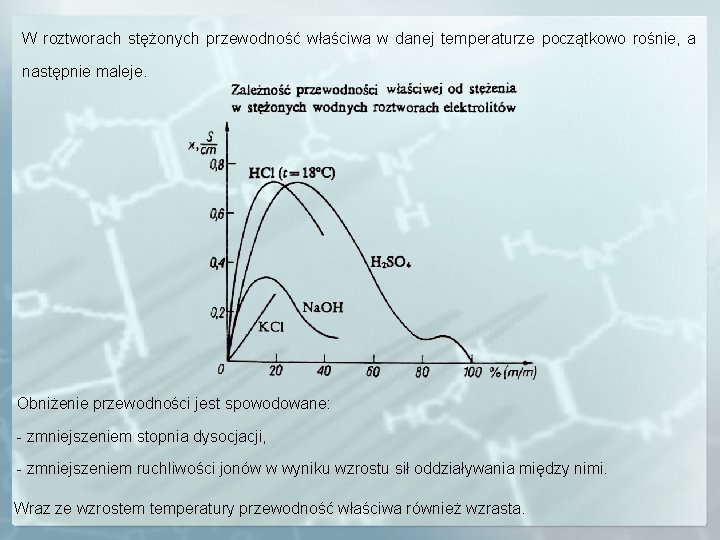
W roztworach stężonych przewodność właściwa w danej temperaturze początkowo rośnie, a następnie maleje. Obniżenie przewodności jest spowodowane: - zmniejszeniem stopnia dysocjacji, - zmniejszeniem ruchliwości jonów w wyniku wzrostu sił oddziaływania między nimi. Wraz ze wzrostem temperatury przewodność właściwa również wzrasta.

Przewodność molowa Λ jest przewodnością jakie wykazuje warstwa elektrolitu umieszczonego między dwiema elektrodami oddalonymi od siebie o 1 cm i o objętości v ml, w której znajduje się 1 mol substancji. gdzie: κ - przewodność właściwa, V– objętość [ml]. [S·cm 2·mol-1] gdzie: κ - przewodność właściwa, c – stężenie [mol·l-1] Prawo Kohlrauscha mówi, że na przewodność molową elektrolitu KA składają się przewodnośći tworzących go jonów K+ i A-. gdzie: α – stopień dysocjacji, przewodności jonowe kationu i anionu.

Przewodność molowa związku zależy od stężenia i rośnie wraz z rozcieńczeniem. Graniczne przewodność molowa Λo jest to przewodność do jakiego dąży elektrolit gdy jego stężenie dąży do zera. Dla związku o wzorze ogólnym Kk. Aa prawdziwe jest prawo Kohlrauscha: gdzie: – graniczne przewodności molowe jonów, k, a – liczba kationów i anionów powstałych w wyniku dysocjacji. Przewodność molowa mocnych elektrolitów zależy liniowo od pierwiastka kwadratowego ze stężenia (Kohlrausch). Przewodność molowa może służyć do porównywania przewodności związków o takim samym wzorze ogólnym Kk. Aa.

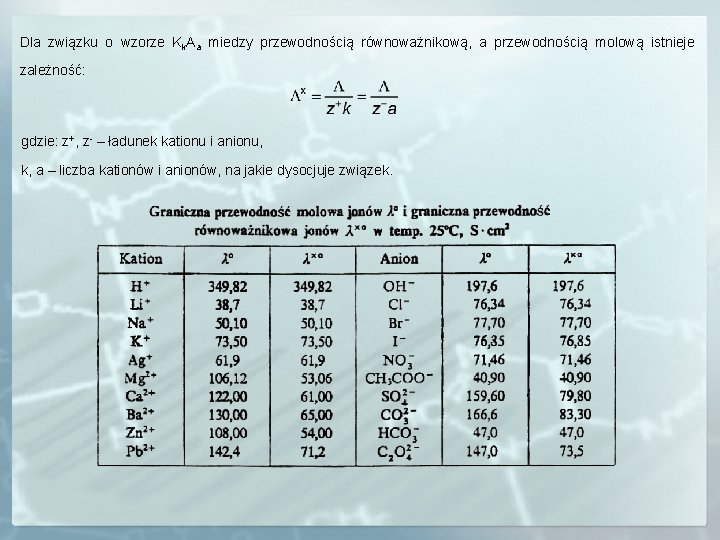
Przewodność równoważnikowa Λx (Λ*) jest przewodnością jakie wykazuje warstwa elektrolitu umieszczonego między dwiema elektrodami oddalonymi od siebie o 1 cm i o objętości V ml, w której znajduje się 1 gramorównoważnik substancji. gdzie: N – stężenie normalne roztworu. Graniczna przewodność równoważnikowa Λxo jest to przewodność równoważnikowa do jakiego dąży elektrolit gdy jego stężenie dąży do zera. Dla związku o wzorze ogólnym Kk. Aa zgodnie z prawem Kohlrauscha przewodność równoważnikowa : gdzie: – graniczna przewodność równoważnikowa jonów, k, a – liczba kationów i anionów powstałych w wyniku dysocjacji. Graniczna przewodność równoważnikowa jonowa dla każdego jonu jest wielkością stałą, zależną od rodzaju rozpuszczalnika i temperatury.

Dla związku o wzorze Kk. Aa miedzy przewodnością równoważnikową, a przewodnością molową istnieje zależność: gdzie: z+, z- – ładunek kationu i anionu, k, a – liczba kationów i anionów, na jakie dysocjuje związek.

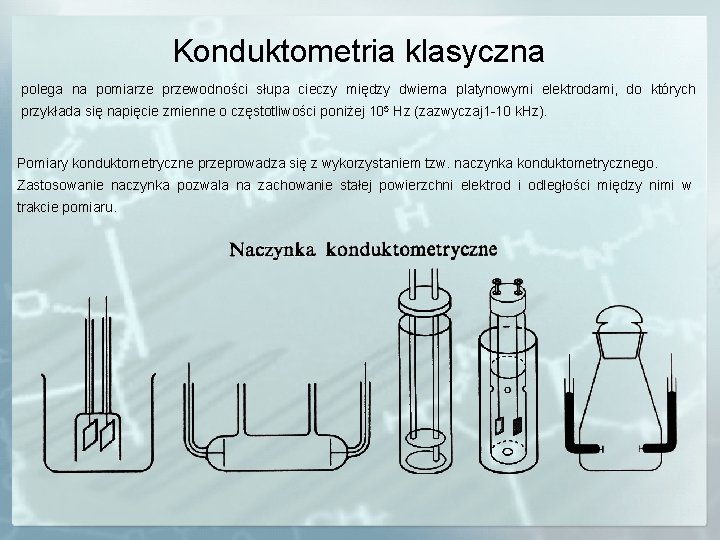
Konduktometria klasyczna polega na pomiarze przewodności słupa cieczy między dwiema platynowymi elektrodami, do których przykłada się napięcie zmienne o częstotliwości poniżej 105 Hz (zazwyczaj 1 -10 k. Hz). Pomiary konduktometryczne przeprowadza się z wykorzystaniem tzw. naczynka konduktometrycznego. Zastosowanie naczynka pozwala na zachowanie stałej powierzchni elektrod i odległości między nimi w trakcie pomiaru.
![Każde naczynko charakteryzuje tzw stała naczynka konduktometrycznego k cm1 gdzie l odległość między Każde naczynko charakteryzuje tzw. stała naczynka konduktometrycznego k: [cm-1] gdzie: l – odległość między](https://slidetodoc.com/presentation_image_h/85b7ba248b4d278f6338860864432480/image-12.jpg)
Każde naczynko charakteryzuje tzw. stała naczynka konduktometrycznego k: [cm-1] gdzie: l – odległość między elektrodami, s – powierzchnia elektrody. Stała naczynka konduktometrycznego k powinna być wyznaczona jeżeli przeprowadza się bezpośrednie pomiary przewodności roztworu badanego. Wykonuje się to mierząc opór R roztworu elektrolitu o znanym przewodności właściwej κ np. 0. 01 mol·l-1 KCl i wyznaczając wartość l/s. k=R·κ

Konduktometria bezpośrednia Ze względu na zależność przewodności roztworu od stężenia wszystkich obecnych w nim jonów bezpośrednie pomiary można wykorzystać: - w detektorach konduktometrycznych w chromatografii cieczowej (jonowej) - do określania czystości wody i ścieków - do wyznaczania stężeń roztworów kwasów, zasad i soli - do kontroli przebiegu procesów technologicznych - do badania czystości substratów i produktów np. zanieczyszczeń cukru solami, czystości paliw - do oznaczania niektórych gazów (chlor, tlen, dwutlenek węgla): # oznaczanie rozpuszczonego w wodzie O 2 oparte na jego reakcji z Tl. 4 Tl + O 2 2 Tl 2 O + 2 H 2 O 4 Tl. OH Powstający dobrze rozpuszczalny wodorotlenek podwyższa przewodność roztworu co daje możliwość określenia ilości O 2. # oznaczanie rozpuszczonego CO 2 powstałego podczas spalania stali węglowej. Gaz przepuszcza się przez płuczkę napełniona znaną ilością Ba(OH)2, a następnie porównuje się przewodność tego roztworu z przewodnością zmierzoną przed wprowadzeniem CO 2. Różnica przewodności daje możliwość pośredniego wyznaczenia zawartości węgla w stali.

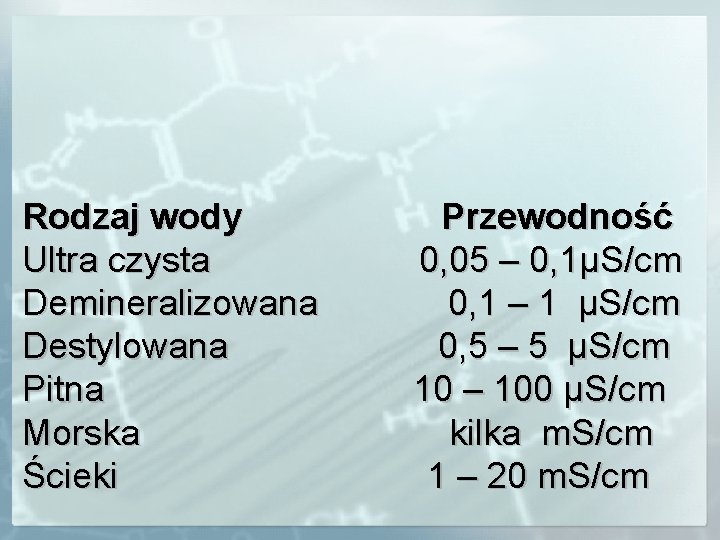
Rodzaj wody Ultra czysta Demineralizowana Destylowana Pitna Morska Ścieki Przewodność 0, 05 – 0, 1µS/cm 0, 1 – 1 µS/cm 0, 5 – 5 µS/cm 10 – 100 µS/cm kilka m. S/cm 1 – 20 m. S/cm

Miareczkowanie konduktometryczne Jest przykładem elektrochemicznego wyznaczania punktu końcowego miareczkowania. Miareczkowanie konduktometryczne może być zastosowane do oznaczania substancji gdy podczas miareczkowania występują zmiany przewodności związane z tworzeniem się: - słabo dysocjowanych związków np. wody, słabych kwasów lub zasad, trudno rozpuszczalnych soli, - jonów o innym przewodnictwie niż pierwotnie zawarte w roztworze np. jony kompleksów. W przypadku miareczkowania konduktometrycznego należy pamiętać, że dodatek titranta zwiększa objętość roztworu przez co zmienia się stężenie jonów. Konieczne zatem jest wprowadzenie tzw. „poprawki na rozcieńczenie”. gdzie: Gr – rzeczywista przewodność, Gm – mierzona przewodność, V – objętość titranta, Vo – początkowa objętość roztworu.

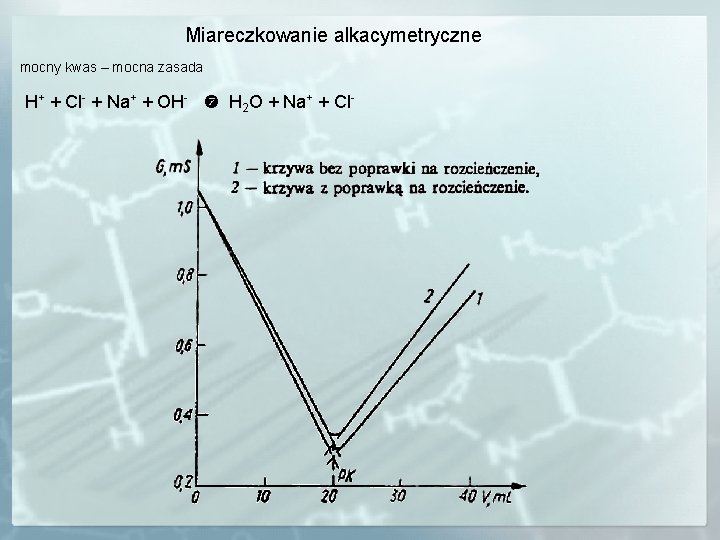
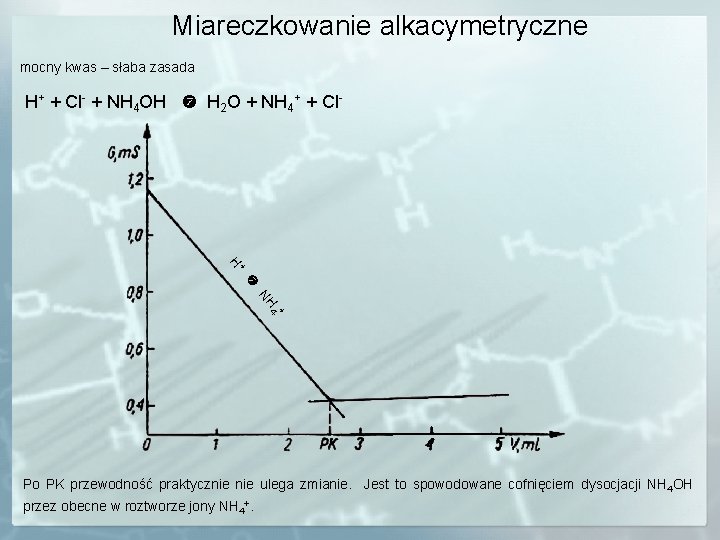
Miareczkowanie alkacymetryczne mocny kwas – mocna zasada H+ + Cl- + Na+ + OH- H 2 O + Na+ + Cl-

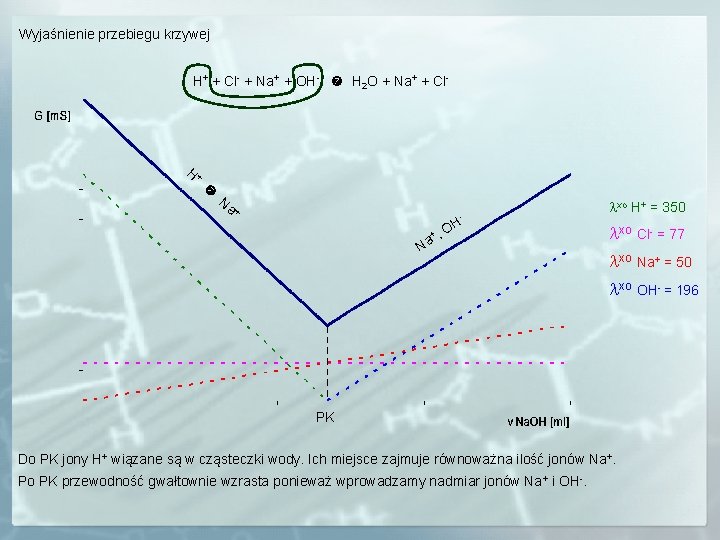
Wyjaśnienie przebiegu krzywej H+ + Cl- + Na+ + OH- H 2 O + Na+ + Cl- H+ Na + - +, Na OH xo H+ = 350 xo Cl- = 77 xo Na+ = 50 xo OH- = 196 PK Do PK jony H+ wiązane są w cząsteczki wody. Ich miejsce zajmuje równoważna ilość jonów Na+. Po PK przewodność gwałtownie wzrasta ponieważ wprowadzamy nadmiar jonów Na+ i OH-.

Miareczkowanie alkacymetryczne mocny kwas – słaba zasada H+ + Cl- + NH 4 OH H 2 O + NH 4+ + Cl- + H NH + 4 Po PK przewodność praktycznie ulega zmianie. Jest to spowodowane cofnięciem dysocjacji NH 4 OH przez obecne w roztworze jony NH 4+.

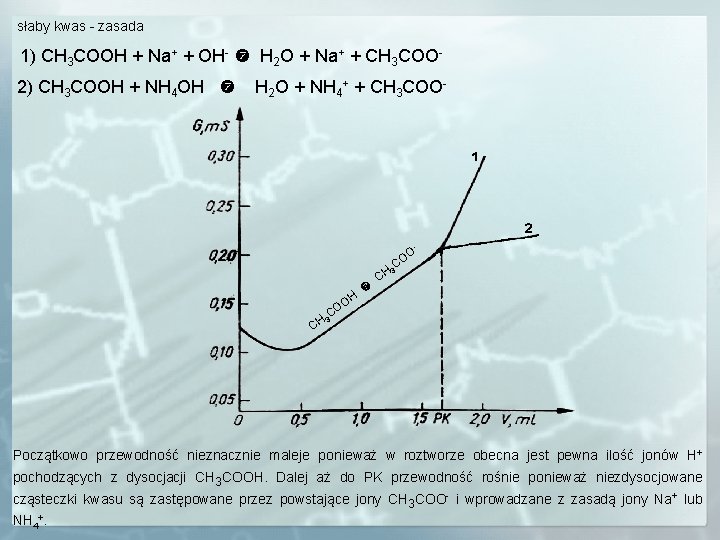
słaby kwas - zasada 1) CH 3 COOH + Na+ + OH- H 2 O + Na+ + CH 3 COO 2) CH 3 COOH + NH 4 OH H 2 O + NH 4+ + CH 3 COO- - CH OH O C CH O CO 3 3 Początkowo przewodność nieznacznie maleje ponieważ w roztworze obecna jest pewna ilość jonów H+ pochodzących z dysocjacji CH 3 COOH. Dalej aż do PK przewodność rośnie ponieważ niezdysocjowane cząsteczki kwasu są zastępowane przez powstające jony CH 3 COO- i wprowadzane z zasadą jony Na+ lub NH 4+.


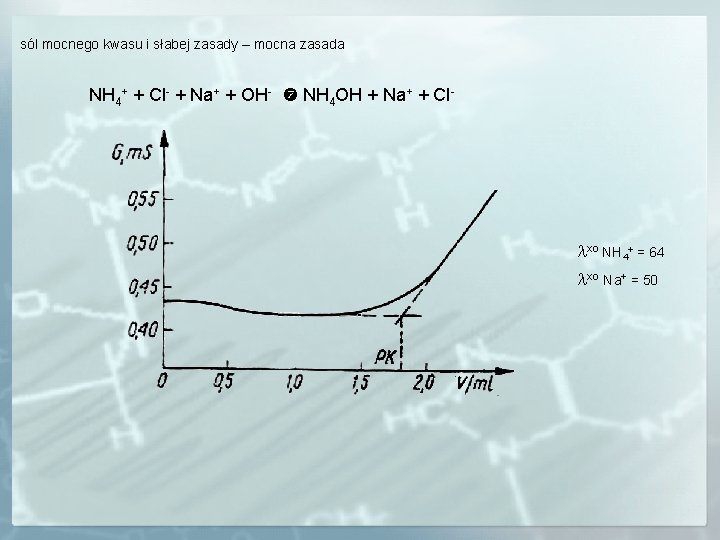
sól mocnego kwasu i słabej zasady – mocna zasada NH 4+ + Cl- + Na+ + OH- NH 4 OH + Na+ + Cl- xo NH 4+ = 64 xo Na+ = 50

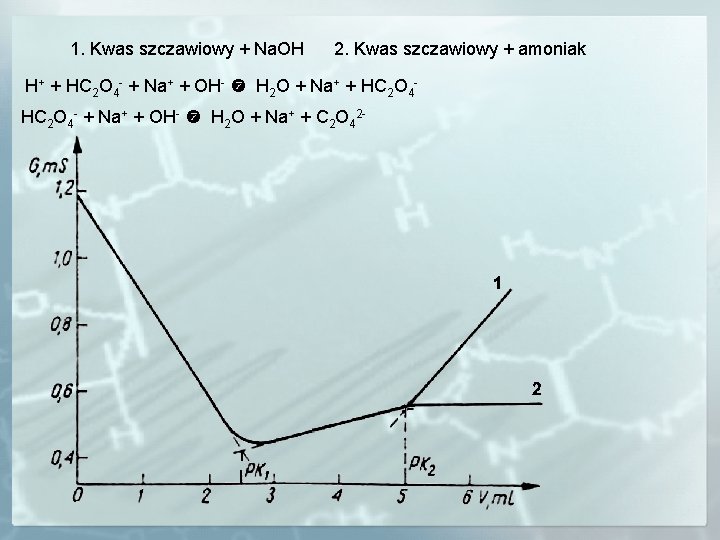
1. Kwas szczawiowy + Na. OH 2. Kwas szczawiowy + amoniak H+ + HC 2 O 4 - + Na+ + OH- H 2 O + Na+ + C 2 O 42 -

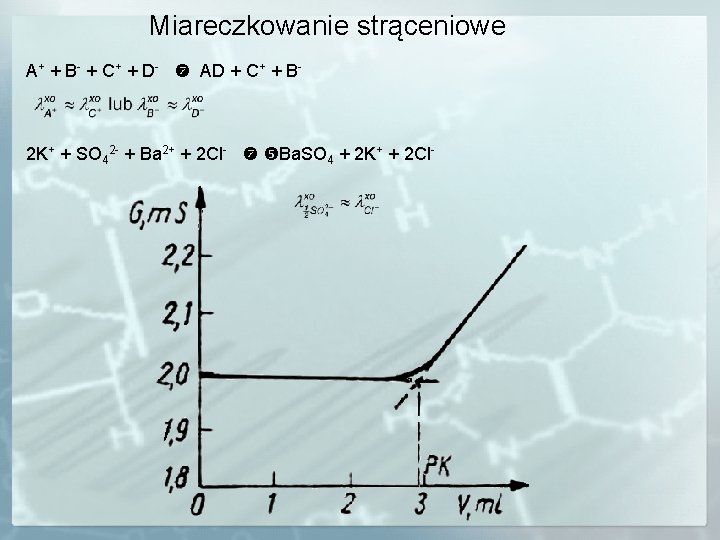
Miareczkowanie strąceniowe A+ + B- + C+ + D- AD + C+ + B- 2 K+ + SO 42 - + Ba 2+ + 2 Cl- Ba. SO 4 + 2 K+ + 2 Cl-

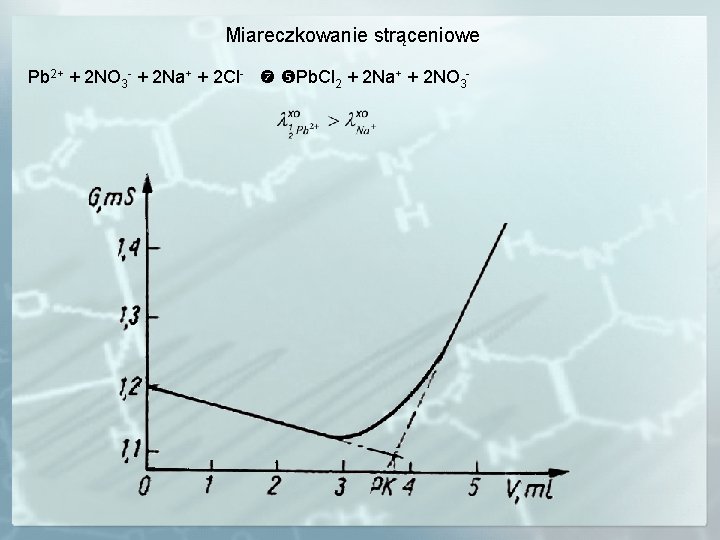
Miareczkowanie strąceniowe Pb 2+ + 2 NO 3 - + 2 Na+ + 2 Cl- Pb. Cl 2 + 2 Na+ + 2 NO 3 -

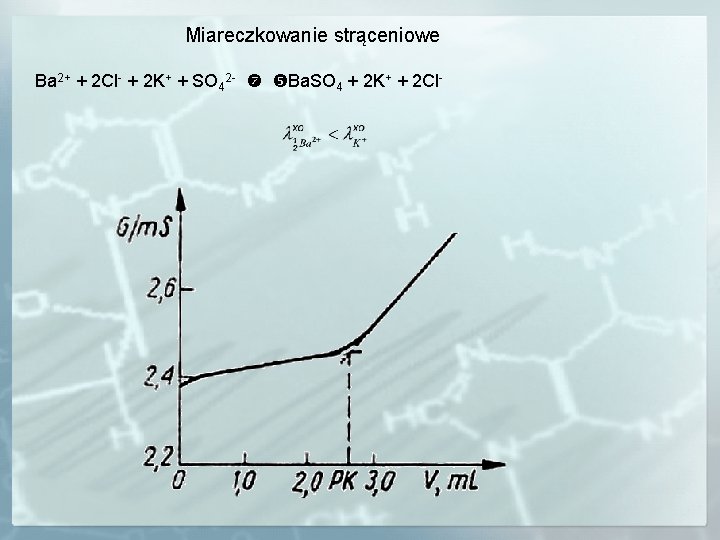
Miareczkowanie strąceniowe Ba 2+ + 2 Cl- + 2 K+ + SO 42 - Ba. SO 4 + 2 K+ + 2 Cl-

Miareczkowanie strąceniowe IRBa. SO 4 = 1. 1 x 10 -10, IRPb. SO 4 = 1. 6 x 10 -8 Ba 2+ + 2 Cl- + Pb 2+ + 2 NO 3 - + 2 K+ + SO 42 - Ba. SO 4 + 2 K+ + 2 Cl- + Pb 2+ + 2 NO 3 - + 2 K+ + SO 42 - Pb. SO 4 + 2 K+ + 2 NO 3 -

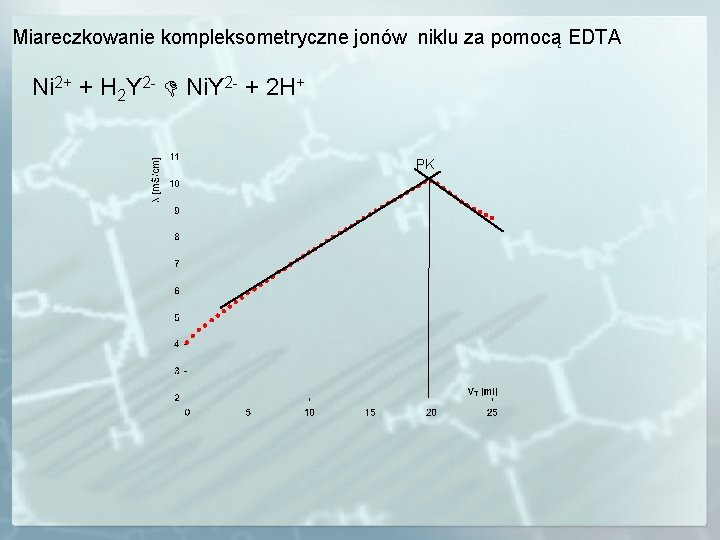
Miareczkowanie kompleksometryczne jonów niklu za pomocą EDTA Ni 2+ + H 2 Y 2 - Ni. Y 2 - + 2 H+ PK

Wyznaczanie stałych fizykochemicznych Wyznaczanie stałej dysocjacji W roztworze dowolnego słabego elektrolitu KA ustala się stan równowagi opisany równaniem: KA K+ + AKtóry można opisać stałą równowagi zgodnie z równaniem: Zgodnie z prawem rozcieńczeń Ostwalda: W przypadku słabego elektrolitu AB stopień dysocjacji można w przybliżeniu wyrazić za pomocą przewodności: gdzie Λ –przewodność molowa elektrolitu, Λo – graniczna przewodność molowa elektrolitu.

Co daje wyrażenie: gdzie Λ –przewodność molowa elektrolitu, Λo – graniczna przewodność molowa elektrolitu. Wyznaczając zatem przewodność G elektrolitu o znanym stężeniu c oraz konduktometrycznego k oblicza się jego przewodność molową, a następnie stałą dysocjacji. stałą naczynka

Wyznaczanie iloczynu rozpuszczalności Trudno rozpuszczalna sól KA w wodzie dysocjuje na jony zgodnie z równaniem: KA K+ + AStężenie jonów obecnych w roztworze opisuje iloczyn rozpuszczalności: IR = [K+][A-] W przypadku trudno rozpuszczalnej soli KA można przyjąć, że przewodność molowa nasyconego roztworu jest równa jej granicznej przewodności molowej. Przyjmując, że stężenie pojedynczego jonu wynosi c otrzymujemy: IR = c 2 W przypadku trudno rozpuszczalnej soli KA można przyjąć, że przewodność molowa nasyconego roztworu jest równa jej granicznej przewodności molowej.

Zgodnie z prawem Kohlrauscha: gdzie: – graniczne przewodności równoważnikowe jonów. Wyznaczając przewodność G nasyconego roztworu trudno rozpuszczalnej soli oraz stałą naczynka konduktometrycznego k można wyznaczyć jego przewodność właściwą κ, a następnie stężenie c oraz iloczyn rozpuszczalności.

Zalety miareczkowania konduktometrycznego 1. można miareczkować bardzo słabe kwasy lub zasady, 2. można miareczkować dwie substancje obok siebie, 3. można miareczkować roztwory rozcieńczone. Wady 1. jest ograniczone do przypadków gdy w badanej próbce obok analitu nie znajdują się w większych stężeniach jony obce, których przewodnictwo nie pozwalałoby miareczkowania, obserwować zmian przewodnictwa w toku

Pytania egzaminacyjne Narysować krzywe miareczkowań konduktometrycznych 1. Mieszaniny kwasu solnego i octowego za pomocą a) wodorotlenku sodu b) amoniaku 2. Azotanu srebra za pomocą a) Na. Cl b) KCl c) Li. Cl d) HCl Którym z tych titrantów najlepiej miareczkować azotan srebra? 3. Równomolowej mieszaniny kwasu szczawiowego i wodoroszczawianu sodu za pomocą a) wodorotlenku sodu b) amoniaku

. 4. Uszeregować związki wg. wzrastającej przewodności roztworów o jednakowych stężeniach molowych: a) KOH, HCl, Na. Cl, kwas octowy b) Cu. Cl 2 , Al. Cl 3, Na. Cl, kwas borowy c) KOH, HCl, H 2 SO 3 , H 2 SO 4 d) Na. OH, amoniak, KCl, Ca(OH)2 5. Wykorzystanie konduktometrii bezpośredniej. 6. Wykorzystanie konduktometrii do wyznaczania stałych fizykochemicznych. 7. Jaki titrant należy zastosować przy konduktometrycznym miareczkowaniu kwasu borowego? Uzasadnić odpowiedź odpowiednimi wykresami. 8. Jaki titrant należy zastosować przy konduktometrycznym miareczkowaniu kwasu masłowego? Uzasadnić odpowiedź odpowiednimi wykresami.

. 9. Do kolejnych zlewek zawierających po 100 ml wody dodano po 0, 001 mola wodorotlenków baru, srebra i sodu. Uszeregować roztwory zgodnie z wzrastającą przewodnością. 10. Do kolejnych zlewek zawierających po 100 ml wody dodano po 0, 001 mola chlorku srebra, siarczku srebra, chlorku sodu, chlorku magnezu. Uszeregować roztwory zgodnie z wzrastającą przewodnością.

 Konduktometria bezpośrednia
Konduktometria bezpośrednia Konduktometria wzory
Konduktometria wzory Sw balladyna
Sw balladyna Zdjęcia chomików
Zdjęcia chomików Protestanckie przekłady biblii
Protestanckie przekłady biblii Co to jest podmiot liryczny
Co to jest podmiot liryczny Moc jednostka
Moc jednostka Ojcowski park narodowy logo co oznacza
Ojcowski park narodowy logo co oznacza Ruah co to znaczy
Ruah co to znaczy Jakie wyróżniamy kody barwne
Jakie wyróżniamy kody barwne Matematyka jest jak
Matematyka jest jak Nilufar guli metodi
Nilufar guli metodi Exempel på gap analys
Exempel på gap analys Prinsip tushunchasi
Prinsip tushunchasi Ta'lim vositalariga nimalar kiradi
Ta'lim vositalariga nimalar kiradi Komparativ juridisk metod
Komparativ juridisk metod Degresivni metod amortizacije
Degresivni metod amortizacije Yalpi fikriy hujum metodi
Yalpi fikriy hujum metodi Cecilia andrée löfholm
Cecilia andrée löfholm Problemlösning rita en bild
Problemlösning rita en bild Iskazi zadaci
Iskazi zadaci Cyril a metod 863
Cyril a metod 863 Chromatografia bibułowa
Chromatografia bibułowa Metod kandidatuppsats
Metod kandidatuppsats Metoda triangulace
Metoda triangulace Photo caption
Photo caption Piramidal metod
Piramidal metod Kabinet diagnostických metod fss
Kabinet diagnostických metod fss Hypotetisk-deduktiv metod
Hypotetisk-deduktiv metod Antrenman periyotlaması nedir
Antrenman periyotlaması nedir Rättssociologisk metod
Rättssociologisk metod Tarbiyaning maqsad va vazifalari
Tarbiyaning maqsad va vazifalari Dogmatski metod
Dogmatski metod Delphi metoda
Delphi metoda наставне методе
наставне методе Kroneker kapelijeva teorema
Kroneker kapelijeva teorema Podział metod instrumentalnych
Podział metod instrumentalnych