Potencjometria Metody analityczne wykorzystuj cztery grupy reakcji chemicznych


















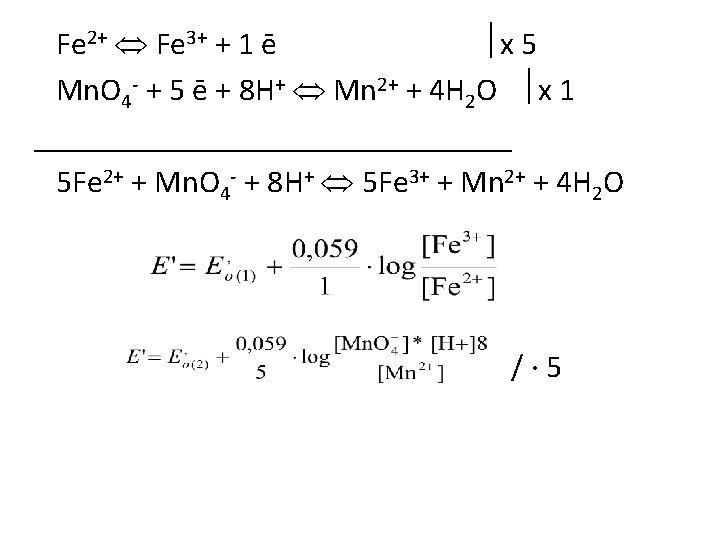



















![[Ag. Cl]=[Ag+]=[Cl-]= 0, 01 mol/l W temperaturze 25 o. C obliczony potencjał elektrody chlorosrebrowej [Ag. Cl]=[Ag+]=[Cl-]= 0, 01 mol/l W temperaturze 25 o. C obliczony potencjał elektrody chlorosrebrowej](https://slidetodoc.com/presentation_image_h2/8adfdd64b80eb568069a79e689c00bc9/image-40.jpg)


![Aby obliczyć stężenie [I-], należy uwzględnić fakt, że Na. I Na+ + I-: n Aby obliczyć stężenie [I-], należy uwzględnić fakt, że Na. I Na+ + I-: n](https://slidetodoc.com/presentation_image_h2/8adfdd64b80eb568069a79e689c00bc9/image-43.jpg)
![Ponieważ Ks. Ag. I l= 2 10 -16 = [Ag+] [ I-] , więc Ponieważ Ks. Ag. I l= 2 10 -16 = [Ag+] [ I-] , więc](https://slidetodoc.com/presentation_image_h2/8adfdd64b80eb568069a79e689c00bc9/image-44.jpg)
- Slides: 44

Potencjometria Metody analityczne wykorzystują cztery grupy reakcji chemicznych:

1. reakcje kwas –zasada (alkacymetria) 2. reakcje kompleksowania(kompleksometria) 3. reakcje strącania osadów (precypitometria) 4. reakcje redox (redoksymetria) Reakcje redox (redoksymetria) Metody oparte na reakcjach utleniania i redukcji. • W miarę przebiegu reakcji reduktor ulega utlenieniu (oddaje elektrony), natomiast utleniacz ulega redukcji (przyjmuje elektrony). • •

• • • Oksydometria - titrant jest odczynnikiem o własnościach utleniających: manganometria KMn. O 4 Mn 7+ → Mn 6+, Mn 4+, Mn 2+ cerometria Ce(SO 4)2 Ce 4+ → Ce 3+ chromianometria K 2 Cr 2 O 7, K 2 Cr. O 4 Cr 6+ → Cr 3+ bromianometria KBr. O 3 Br 5+ → Brjodometria

Reduktometria - titrant jest odczynnikiem o własnościach redukujących (ferrometria Fe. SO 4, tytanometria Ti. Cl 3, askorbinometria ) Punkt równoważnikowy (PR) wyznaczany jest: za pomocą wskaźników i potencjometrycznie. Wskaźniki te są układami redox, których forma utleniona posiada odmienne zabarwienie niż forma zredukowana.

W miareczkowaniach manganometrycznych i jodometrycznych nie ma potrzeby stosowania dodatkowych wskaźników, gdyż manganian (VII) potasu i jod same odgrywają ich rolę. Np. jako roztworu miareczkującego używa się manganianu (VII) potasu o silnie fioletowym zabarwieniu, który w zależności od środowiska reakcji (ze zmianą p. H zmienia się potencjał redoks układu) ulega różnym przemianom: • środowisko kwaśne - roztwór ulega odbarwieniu Mn. O 4¯ + 8 H+ +5 e → Mn 2+ + 4 H 2 O (E° = + 1, 53 V) • środowisko obojętne lub słabo zasadowe lub słabo kwasowe – wytrąca się brunatny osad Mn. O 2 Mn. O 4¯ + 2 H 2 O +3 e → Mn. O 2 ↓ + 4 OH¯ (E° = + 0, 58 V) • środowisko mocno zasadowe - roztwór przybiera zieloną barwę Mn. O 4¯ + e → Mn. O 42¯ (E° = + 0, 56 V)

Miareczkowanie potencjometrycznie Reakcje utleniania i redukcji, będące podstawą miareczkowania redoksymetrycznego, przebiegają znacznie wolniej od reakcji jonowych (np. alkacymetria). Wymiana elektronów pomiędzy jonami przebiega w kilku etapach, a najwolniejszy z nich decyduje o szybkości całego procesu. Ogólne równanie reakcji redoks można schematycznie zapisać • Ox 1 + n 1 e → Red 1 | n 2 • Red 2 → Ox 2 + n 2 e | n 1 • n 2 Ox 1 + n 1 Red 2 = n 2 Red 1 + n 1 Ox 2

Układ, w którym postać utleniona jest związana z postacią zredukowaną tylko wymianą elektronów, nazywany jest sprzężoną parą redoks (np. Fe 3+/Fe 2+). Podczas miareczkowania redoks, w miarę dodawania odczynnika (utleniacza lub reduktora) zmieniają się stężenia postaci utlenionej i zredukowanej miareczkowanego układu. Mamy więc do czynienia z dwoma układami redoks, którym odpowiadają potencjały obliczone ze wzoru Nernsta:

• • Układy te reagują ze sobą zgodnie z ogólnym równaniem: m 1 Utl 1 + m 2 Red 2 m 1 Red 1 + m 2 Utl 2 gdzie: m 1, m 2 – współczynniki reakcji n 1, n 2 – liczby elektronów wymienianych w odpowiednich reakcjach połówkowych redoks m 1 – jest bardzo często równe n 1, natomiast m 2 jest bardzo często równe n 2. k – 2, 303 RT/F i wynosi: 0, 060 V w t=30 o. C; 0, 059 V w 25 o. C i 0, 058 V w 20 o. C itd. R – stała gazowa, 8, 314 J K-1 mol-1 T – temperatura bezwzględna F – stała Faradaya, 96487 C mol-1

Krzywa miareczkowania redoks jest zależnością potencjału utleniającoredukującego układu redoks od objętości dodawanego titranta E’= f(Vtitr). Krzywą miareczkowania redoks można podzielić na trzy odcinki: a) odcinek krzywej do punktu równoważności b) w punkcie równoważności (PR) c) odcinek krzywej w dowolnym punkcie miareczkowania po przekroczeniu PR.

a) Przed osiągnięciem punktu równoważności potencjał roztworu zależy tylko od potencjału układu miareczkowanego: Utl 1 + n 1 Red 1. Dowolny punkt na tym odcinku krzywej można obliczyć z równania Nernsta dla układu miareczkowanego: b) Ered 1 = Eutl 2 = EPR

c) Potencjał redoks układu po przekroczeniu punktu równoważności Potencjał w dowolnym punkcie krzywej miareczkowania po przekroczeniu punktu równoważności obliczamy podobnie jak dla przypadku przed PR. Potencjał utleniającoredukujący roztworu zależy od potencjału układu, którym miareczkujemy (titranta) Red 2 Utl 2 + n 2 Dowolny punkt na tym odcinku krzywej można obliczyć z równania Nernsta dla układu titranta:

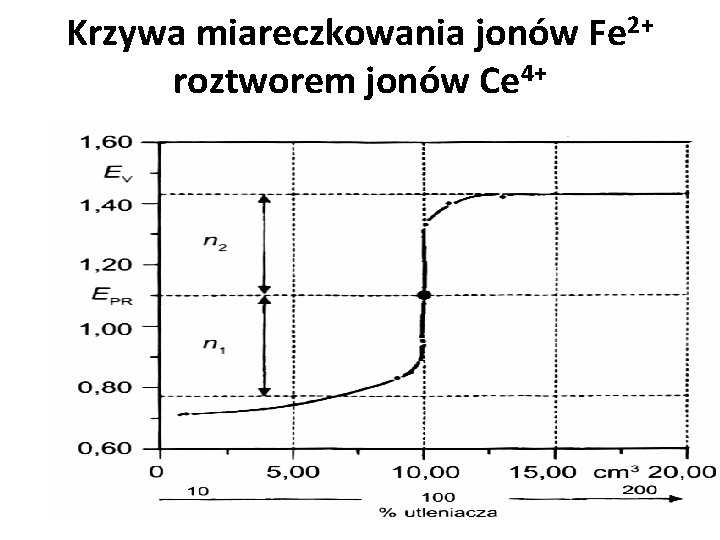
Przykładowa krzywa miareczkowania potencjometrycznego Miareczkowanie 10 ml 0, 1 mol/l roztworu jonów Fe 3+ roztworem 0, 1 mol/l jonów Ce 4+ w 1 mol/l HCl, E 0 Ce 4+/Ce 3+ = 1, 45 V, E 0 Fe 3+/Fe 2+ = 0, 77 V, temp 25 o. C (pod. red. R. Kocjana, „Chemia analityczna”, Wydawnictwo Lekarskie PZWL, W-wa 2000) W całym dziale Redoksymetrycznym ten proces nazywa się oksydometrią, a dokładniej, jeżeli titrantem jest Ce to Cerometrią Cr 4+ + Fe 2+ Ce 3+ + Fe 3+ (gdyby titrantem był Fe to Ferrometria i proces ogólnie zwany Reduktometrią).



Krzywa miareczkowania jonów Fe 2+ roztworem jonów Ce 4+

Ad. b) Potencjał układu w punkcie równoważności W punkcie równoważności (PR) potencjały obu układów redoks są sobie równe: a) E 1’ = E 2 ‘= E’PR oraz b) [Utl 1] = [Red 1 ] i [Utl 2] = [Red 2]

Mnożymy odpowiednio równania przez n 1 lub n 2 oraz uwzględniamy założenie b) • E’ 1 · n 1 = E’’ 0(1) · n 1 + | k/n 1· n 1 ·log 1 • E’ 2 · n 2 = E’’ 0(2) · n 2 + | k/n 2· n 2 ·log 1 Dodajemy równania stronami: E’ 1 · n 1 + E’ 2 · n 2 = E’’ 0(1) · n 1 + E’’ 0(2) · n 2 Uwzględniając punkt a) E 1’ = E 2 ‘= E’PR (n 1+n 2) = E’’ 0(1) · n 1 + E’’ 0(2) · n 2

Ostatecznie potencjał w PR obliczamy ze wzoru: gdzie: E’’ 0(1) - rzeczywisty potencjał normalny reakcji połówkowej (1) E’’ 0(2) - rzeczywisty potencjał normalny reakcji połówkowej (2) • n 1 – liczba elektronów przenoszona w reakcji (1) • n 2 - liczba elektronów przenoszona w reakcji (2)

Potencjał rzeczywisty obliczmy w dwojaki sposób w zależności czy w reakcji połówkowej nie biorą udział jony H+ np. Fe 2+ Fe 3+ + e to potencjał rzeczywisty E’’ 0(1) = E’ 0(2) • Inna jest sytuacja, jeżeli w reakcji biorą udział jony H+ • Zad. Jaki jest potencjał półogniwa w PR miareczkowania jonów Fe 2+ jonami Mn. O 4 -- w obecności kwasu, jeżeli p. H w PR wynosi 2, 3, temp 25 o. C, E 0 Fe 3+/Fe 2+ = +0, 771 V (reduktor), E 0 Mn. O 4 -/Mn 2+ = +1, 51 V (utleniacz)
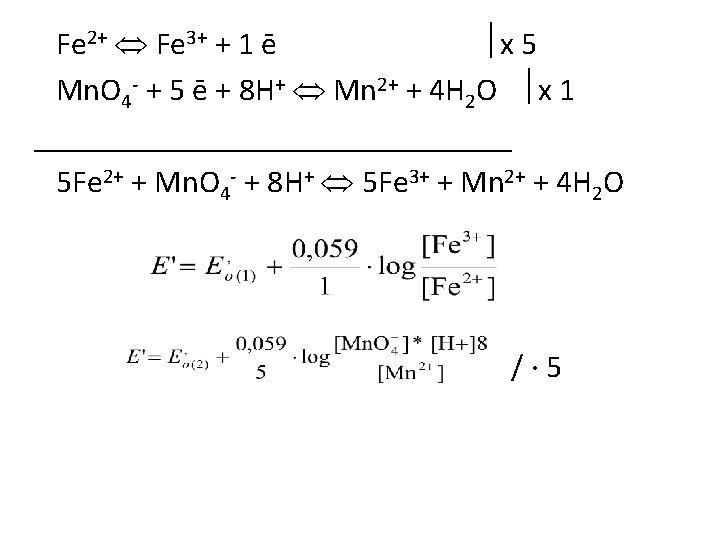
Fe 2+ Fe 3+ + 1 ē x 5 Mn. O 4 - + 5 ē + 8 H+ Mn 2+ + 4 H 2 O x 1 _______________ 5 Fe 2+ + Mn. O 4 - + 8 H+ 5 Fe 3+ + Mn 2+ + 4 H 2 O /· 5

• W celu likwidacji n w mianowniku mnożymy każde z nich przez właściwe n oraz dodajemy oba równania stronami: 6 E’ = Eo(1)’’ + 5 Eo(2) ‘’+ W PR = oraz = Czyli [Fe 3+] = 5 [Mn 2+] oraz [Fe 2+] = 5[Mn. O 4 -] w równaniu pozostają tylko zależności Mn 2+ i Mn. O 46 E’ = Eo(1)’’ + 5 Eo(2) ‘’+

Po skróceniu tych samych odpowiednich wyrazów, równanie wygląda następująco: E’ = 1/6 · (Eo(1)’+ 5 · Eo(2)’) + · log [H+]8 Ostateczne, uporządkowane równanie ogólne + · log [H+]m lub _ · p. H Obliczenie zadania E’PR = _ 2, 3 · = 1, 21 V

Potencjał PR nie zależy ani od stężeń, ani aktywności składników układu redoks biorących udział w reakcji redoks, gdyż te wielkości nie występują w powyższym równaniu. Jeżeli w reakcji redoks uczestniczą pośrednio, tzn. , jeżeli są wiązane lub wydzielane jony H+ lub OH-, to wtedy p. H wpływa na Eo, , . Wtedy należy uwzględnić wpływ tych jonów w obliczeniach: gdzie: Eo, - potencjał normalny układu redoks k – współczynnik zależny od temperatury m – współczynnik stechiometryczny n – liczba elektronów wymienionych w reakcji p. H= – log [H 3 O+]

• Potencjał normalny to stała termodynamiczna, niezależna od składu roztworu. • Potencjał formalny (rzeczywisty) to wartość stała, określona dla ściśle sprecyzowanego składu roztworu. • Dla każdej pary reakcji połówkowych w danej temp. jest tylko jeden termodynamiczny potencjał standardowy Eo ale potencjałów formalnych (rzeczywistych) może być wiele. • SEM ogniwa pomiarowego zależy od potencjału elektrody odniesienia i w przypadku zastosowania NEK (nasyconej elektrody kalomelowej), będzie mniejsze o ok. 0, 25 V od wartości E’ obliczonych względem normalnej elektrody wodorowej

• Zad. Jaki będzie potencjał rzeczywisty dla układu Cr 2 O 72 -/Cr 3+ w PR przy p. H 3, 5 w temp. 15 o. C E 0 wynosi +1, 3 V względem a) NEW b) NEK a) elektroda platynowa wg NEW Cr 2 O + 6ē + 14 H+ 2 Cr 3+ + 7 H 2 O Ponieważ [Cr 2 O ]= [Cr 3+]2 = 50% E’ = 1, 3= +0, 835 V b) względem NEK 0, 835 -0, 25 = 0, 585 V więc

1. Oblicz potencjał elektrody miedziowej zanurzonej do roztworu zawierającego 0, 01 mol/l Cu. SO 4 i 0, 01 mol/l Cu(NO 3)2 , temp. 25 o. C: a) względem nas. elektrody wodorowej b) względem nas. elektrody kalomelowej, jeżeli potencjał normalny elektrody kalomelowej wynosi 0, 34 V Cu 2+ + 2 ē Cu 0 + 1ē a) Potencjał elektrody miedziowej =0, 34 + 0, 0295 log 0, 02=0, 290 V Potencjał normalny miedzi jest wyrażony względem normalnej elektrody wodorowej i obliczona wartość jest równa względem tej elektrody. b) Potencjał nasyconej elektrody kalomelowej względem wodorowej wynosi 0, 244 V, a więc potencjał elektrody miedziowej względem nasyconej kalomelowej wynosi: +0, 290 -(+0, 244)= +0, 046 V

2. Obliczyć SEM ogniwa złożonego z dwóch półogniw redox Fe 3+/Fe 2+ i Cr 2 O 72 - i Cr 3+, jeżeli stężenia wszystkich składników układu wynoszą każdego z osobna 0, 1 mol/l temp. 25 o. C Potencjały normalne odpowiednio 0, 77 V i 1, 33 V = + 0, 77 V = SEM= E 2 -E 1 SEM=1, 20 -0, 77= +0, 43 V +1, 20 V

3. Obliczyć SEM ogniwa chemicznego złożonego z dwóch półogniw redox , temp. 25 o. C V V Pt||Fe 3+ (1 mol/l ) Fe 2+ (0, 010 mol/l ) || Ce 4+ (0, 00010 mol/l) || Pt Ce 3+ (0, 10 mol/l) Jony Ce 4+ są utleniaczem a same się redukują aż do stanu równowagi i prąd przestaje płynąć Ce 4+ + Fe 2+ Ce 3+ + Fe 3+ =+0, 889 V

= + 1, 433 V SEM= E 2 - E 1 SEM= 1, 433 -0, 889= +0, 54 V

KRZYWA MIARECZKOWANIA STRĄCENIOWEGO Miareczkowanie strąceniowe prowadzi się w układzie zawierającym trudno rozpuszczalny osad oraz metaliczną elektrodę znajdującą się w równowadze z jonami tego samego metalu, występującymi w roztworze i osadzie: Meo (elektroda) Men+ + ne, w obecności osadu. Aktywność formy zredukowanej a. Me = 1. Równanie Nernsta przybiera wówczas postać typową dla elektrody drugiego rodzaju.

W celu przeprowadzenia tego typu miareczkowania, należy zbudować ogniwo złożone z elektrody odniesienia o stałym potencjale oraz elektrody wskaźnikowej, której potencjał zależy od stężenia oznaczanego jonu, jest to jednocześnie jeden z jonów wchodzących w skład osadu. Osad ten powstaje jako produkt reakcji pomiędzy roztworem miareczkującym i miareczkowanym. Zastosowanie miareczkowania potencjometrycznego osadowego wymaga zastosowania odpowiedniej elektrody wskaźnikowej. Rodzaj elektrody wskaźnikowej zależy od składu osadu. Metodę tę wykorzystuje się najczęściej do oznaczania jonów Ag+ oraz jonów tworzących osady z jonami Ag+, takich jak Cr-, Br-, I-, SCN- i inne. •

Potencjał układu przed punktem równoważności W przypadku oznaczania Ag+ lub Cl-(X -) podczas miareczkowania zachodzi reakcja: Ag+ + X - Ag. X W roztworze zmienia się stężenie jonów Ag+ i X-, w sposób opisany przez iloczyn rozpuszczalności Ks soli tworzącej się podczas miareczkowania: Ks. Agx = [Ag]+[X -] Jako elektrodę wskaźnikową stosuje się elektrodę srebrową, która jest elektrodą metaliczną pierwszego rodzaju. Jej potencjał zmienia się zgodnie z równaniem Nernsta: Jednocześnie jest to wzór na potencjał elektrody I rodzaju: Przed PR stężenie jonów Ag+ nie związanych w osad jest dość duże w stosunku do tych, które są określone iloczynem rozpuszczalności soli Ag. X. W miarę dodawania jonów X – zmniejsza się stężenie wolnych jonów Ag+, a więc potencjał jest coraz mniejszy.

Potencjał układu w punkcie równoważności Podczas miareczkowania Ag+ jonami X – w PR wszystkie jony Ag+ są związane w osad. Stężenie jonów Ag+ jest określone przez iloczyn rozpuszczalności soli: [Ag+] = Ponieważ: Ag. X Ag+ +Xwięc Ks. Ag. X = [Ag+] · [X-] dlatego dla soli typu 1: 1, tzn. AX, stężenie obu składników w PR są jednakowe [Ag+] = [X-] =

Przy miareczkowaniu strąceniowym PR odpowiada tym stężeniom składników związku trudno rozpuszczalnego, przy których roztwór czystej substancji jest nasycony w danej temperaturze. Dla soli typu A 2 X w PR np. Ag 2 S 2 Ag+ + S 2 X 2 x x Ks= (2 x)2 · x= 4 x 3 Stąd x= wtedy [Ag+] = 2 = potencjał wynosi E’ = Eo + k/n ·log 2 · lub E’ = Eo + k/n Ogólnie dla A 2 X [A+] = 2[X-], czyli: [X -] = , a więc [A+] = 2 =

Potencjał układu po przekroczeniu PR Jeżeli miareczkujemy Ag+ jonami X -, to po przekroczeniu PR mamy układ przypominający elektrodę drugiego rodzaju, czyli odwracalną względem anionu: Ago/Ag. X (X -) elektroda odniesienia. O potencjale elektrody srebrowej decydują jony Ag+, które są określone przez Ks Ag. X oraz efekt wspólnego jonu przez jony X-, które po PR są w dużym nadmiarze. Potencjał liczymy wówczas ze wzoru:

Potencjał maleje w miarę wzrostu stężenia jonów X -, które obniżają rozpuszczalność osadu, a tym samym stężenie Ag+. W przypadku oznaczania jonów X – za pomocą Ag+ sytuacja przed i po PR jest opisana odwrotnie.

Przykłady 1. Obliczyć potencjał elektrody chlorosrebrowej zanurzonej w roztworze 0, 01 mol/l Na. Cl. Normalny potencjał elektrody chlorosrebrowej względem normalnej elektrody wodorowej wynosi + 0, 222 V Elektroda chlorosrebrowa jest elektrodą drugiego rodzaju, jest odwracalna względem anionu. Przemiany zachodzące na elektrodzie można przedstawić równaniem: Ago + Cl- Ag. Cl + 1ē W stanie równowagi szybkości reakcji w obu kierunkach są jednakowe.

Potencjał tej elektrody jest wyrażony wzorem Nernsta: lub Elektrodą chlorosrebrową jest zazwyczaj drut srebrny pokryty elektrolitycznie Ag. Cl , zanurzony w roztworze zawierającym jony Cl-, pochodzące z chlorku lub kwasu solnego. Schemat elektrochemiczny tej elektrody: Ag/ Ag. Cl(s) /Cl-.

Elektrodę chlorosrebrową można traktować jako elektrodę reagującą na aktywność jonu Ag+, która jest uzależniona od aktywności jonu Cl- przez iloczyn rozpuszczalności Ag. Cl Ponieważ Ks. Ag. Cl=1, 6 10 -10 w 25 o. C, to potencjał elektrody chlorosrebrowej, zależy od aktywności a jonu Cl-. Mamy potencjał normalny elektrody chlorosrebrowej.
![Ag ClAgCl 0 01 moll W temperaturze 25 o C obliczony potencjał elektrody chlorosrebrowej [Ag. Cl]=[Ag+]=[Cl-]= 0, 01 mol/l W temperaturze 25 o. C obliczony potencjał elektrody chlorosrebrowej](https://slidetodoc.com/presentation_image_h2/8adfdd64b80eb568069a79e689c00bc9/image-40.jpg)
[Ag. Cl]=[Ag+]=[Cl-]= 0, 01 mol/l W temperaturze 25 o. C obliczony potencjał elektrody chlorosrebrowej wynosi 0, 34 V

Inaczej: Jeżeli podane jest E’Ag+/Ag = 0, 80 V to wtedy Potencjał elektrody srebrowej wyraża się wzorem: = 0, 80 V + 0, 059 log a. Ag+ Ponieważ Ks. Ag. Cl=1, 6 10 -10 = [Ag+] [Cl-] , więc [Ag+] = 1, 6 10 -10 / 0, 01 = 0, 80+ 0, 059 log 1, 6 10 -10 - 0, 059 log 0, 010 = 0, 222 - 0, 059 log 0, 010 = 0, 34 V ( Na czerwono normalny potencjał elektrody chlorosrebrowej względem NEW) Odp. Potencjał elektrody chlorosrebrowej względem NEW wynosi + 0, 340 V

• Przykład 2. Obliczyć potencjał redoks układu 0, 3% (m/m) roztwór Na. I+stały Ag. I, jeżeli Ks. Ag. I=2 10 -16. E’ 0 Ag+/Ag wynosi + 0, 80 V, temp. 25 o. C (Na – 23; I – 127; Ag – 108). Mamy tutaj do czynienia z elektrodą drugiego rodzaju, elektrodą jodosrebrową, jest to więc przypadek analogiczny do poprzedniego, tylko Ks jest inny. Schemat elektrochemiczny tej elektrody Ag/ Ag. I(s) /I-. Przemiany zachodzące w elektrodzie można zapisać: Ag + I- Ag. I + 1ē wzór na potencjał
![Aby obliczyć stężenie I należy uwzględnić fakt że Na I Na I n Aby obliczyć stężenie [I-], należy uwzględnić fakt, że Na. I Na+ + I-: n](https://slidetodoc.com/presentation_image_h2/8adfdd64b80eb568069a79e689c00bc9/image-43.jpg)
Aby obliczyć stężenie [I-], należy uwzględnić fakt, że Na. I Na+ + I-: n Na. I = n Icm Na. I = [I-] = 0, 02 mol /L
![Ponieważ Ks Ag I l 2 10 16 Ag I więc Ponieważ Ks. Ag. I l= 2 10 -16 = [Ag+] [ I-] , więc](https://slidetodoc.com/presentation_image_h2/8adfdd64b80eb568069a79e689c00bc9/image-44.jpg)
Ponieważ Ks. Ag. I l= 2 10 -16 = [Ag+] [ I-] , więc [Ag+] = 2 10 -16 / 0, 02 E’ = + 0, 80 V + 0, 059 log Ks. Ag. I – 0, 059 log [I-] Normalny potencjał elektrody jodosrebrowej = – 0, 059 log [I-] E’ = + 0, 80 V + 0, 059 log 2 10 -16 – 0, 059 log 0, 02= 0, 1260+0, 1 = -0, 026 V Normalny potencjał elektrody jodosrebrowej Odp. Potencjał układu Ag(Ag. I(s)/Na. I wynosi – 0, 026 V.
 Multipletowość nmr
Multipletowość nmr Budowa atomu
Budowa atomu Acetylen hybrydyzacja
Acetylen hybrydyzacja Elektroda trzeciego rodzaju
Elektroda trzeciego rodzaju Zaznacz na osi liczbowej liczby spełniające warunek
Zaznacz na osi liczbowej liczby spełniające warunek Katalaza jest przykładem szczególnie skutecznie
Katalaza jest przykładem szczególnie skutecznie Legenda o andrzejkach
Legenda o andrzejkach Cnoty moralne
Cnoty moralne Napój otrzymano po tym jak rozcieńczono 450 ml soku
Napój otrzymano po tym jak rozcieńczono 450 ml soku Jaki jest najstarszy instrument strunowy
Jaki jest najstarszy instrument strunowy Stowarzyszenie cztery pory roku
Stowarzyszenie cztery pory roku Cztery prawdy wiary
Cztery prawdy wiary Za 30 dag orzechów zapłacono 15 75 zł
Za 30 dag orzechów zapłacono 15 75 zł Cztery żywioły prezentacja dla dzieci
Cztery żywioły prezentacja dla dzieci Prezentacja o czworokątach
Prezentacja o czworokątach W procesie spalania pirytu
W procesie spalania pirytu Alkohole monohydroksylowe ulegają reakcji
Alkohole monohydroksylowe ulegają reakcji Wydajność reakcji
Wydajność reakcji Mechanizmy reakcji organicznych
Mechanizmy reakcji organicznych Termochemia
Termochemia Mechanizmy reakcji organicznych
Mechanizmy reakcji organicznych Estry otrzymywanie
Estry otrzymywanie Entalpia reakcji wzór
Entalpia reakcji wzór Zadania szybkość reakcji
Zadania szybkość reakcji Równowaga chemiczna reakcji 2so3
Równowaga chemiczna reakcji 2so3 Macierz reakcji łańcucha dostaw
Macierz reakcji łańcucha dostaw Najaktywniejszym niemetalem jest
Najaktywniejszym niemetalem jest Typy reakcji organicznych
Typy reakcji organicznych Entalpia reakcji wzór
Entalpia reakcji wzór Węzły chłonne szyi rysunek
Węzły chłonne szyi rysunek Operace symetrie
Operace symetrie Grupy ryzyka wg spauldinga
Grupy ryzyka wg spauldinga 15 zasad netykiety
15 zasad netykiety Grupy rodzinne al-anon
Grupy rodzinne al-anon Nazwa grupy młodzieżowe
Nazwa grupy młodzieżowe Co oznacza grupa na zajęciach wf bk
Co oznacza grupa na zajęciach wf bk Pynna
Pynna Grupy dyspanseryjne w poz
Grupy dyspanseryjne w poz Diagnoza grupy
Diagnoza grupy Algorytm little'a
Algorytm little'a Antygeny
Antygeny Technika grupy nominalnej
Technika grupy nominalnej Paramilitarne grupy dyspozycyjne
Paramilitarne grupy dyspozycyjne Grupy nominalne
Grupy nominalne Fazy grupy
Fazy grupy