LES ANTI INTGRASES LAVENIR DIU de prise en










































- Slides: 67

LES ANTI INTÉGRASES L’AVENIR? DIU de prise en charge multidisciplinaire des personnes vivant avec le VIH-SIDA dans la région des Grands Lacs Promotion 13 Dr Nathalie Dournon, Solène Patrat-Delon

Qu’est-ce qu’un bon ARV? Quelques critères à prendre en compte � Efficacité � Tolérance : immédiate et à long terme � Compatible dans des situations particulières: grossesse, TB, …. � Disponibilité, coût � Simplicité de prise � Molécules disponibles en 2 e ligne en cas d’échec Quelle place donner aux anti intégrases dans la PEC dès maintenant et à l’avenir?

Recommandations OMS de juillet 2019 1ère ligne d’ARV DTG + combinaison de 2 INRTI : pour adultes *, adolescents et enfants si DTG autorisé EFV 400 mg + combinaison de 2 INRTI RAL chez enfants pour qui DTG n’est pas autorisé RAL chez nouveau-né 2ème ligne ARV DTG + combinaison optimisée de 2 INRTI si 1ère ligne sans DTG: pour adultes, adolescents et enfants si DTG autorisé IP boosté + combinaison optimisée de 2 INRTI si 1ère ligne avec DTG * Pour les femmes en âge de procréer: proposer une contraception, si non, une information loyale sur le risque fœtal…. Comment en est-on arrivé là: entre raison(s) et alerte?

L’ainé: le raltégravir

Anti-intégrases 5 sont disponibles: � Raltégravir 2007 � Elvitegravir 2013 � Dolutegravir 2014 � Bictegravir 2018 � Cabotegravir… 2020

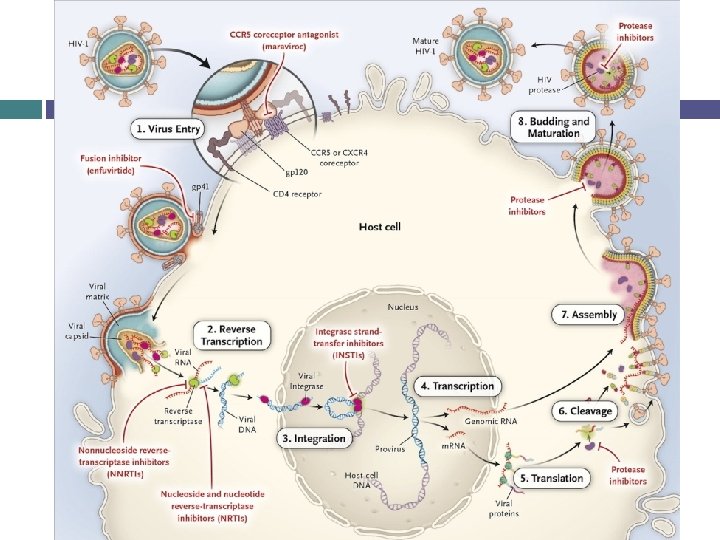
Mécanismes d’actions


Raltégravir: 2007

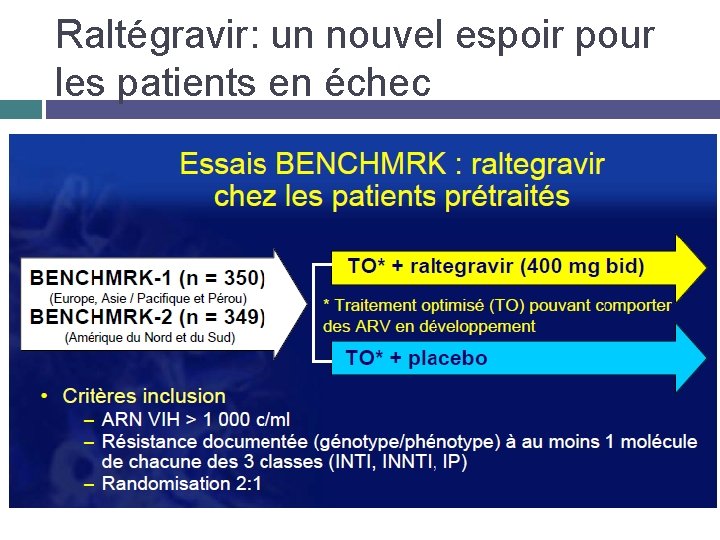
Raltégravir: un nouvel espoir pour les patients en échec

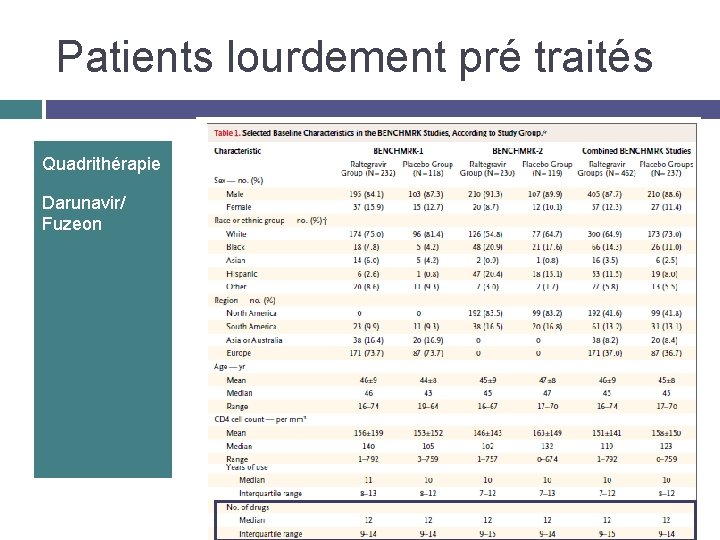
Patients lourdement pré traités Quadrithérapie Darunavir/ Fuzeon

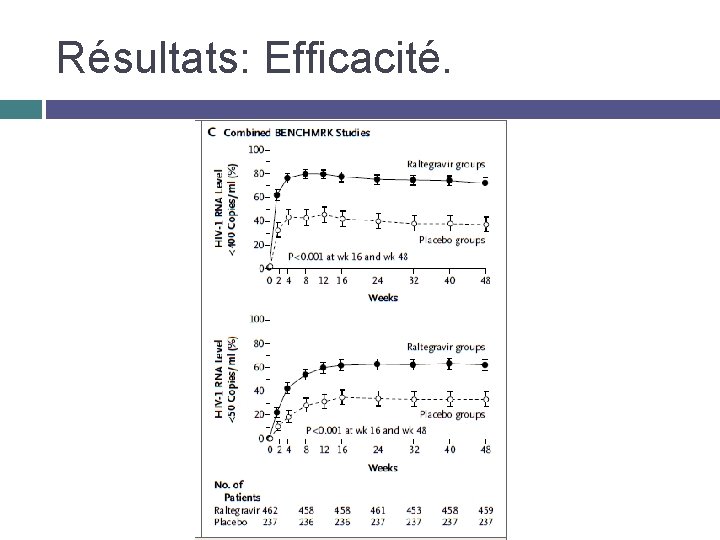
Résultats: Efficacité.

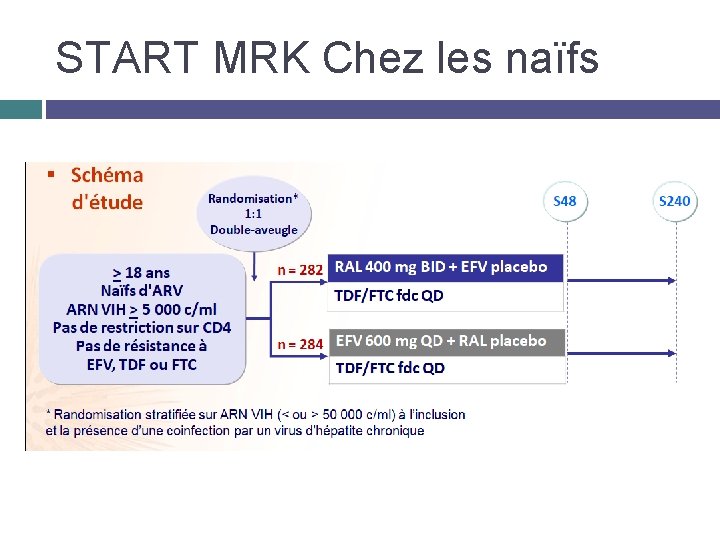
START MRK Chez les naïfs

Résultats à 1 an

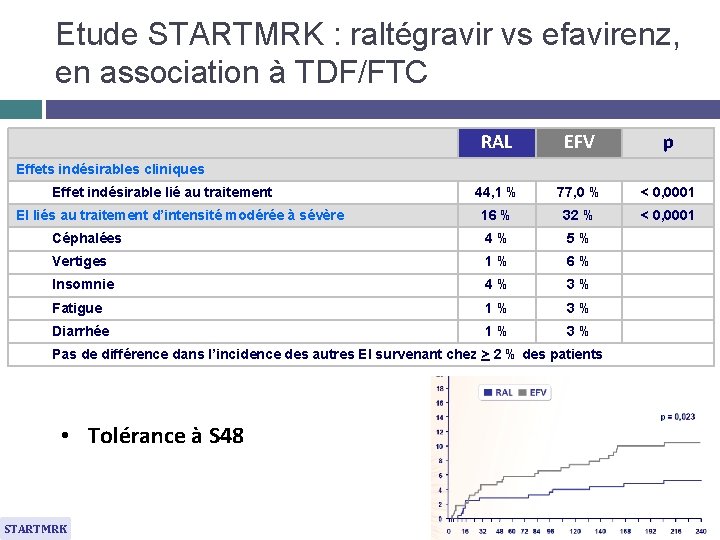
Etude STARTMRK : raltégravir vs efavirenz, en association à TDF/FTC RAL EFV p 44, 1 % 77, 0 % < 0, 0001 16 % 32 % < 0, 0001 Céphalées 4% 5% Vertiges 1% 6% Insomnie 4% 3% Fatigue 1% 3% Diarrhée 1% 3% Effets indésirables cliniques Effet indésirable lié au traitement EI liés au traitement d’intensité modérée à sévère Pas de différence dans l’incidence des autres EI survenant chez > 2 % des patients • Tolérance à S 48 STARTMRK Lennox JL. Lancet 2009; 374: 796 -806

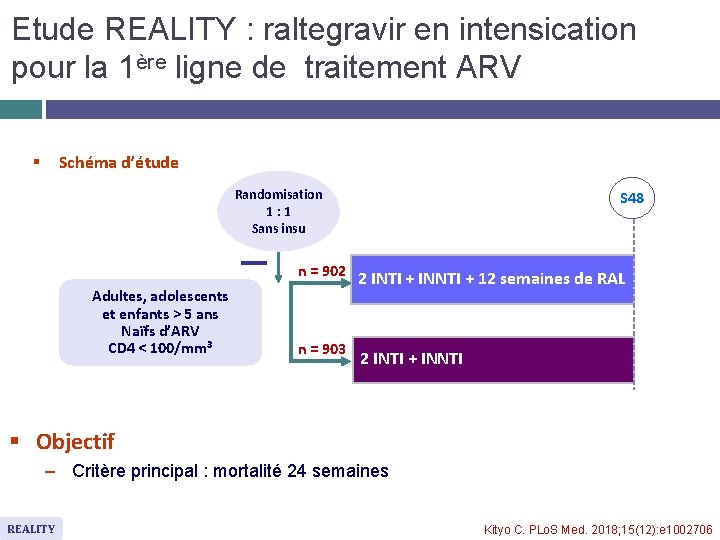
Etude REALITY : raltegravir en intensication pour la 1ère ligne de traitement ARV Schéma d’étude § Randomisation 1: 1 Sans insu n = 902 Adultes, adolescents et enfants > 5 ans Naïfs d’ARV CD 4 < 100/mm 3 n = 903 S 48 2 INTI + INNTI + 12 semaines de RAL 2 INTI + INNTI § Objectif – Critère principal : mortalité 24 semaines REALITY Kityo C. PLo. S Med. 2018; 15(12): e 1002706

Etude REALITY : raltegravir en intensication pour la 1ère ligne de traitement ARV Mortalité ARN VIH < 50 copies/ml (IC 95 %) RAL en intensification Trithérapie standard % % 100 20 74, 1 % 80 15 13, 0 % 10, 9 % 12, 4 % 10 10, 2 % 5 60 76, 0 % 0 82, 9 % 79, 5 % 42, 8 % 54, 6 % 40 S 24 : HR =1, 09 (IC 95 % : 0, 82 -1, 46) ; p = 0, 54 77, 2 % 20 14, 5 % 0 0 8 16 830 825 801 n à risque 903 902 REALITY 24 32 Semaines 789 786 775 40 48 0 4 12 24 Semaines 760 766 669 657 Modification moyenne CD 4/mm 3 à S 48 : + 163 vs + 148 (p = 0, 04) 48 Kityo C. PLo. S Med. 2018; 15(12): e 1002706

Etude REALITY : Raltegravir efficace rapidement! La trithérapie standard (FTC/TDF + EFV) intensifiée avec raltegravir pendant les 12 premières semaines � Etait bien tolérée � Entrainait une réduction plus rapide de l’ARN VIH jusqu’à S 24, et une augmentation plus importante des CD 4 à S 48 � Mais ne réduisait pas la mortalité ni les événements OMS grade 3 ou 4 à S 24 ou à S 48 Kityo C. PLo. S Med. 2018; 15(12): e 1002706

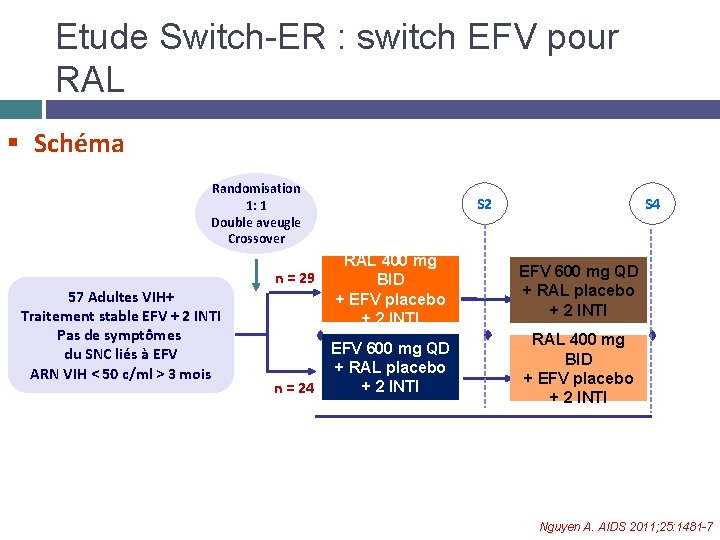
Etude Switch-ER : switch EFV pour RAL § Schéma Randomisation 1: 1 Double aveugle Crossover 57 Adultes VIH+ Traitement stable EFV + 2 INTI Pas de symptômes du SNC liés à EFV ARN VIH < 50 c/ml > 3 mois n = 29 n = 24 S 2 RAL 400 mg BID + EFV placebo + 2 INTI S 4 EFV 600 mg QD + RAL placebo + 2 INTI RAL 400 48 weeks mg EFV 600 mg QD 24 weeks BID Primary Endpoint Secondary Endpoint + RAL placebo + EFV placebo + 2 INTI Nguyen A. AIDS 2011; 25: 1481 -7

Etude Switch-ER : switch EFV pour RAL La moitié des patients sous un traitement stable avec EFV préféraient le switch pour RAL, après exposition en doubleaveugle à RAL pendant 2 semaines A la fin de l’étude, 51 % des patients switchent pour RAL Limites de l’étude � � � Faible nombre de patients Peu de femmes Exclusion des patients ne tolérant pas EFV Nguyen A. AIDS 2011; 25: 1481 -7

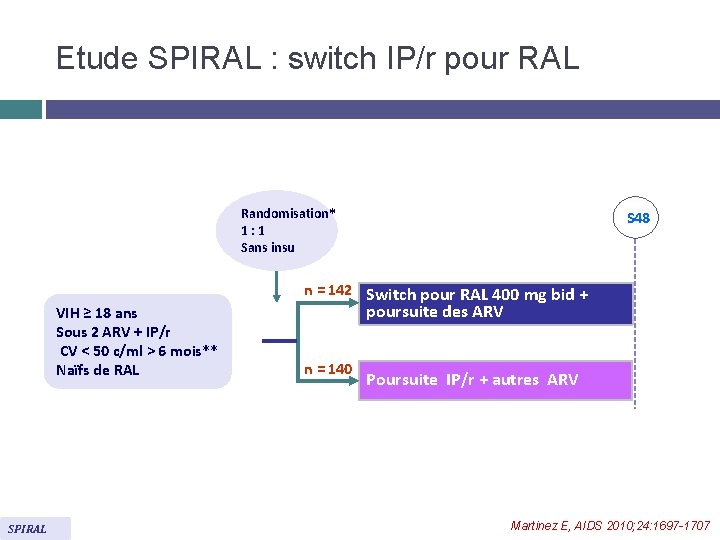
Etude SPIRAL : switch IP/r pour RAL Randomisation* 1: 1 Sans insu VIH ≥ 18 ans Sous 2 ARV + IP/r CV < 50 c/ml > 6 mois** Naïfs de RAL SPIRAL S 48 n = 142 Switch pour RAL 400 mg bid + poursuite des ARV n = 140 Poursuite IP/r + autres ARV Martinez E, AIDS 2010; 24: 1697 -1707


Etude SPIRAL : switch IP/r pour RAL Conclusions � Chez les adultes infectés par le VIH avec une charge virale indétectable (< 50 c/ml) de manière prolongée sous traitement ARV comportant un IP/r, le switch de l’IP/r pour le raltégravir entraîne Une efficacité non inférieure Et un meilleur profil lipidique Martinez E, AIDS 2010; 24: 1697 -1707

Mais….

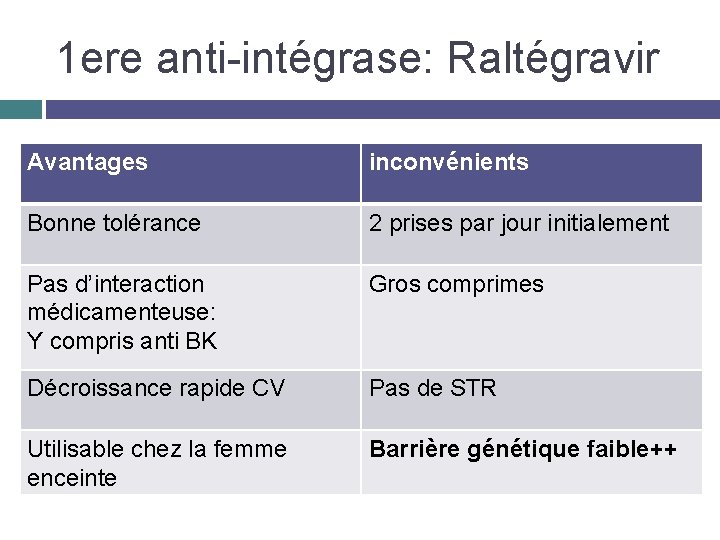
1 ere anti-intégrase: Raltégravir Avantages inconvénients Bonne tolérance 2 prises par jour initialement Pas d’interaction médicamenteuse: Y compris anti BK Gros comprimes Décroissance rapide CV Pas de STR Utilisable chez la femme enceinte Barrière génétique faible++

Une solution? Le dolutegravir

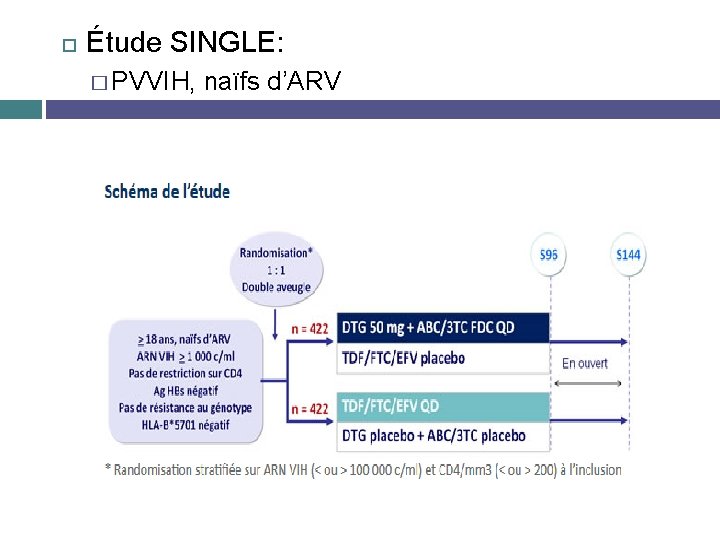
DTG en 1ère ligne: « le bon élève » De nombreuses études: � DTG vs RAL : même efficacité (SPRING) � DTG vs DRV/r : supériorité, pas de résistance, peu d’ES (FLAMINGO) � DTG vs ATV/r chez femmes: supériorité, moins d’arrêt de ttt (ARIA) Étude SINGLE: EFV vs DTG � Randomisée, double aveugle, phase 3 � PVVIH, naïfs d’ARV

Étude SINGLE: � PVVIH, naïfs d’ARV

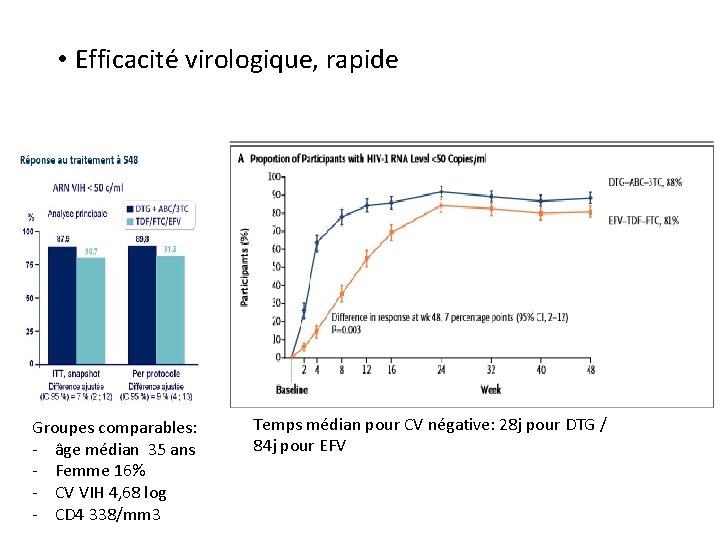
• Efficacité virologique, rapide Groupes comparables: - âge médian 35 ans - Femme 16% - CV VIH 4, 68 log - CD 4 338/mm 3 Temps médian pour CV négative: 28 j pour DTG / 84 j pour EFV

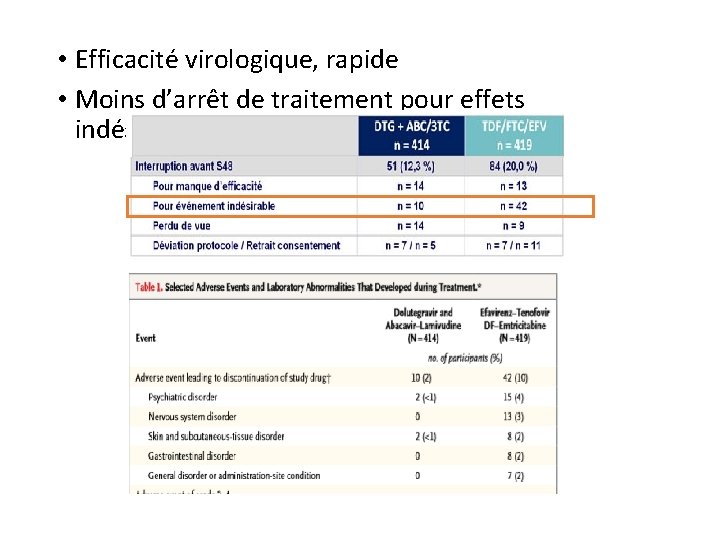
• Efficacité virologique, rapide • Moins d’arrêt de traitement pour effets indésirables

• Efficacité virologique, rapide • Moins d’arrêt de traitement pour effets indésirables 1 seul arrêt de ttt pour insomnie sous DTG

• Efficacité virologique, rapide • Moins d’arrêt de traitement pour effets indésirables • Moins de risque d’acquisition de résistance (idem dans autres études: pas de résistance même si échec) barrière génétique haute++

• Efficacité virologique, rapide • Moins d’arrêt de traitement pour effets indésirables • Moins de risque d’acquisition de résistance (idem dans autres études: pas de résistance même si échec) • Même résultats dans études chez patient naïf: • Sur efficacité et rapidité • Sur (non)acquisition de résistance • Sur bonne tolérance DTG semble un ARV idéal en 1ère ligne

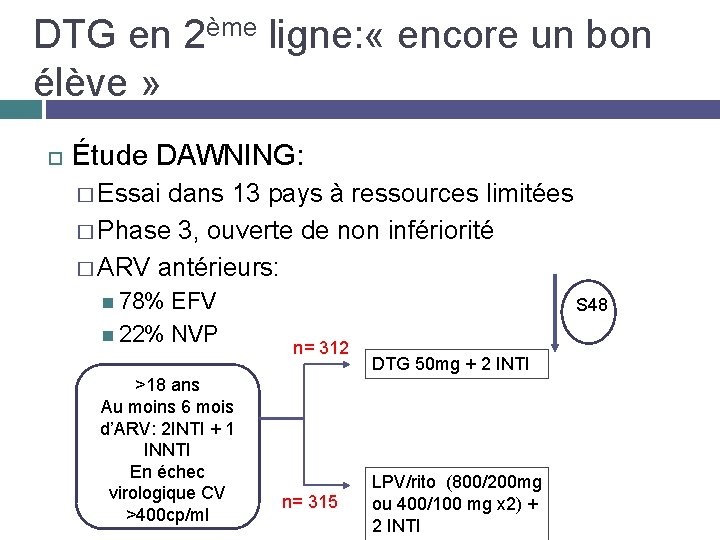
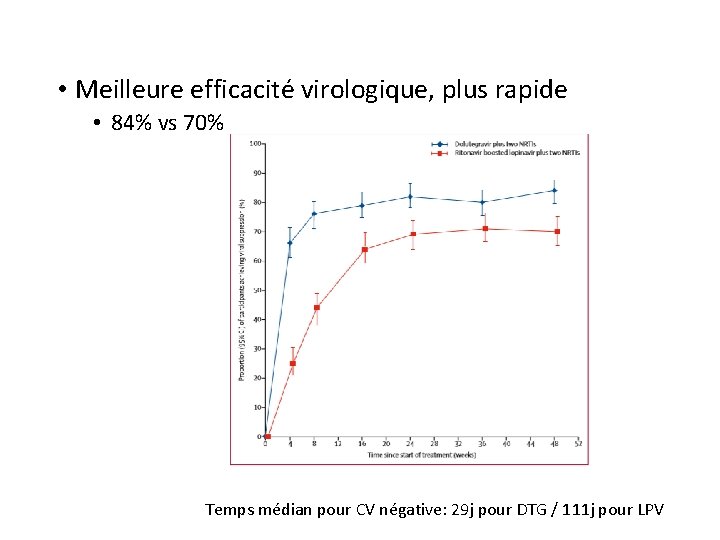
DTG en 2ème ligne: « encore un bon élève » Étude DAWNING: � Essai dans 13 pays à ressources limitées � Phase 3, ouverte de non infériorité � ARV antérieurs: 78% EFV 22% NVP >18 ans Au moins 6 mois d’ARV: 2 INTI + 1 INNTI En échec virologique CV >400 cp/ml S 48 n= 312 n= 315 DTG 50 mg + 2 INTI LPV/rito (800/200 mg ou 400/100 mg x 2) + 2 INTI

• Meilleure efficacité virologique, plus rapide • 84% vs 70% Temps médian pour CV négative: 29 j pour DTG / 111 j pour LPV

• Meilleure efficacité virologique, plus rapide • Meilleure tolérance • Arrêt pour effets secondaires: 3% vs 6% (aucun pour insomnie) DTG n=310 LPV-rito n=314 diarrhée 8% 34% Vomissement 2% 5% Effets psychiatriques 6% 5% Insomnie 3% 2%

• Meilleure efficacité virologique, plus rapide • Meilleure tolérance • Barrière génétique élevée: • Dans groupe DTG: 2 patients avec acquisition de résistance sur intégrase, dont 1 sur NUC (mutation impactant à bas niveau) • Dans groupe IP: 3 patients avec acquisition de résistance sur NUC/ aucun sur protéase DTG a un intérêt fort en 2ème ligne d’ARV, après 2 INTI + 1 INNTI

Efficace, bien toléré, barrière génétique élevée…. Le DOLUTEGRAVIR est-il l’ARV parfait? Qu’en est-il des populations particulières?

Risque malformatif du DTG… quid? Données rassurantes sur RALTEGRAVIR et grossesse Données animales rassurantes sur DOLUTEGRAVIR et foetopathie Finalement: données TSEPAMO � En 2016: DTG devient la 1ère ligne d’ARV au Botswana � Programme de surveillance des anomalies de fermeture du tube neural = AFTN (suite EFV) � 1ère analyse 04/2018: incidence des AFTN était de 4/426 (0. 94%) sous DTG = 10 x plus élevé que si pas de DTG ou pas de VIH !! Restriction d’usage du DTG par OMS en 2018

Poursuite étude TSEPAMO: � 8 maternités publiques + 10 à partir de juillet 2018 = 72% des naissances � 119 477 naissances dont: (444 données manquantes) 1683 exposés au DTG pdt conception 3840 sous DTG après conception 7959 exposés à EFV pdt conception 6833 sous ARV non DTG non EFV à conception � Pas de prévention pré conceptionnelle par folate

Sur risque d’anomalie de fermeture du tube neural: + 2 AFTN sur 1000 naissances

Explications? Antagonisme du DTG sur folate? effet de la supplémentation? Données au Brésil: DTG en 1ère ligne depuis 2017 � Politique de prévention préconceptionnelle par Folate � AFTN = 0, 006% � À partir de 2018: 3390 grossesses sous anti ARV / 382 femmes sous DTG � Pas de cas d’AFTN � …. Plutôt rassurant mais à prendre avec précautions levée de la restriction d’usage du DTG chez femme en âge de procréer …. Avec une contraception si possible, et si non, une

Sécurité du DTG en cas de tuberculose Problématique VIH/tuberculose: � 1ère IO en Afrique � Interactions avec RIFAMPICINE � Toxicités cumulées � IRIS RIFAMPICINE: Pas d’interaction significative Interaction EFV DTG doubler dose de DTG à 50 mg x 2/jour RALTEGRAVIR IP boosté ne pas les utiliser

Étude INSPIRING: (double dose de DTG …difficile à mettre en place) � Étude non comparative, randomisée, en ouvert � PVVIH naïfs, traité pour une tuberculose sensible < 8 semaines Bonne efficacité sur VIH Idem pour BK: 88% de guérison 2 échecs virologiques documentés: pas de résistance génotypique Aucun arrêt de TARV pour ES

Le DTG est un ARV incontournable au présent et dans un avenir proche Efficace, bien toléré, barrière génétique élevée Utilisable dans des populations spécifiques: � tuberculose ok, mais nécessité de doubler la dose …. Difficultés de mise en place/ étude pour voir si 50 mg/j avec RIFAMPICINE pourrait suffire � femme enceinte : on attend encore des

L’avenir des ARV: Allègement et simplification Pour gagner en tolérance ou en simplicité Différentes stratégies sont proposées: Diminution du nombre de prise (Diminution du nombre de comprimés) Diminution de nombre d’ARV: bithérapie, monothérapie? Le DOLUTEGRAVIR permet -il d’envisager des simplifications?

Place du DTG dans les bithérapies en switch? • Études ASPIRE: • Étude phase 3, en ouvert, randomisé • Chez PVVIH bien contrôlé, sans échec • Switch pour DTG 3 TC

• Études SWORD: • Étude phase 3, en ouvert, randomisé • Chez PVVIH bien contrôlé, sans échec • Switch pour DTG RILPIVIRINE • Excellente réponse virologique • Moins bonne tolérance (que le TARV habituel des patients…) • Que 4% des patients qui arrêtent DTG, RILPI, et 7% à 2 ans • Effets secondaires peu graves • Qq échecs thérapeutiques, sans émergence de résistance au DTG

Place du DTG en monothérapie en switch? • Étude DOLAM: • En ouvert, randomisé • Ca ne marche pas!! : 2 patients ont développé un échec avec acquisition de résistance au DTG avant 6 mois

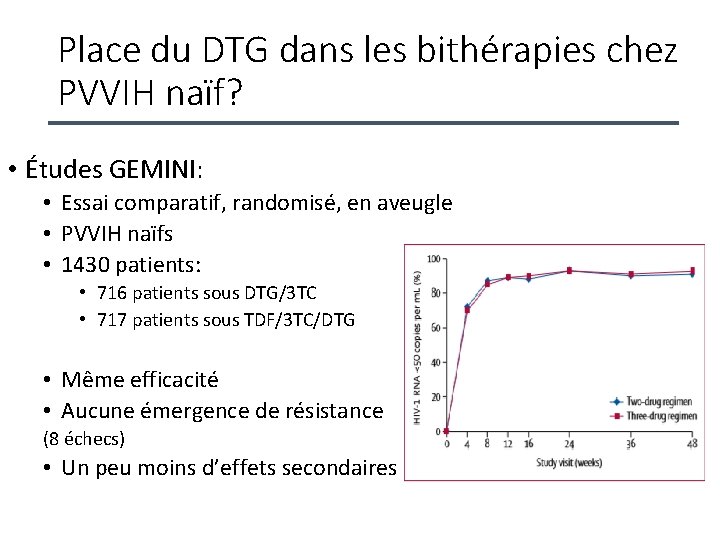
Place du DTG dans les bithérapies chez PVVIH naïf? • Études GEMINI: • Essai comparatif, randomisé, en aveugle • PVVIH naïfs • 1430 patients: • 716 patients sous DTG/3 TC • 717 patients sous TDF/3 TC/DTG • Même efficacité • Aucune émergence de résistance (8 échecs) • Un peu moins d’effets secondaires

Le DTG est un ARV incontournable au présent et dans un avenir proche Efficace, bien toléré, barrière génétique élevée Utilisable dans des populations spécifiques, avec encore des précautions Permet des stratégies d’allègement

Et demain? : cabotegravir

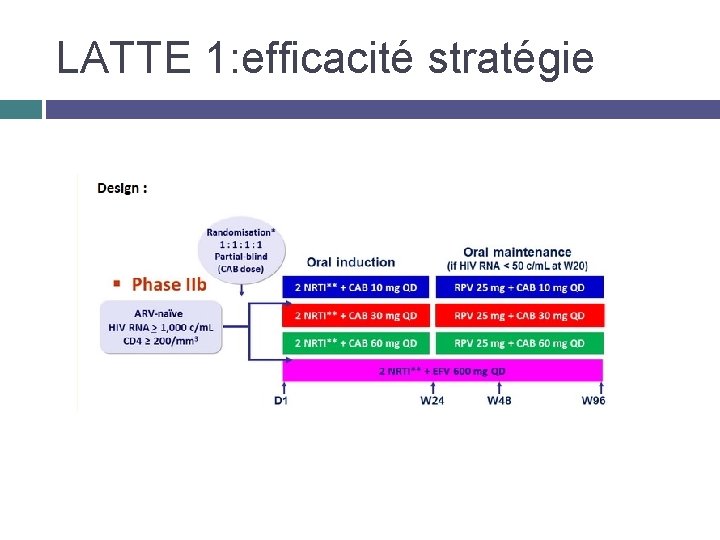
LATTE 1: efficacité stratégie

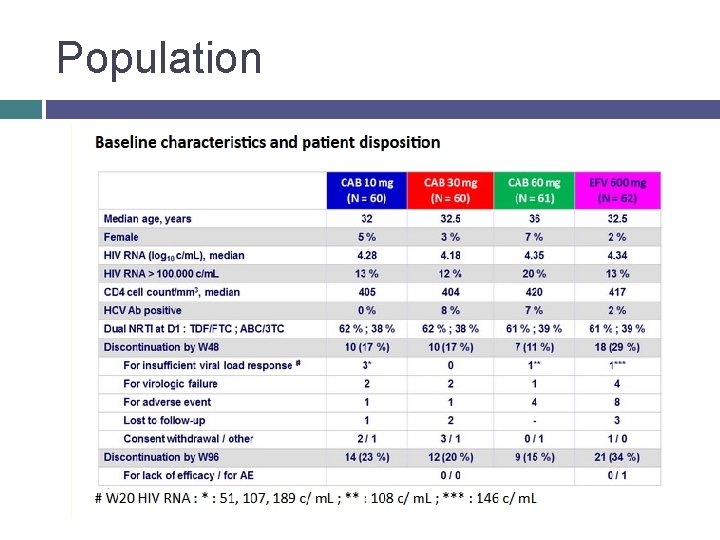
Population

Résultats

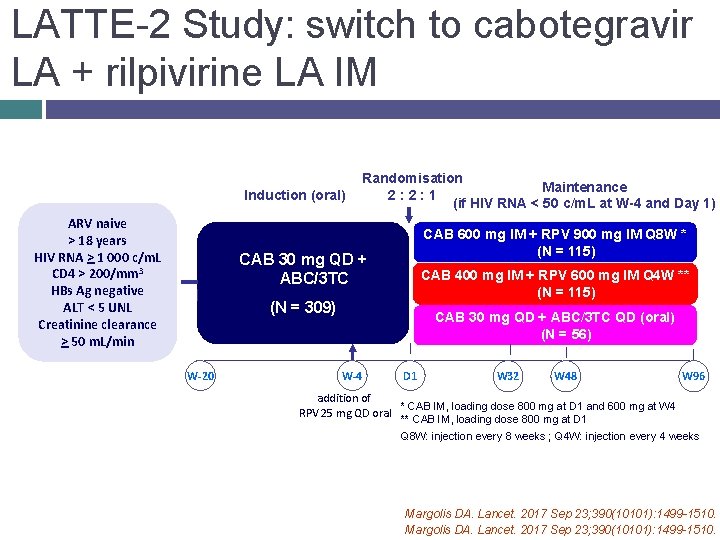
LATTE-2 Study: switch to cabotegravir LA + rilpivirine LA IM Induction (oral) ARV naive > 18 years HIV RNA > 1 000 c/m. L CD 4 > 200/mm 3 HBs Ag negative ALT < 5 UNL Creatinine clearance > 50 m. L/min Randomisation Maintenance 2: 2: 1 (if HIV RNA < 50 c/m. L at W-4 and Day 1) CAB 600 mg IM + RPV 900 mg IM Q 8 W * (N = 115) CAB 30 mg QD + ABC/3 TC CAB 400 mg IM + RPV 600 mg IM Q 4 W ** (N = 115) (N = 309) W-20 CAB 30 mg QD + ABC/3 TC QD (oral) (N = 56) W-4 D 1 W 32 W 48 W 96 addition of * CAB IM, loading dose 800 mg at D 1 and 600 mg at W 4 RPV 25 mg QD oral ** CAB IM, loading dose 800 mg at D 1 Q 8 W: injection every 8 weeks ; Q 4 W: injection every 4 weeks Margolis DA. Lancet. 2017 Sep 23; 390(10101): 1499 -1510.

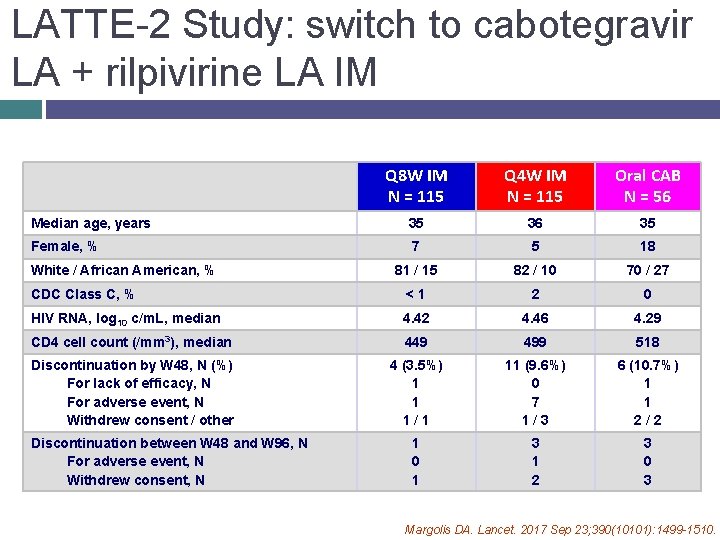
LATTE-2 Study: switch to cabotegravir LA + rilpivirine LA IM Q 8 W IM N = 115 Q 4 W IM N = 115 Oral CAB N = 56 Median age, years 35 36 35 Female, % 7 5 18 81 / 15 82 / 10 70 / 27 CDC Class C, % <1 2 0 HIV RNA, log 10 c/m. L, median 4. 42 4. 46 4. 29 CD 4 cell count (/mm 3), median 449 499 518 Discontinuation by W 48, N (%) For lack of efficacy, N For adverse event, N Withdrew consent / other 4 (3. 5%) 1 1 1/1 11 (9. 6%) 0 7 1/3 6 (10. 7%) 1 1 2/2 1 0 1 3 1 2 3 0 3 White / African American, % Discontinuation between W 48 and W 96, N For adverse event, N Withdrew consent, N Margolis DA. Lancet. 2017 Sep 23; 390(10101): 1499 -1510.

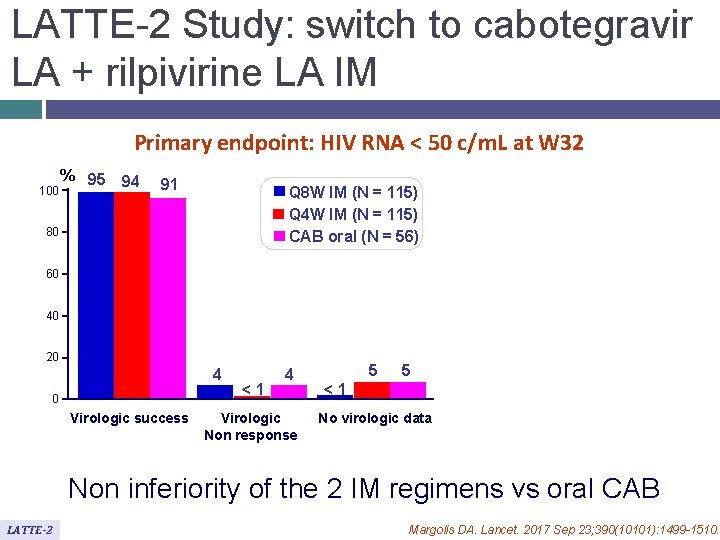
LATTE-2 Study: switch to cabotegravir LA + rilpivirine LA IM Primary endpoint: HIV RNA < 50 c/m. L at W 32 100 % 95 94 91 Q 8 W IM (N = 115) Q 4 W IM (N = 115) CAB oral (N = 56) 80 60 40 20 4 0 Virologic success <1 4 Virologic Non response 5 5 <1 No virologic data Non inferiority of the 2 IM regimens vs oral CAB LATTE-2 Margolis DA. Lancet. 2017 Sep 23; 390(10101): 1499 -1510.

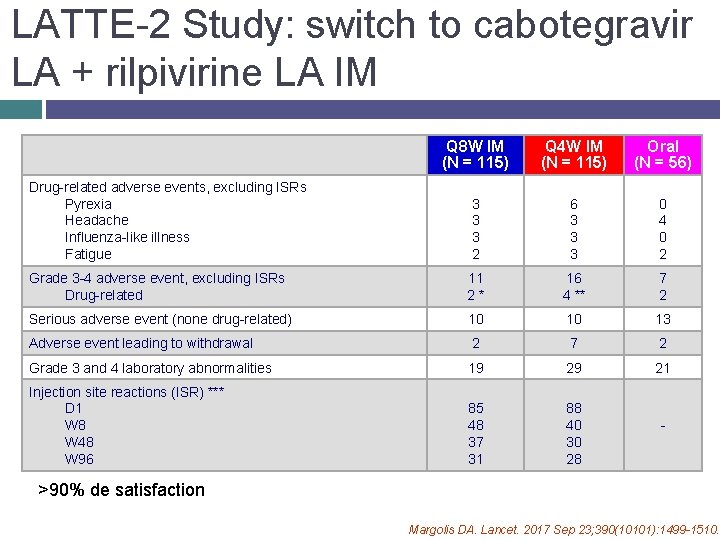
LATTE-2 Study: switch to cabotegravir LA + rilpivirine LA IM Q 8 W IM (N = 115) Q 4 W IM (N = 115) Oral (N = 56) 3 3 3 2 6 3 3 3 0 4 0 2 Grade 3 -4 adverse event, excluding ISRs Drug-related 11 2 * 16 4 ** 7 2 Serious adverse event (none drug-related) 10 10 13 Adverse event leading to withdrawal 2 7 2 Grade 3 and 4 laboratory abnormalities 19 29 21 Injection site reactions (ISR) *** D 1 W 8 W 48 W 96 85 48 37 31 88 40 30 28 Drug-related adverse events, excluding ISRs Pyrexia Headache Influenza-like illness Fatigue - >90% de satisfaction Margolis DA. Lancet. 2017 Sep 23; 390(10101): 1499 -1510.

LATTE-2 Study: conclusion Efficacité tolérance Margolis DA. Lancet. 2017 Sep 23; 390(10101): 1499 -1510.

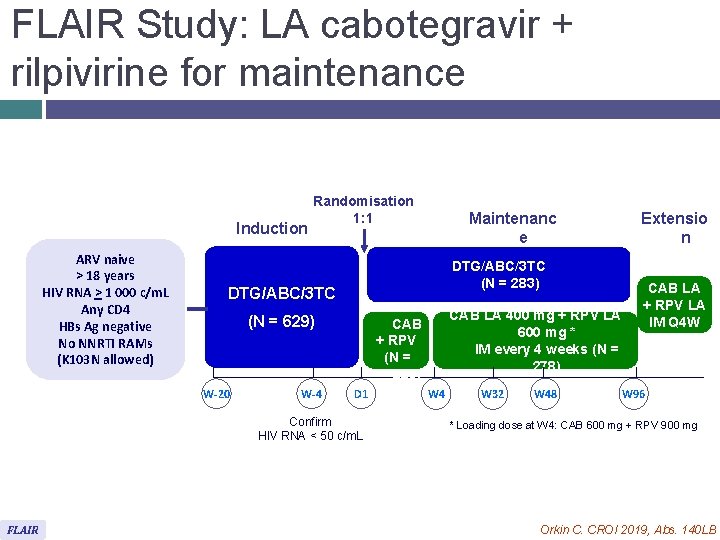
FLAIR Study: LA cabotegravir + rilpivirine for maintenance Induction ARV naive > 18 years HIV RNA > 1 000 c/m. L Any CD 4 HBs Ag negative No NNRTI RAMs (K 103 N allowed) Randomisation 1: 1 DTG/ABC/3 TC (N = 283) DTG/ABC/3 TC Oral CAB + RPV (N = 283) (N = 629) W-20 W-4 D 1 Confirm HIV RNA < 50 c/m. L FLAIR Maintenanc e CAB LA 400 mg + RPV LA 600 mg * IM every 4 weeks (N = 278) W 4 W 32 W 48 Extensio n CAB LA + RPV LA IM Q 4 W W 96 * Loading dose at W 4: CAB 600 mg + RPV 900 mg Orkin C. CROI 2019, Abs. 140 LB

FLAIR Study: LA cabotegravir + rilpivirine for maintenance DTG/ABC/3 TC N = 283 CAB LA + RPV LA N = 283 Median age, years 34 34 Female, % 23 22 White / Black or African American, % 71 / 20 76 / 17 HIV RNA, copies/m. L: < 100 000 / ≥ 100 000, % 80 / 20 CD 4 cell count/mm 3 median < 200/mm 3, % 452 8 437 6 HCV co-infection, % 3 7 625 624 12 (4. 2) 2 10 12 (4. 2) 8 2 W-20 characteristics D 1: CD 4 cell count/mm 3, median Discontinuation D 1 -W 48, N (%) For adverse event For other reasons Orkin C. CROI 2019, Abs. 140 LB

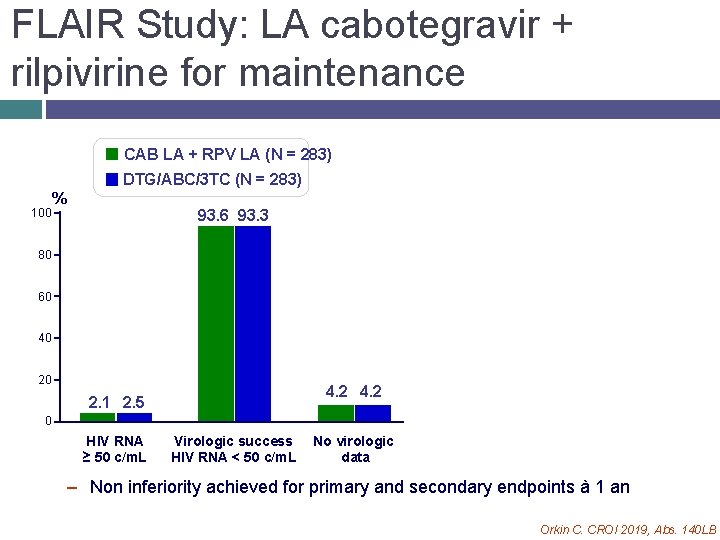
FLAIR Study: LA cabotegravir + rilpivirine for maintenance CAB LA + RPV LA (N = 283) DTG/ABC/3 TC (N = 283) 100 % 93. 6 93. 3 80 60 40 20 4. 2 2. 1 2. 5 0 HIV RNA ≥ 50 c/m. L Virologic success HIV RNA < 50 c/m. L No virologic data – Non inferiority achieved for primary and secondary endpoints à 1 an Orkin C. CROI 2019, Abs. 140 LB

FLAIR Study: LA cabotegravir + rilpivirine for maintenance % 100 80 60 Acceptability of injection site reaction and pain 3 6 16 5 29 0 11 <1 3 11 24 29 1 4 14 1 2 11 1 3 12 35 31 35 Very acceptable Moderately acceptable A little acceptable 60 45 55 49 Pain ISR Pain 33 ISR 80 Not at all acceptable 57 47 100 Pain ISR W 5 % W 41 Participants with ISR W 48 71 43 40 38 32 31 33 29 27 27 24 28 Weeks 32 36 34 24 20 44 48 20 0 FLAIR Totally acceptable 28 40 20 50 4 8 Loading dose 12 16 20 40 Murray M, IAS 2019, Abs. MOPEB 258

FLAIR Study: conclusion � IM injections of CAB LA + RPV LA every 4 weeks was non inferior to daily oral DTG/ABC/3 TC at W 48 For proportion of virologic rebound: HIV RNA ≥ 50 c/m. L in 2. 1% vs 2. 5% For proportion maintaining HIV-1 suppression � Injection site reactions in the LA arm were common but mainly grade 1 or 2, with few associated discontinuations � Highly positive treatment satisfaction and preference outcomes with LA regimen FLAIR Orkin C. CROI 2019, Abs. 140 LB

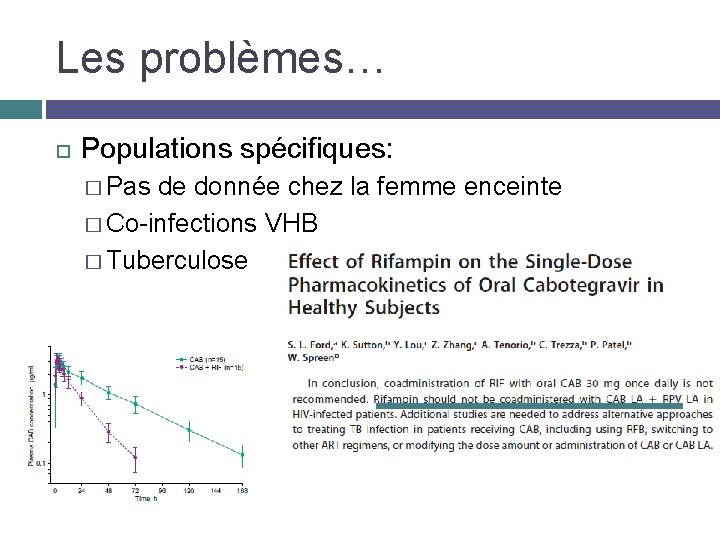
Les problèmes… Populations spécifiques: � Pas de donnée chez la femme enceinte � Co-infections VHB � Tuberculose

Conclusion Avenir à court terme: place des anti intégrases, en particulier DTG ++ � � � Efficace Bien toléré Barrière génétique haute Possibilité d’utilisation dans des pop° spécifiques Possibilité de simplification À long terme: de nouvelles thérapeutiques sont proposées: � � � Nouvelle anti intégrase: CABOTEGRAVIR Inhibiteurs d’entrée: FOSTEMSAVIR, IBALIZUMAB Nouvel INNTI: DORAVIRINE Nouvelle classe INTTI: ISLATRAVIR …

Merci de votre attention
 Anti a and anti rh blood type
Anti a and anti rh blood type Première prise de contact avec les élèves
Première prise de contact avec les élèves Prise de constantinople par les croisés
Prise de constantinople par les croisés Benjamin grasset
Benjamin grasset Blc diu
Blc diu Schematic arrangement of diesel power plant
Schematic arrangement of diesel power plant Hasna hena diu
Hasna hena diu Diu mirena duracion
Diu mirena duracion Diu payment system
Diu payment system Gaio vipstano c fonteio
Gaio vipstano c fonteio Gynefix diu
Gynefix diu Blc diu
Blc diu Zahid hasan diu
Zahid hasan diu Tabatière anatomique
Tabatière anatomique Cse diu
Cse diu Angle
Angle Prise de note
Prise de note Prise en charge du client
Prise en charge du client Fivre 2017
Fivre 2017 Maladie de forestier
Maladie de forestier Prise de terrain en u
Prise de terrain en u Papillon de comptage inventaire
Papillon de comptage inventaire Prise marteau badminton
Prise marteau badminton Retro coronaire
Retro coronaire Peptide c valeurs normales
Peptide c valeurs normales Torus palatin prise en charge
Torus palatin prise en charge Schéma d'un ascenseur électrique
Schéma d'un ascenseur électrique Prise de poids sophie marceau
Prise de poids sophie marceau Prise en charge psychologique définition
Prise en charge psychologique définition Prise en charge hyponatremie
Prise en charge hyponatremie Ou a été prise cette photo
Ou a été prise cette photo Classification des locaux selon nf c 15-100
Classification des locaux selon nf c 15-100 Script pour prendre rendez vous
Script pour prendre rendez vous Vs pep de boussignac
Vs pep de boussignac Dermatochalasis prise en charge
Dermatochalasis prise en charge Prise en main a distance gratuit
Prise en main a distance gratuit Diathèse de ménétrier pdf
Diathèse de ménétrier pdf Les themes traites dans la ficelle
Les themes traites dans la ficelle Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Grand corp malade train
Grand corp malade train Classe de mot variable et invariable
Classe de mot variable et invariable Les parts de les flors
Les parts de les flors Fonctions techniques et solutions techniques
Fonctions techniques et solutions techniques Toc toc quelqu'un frappe à ma porte
Toc toc quelqu'un frappe à ma porte Les constellations les plus connues
Les constellations les plus connues Type d'organisateur textuel
Type d'organisateur textuel Allez vous en sur les places
Allez vous en sur les places Les lettres en français
Les lettres en français Les voitures les plus rapides du monde
Les voitures les plus rapides du monde L'horloge stratégique
L'horloge stratégique Remplacez les mots soulignes par les pronoms convenable
Remplacez les mots soulignes par les pronoms convenable Les mot variable
Les mot variable Cestbeaulavie
Cestbeaulavie Preactionneurs
Preactionneurs Le volcan le plus dangereux du monde
Le volcan le plus dangereux du monde Qu'est-ce que tu aimes manger
Qu'est-ce que tu aimes manger Les parts de les plantes
Les parts de les plantes Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Type de texte expressif
Type de texte expressif Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Anti italian cartoon
Anti italian cartoon Torque antihorario
Torque antihorario Anti federalist beliefs
Anti federalist beliefs What is anti matter
What is anti matter Pantun sindiran 2 kerat
Pantun sindiran 2 kerat Anti petrarchismo
Anti petrarchismo Anti bias education
Anti bias education Hydroboration oxidation syn or anti
Hydroboration oxidation syn or anti