La funzione della microcircolazione quella di asservire ai













































































- Slides: 112


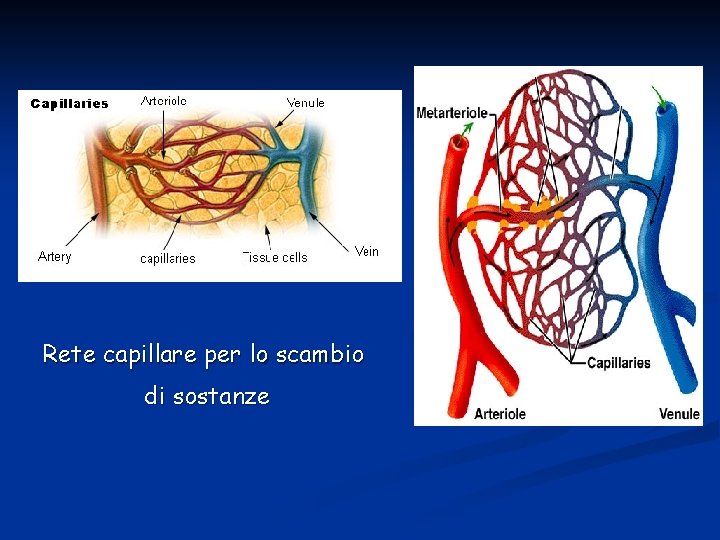
La funzione della microcircolazione è quella di asservire ai due scopi principali di trasporto di nutrienti ai tessuti e rimozione delle sostanze di scarto. La microcircolazione utilizza arteriole, capillari, venule e terminali linfatici. Le arteriole controllano il flusso sanguigno a ciascuna area di tessuto e le condizioni locali del tessuto determinano un controllo sul diametro arteriolare.

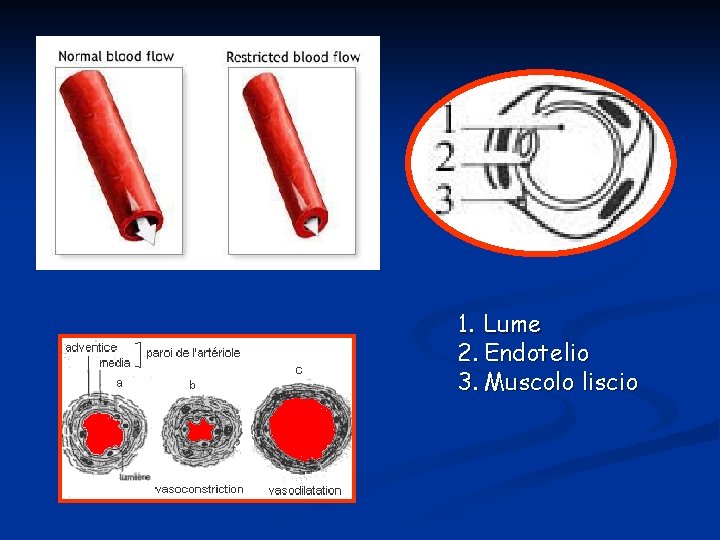
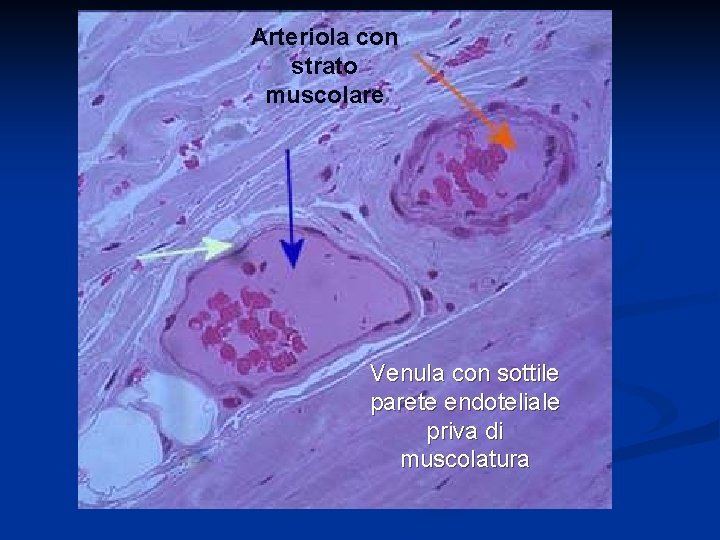
Arteriole e Arteriole terminali Piccoli vasi di resistenza, precapillari, formati da endotelio che poggia su uno o più strati di tessuto muscolare liscio. Le arteriole più piccole (7μm) sono dette terminali (sfinteri pre-capillari) in quanto danno origine ai capillari. Sono riccamente innervate dal sistema simpatico e rispondono all’attivazione di recettori 1 e 2 adrenergici. Influenzano lo scambio capillare regolandone la pressione idrostatica.

1. Lume 2. Endotelio 3. Muscolo liscio

Arteriola con strato muscolare Venula con sottile parete endoteliale priva di muscolatura

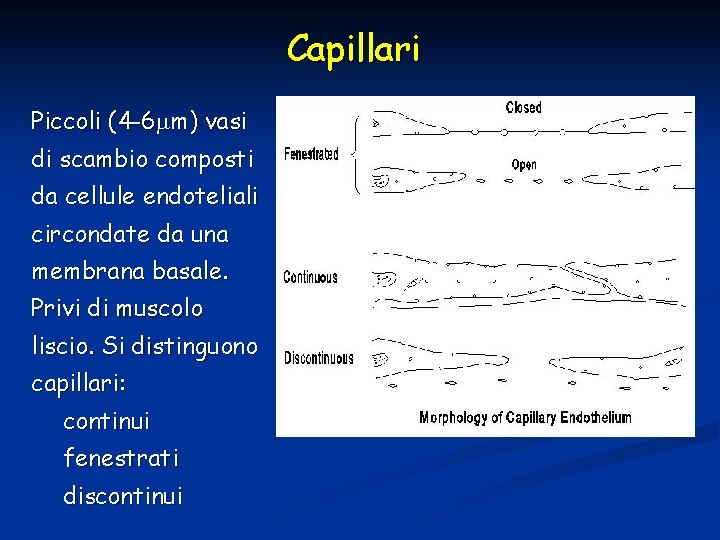
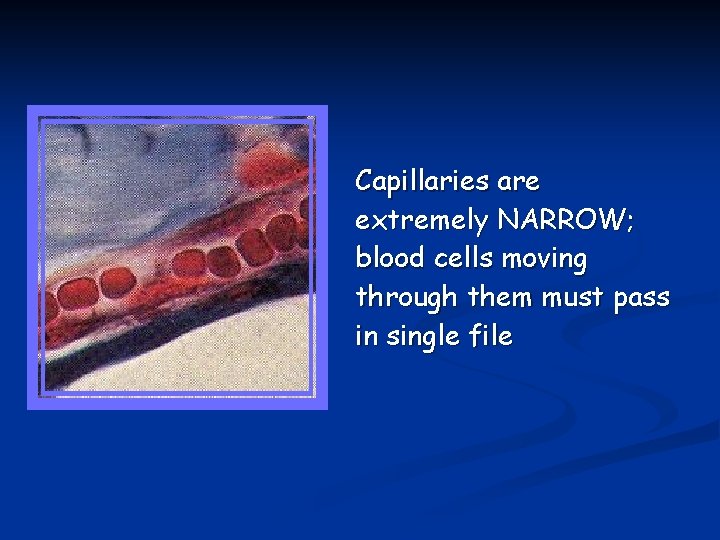
Capillari Piccoli (4 -6 m) vasi di scambio composti da cellule endoteliali circondate da una membrana basale. Privi di muscolo liscio. Si distinguono capillari: continui fenestrati discontinui

Continui o di primo tipo: si trovano nel muscolo, nella cute, nel SNC. Le cellule endoteliali sono molto vicine con stretti spazi fra le une e le altre. Bassa permeabilità. A livello di SNC ci sono giunzioni strette che sono responsabili della formazione della barriera ematoencefalica Fenestrati o di secondo tipo: in cellule esocrine, glomeruli renali, mucosa intestinale. Endotelio con perforazioni con una permeabilità relativamente alta. Discontinui o di terzo tipo: in fegato, milza, midollo osseo. Grossi spazi intercellulari con elevata permeabilità


Capillaries are extremely NARROW; blood cells moving through them must pass in single file

Venule Piccoli (15 -30 m) vasi di scambio composti da cellule endoteliali circondate da una membrana basale e scarso muscolo liscio. Le venule più grandi ricevono afferenze simpatiche possono alterare il tono giocando un ruolo nella regolazione della pressione idrostatica del capillare. Terminali linfatici Li vedremo meglio facendo il sistema linfatico. Formati da endotelio con una membrana basale molto permeabile. Hanno valvole unidirezionali per eliminare la linfa dai tessuti.

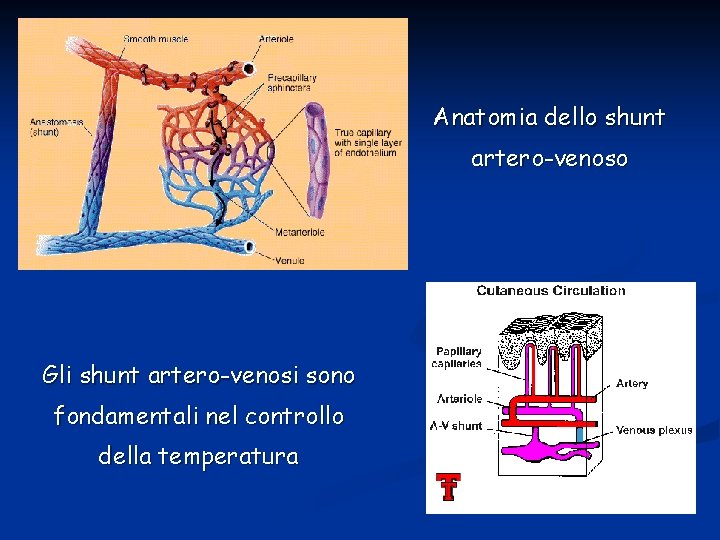
Esistono tessuti che sono caratterizzati da una bassa densità di capillari quali ad esempio cartilagine e tessuto sottocutaneo. Al contrario alcuni tessuti risultano molto riccamente vascolarizzati perché hanno un’elevata attività metabolica. È questo il caso di cuore, muscolo striato, fegato e rene. Distinguiamo Flusso nutrizionale: si intende il flusso di sangue attraverso i capillari per scambio di gas e soluti Flusso non-nutrizionale o cortocircuitato: si intende il flusso attraverso shunt artero-venosi.

Rete capillare per lo scambio di sostanze

Anatomia dello shunt artero-venoso Gli shunt artero-venosi sono fondamentali nel controllo della temperatura

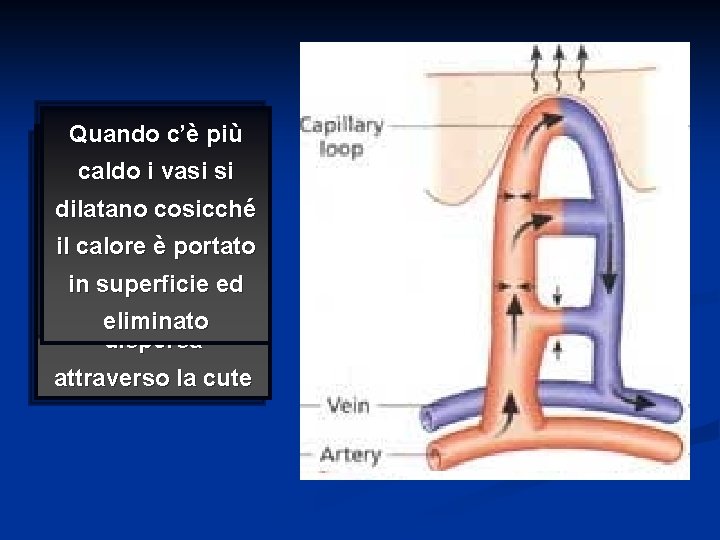
Quando c’è più Quando c’è freddo caldo i vasi si i vasi del derma dilatano cosicché costringono il calore è portato limitando così la in superficie ed quantità di calore eliminato dispersa attraverso la cute

I capillari del nostro organismo sono circa 10 miliardi per una superficie di scambio di 500 -700 m 2. In genere la distanza max fra capillare e cellula non è mai superiore a 20 -30 m. Molto spesso gli eritrociti devono deformarsi per passare attraverso i capillari più piccoli. La velocità di scorrimento non è costante, ma dipende dallo stato di vasocostrizione e vasodilatazione delle arteriole. In genere V 1 mm/s.

Funzioni attive dell’endotelio capillare L’endotelio capillare (epitelio squamoso semplice) non ha solo una funzione passiva di barriera fra ambiente sanguigno e tessuto, ma ha un ruolo attivo in quanto secerne un certo numero di sostanze capaci di provocare contrazione o rilasciamento del muscolo liscio vascolare.

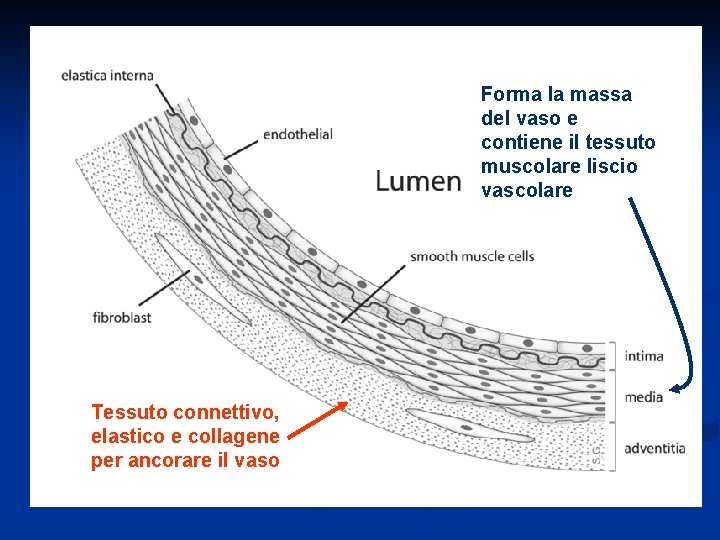
Forma la massa del vaso e contiene il tessuto muscolare liscio vascolare Tessuto connettivo, elastico e collagene per ancorare il vaso

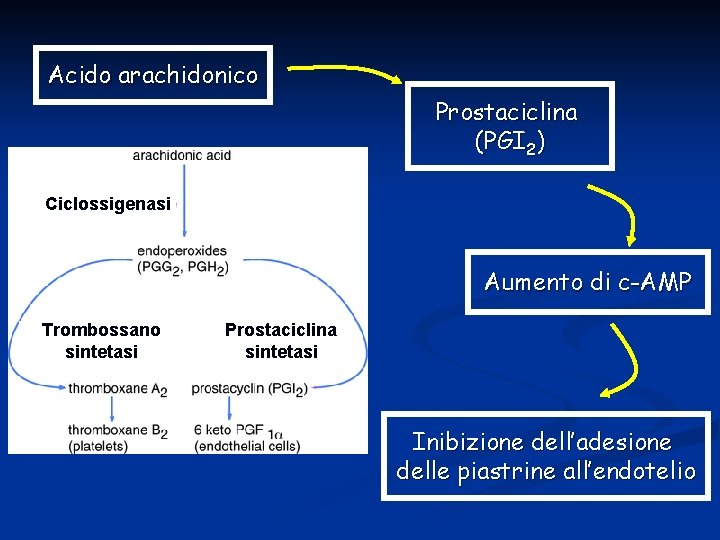
Fra le sostanze secrete dall’endotelio ne vediamo alcune. PROSTACICLINA: Per evitare che le piastrine in condizioni normali si aggreghino a formare tappi, viene sintetizzata prostaciclina che deriva dall’acido arachidonico. Lo stimolo alla secrezione è dato dalla distensione meccanica del vaso da parte del flusso sanguigno. Quando questo si interrompe per lesione vascolare, la sintesi di prostaciclina termina.

Acido arachidonico Prostaciclina (PGI 2) Ciclossigenasi Aumento di c-AMP Trombossano sintetasi Prostaciclina sintetasi Inibizione dell’adesione delle piastrine all’endotelio

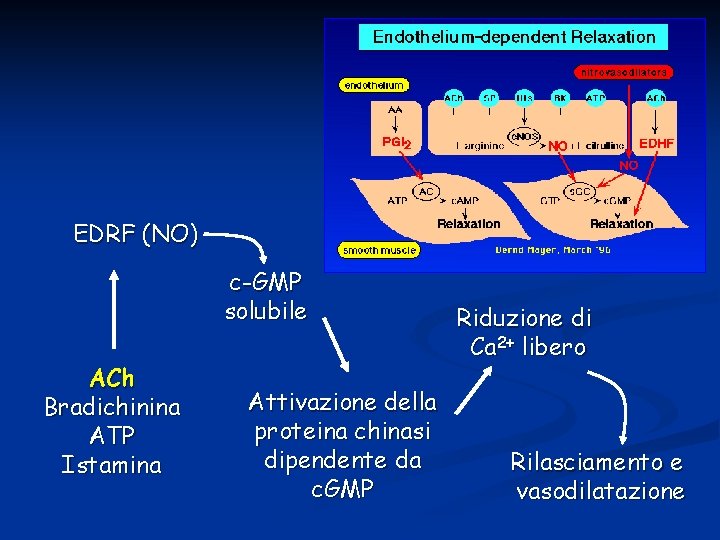
EDRF: Accanto alla prostaciclina esiste il fattore rilasciante di origine endoteliale (EDRF) oggi identificato come NO, prodotto dall’enzima NOsintasi a partire dalla L-Arg e che ha una potente azione vasodilatante soprattutto in risposta ad ACh, ma anche ad altre sostanze e neurotrasmettitori. In vasi privi di endotelio non si ha produzione né di PGI 2 né di EDRF

EDRF (NO) c-GMP solubile ACh Bradichinina ATP Istamina Attivazione della proteina chinasi dipendente da c. GMP Riduzione di Ca 2+ libero Rilasciamento e vasodilatazione

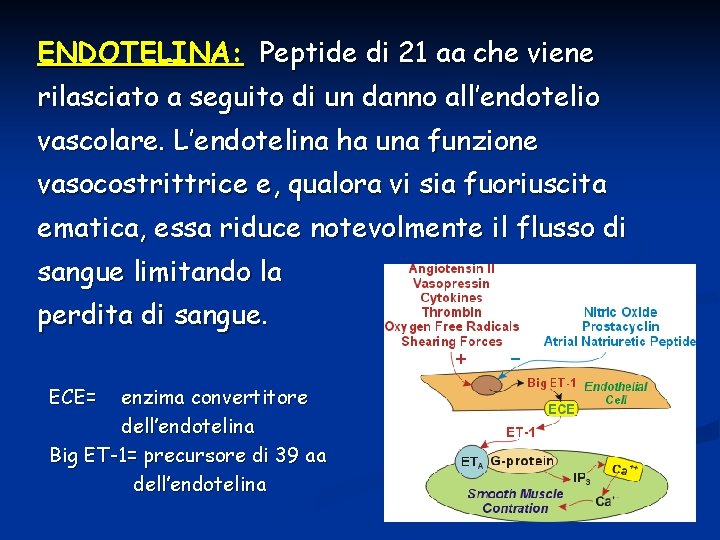
ENDOTELINA: Peptide di 21 aa che viene rilasciato a seguito di un danno all’endotelio vascolare. L’endotelina ha una funzione vasocostrittrice e, qualora vi sia fuoriuscita ematica, essa riduce notevolmente il flusso di sangue limitando la perdita di sangue. ECE= enzima convertitore dell’endotelina Big ET-1= precursore di 39 aa dell’endotelina

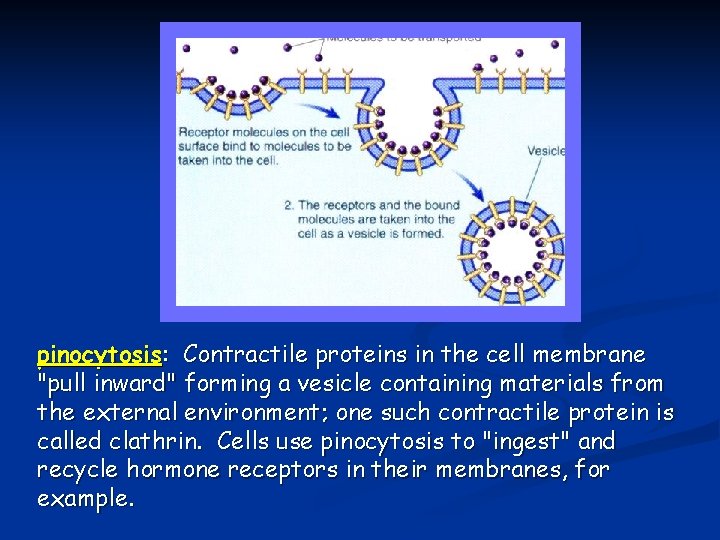
Ruolo passivo dell’endotelio capillare: diffusione, filtrazione, pinocitosi Fluidi, elettroliti, gas, molecole di piccolo e grande peso molecolare, acqua si possono muovere attraverso l’endotelio capillare grazie a diversi meccanismi. La permeabilità varia nei diversi tipi di capillare e, in genere, è maggiore al capo arterioso rispetto al capo venoso. La pinocitosi è un meccanismo che permette il passaggio di macromolecole attraverso l’endotelio ed avviene attraverso la formazione di vescicole di trasporto.

pinocytosis: Contractile proteins in the cell membrane "pull inward" forming a vesicle containing materials from the external environment; one such contractile protein is called clathrin. Cells use pinocytosis to "ingest" and recycle hormone receptors in their membranes, for example.



Diffusione Particolarmente importante a livello capillare per il trasporto di gas e sostanze liposolubili è il meccanismo della diffusione. In realtà si tratta di un meccanismo complesso che deve tenere conto di: Attrazione fra molecole di soluto e solvente q Interazioni fra le molecole di soluto q Configurazione dei pori q Le molecole liposolubili si muovono con grande rapidità fra sangue e tessuto. Il grado di solubilità lipidica fornisce un buon indice della facilità di trasferimento di molecole lipidiche attraverso l’endotelio capillare.

La diffusione è regolata dalla legge di Fick: J = - D • A • dc/dx dove J= flusso in moli/s D= coefficiente di diffusione A= area di scambio dc/dx= gradiente di concentrazione al variare dello spessore Per molecole di dimensioni piccole (Na. Cl, urea, glucosio) i pori offrono scarse limitazioni alla diffusione, che risulta tanto rapida che dc/dx è piccolo.

Per molecole piccole quindi il fattore limitante è la velocità con cui le sostanze sono trasportate dal flusso sanguigno: trasporto flusso-limitato. Per molecole più grandi è il vaso capillare che costituisce un ostacolo: trasporto limitato dalla diffusione.

Le molecole liposolubili si muovono velocemente fra sangue e tessuti perché passano attraverso tutto l’endotelio (O 2 e CO 2). O 2 è così diffusibile attraverso l’endotelio che già a livello arteriolare esso passa nei tessuti e a livello capillare la saturazione di O 2 nel sangue è già ridotta all’ 80%.

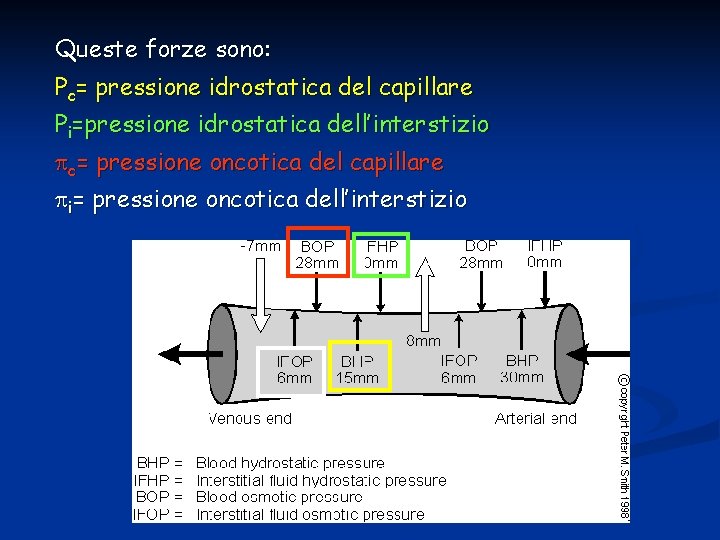
Filtrazione La filtrazione è determinata dalla somma di pressione idrostatica e pressione osmotica che regolano la direzione e l’entità del movimento di acqua. Le forze idrostatiche del capillare dipendono da: v pressione arteriosa: se aumenta, aumenta Pc v pressione venosa: se aumenta, aumenta Pc v resistenze pre-capillari: se aumenta, diminuisce P c v resistenze post-capillari: se aumenta, aumenta P c In media Pc vale 32 mm. Hg al capo arterioso e 15 mm. Hg al capo venoso

In alcuni compartimenti (glomeruli renali) la Pc è tanto elevata da garantire sempre (o quasi) filtrazione su tutta la lunghezza del capillare. In altri compartimenti (mucosa intestinale) le forze osmotiche e idrostatiche sono tali che si ha assorbimento su tutto il capillare. Il fatto quindi che esista filtrazione o riassorbimento dipende dal bilanciamento di 4 forze che si combinano secondo la legge di Starling.

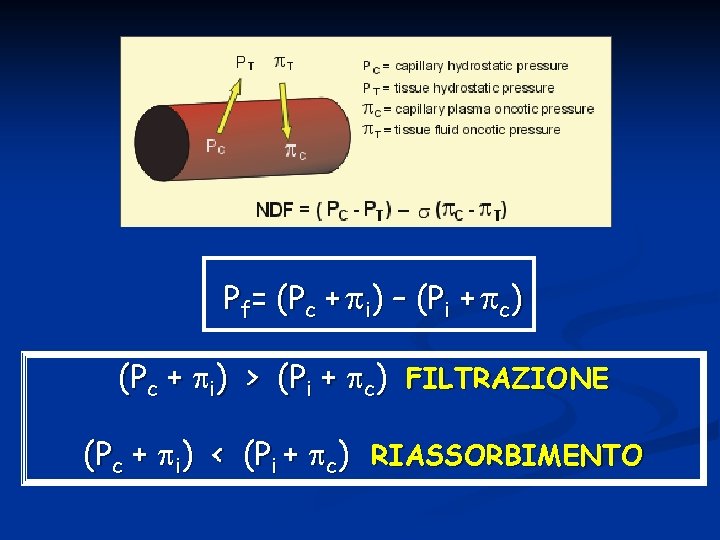
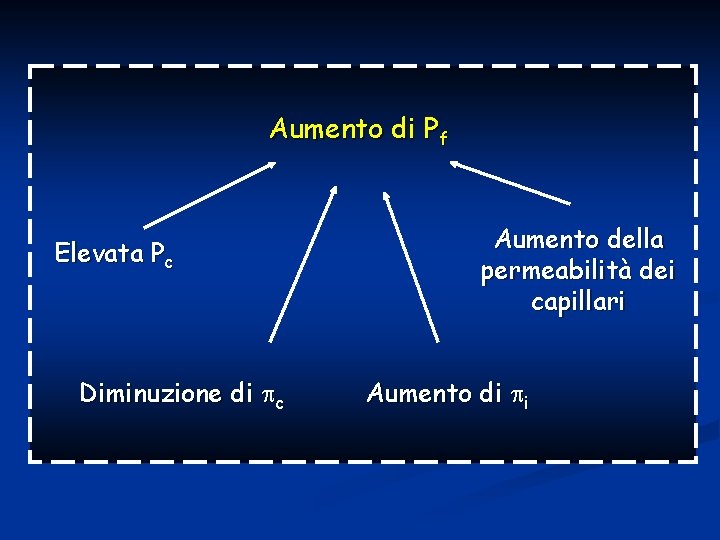
Queste forze sono: Pc= pressione idrostatica del capillare Pi=pressione idrostatica dell’interstizio c= pressione oncotica del capillare i= pressione oncotica dell’interstizio

Pf= (Pc + i) – (Pi + c) (Pc + i) > (Pi + c) FILTRAZIONE (Pc + i) < (Pi + c) RIASSORBIMENTO

Il fattore chiave per impedire una perdita eccessiva di acqua dai capillari è la pressione colloido-osmotica o oncotica del capillare dovuta alle proteine plasmatiche. Il maggior determinante (per il 70%) di questo parametro è l’albumina che ha un elevato peso molecolare (69 k. Da), ha carica negativa al p. H sanguigno e quindi trattiene anche ioni Na+ che aumentano la sua forza osmotica. Se così non fosse l’albumina dovrebbe trovarsi nel sangue ad una concentrazione di 12 gr/100 ml di plasma, rendendo quest’ultimo troppo viscoso. La sua concentrazione è di circa 4. 5 gr/100 ml di plasma

La velocità con cui una sostanza si muove attraverso l’endotelio capillare dipende, oltre che dalle forze di Starling, anche da altri parametri. Si definisce: Qf = K A m ΔP / Δx dove ΔP= somma fra forze idrostatiche ed osmotiche Am= area di scambio disponibile per la filtrazione Δx= distanza attraverso la parete = viscosità del filtrato K= costante di filtrazione della membrana

Questa può essere riscritta come: Q f= K t • Δ P perché e Δx sono in genere costanti e Am non è nota. In media si ha Kt=0. 0061 ml/min/mm. Hg per 100 gr di tessuto. Questo parametro aumenta moltissimo in particolari distretti corporei e specialmente a livello dei glomeruli renali per il processo di ultrafiltrazione.


Il sistema linfatico è una strada accessoria attraverso la quale i fluidi possono passare dallo spazio interstiziale al sangue. I vasi linfatici possono trasportare, via dallo spazio interstiziale, proteine e particelle corpuscolate che non potrebbero essere riassorbite attraverso i capillari (ad esempio i chilomicroni). Senza questa funzione del sistema linfatico moriremmo nell’arco di 24 ore.

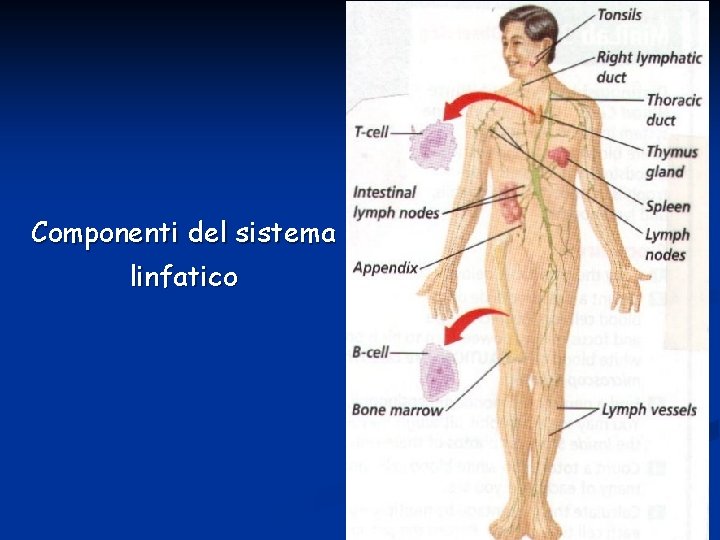
Il sistema linfatico è formato da vasi linfatici, linfonodi e organi. Le funzioni principali di questo sistema includono: § assorbimento del fluido in eccesso nel liquido interstiziale e drenaggio nel torrente sanguigno § assorbimento dei grassi (a livello dei villi) § funzioni immunitarie I vasi linfatici sono strettamente associati con i vasi sanguigni e i più grossi sono simili ai vasi venosi. Sono distribuiti in tutto il corpo e la contrazione del muscolo scheletrico determina il movimento della linfa attraverso le valvole linfatiche.


entrante uscente

Componenti del sistema linfatico

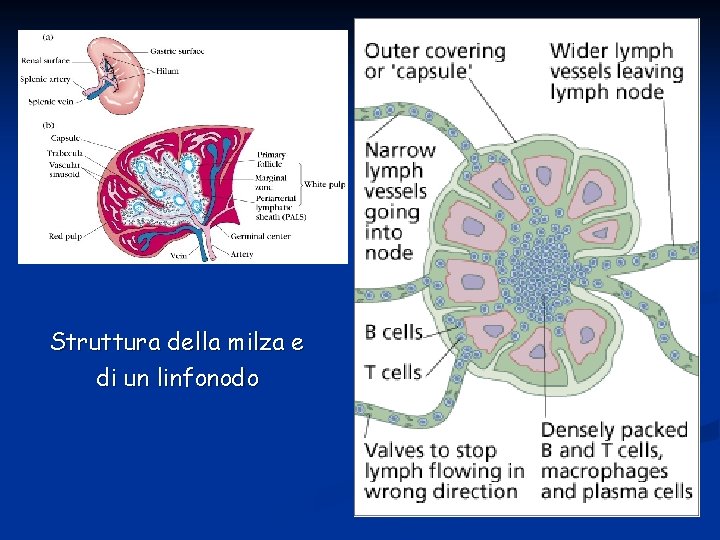
Vasi linfatici Organi: 1. Midollo osseo: produce linfociti. I linfociti B maturano nel midollo osseo, mentre i linfociti T nel timo 2. Milza: è come un grosso linfonodo, ma è un importante serbatoio di sangue con la funzione di ripulire il sangue che vi passa attraverso. Le principali funzioni sono:

i. Ematopoiesi nel feto (tutte le cellule del sangue nel feto, solo linfociti e monociti dopo la nascita) ii. Filtrazione del sangue iii. Funzione iv. 3. emocateretica nell’adulto Serbatoio di sangue Timo: secerne timosina che fa maturare i linfociti T

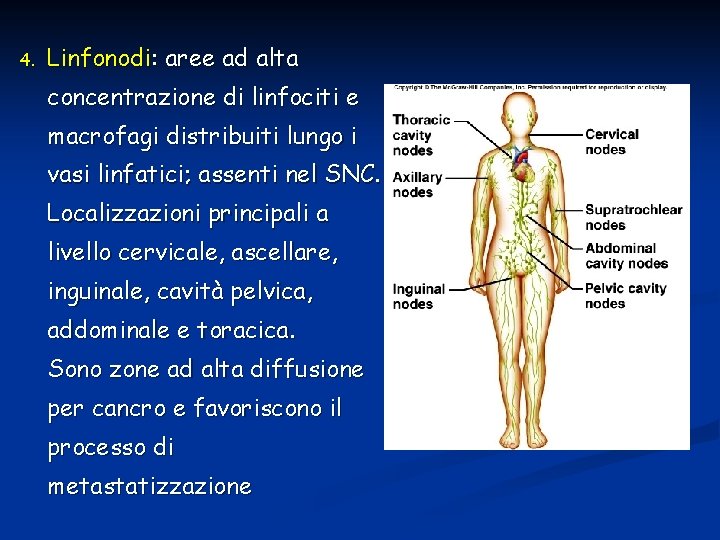
4. Linfonodi: aree ad alta concentrazione di linfociti e macrofagi distribuiti lungo i vasi linfatici; assenti nel SNC. Localizzazioni principali a livello cervicale, ascellare, inguinale, cavità pelvica, addominale e toracica. Sono zone ad alta diffusione per cancro e favoriscono il processo di metastatizzazione

I linfonodi si trovano anche singoli o in piccoli gruppi a livello del tratto respiratorio, urinario, riproduttore e digestivo. 5. MALT – mucosa associated lymphoid tissue Placche del Peyer nell’ileo Tonsille palatine faringee (adenoidi) linguali Alcuni nell’appendice


Struttura della milza e di un linfonodo

Quasi tutti i tessuti corporei sono caratterizzati da terminali linfatici che drenano il liquido in eccesso dagli spazi interstiziali. Le eccezioni includono • porzioni superficiali della pelle • CNS • endomisio del muscolo scheletrico • ossa Tutta la linfa che deriva dalla parte inferiore del corpo viene drenata dal dotto toracico e si svuota nel sistema venoso all’altezza della giunzione fra vena giugulare interna e succlavia sinistra. Similmente per la linfa proveniente dalla parte sx del capo, dal braccio sx e parte del torace.

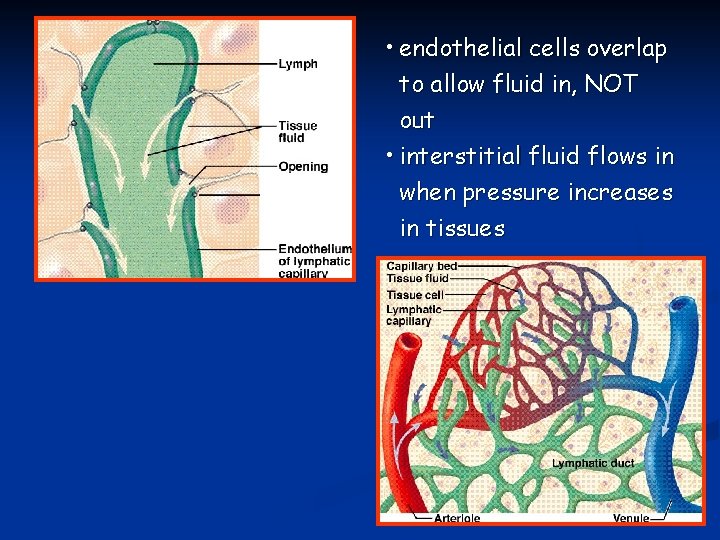
La linfa proveniente dalla parte dx del capo, braccio dx e parte rimanente del torace si svuota nel dotto linfatico dx che si svuota nel sistema venoso all’altezza della giunzione fra vena giugulare interna dx e succlavia dx. I vasi terminali del sistema linfatico formano una rete molto distribuita costituita da vasi altamente permeabili. Sono privi di tight junctions tra le cellule endoteliali e sono connessi al tessuto connettivo da filamenti. Con la contrazione muscolare questi distorgno i vasi linfatici che aprono passaggi fra le cellule endoteliali permettendo l’ingresso di proteine, cellule e grosse molecole.


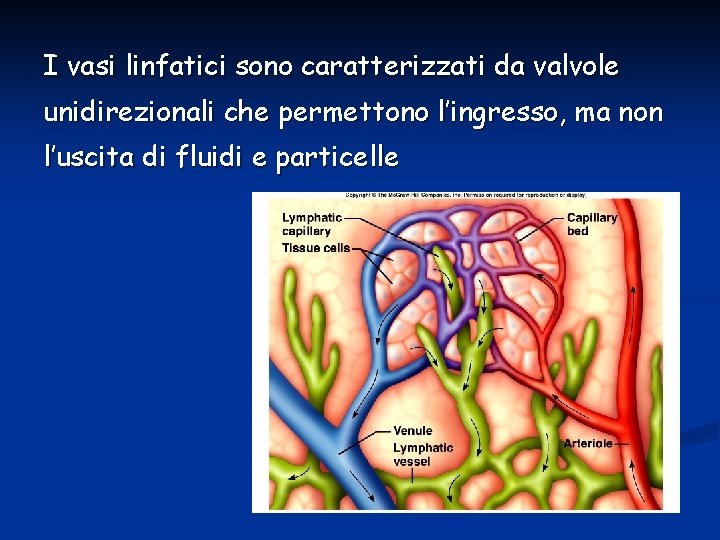
I vasi linfatici sono caratterizzati da valvole unidirezionali che permettono l’ingresso, ma non l’uscita di fluidi e particelle

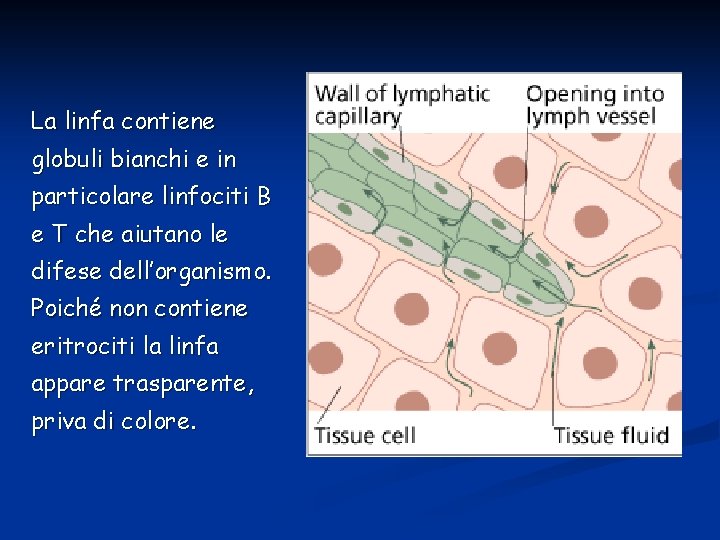
La linfa contiene globuli bianchi e in particolare linfociti B e T che aiutano le difese dell’organismo. Poiché non contiene eritrociti la linfa appare trasparente, priva di colore.

• endothelial cells overlap to allow fluid in, NOT out • interstitial fluid flows in when pressure increases in tissues

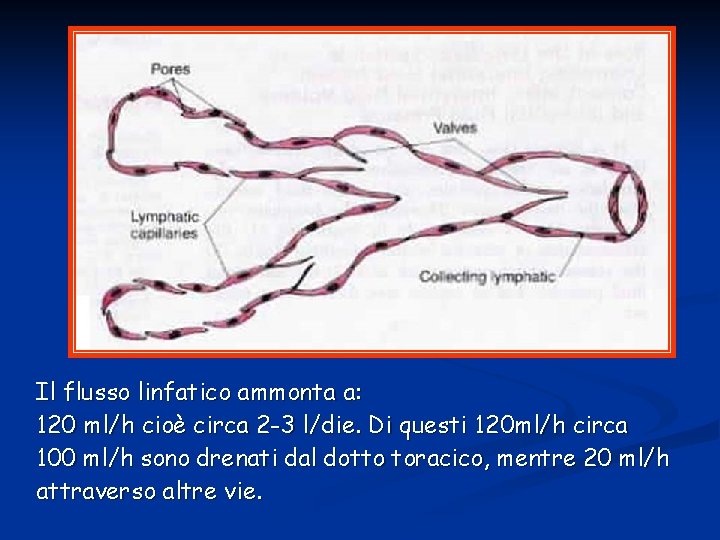
Il flusso linfatico ammonta a: 120 ml/h cioè circa 2 -3 l/die. Di questi 120 ml/h circa 100 ml/h sono drenati dal dotto toracico, mentre 20 ml/h attraverso altre vie.

Il volume attraverso il sistema linfatico in 24 ore è pari quasi al volume totale del plasma e le proteine che tornano al sangue sono circa il 25%-50% delle proteine circolanti. Se le proteine non fossero rimosse dal fluido interstiziale, causerebbero una pressione osmotica che richiamerebbe acqua dai capillari causando edema. In media il 67% circa di linfa prodotta proviene da fegato ed intestino. Ogni fattore che aumenta la filtrazione determina aumento del flusso linfatico.

Aumento di Pf Elevata Pc Diminuzione di c Aumento della permeabilità dei capillari Aumento di i

In sommario possiamo dire che la velocità del flusso linfatico è determinato da: pressione del fluido interstiziale attività della pompa linfatica Il sistema linfatico gioca un ruolo fondamentale nel controllare sia la concentrazione delle proteine del fluido interstiziale (1), il volume del fluido interstiziale (2) e le pressione del fluido interstiziale (3).

1) 2) 3) Una modificazione della concentrazione di proteine dell’interstizio determina un aumento della pressione oncotica dell’interstizio e quindi un accumulo di liquidi conseguente edema. Il volume interstiziale aumenta e di conseguenza anche la pressione interstiziale. Quando la pressione dell’interstizio aumenta anche il flusso linfatico tende ad aumentare riequilibrando la situazione.


Uno dei principi fondamentali della circolazione è la capacità di ciascun tessuto di controllare il suo flusso locale in funzione delle necessità metaboliche. Quali sono le necessità di un tessuto? i. distribuzione di ossigeno ai tessuti ii. distribuzione di nutrienti (aa, glucosio, ac. grassi) iii. rimozione di CO 2 iv. rimozione di H+ v. trasporto di ormoni e altre sostanze vi. mantenimento di un ambiente equilibrato

Il flusso dei vari organi è differente. Alcuni risultano molto più vascolarizzati di altri e in più alcuni tessuti non subiscono variazioni nell’arco delle 24 ore, mentre altri hanno una variazione di flusso più marcata. La necessità di controllare il flusso locale deriva dal fatto che è impossibile fornire sempre un flusso elevato a tutti i tessuti. Il flusso in ciascun distretto è regolato in modo tale da garantire le necessità del momento: non di più e non di meno. La capacità intrinseca di regolare il flusso sanguigno è detta regolazione locale.

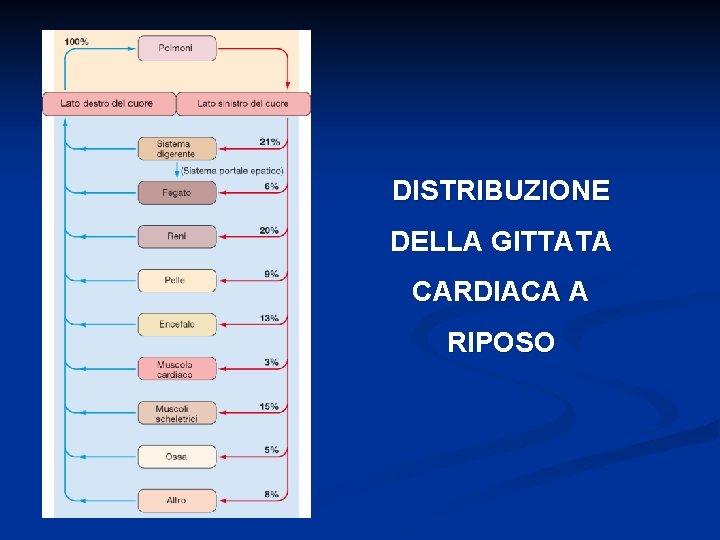
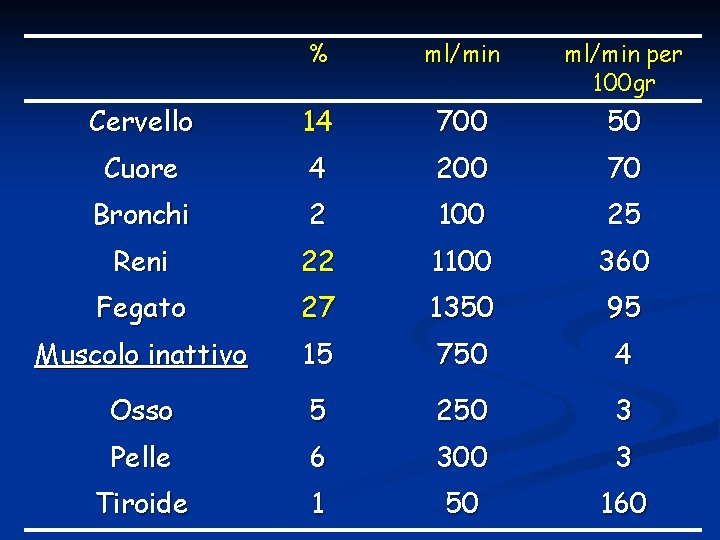
DISTRIBUZIONE DELLA GITTATA CARDIACA A RIPOSO

% ml/min per 100 gr Cervello 14 700 50 Cuore 4 200 70 Bronchi 2 100 25 Reni 22 1100 360 Fegato 27 1350 95 Muscolo inattivo 15 750 4 Osso 5 250 3 Pelle 6 300 3 Tiroide 1 50 160


Meccanismi di controllo del flusso locale Il controllo è di due tipi: Acuto: rapide variazione delle resistenze arteriolari e degli sfinteri pre-capillari che avvengono nell’arco di secondi o minuti A lungo termine: variazioni lente del flusso che avvengono nell’arco di giorni, settimane o anche mesi.

Il flusso sanguigno è regolato dai vasi di resistenza che hanno la parete formata quasi completamente da muscolo liscio. Se il muscolo è totalmente contratto si ha vasocostrizione, mentre se il muscolo è rilasciato si ha vasodilatazione e quindi apertura del lume vascolare. Possiamo dire che il muscolo liscio vascolare controlla: Ø Resistenza periferica totale Ø Tono arterioso e venoso Ø Distribuzione del flusso


L’attività del muscolo liscio vascolare risponde a svariate stimolazioni quali: 1. Pressoria o risposta miogena 2. Endoteliale N. B. : Entrambi questi sono stimoli che derivano dall’interno dei vasi stessi per segnali meccanici come lo stiramento del vaso (risposta miogena) o fattori endoteliali (come EDRF e endotelina)

3. 4. 5. Metabolica locale: segnali che derivano dai tessuti circostanti, la maggior parte dei quali è correlata al metabolismo tissutale (K+, H+, adenosina…) Nervosa per attivazione del SNA (stimolazione estrinseca) Ormonale dovuta a sostanze circolanti nel sangue

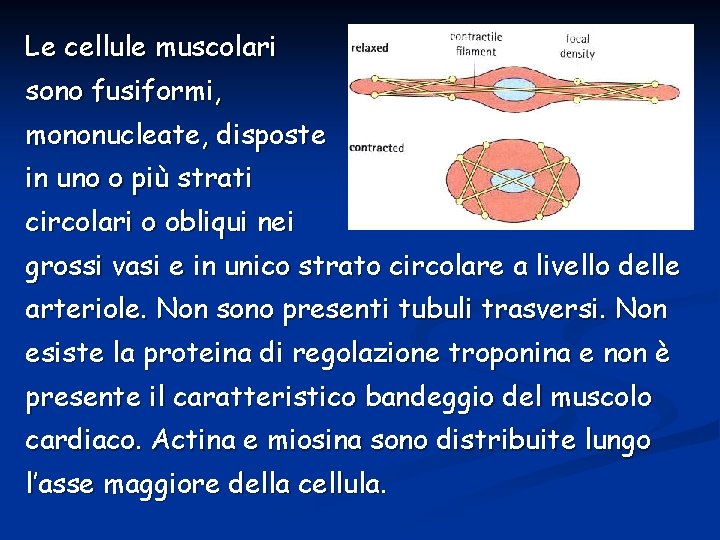
Le cellule muscolari sono fusiformi, mononucleate, disposte in uno o più strati circolari o obliqui nei grossi vasi e in unico strato circolare a livello delle arteriole. Non sono presenti tubuli trasversi. Non esiste la proteina di regolazione troponina e non è presente il caratteristico bandeggio del muscolo cardiaco. Actina e miosina sono distribuite lungo l’asse maggiore della cellula.

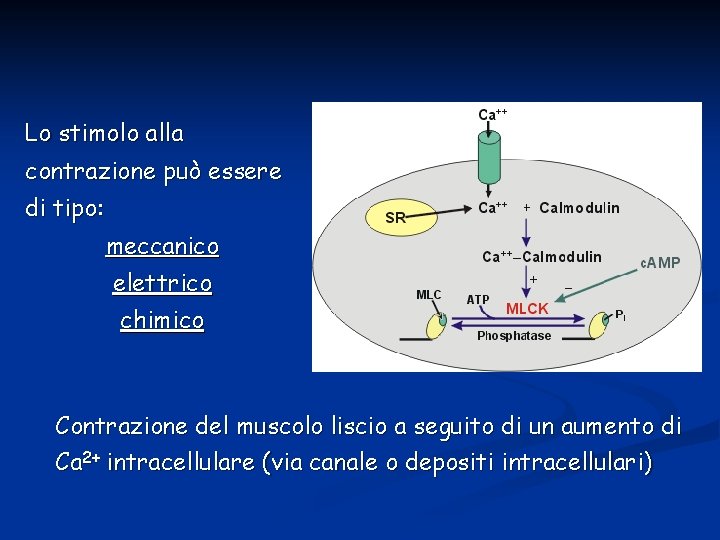
Lo stimolo alla contrazione può essere di tipo: meccanico elettrico chimico Contrazione del muscolo liscio a seguito di un aumento di Ca 2+ intracellulare (via canale o depositi intracellulari)

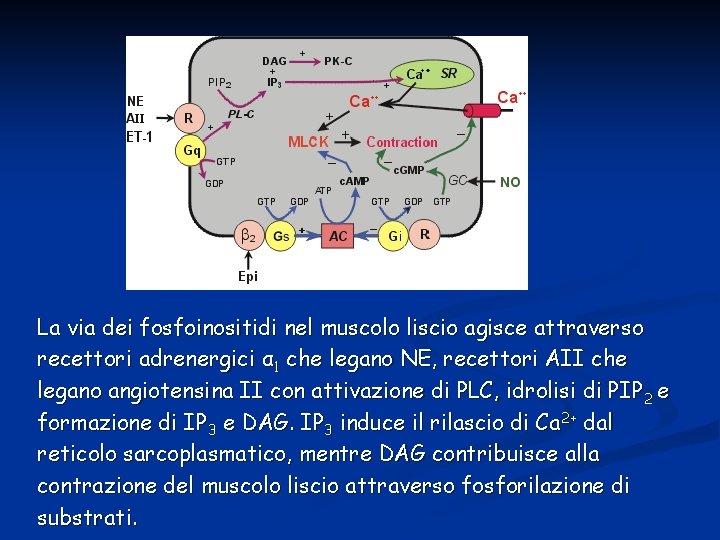
La via dei fosfoinositidi nel muscolo liscio agisce attraverso recettori adrenergici α 1 che legano NE, recettori AII che legano angiotensina II con attivazione di PLC, idrolisi di PIP 2 e formazione di IP 3 e DAG. IP 3 induce il rilascio di Ca 2+ dal reticolo sarcoplasmatico, mentre DAG contribuisce alla contrazione del muscolo liscio attraverso fosforilazione di substrati.

Benché nel muscolo liscio manchi la troponina, la regolazione della contrazione è ancora a carico degli ioni Ca 2+. Esiste una proteina regolatoria detta caldesmosoma che lega il complesso Ca-CAM regolando l’attacco della tropomiosina ai siti di legame per la miosina presenti sui filamenti sottili. L’aumento del calcio citosolico determina un aumento dei livelli del complesso Ca-CAM che, a sua volta, lega la proteina caldesmosoma rimuovendo il blocco tropomiosinico sui siti di attacco dei filamenti sottili. In sostanza la proteina caldesmosoma sostituisce la troponina come proteina regolatoria


Un aumento del metabolismo tissutale determina un aumento del flusso locale. Un aumentata richiesta di ossigeno è uno dei fattori più potenti nel determinare un aumento del flusso. Questo avviene per esempio nel caso di altitudine elevata, avvelenamento da monossido di ossigeno, avvelenamento da cianuro.

È importante notare che questi meccanismi di controllo locale agiscono in maniera indipendente dai meccanismi di controllo estrinseci e possono quindi essere studiati in organi isolati e perfusi, privi di innervazione e controllo neurormonale. Infine, bisogna notare che il bilanciamento fra meccanismi locali e controllo estrinseco in vivo determina il tono vascolare e quindi il flusso sanguigno nel tessuto.

Vediamo ora alcuni esempi di regolazione locale del flusso sanguigno: autoregolazione iperemia attiva iperemia reattiva

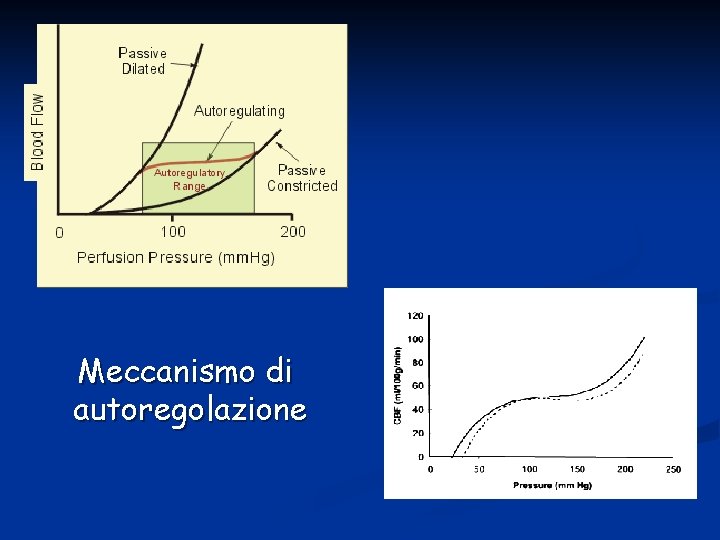
Autoregolazione L’autoregolazione è un tipo di regolazione del flusso sanguigno locale. È definita come l’abilità intrinseca di un organo di mantenere, a metabolismo tissutale costante, un flusso costante nonostante variazioni della pressione di perfusione. Ad esempio se la pressione di perfusione aumenta il flusso sanguigno inizialmente aumenta, per poi tornare verso i valori normali nell’arco di pochi minuti. Questa autoregolazione avviene indipendentemente da influenze ormonali e nervose e quindi è intrinseca dell’organo.

Quando la pressione di perfusione aumenta, il flusso sanguigno tende ad aumentare in accordo con la legge: Q=ΔP / R La teoria miogenica dell’autoregolazione suggerisce che, quando un vaso viene stirato da un brusco aumento di pressione, il vaso reagisce con una vasocostrizione che, aumentando la resistenza vascolare, determina una riduzione del flusso. Non è necessaria l’integrità dell’endotelio. Sono stimolati canali del Ca 2+ stretch-activated che si aprono in risposta alla distensione e fanno entrare calcio che dà inizio alla contrazione del muscolo liscio.

Meccanismo di autoregolazione

I vasi sanguigni di vari organi hanno capacità differenti di autoregolarsi. Il circolo renale, cerebrale e coronarico mostrano una capacità autoregolatoria eccellente. L’autoregolazione assicura che questi organi, critici per la sopravvivenza, abbiano un flusso adeguato e un’elevata disponibilità di O 2. L’autoregolazione del muscolo striato e del circolo splancnico è inferiore. La capacità autoregolatoria del circolo cutaneo è quasi assente.

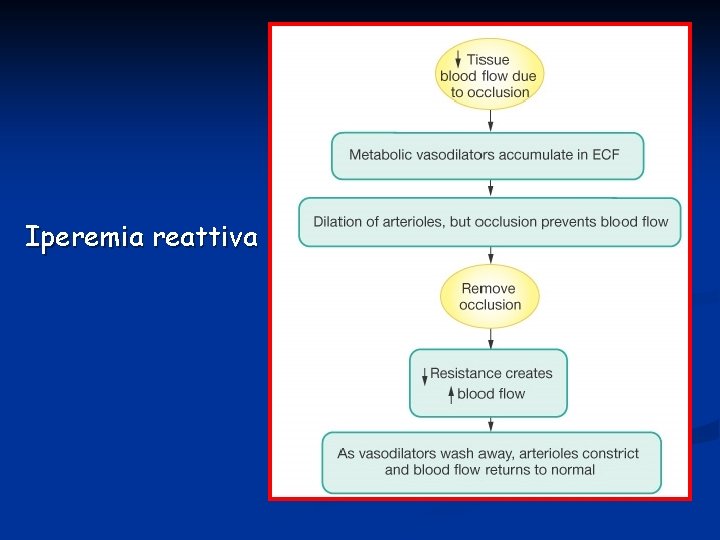
Accanto alla teoria miogenica intrinseca al vaso esiste anche una teoria metabolica secondo la quale la richiesta di nutrienti e l’accumulo di sostanze tossiche determina un aumento del flusso sanguigno locale. Questo stesso meccanismo è alla base di un fenomeno noto come iperemia reattiva che è un aumento transiente del flusso sanguigno ad un organo a seguito di un breve periodo di ischemia. L’ischemia determina ipossia e l’accumulo di sostanze vasodilatanti (adenosina).

Iperemia reattiva

Diversi meccanismi possono essere coinvolti nella regolazione metabolica del flusso sanguigno: § ipossia: la diminuita p. O 2 a livello tissutale o per scarso rifornimento e/o per aumentata richiesta causa vasodilatazione § metaboliti del tessuto

Più aumenta il metabolismo tessutale (richiesta di nutrienti e produzione di scarto), tanto maggiore è il flusso sanguigno. Questo comporta la produzione di una o più sostanze vasodilatanti. Fra queste sono state identificate. adenosina derivati dell’ATP CO 2 istamina H+ K+ acido lattico Fra queste sostanze quella con le maggiori proprietà e facilmente rilasciata è l’adenosina. È stato dimostrato che a livello cardiaco quando il flusso coronarico diminuisce troppo, le cellule cardiache rilasciano significative dosi di adenosina (derivata da idrolisi di ATP).

Meccanismi metabolici della vasodilatazione Stimolo Sostanza Effetto Esempio tipico Ipossia Adenosina Vasodilatante Flusso coronarico Accumulo di tossici K+ Vasodilatante Muscolo striato attivo Aumentato metabolismo ossidativo CO 2 Vasodilatante Flusso sanguigno cerebrale Aumentato metabolismo anaerobico H+ Vasodilatante Flusso sanguigno cerebrale Idrolisi dei nucleotidi dell’adenina Fosfato inorganico Vasodilatante Muscolo striato attivo

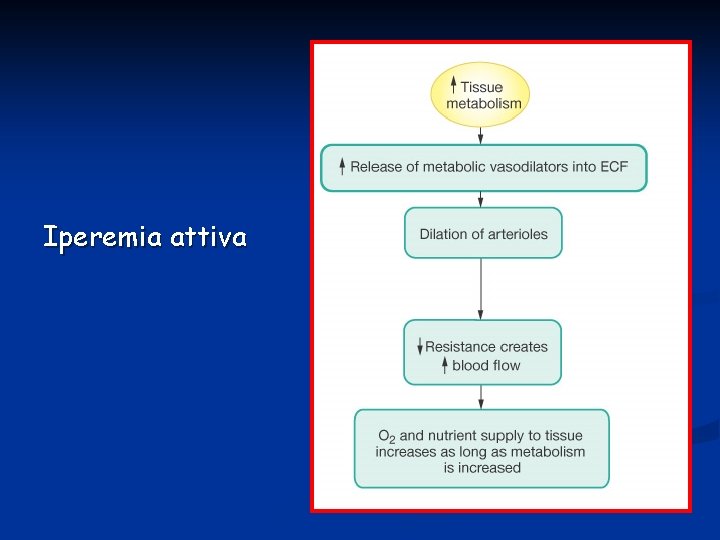
L’iperemia attiva è l’incremento di flusso ad un organo associata ad un aumento dell’attività metabolica. Esempi di questo tipo sono: § aumento dell’attività muscolare: lo ione K+ che si accumula nello spazio extracellulare funziona come principale fattore metabolico per la vasodilatazione § aumento dell’attività cardiaca § aumento dell’attività gastrointestinale nella fase digestiva

Iperemia attiva

Controllo a lungo termine I meccanismi di controllo del flusso locale a lungotermine comportano una variazione del grado di vascolarizzazione del tessuto. Questo processo di vascolarizzazione avviene in tessuti cancerosi e in tessuti normali, con una facilità maggiore nei tessuti di individui giovani rispetto ad individui anziani o vecchi.

Un ruolo fondamentale è giocato dall’ossigeno, tanto che in individui che abitano ad alte quote (dove la pressione di O 2 è inferiore) la vascolarizzazione tende ad aumentare. In neonati immaturi posti in ambiente iperossigenato, l’eccesso di ossigeno causa un improvviso blocco della crescita capillare soprattutto a livello della retina. La crescita di nuovi vasi sanguigni prende il nome di angiogenesi ed avviene in risposta a fattori angiogenici che sono rilasciati da: v tessuti ischemici v tessuti in rapida crescita v tessuti ad elevata rate metabolica

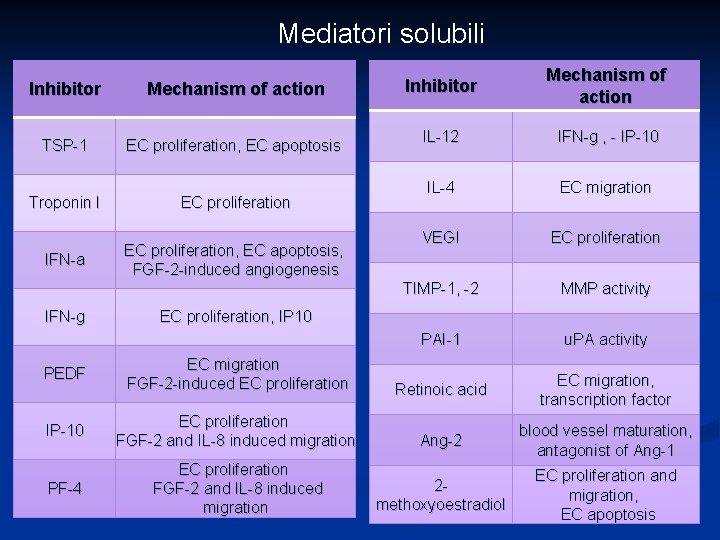
Fra questi fatori angiogenici ricordiamo: fattore di crescita endoteliale (EGF) angiogenina fattore di crescita dei fibroblasti (FGF) Esistono anche numerosi fattori inibitori che hanno normalmente la funzione di inibire e controbilanciare l’angiogenesi.

ENDOGENOUS INHIBITORS OF ANGIOGENESIS

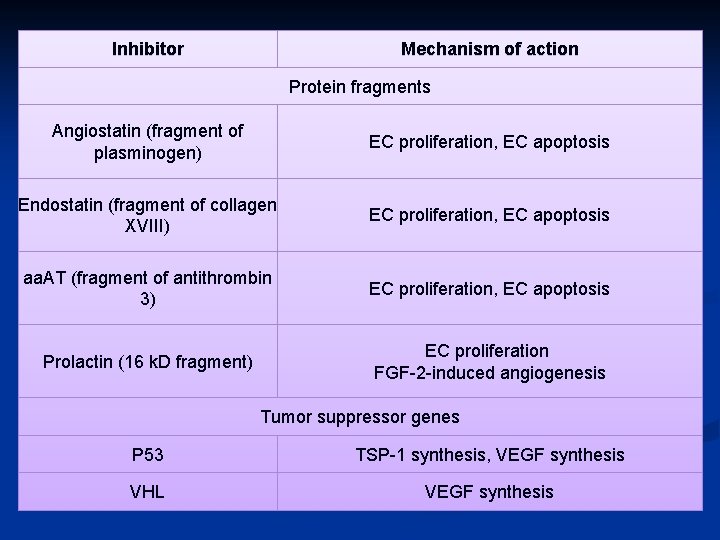
Mediatori solubili Inhibitor Mechanism of action TSP 1 EC proliferation, EC apoptosis Troponin I EC proliferation IFN a EC proliferation, EC apoptosis, FGF 2 induced angiogenesis IFN g Inhibitor Mechanism of action IL 12 IFN g , IP 10 IL 4 EC migration VEGI EC proliferation TIMP 1, 2 MMP activity PAI 1 u. PA activity EC proliferation, IP 10 PEDF EC migration FGF 2 induced EC proliferation Retinoic acid EC migration, transcription factor IP 10 EC proliferation FGF 2 and IL 8 induced migration Ang 2 blood vessel maturation, antagonist of Ang 1 PF 4 EC proliferation FGF 2 and IL 8 induced migration 2 methoxyoestradiol EC proliferation and migration, EC apoptosis

Inhibitor Mechanism of action Protein fragments Angiostatin (fragment of plasminogen) EC proliferation, EC apoptosis Endostatin (fragment of collagen XVIII) EC proliferation, EC apoptosis aa. AT (fragment of antithrombin 3) EC proliferation, EC apoptosis Prolactin (16 k. D fragment) EC proliferation FGF 2 induced angiogenesis Tumor suppressor genes P 53 TSP 1 synthesis, VEGF synthesis VHL VEGF synthesis

Clinical manipulation of angiogenesis Therapeutic goal Inhibition of angiogenesis Stimulation of angiogenesis • Hemangiomas • Psoriasis • Myocardial ischemia • Kaposi's sarcoma • Peripheral ischemia • Ocular neovascularization • Cerebral ischemia • Rheumatoid arthritis • Wound healing • Endometriosis • Reconstructive surgery • Atherosclerosis • Ulcer healing • Tumor growth and metastasis


Tumour cells release angiogenic growth factors that diffuse into the nearby tissues. q The angiogenic growth factors bind to specific receptors located on the endothelial cells (EC) of nearby pre-existing blood vessels. q Once growth factors bind to their receptors, the endothelial cells are activated and signals are sent to the nucleus. Enzymes are released which create small pores in the basement membrane surrounding the existing blood vessels.

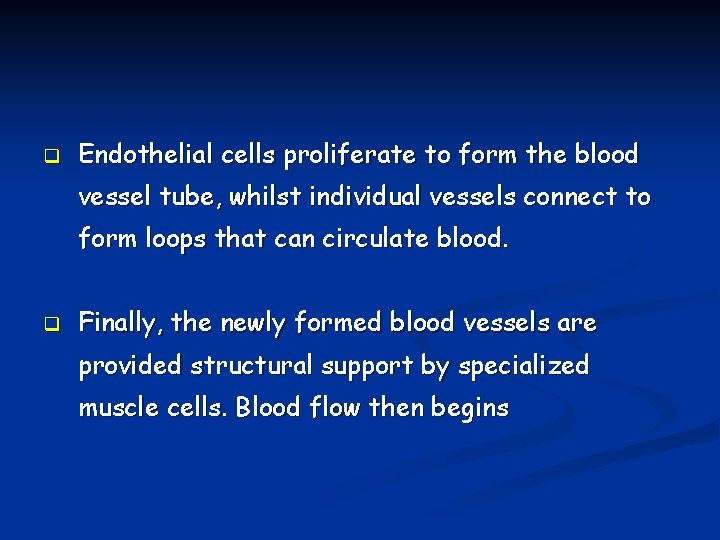
q The endothelial cells begin to proliferate, and migrate out through the pores of the existing vessel towards the tumour tissue, whilst specialized adhesion molecules, or ‘integrins’ help to pull the new blood vessel sprout forward. q Metalloproteinases are produced to disperse the tissue in front of the growing vessel, and as it extends, to remould it around the vessel.

q Endothelial cells proliferate to form the blood vessel tube, whilst individual vessels connect to form loops that can circulate blood. q Finally, the newly formed blood vessels are provided structural support by specialized muscle cells. Blood flow then begins

Angiogenesi eccessiva Si verifica in soggetti affetti da tumore, cecità diabetica, degenerazione maculare legata all’età, artrite reumatoide, psoriasi e altre patologie (una settantina). I nuovi vasi sanguigni alimentano i nuovi tessuti distruggendo il tessuto sano e, nel caso del cancro, i nuovi vasi funzionano come vie di fuga per le cellule tumorali che vanno ad attaccare altri tessuti (metastatizzazione).

L’eccesso si verifica quando le cellule malate producono troppi fattori angiogenici, competendo con il normale bilanciamento degli inibitori dell’angiogenesi. Si stanno mettendo a punto, per il trattamento di queste patologie nuove terapie antiangiogeniche mirate a fermare questa crescita ex-novo di vasi sanguigni.

Angiogenesi insufficiente Si riscontra nei casi di patologie coronariche, ictus e ritardata guarigione di ferite. La circolazione non viene ripristinata nel modo corretto in brevi tempi e il tessuto rischia di necrotizzare. In genere la causa è la scarsa o assente produzione di fattori angiogenici. Si stanno cercando nuovi metodi per lo sviluppo di terapie angiogeniche per la cura di queste patologie.

Regolazione estrinseca della circolazione La noradrenalina è un fattore potentemente vasocostrittore. Quando il sistema simpatico viene stimolato in situazioni di stress o esercizio fisico, i terminali simpatici rilasciano NA. Le fibre simpatiche innervano il muscolo liscio vascolare ovunque tranne che a livello encefalico dove non esistono recettori α 1. Inoltre il sistema simpatico stimola la midollare del surrene a produrre catecolamine che aggiungono il loro effetto fornendo un doppio sistema di regolazione.

Regioni vasocostrittrici del bulbo tonicamente attive Fibre fra T 2 e L 5 Fibre pre-gangliari dirette alla catena simpatica paravertebrale Rami post-gangliari diretti ad arterie e vene Vasocostrizione per meccanismo -adrenergico

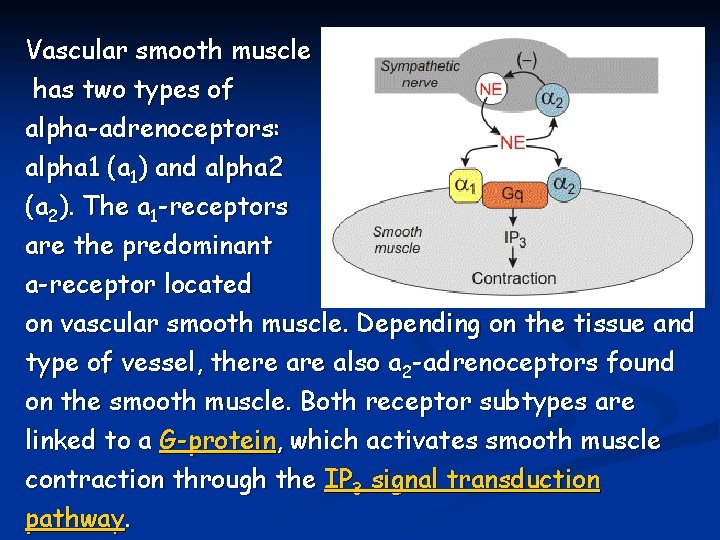
Vascular smooth muscle has two types of alpha-adrenoceptors: alpha 1 (a 1) and alpha 2 (a 2). The a 1 -receptors are the predominant a-receptor located on vascular smooth muscle. Depending on the tissue and type of vessel, there also a 2 -adrenoceptors found on the smooth muscle. Both receptor subtypes are linked to a G-protein, which activates smooth muscle contraction through the IP 3 signal transduction pathway.

CARATTERISTICHE LOCALIZZAZIONE DEL RECETTORE MEDIATORE CHIMICO TIPI DI RECETTORE α 1 β 2 Ovunque tranne a livello encefalico Muscolo liscio arteriolare, cuore e muscolo scheletrico Noradrenalina del simpatico e del surrene Adrenalina del surrene RISPOSTA DEL MUSCOLO LISCIO VASCOLARE Vasocostrizione Vasodilatazione

Fra le sostanze vasocostrittrici quella che ha il potere maggiore è sicuramente l’angiotensina che viene prodotta a partire da un precursore di origine epatica sotto stimolazione della renina (sistema renina-angiotensina). In genere essa ha azione a livello di tutte le arteriole (vedremo soprattutto a livello renale) determinando un notevole aumento della resistenza vascolare sistemica e quindi un aumento della pressione.

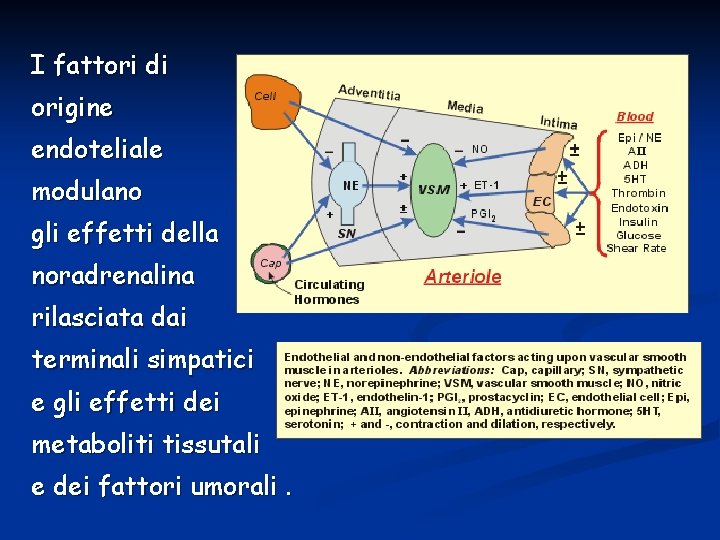
I fattori di origine endoteliale modulano gli effetti della noradrenalina rilasciata dai terminali simpatici e gli effetti dei metaboliti tissutali e dei fattori umorali.

Infine possiamo dire che i fattori estrinseci (fattori che originano al di fuori dell’organo o del tessuto in cui il vaso è alloggiato) e i fattori intrinseci (fattori che originano dal vaso stesso o dal tessuto circostante) determinano il tono vascolare. Agiscono sia fattori vasocostrittori che fattori vasodilatanti.

 Io appartengo all'unica razza che conosco quella umana
Io appartengo all'unica razza che conosco quella umana Frase passiva
Frase passiva L'aria è quella cosa leggera
L'aria è quella cosa leggera Sistema universitario francese e italiano a confronto
Sistema universitario francese e italiano a confronto Grafico della funzione coseno
Grafico della funzione coseno Ln derivata
Ln derivata Schema di jakobson
Schema di jakobson Dominio di una funzione irrazionale fratta
Dominio di una funzione irrazionale fratta Il racconto della chimica e della terra
Il racconto della chimica e della terra Culture e formati della televisione e della radio
Culture e formati della televisione e della radio Prove della sfericità della terra
Prove della sfericità della terra Fasi lavorazione seta
Fasi lavorazione seta Disturbo oppositivo provocatorio sostegno
Disturbo oppositivo provocatorio sostegno Saba la mia bambina
Saba la mia bambina Elena bettinelli
Elena bettinelli Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Simonetta klein il racconto della chimica
Simonetta klein il racconto della chimica Favola la coccinella in cerca della felicità
Favola la coccinella in cerca della felicità Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Moti millenari zanichelli
Moti millenari zanichelli Terzo principio fichte
Terzo principio fichte Prove della sfericità della terra
Prove della sfericità della terra Pei disturbo misto della condotta e della sfera emozionale
Pei disturbo misto della condotta e della sfera emozionale Il racconto delle scienze naturali soluzioni
Il racconto delle scienze naturali soluzioni Distributore a mano impianto frenante
Distributore a mano impianto frenante Complesso maggiore di istocompatibilità
Complesso maggiore di istocompatibilità Funzione
Funzione Funzione
Funzione Distribuzione normale standardizzata excel
Distribuzione normale standardizzata excel Sensitività complementare
Sensitività complementare Funzione di ripartizione statistica
Funzione di ripartizione statistica Biomolecole zanichelli
Biomolecole zanichelli Relazione funzione strumentale area 1
Relazione funzione strumentale area 1 Come calcolare la primitiva di una funzione
Come calcolare la primitiva di una funzione Relazione funzione strumentale area 2 2019/2020
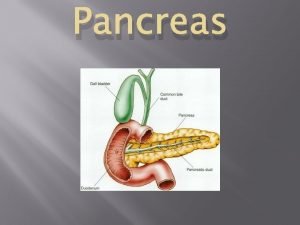
Relazione funzione strumentale area 2 2019/2020 Pancreas funzione
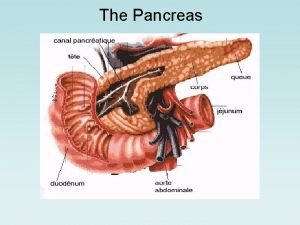
Pancreas funzione Gerundivo predicativo
Gerundivo predicativo Limite definizione
Limite definizione Funzione a tratti matlab
Funzione a tratti matlab Grafico funzione lineare
Grafico funzione lineare Funzione di langevin
Funzione di langevin Asse trasverso iperbole
Asse trasverso iperbole A zacinto
A zacinto Le relazioni binarie
Le relazioni binarie F(x) = senx
F(x) = senx Giunzioni citoneurali
Giunzioni citoneurali Teoremi sulle funzioni continue
Teoremi sulle funzioni continue Equazioni esponenziali esercizi doc
Equazioni esponenziali esercizi doc Seminalplasmina funzione
Seminalplasmina funzione Funzione pancreas
Funzione pancreas Figura strumentale inclusione
Figura strumentale inclusione Funzione
Funzione Funzione sintattica
Funzione sintattica Funzione modale
Funzione modale Schema studio funzione
Schema studio funzione Tir excel
Tir excel Funzione inversa esponenziale
Funzione inversa esponenziale Governo funzione esecutiva
Governo funzione esecutiva Relazione finale sostegno compilata
Relazione finale sostegno compilata Funzione economica
Funzione economica Nucleo arcuato funzione
Nucleo arcuato funzione Deduzione trascendentale
Deduzione trascendentale Grafico della tangente goniometrica
Grafico della tangente goniometrica Topoisomerasi
Topoisomerasi Funzioni esponenziali zanichelli
Funzioni esponenziali zanichelli Funzione
Funzione Funzione ispettiva del parlamento
Funzione ispettiva del parlamento Asintoto orizzontale
Asintoto orizzontale Compensazione hicksiana microeconomia
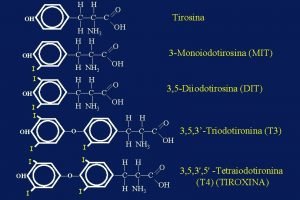
Compensazione hicksiana microeconomia Funzione tiroidea
Funzione tiroidea Funzione
Funzione Disequazioni lineari in due variabili
Disequazioni lineari in due variabili Relazione finale classe quinta scuola primaria
Relazione finale classe quinta scuola primaria Funzione canonica
Funzione canonica Progetto funzione strumentale area 1
Progetto funzione strumentale area 1 Funzione di indirizzo e controllo politico del parlamento
Funzione di indirizzo e controllo politico del parlamento Epipodofillotossine
Epipodofillotossine Analessi e prolessi
Analessi e prolessi La congiunzione che serve a concludere un discorso
La congiunzione che serve a concludere un discorso Integrale di x
Integrale di x Astrociti
Astrociti Gruppo0 1sp
Gruppo0 1sp Pancreatic juice
Pancreatic juice Definizione grafico di una funzione
Definizione grafico di una funzione Fabula schema
Fabula schema Eterosaccaridi
Eterosaccaridi Funzione del costo
Funzione del costo Funzione continua in un intervallo
Funzione continua in un intervallo Formula distanza tra due punti
Formula distanza tra due punti Proteine
Proteine La funzione amministrativa
La funzione amministrativa Funzione composta grafico
Funzione composta grafico Aumento ponderale
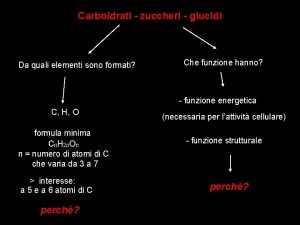
Aumento ponderale Carboidrati funzione
Carboidrati funzione Figura strumentale sostegno
Figura strumentale sostegno Potenze a esponente reale
Potenze a esponente reale Proprietà delle funzioni
Proprietà delle funzioni Funzione eritrocateretica
Funzione eritrocateretica Pancreas funzione
Pancreas funzione Simmetria delle funzioni trigonometriche
Simmetria delle funzioni trigonometriche Struttura dei carboidrati
Struttura dei carboidrati Personaggio tipo o individuo
Personaggio tipo o individuo Funzione
Funzione Funzione
Funzione Microscopio campo chiaro
Microscopio campo chiaro Marco de giorgi funzione pubblica
Marco de giorgi funzione pubblica Funzione educativa del gioco
Funzione educativa del gioco Teorema di schwarz
Teorema di schwarz La funzione dello spazio nel testo narrativo
La funzione dello spazio nel testo narrativo Come calcolare massimi minimi e flessi
Come calcolare massimi minimi e flessi Pitagora e i pitagorici mappa concettuale
Pitagora e i pitagorici mappa concettuale Principi termodinamica
Principi termodinamica