VVOJ HPLC METODY Principy vvoje HPLC metod 1



































- Slides: 68

VÝVOJ HPLC METODY

Principy vývoje HPLC metod 1. 2. 3. 4. 5. Definování cíle metody Informace o vzorku Výběr vhodného detektoru Výběr LC metody Prvotní experimenty se standardy Na základě: chemických a fyzikálních vlastností analytů požadované citlivosti různorodosti vzorku (interference) dostupnosti detektoru 6. Experiment s hlavními proměnnými 7. Reálné vzorky; úprava vzorku 8. Optimalizace 9. Řešení problémů 10. Validace metody 2

Definice cíle § Jaký je účel? Jaký je cíl metody? Analytický x Preparativní Kvantitativní x kvalitativní analýza? § Jaké jsou vlastnosti analytu a vzorku? Očekávaná koncentrace ve vzorku? Jsou k dispozici standardy? Je nutné rozdělit všechny složky vzorku? Fyzikálně chemické vlastnosti vzorku o o o o Molekulová hmotnost Náboj – pozitivní / negativní Hydrofobicita Affinita - “zámek a klíč” vazebná místa Rozpustnost & stabilita p. H, pak, iontová síla, organická rozpouštědla struktura látky a její funkční skupiny UV spektrum 3

Metoda analytická x preparativní Pokud se jedná o kvantitativní analýzu, jaké jsou vyžadovány míry správnosti a přesnosti? Jaké jsou očekávané rozmezí koncentrací analytů? Pokud se jedná o kvalitativní analýzu, mají byt identifikovány pouze hlavní píky nebo i minoritní? Je nutné rozdělit všechny složky vzorku? Analytical Requirements Jaká bude matrice vzorku? Linearity Kolik vzorků bude nutno analyzovat? Precision Jsou dostupné standardy? Accuracy Jaký HPLC systém mám k dispozici? Sensitivity Preparative Requirements Assay reproducibility Recovery Robustness Product purity Capacity Costs Scale up Process throughput Speed 4

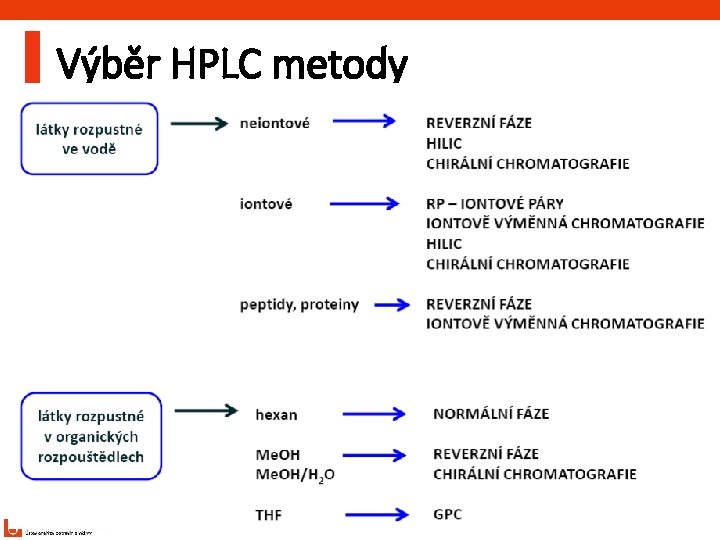
Výběr HPLC metody 5

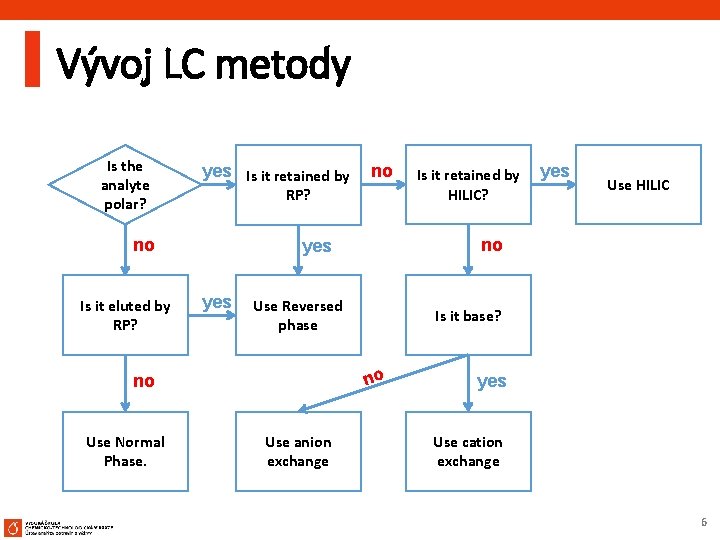
Vývoj LC metody Is the analyte polar? yes Is it retained by RP? no Is it eluted by RP? yes Use Reversed phase yes Use HILIC Is it base? no Use anion exchange Is it retained by HILIC? no yes no Use Normal Phase. no yes Use cation exchange 6

Vývoj metody § Výběr způsobu separace § mapa p. H § Optimalizace gradientové eluce • • Spád gradientu Koncentrace mobilní fáze § Vyhodnocení • • Zahlcení: šířka a tvar píku Rozlišení Stupeň separace mezi analyty a dalšími látkami přítomnými ve směsi Výtěžnost Hmotnostní výtěžnost Aktivitní výtěžnost Kapacita 7

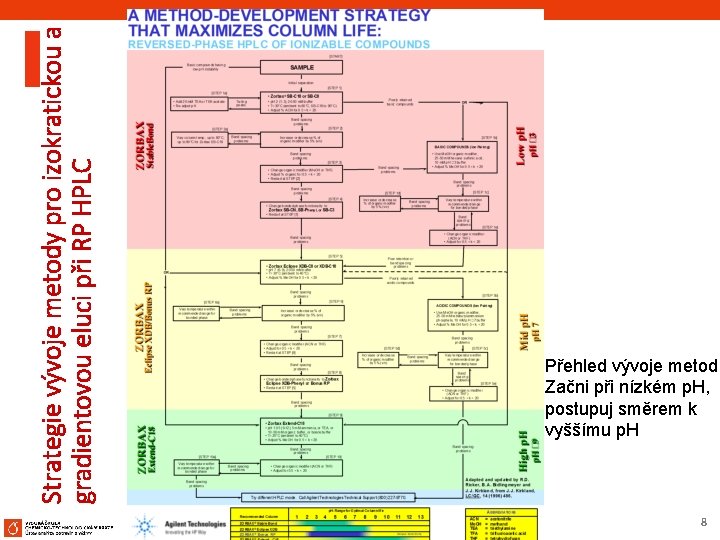
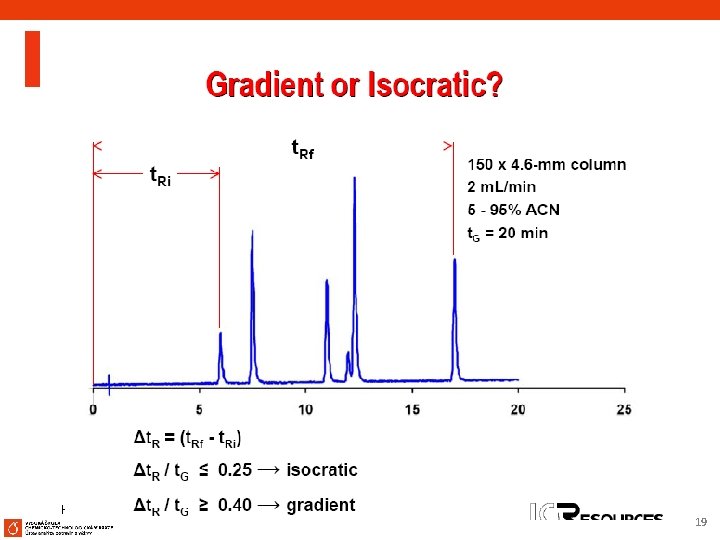
Strategie vývoje metody pro izokratickou a gradientovou eluci při RP HPLC Přehled vývoje metod: Začni při nízkém p. H, postupuj směrem k vyššímu p. H 8

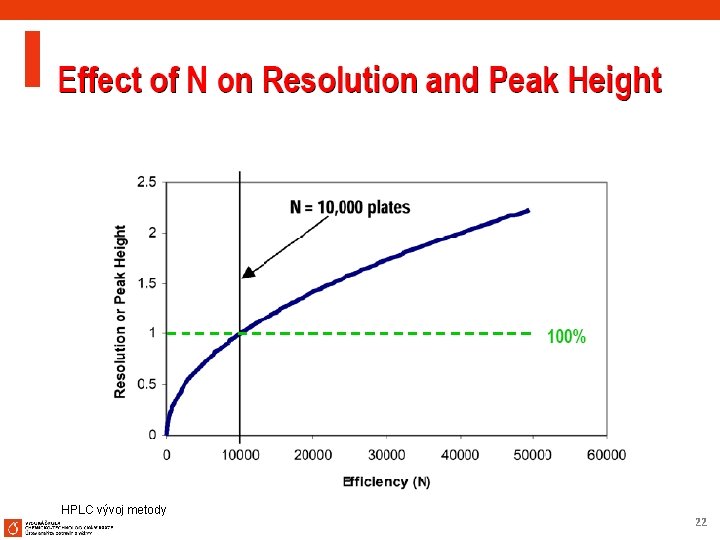
Základní rozlišení R Resolution VN (a-1) k' = a k'+1 4 R ³ 1. 5 Efficiency Avg. = 5. 000 Best = 25. 000 Length Particle size Separation a > 1. 2 Stationary Mobile phase Retention 2 < K < 10 % H 2 O Rovnice pro izokratickou eluci 9

Doporučené cíle vývoje metody n Odpovídající rozlišení pro všechny píky, Rs 1. 7 n Retence prvního píku by měla být minimálně k=1 n Doba analýzy kratší než 30 minut, raději 20 minut , k 3 -8 (2 -10) n (pro kolony s menší velikostí částic ještě kratší) n Robustnost a spolehlivost method n Použití pufrované mobilní fáze – nejdříve zkusit nízké p. H 10

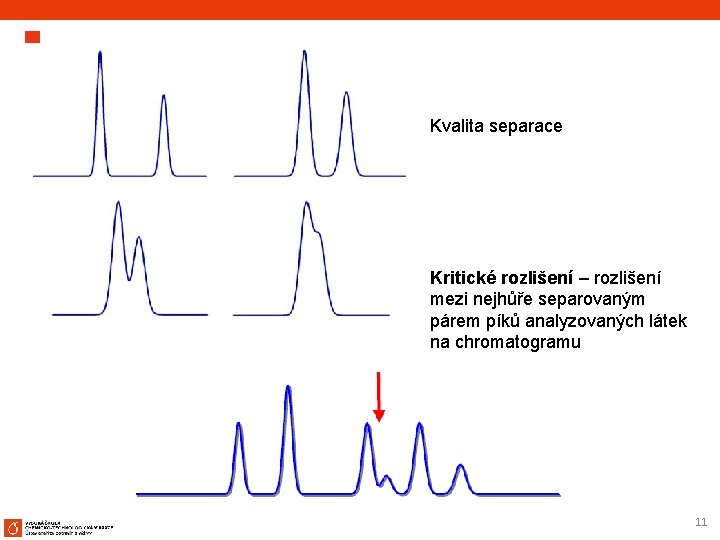
Kvalita separace Kritické rozlišení – rozlišení mezi nejhůře separovaným párem píků analyzovaných látek na chromatogramu 11

12 12

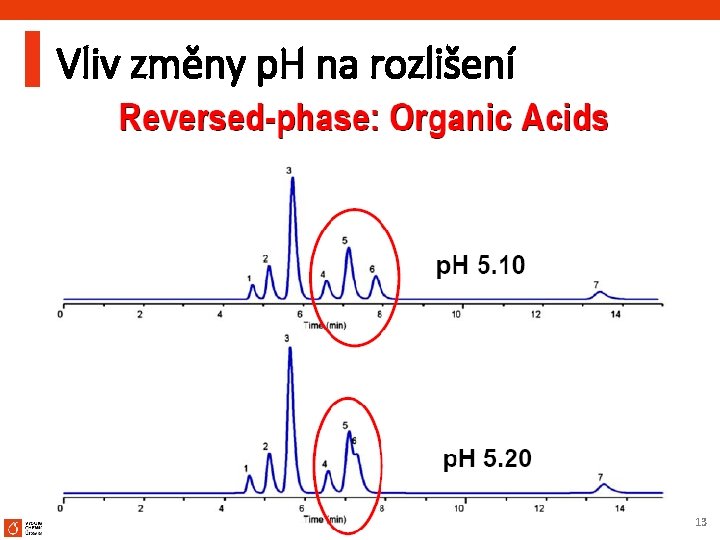
Vliv změny p. H na rozlišení HPLC vývoj metody 13

HPLC vývoj metody 14

15

16

17

HPLC vývoj metody 18

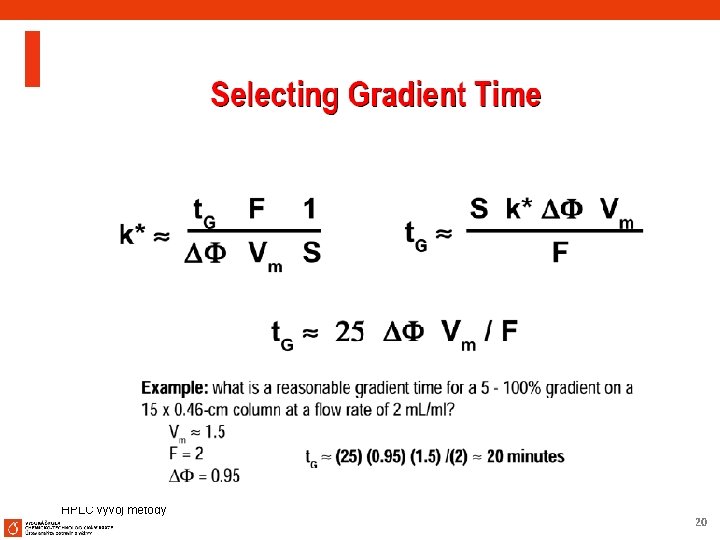
HPLC vývoj metody 19

HPLC vývoj metody 20

HPLC vývoj metody 21

HPLC vývoj metody 22

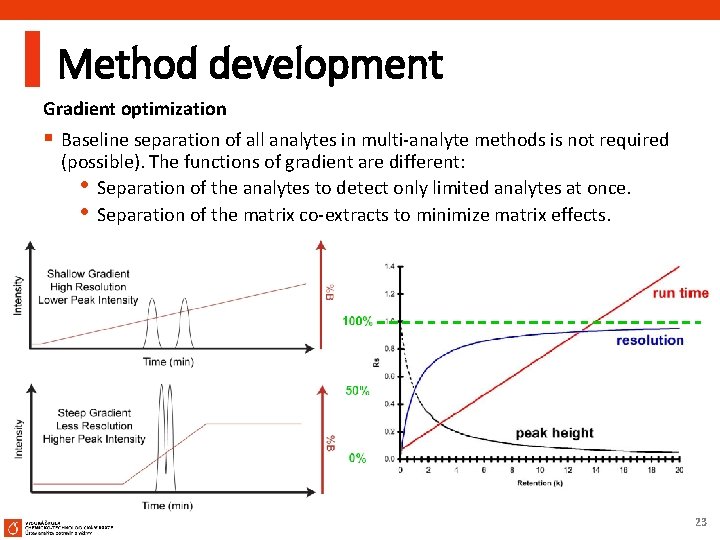
Method development Gradient optimization § Baseline separation of all analytes in multi-analyte methods is not required (possible). The functions of gradient are different: • Separation of the analytes to detect only limited analytes at once. • Separation of the matrix co-extracts to minimize matrix effects. 23

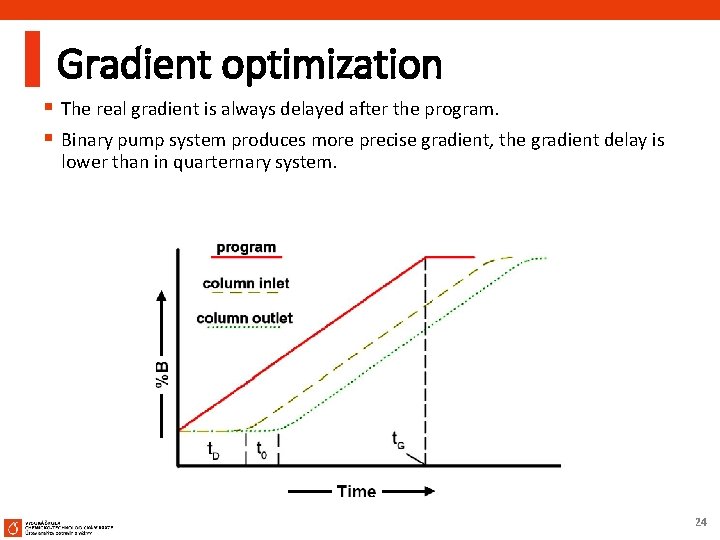
Gradient optimization § The real gradient is always delayed after the program. § Binary pump system produces more precise gradient, the gradient delay is lower than in quarternary system. 24

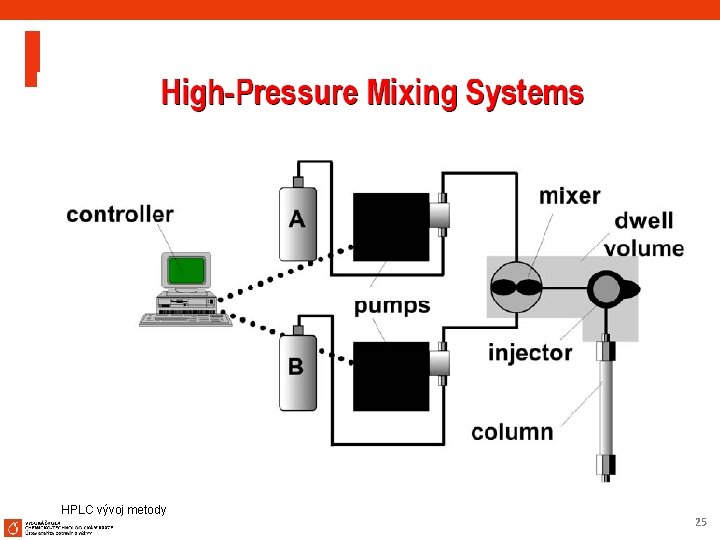
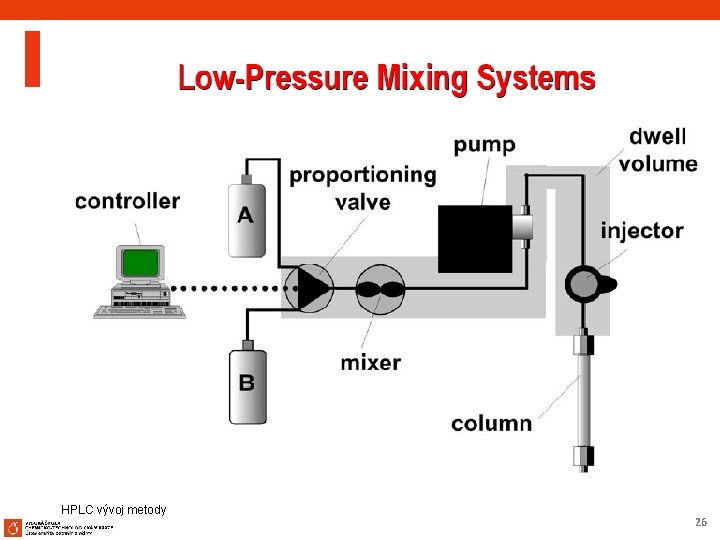
HPLC vývoj metody 25

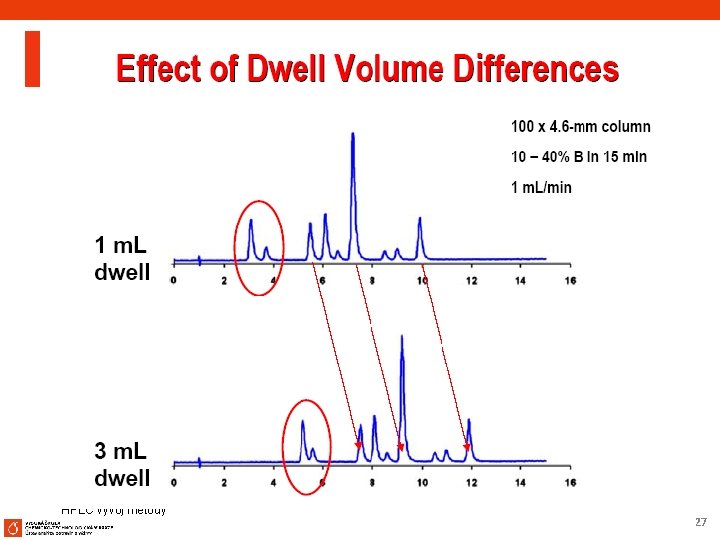
HPLC vývoj metody 26

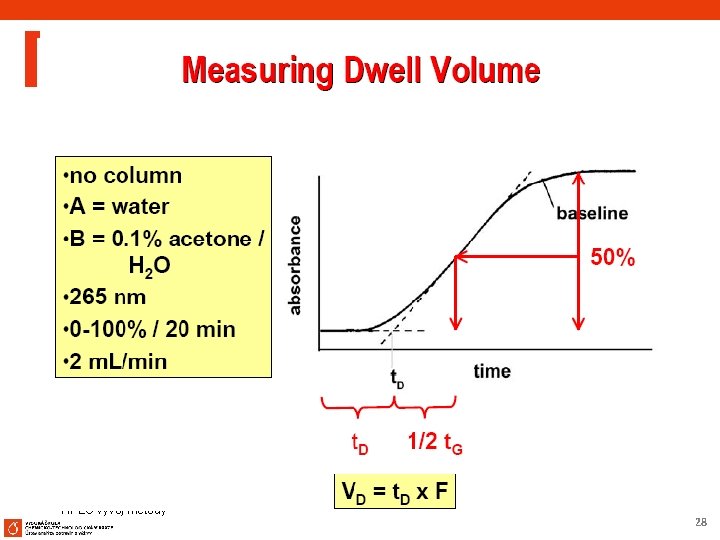
HPLC vývoj metody 27

HPLC vývoj metody 28

HPLC vývoj metody 29

HPLC vývoj metody 30

HPLC vývoj metody 31

HPLC vývoj metody 32

HPLC vývoj metody 33

HPLC vývoj metody 34

HPLC vývoj metody 35

HPLC vývoj metody 36

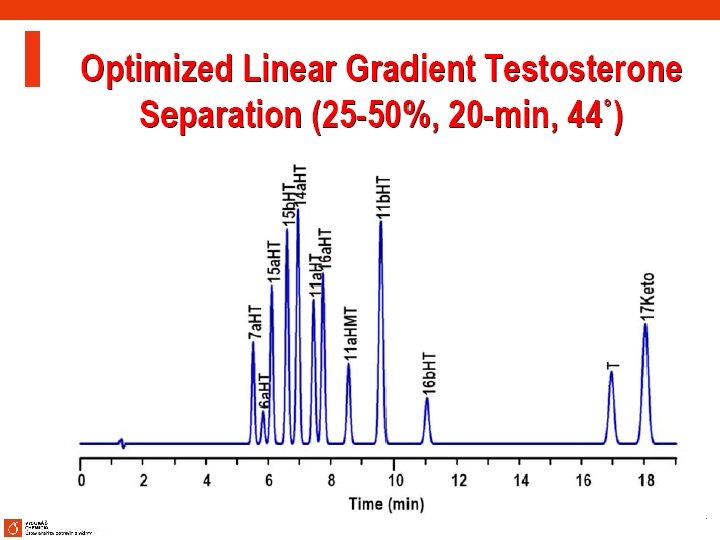
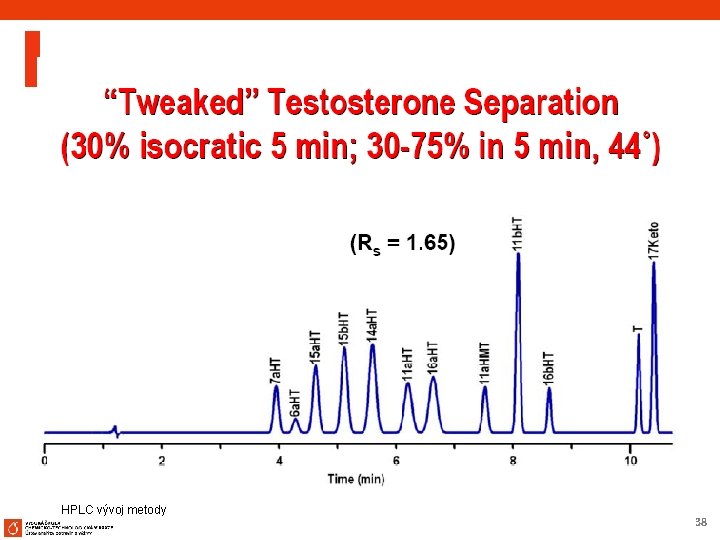
HPLC vývoj metody 37

HPLC vývoj metody 38

p. H významný parametr při vývoji metody Nízké p. H, 1 -4 - střední p. H, 3 -8 - Vysoké p. H, 7 -12 § Základem vývoje metody je změna retence ionizovatelných sloučenin změnou p. H § Začátek vývoje metody při nízkém p. H § p. H je hlavním parametrem při výběru stacionární fáze Výběr vhodné stacionární fáze pro dané p. H • Zvolte reverzní stacionární fázi na základě požadavků separace a optimální životnosti kolony • Pokud je to možné, vždy používejte nízké hodnoty p. H, protože je nejlepší chromatografie pro ionizovatelné sloučeniny; pokud ne, použijte střední p. H, v případě nedostatečné retence zvolte vysoké p. H • Zvolte nejmenší velikost částic v souladu s potřebami účinností separace; používejte vhodný oxid křemičitý typu B sol-gel • Optimalizujte výběr a složení rozpouštědla, typ pufru, koncentraci pufru, a teplotu 39

Změna retence ionizovatelných sloučenin změnou p. H n Retence ionizovatelných sloučenin je výrazně ovlivněna p. H n Ionizovatené sloučeniny (kyseliny a báze) mohou být analyty nebo součásti matrice n Nenabité analyty mají lepší retenci (kyseliny při nízkém p. H a báze při vysokém p. H) n Silanolové skupiny na silikagelu ionizují při středním p. H, se vzrůstající retencí bazických analytů (např. možné ion-exchange interakce) n Výběr mobilní fáze a typu kolony pro optimalizaci retence a selektivity při vývoji metody n Přesná kontrola p. H zlepšuje reprodukovatelnost metody n Rozsah p. H 1 – 12 zajišťuje maximální flexibilitu při vývoji metody (omezení kolonou) HPLC vývoj metody 40

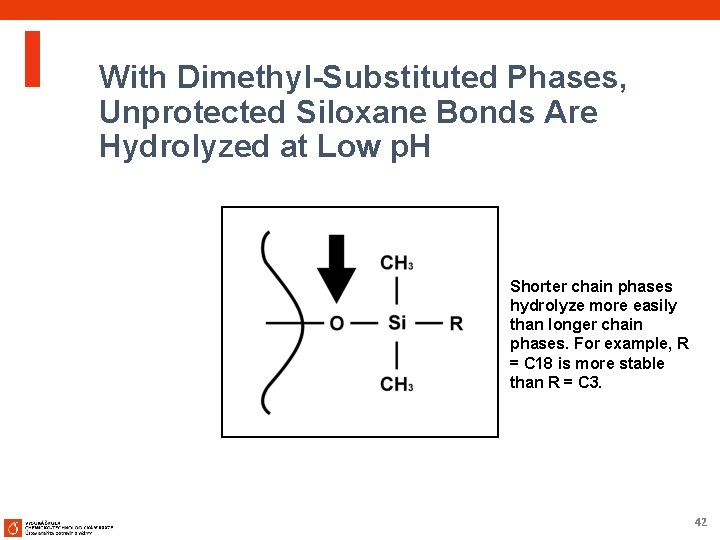
Proč nízké p. H? Logický začátek vývoje metody n Silanolové skupiny oxidu křemičitého jsou protonizované, čímž jsou minimalizovány ion-exchange interakce s bazickými sloučeninami ¨ Dobrý tvar píku ¨ Reprodukovatelnost v dlouhém období ¨ Krátké retenční časy bazické látky jsou nabité ¨ Kyseliny jsou protonované formě - zvýšená retence, Retenční časy stabilní při malé změně p. H, robustní metoda ¨ Výborný výběr mobilní fáze (kyselina mravenčí, TFA s LC / MS). • Při nízkém p. H • Dochází ke kolapsu (zhroucení) vázané fáze - hydrolýza siloxanové vazby • kolaps je rychlejší při vyšší teplotě • kolaps je rychlejší pro fáze s kratším řetězcem (C 3, CN, Phenyl) 41

With Dimethyl-Substituted Phases, Unprotected Siloxane Bonds Are Hydrolyzed at Low p. H Shorter chain phases hydrolyze more easily than longer chain phases. For example, R = C 18 is more stable than R = C 3. 42

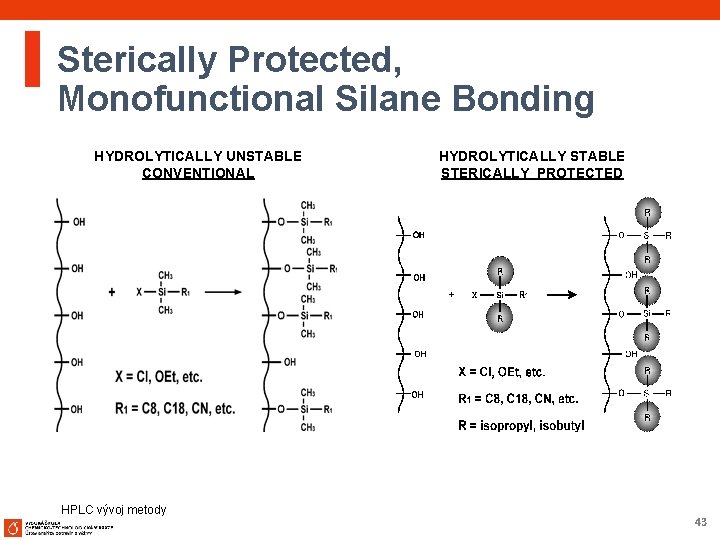
Sterically Protected, Monofunctional Silane Bonding HYDROLYTICALLY UNSTABLE CONVENTIONAL HPLC vývoj metody HYDROLYTICALLY STABLE STERICALLY PROTECTED 43

Low p. H Range Výběr vhodné stacionární fáze pro nízké p. H § Stable. Bond (5 phases: C 18, C 3, CN, Phenyl) • • • designed for low p. H sterically protected silanes non-endcapped highly temperature stable short-chain phases very stable Extremely low LC/MS bleed • Vynikající životnost kolony - patentovaná sterická technologie ochrany • Plně hydroxylovaný ultra-čistý oxid křemičitý zlepšuje tvar píku • Pět různých stacionárních fází 80Å - SB-C 18, SB-CN, SB-Phenyl, SBC 3 - optimální selektivita, vysoká životnost • Čtyři různé 300 A vázané fáze – selektivita pro separaci proteinovů a peptidovů 44

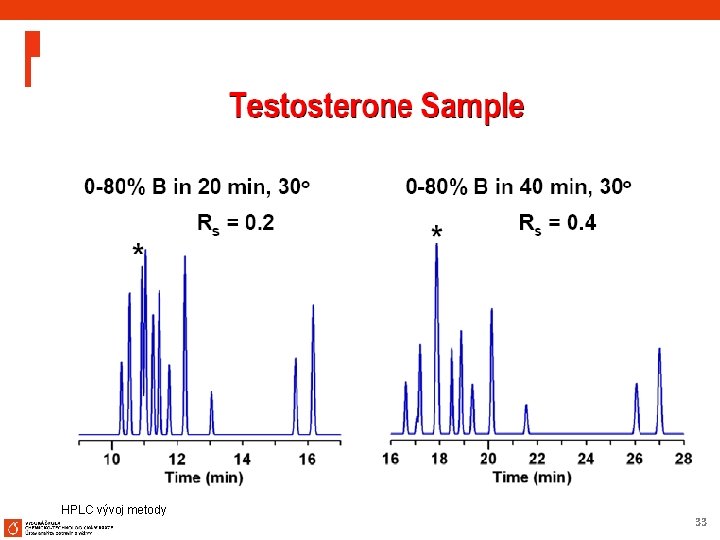
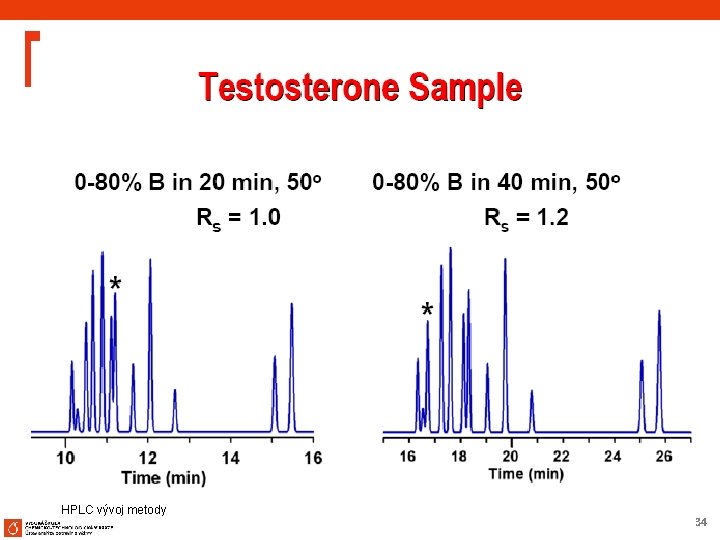
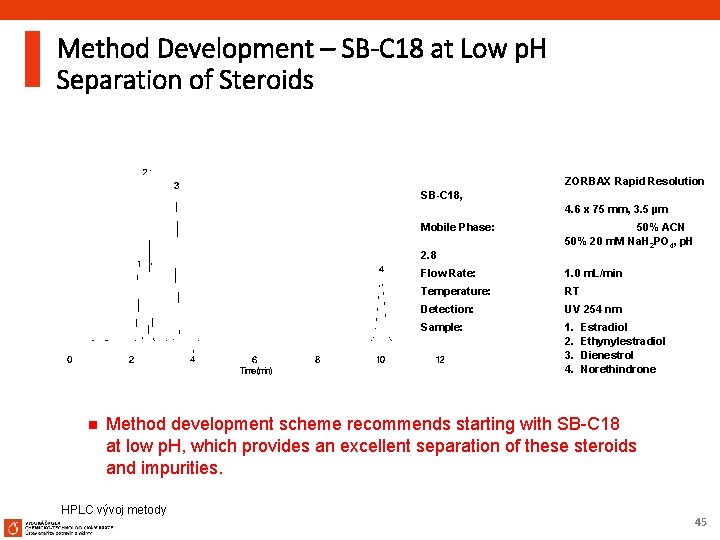
Method Development – SB-C 18 at Low p. H Separation of Steroids Column: SB-C 18, ZORBAX Rapid Resolution 4. 6 x 75 mm, 3. 5 µm Mobile Phase: 2. 8 n 50% ACN 50% 20 m. M Na. H 2 PO 4, p. H Flow Rate: 1. 0 m. L/min Temperature: RT Detection: UV 254 nm Sample: 1. 2. 3. 4. Estradiol Ethynylestradiol Dienestrol Norethindrone Method development scheme recommends starting with SB-C 18 at low p. H, which provides an excellent separation of these steroids and impurities. HPLC vývoj metody 45

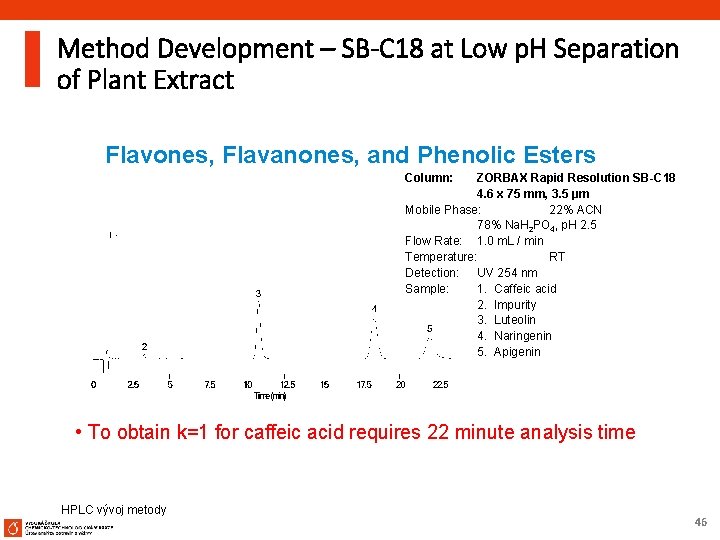
Method Development – SB-C 18 at Low p. H Separation of Plant Extract Flavones, Flavanones, and Phenolic Esters Column: ZORBAX Rapid Resolution SB-C 18 4. 6 x 75 mm, 3. 5 µm Mobile Phase: 22% ACN 78% Na. H 2 PO 4, p. H 2. 5 Flow Rate: 1. 0 m. L / min Temperature: RT Detection: UV 254 nm Sample: 1. Caffeic acid 2. Impurity 3. Luteolin 4. Naringenin 5. Apigenin • To obtain k=1 for caffeic acid requires 22 minute analysis time HPLC vývoj metody 46

Method Development – Change Organic Modifier : Separation of Plant Extract Flavones, Flavanones, and Phenolic Esters Column: ZORBAX Rapid Resolution SB-C 18 4. 6 x 75 mm, 3. 5 µm Mobile Phase: 40% Me. OH 60% Na. H 2 PO 4, p. H 2. 5 Flow Rate: 1. 0 m. L/min Temperature: RT Detection: UV 254 nm Sample: 1. Caffeic acid 2. Impurity 3. Naringenin 4. Luteolin 5. Apigenin • Methanol as the organic modifier changes selectivity and increases the analysis time. HPLC vývoj metody 47

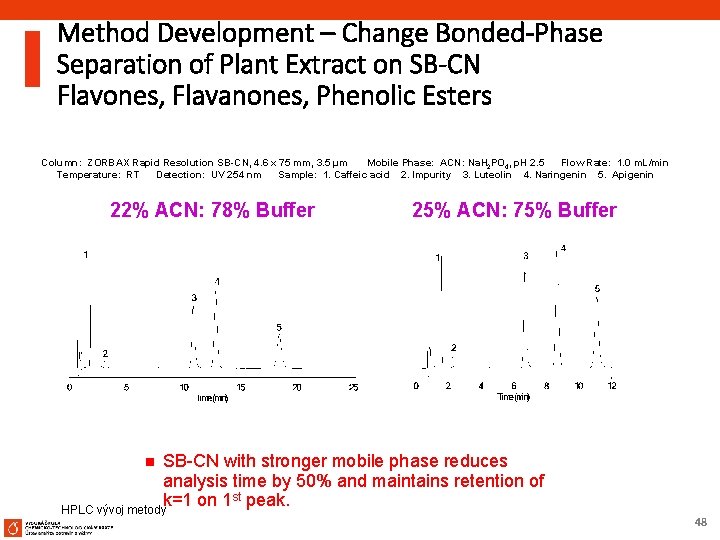
Method Development – Change Bonded-Phase Separation of Plant Extract on SB-CN Flavones, Flavanones, Phenolic Esters Column: ZORBAX Rapid Resolution SB-CN, 4. 6 x 75 mm, 3. 5 µm Mobile Phase: ACN: Na. H 2 PO 4, p. H 2. 5 Flow Rate: 1. 0 m. L/min Temperature: RT Detection: UV 254 nm Sample: 1. Caffeic acid 2. Impurity 3. Luteolin 4. Naringenin 5. Apigenin 22% ACN: 78% Buffer 25% ACN: 75% Buffer SB-CN with stronger mobile phase reduces analysis time by 50% and maintains retention of k=1 on 1 st peak. HPLC vývoj metody n 48

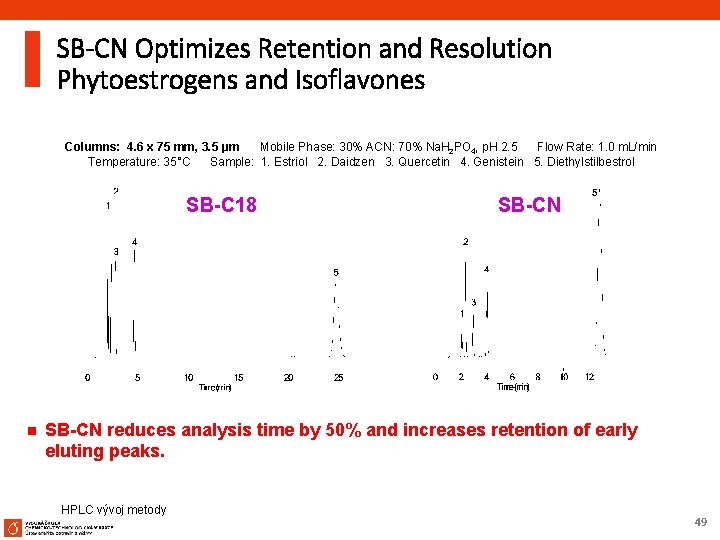
SB-CN Optimizes Retention and Resolution Phytoestrogens and Isoflavones Columns: 4. 6 x 75 mm, 3. 5 µm Mobile Phase: 30% ACN: 70% Na. H 2 PO 4, p. H 2. 5 Flow Rate: 1. 0 m. L/min Temperature: 35°C Sample: 1. Estriol 2. Daidzen 3. Quercetin 4. Genistein 5. Diethylstilbestrol SB-C 18 n SB-CN reduces analysis time by 50% and increases retention of early eluting peaks. HPLC vývoj metody 49

Vývoj metody při neutrálním p. H Proč vyvíjet RP-HPLC metody při střední hodnotě p. H? • Analyty jsou při nízkém p. H nestabilní • Lepší rozpustnost analytů při střední hodnotě p. H • Vyšší retence základních analytů • Lepší selektivita v rozmezí p. H 3 – 8 Výběr vhodné stacionární fáze pro neutrální p. H Dlouhá životnost kolon s dvojitým endcappingem při středním p. H Dlouhá životnost oxidu křemičitého Dvojitý endcapping - vynikající tvar píků Různé stacionární fáze (C 18, C 8, fenyl) pro optimalizaci selektivity 50

Neutrální p. H - problémy § Při neutrálním p. H je třeba dbát na to, aby se nevyvíjely metody kolem p. Ka analytu, protože to může vést k velkým změnám retence s malými změnami p. H § Podkladový - oxidu křemičitý se nabije (přibližně p. H 4 -6); tyto silanoly tak mohou způsobit „chvostování“ bazických sloučenin § Tyto silanoly musí být pokryty endcappingem kolony, mohou být použita aditiva jako je TEA (méně žádoucí) nebo polární stacionární fáze § Při zvyšování p. H je nutno zabránit rozpouštění oxidu křemičitého silným pokrytím kolony – encapping § Tato oblast p. H (pro p. Ka sloučeniny) se změní pro každý analyt § Při zvyšování p. H musí být zabráněno rozkladu oxidu křemičitého silica breakdown použitím vhodného oxidu křemičitého a chemickými vazbami 51

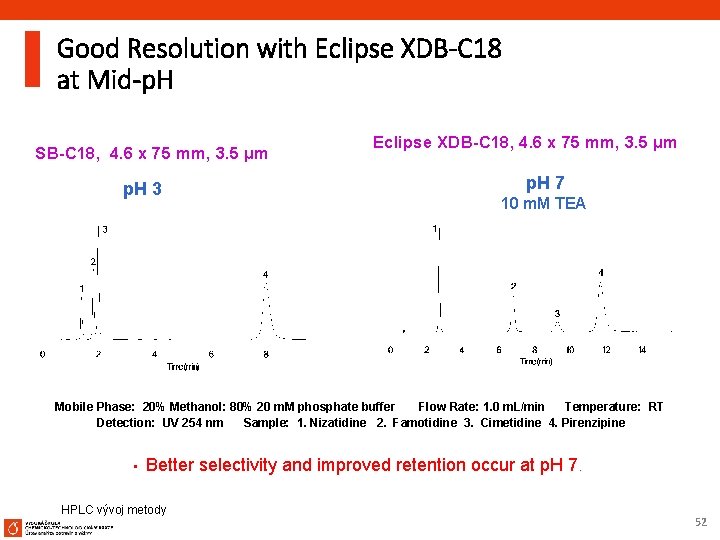
Good Resolution with Eclipse XDB-C 18 at Mid-p. H SB-C 18, 4. 6 x 75 mm, 3. 5 µm p. H 3 Eclipse XDB-C 18, 4. 6 x 75 mm, 3. 5 µm p. H 7 10 m. M TEA Mobile Phase: 20% Methanol: 80% 20 m. M phosphate buffer Flow Rate: 1. 0 m. L/min Temperature: RT Detection: UV 254 nm Sample: 1. Nizatidine 2. Famotidine 3. Cimetidine 4. Pirenzipine • Better selectivity and improved retention occur at p. H 7. HPLC vývoj metody 52

Eclipse XDB Selectivity Options Maximize Retention at p. H 7 Columns: 4. 6 x 150 mm, 5 µm Mobile Phase: 10% ACN: 90% Na 2 HPO 4, p. H 7 Flow Rate: 1. 5 m. L/min Temperature: 35°C Detection: UV 254 nm Sample: 1. Procainamide 2. n-Acetylprocainamide 3. n-Propionylprocainamide Eclipse XDB-C 18 1 Eclipse XDB-C 8 Eclipse XDB-Phenyl 1 1 n Eclipse XDB-Phenyl provides improved retention of these procainamides. HPLC vývoj metody 53

Bonus-RP Provides Alternate Selectivity at Mid-p. H n Polar alkyl-amide bonded-phase for unique selectivity n Improves peak shape of basic compounds n Triple-endcapped for good lifetime at mid-p. H n Enhanced low-p. H stability (sterically protecting bonding) for alternate selectivity at low p. H n Compatible with 100% aqueous mobile phases HPLC vývoj metody 54

Vývoj metody při vysokém p. H n Analyty nejsou rozpustné při nižším p. H Analyty nejsou stabilní při nižším p. H Zvýšení retence sloučenin při stanovení v nenabité formě • • Zlepšení selektivity Bazické sloučeniny jsou ve formě volné báze, větší retence a různá selektivita – snadnější separace složité směsi bazických sloučenin při vysokém p. H Malá změny retence v této oblasti - robustní metody Vyšší retence, ale toto může být jediná oblast, kde se některé analyty budou separovat Při vysokém p. H zabráněno zkroucení (breakdown) oxidu křemičitém chemickými vazbami a použitím vhodného oxidu křemičitého Silica–Based HPLC kolony vhodné pro vysoké p. H n Nové technologie na ochranu oxidu křemičitého před rozpouštěním poskytují dobrou životnost při vysokém p. H n Vysoká účinnost kolon na bázi oxidu křemičitého poskytuje vysoké rozlišení n Robustní metody mohou být zavedeny za použití stejných parametrů jako při nízkém p. H 55

Choose Extend-C 18 for High p. H n Patented bidentate C 18 -C 18 bonding for superior high p. H stability – up to p. H 11. 5 n Improved performance over polymeric columns n Excellent peak shape with double endcapping n LC/MS at high p. H (ammonium hydroxide) with high efficiency Extend-C 18 Bidentate Structure Silica support HPLC vývoj metody 56

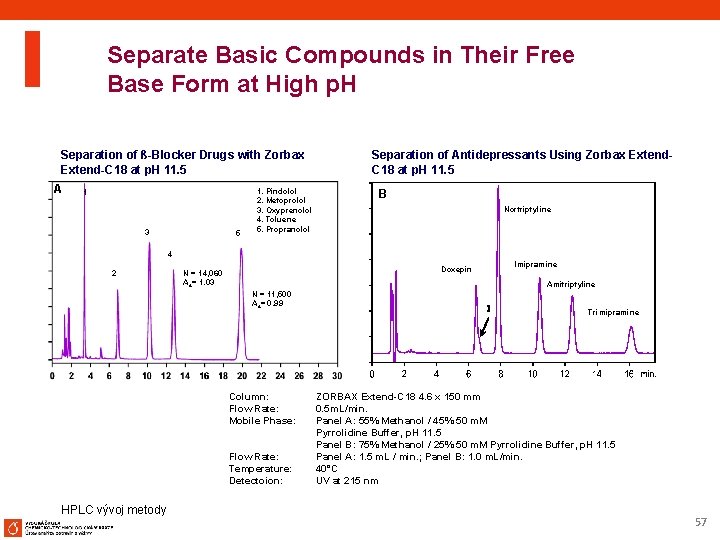
Separate Basic Compounds in Their Free Base Form at High p. H Separation of ß-Blocker Drugs with Zorbax Extend-C 18 at p. H 11. 5 A 1 3 5 1. Pindolol 2. Metoprolol 3. Oxyprenolol 4. Toluene 5. Propranolol Separation of Antidepressants Using Zorbax Extend. C 18 at p. H 11. 5 B Nortriptyline 4 2 Amitriptyline N = 11, 500 As= 0. 99 Column: Flow Rate: Mobile Phase: Flow Rate: Temperature: Detectoion: HPLC vývoj metody Imipramine Doxepin N = 14, 060 As= 1. 03 I Trimipramine ZORBAX Extend-C 18 4. 6 x 150 mm 0. 5 m. L/min. Panel A: 55% Methanol / 45% 50 m. M Pyrrolidine Buffer, p. H 11. 5 Panel B: 75% Methanol / 25% 50 m. M Pyrrolidine Buffer, p. H 11. 5 Panel A: 1. 5 m. L / min. ; Panel B: 1. 0 m. L/min. 40°C UV at 215 nm 57

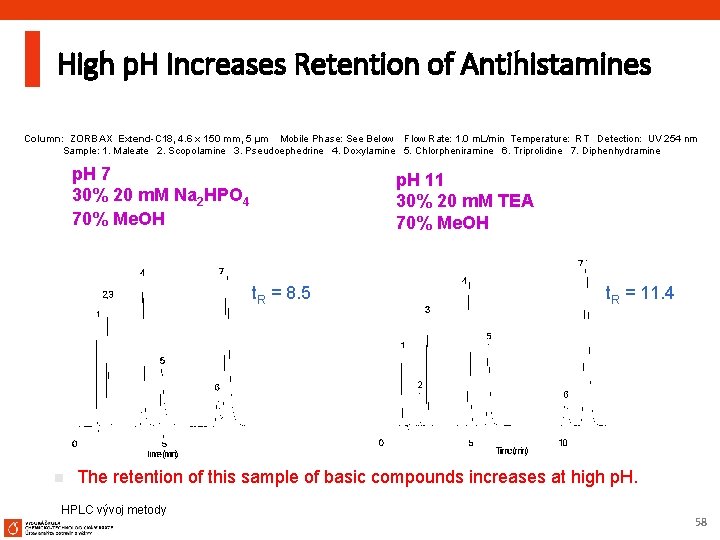
High p. H Increases Retention of Antihistamines Column: ZORBAX Extend-C 18, 4. 6 x 150 mm, 5 µm Mobile Phase: See Below Flow Rate: 1. 0 m. L/min Temperature: RT Detection: UV 254 nm Sample: 1. Maleate 2. Scopolamine 3. Pseudoephedrine 4. Doxylamine 5. Chlorpheniramine 6. Triprolidine 7. Diphenhydramine p. H 7 30% 20 m. M Na 2 HPO 4 70% Me. OH p. H 11 30% 20 m. M TEA 70% Me. OH t. R = 8. 5 n t. R = 11. 4 The retention of this sample of basic compounds increases at high p. H. HPLC vývoj metody 58

Extend-C 18 Provides High Efficiency and Good Peak Shape Mobile Phase: 65% 20 m. M TEA, p. H 11: 35% Me. OH Temperature: RT Detection: UV 254 nm Sample: 1. Pyridoxine 2. Pyridine 3. n-Methylbenzylamine 4. Procainamide 5. n-Acetylprocainamide n Polymeric-Based Column Extend-C 18 4. 0 x 250 mm, 5 µm Flow Rate: 0. 5 m. L/min 4. 6 x 250 mm, 5 µm Flow Rate: 1. 0 m. L/min In comparison to polymeric columns, the Extend-C 18 has superior efficiency and peak shape HPLC vývoj metody 59

Doporučené pufry pro vysoké p. H Buffer p. Ka Effective p. H range Pyrrolidine 11. 3 Triethylamine (TEA) 1 -methyl-piperidine glycine 9. 8 TRIS 8. 1 10. 3 – 12. 3 10. 7 9. 7 – 11. 7 10. 3 9. 3 – 11. 3 8. 8 – 10. 8 7. 1 – 9. 1 Borate 9. 2 Ammonia Diethylamine 8. 2 – 10. 2 9. 5 – 11. 5 9. 2 10. 5 60

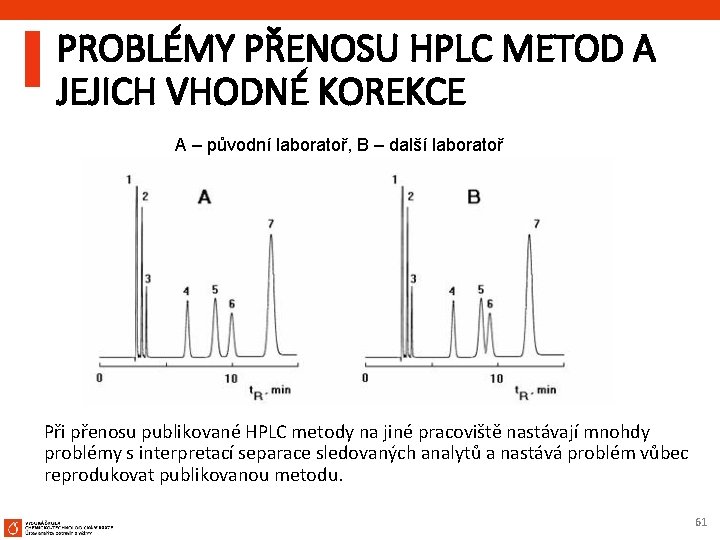
PROBLÉMY PŘENOSU HPLC METOD A JEJICH VHODNÉ KOREKCE A – původní laboratoř, B – další laboratoř Při přenosu publikované HPLC metody na jiné pracoviště nastávají mnohdy problémy s interpretací separace sledovaných analytů a nastává problém vůbec reprodukovat publikovanou metodu. 61

Chromatogram A znázorňuje původní publikovanou metodu Chromatogram B - po přenosu metody do jiné laboratoře Je zřejmé, že nedochází k separaci analytů 5, 6 - rozlišení RS < 1, 5 Existuje několik příčin proč nedochází k dokonalé separaci: a) chromatografický systém není dostatečně ekvilibrovaný b) došlo ke změně chromatografické kolony c) změna chromatografického (HPLC) systému d) změna v chromatografickém postupu Nedostatečnou ekvilibraci chromatografické kolony jako hrubou chybu vyloučíme a dále budeme rozebírat pouze poslední tři možné příčiny 62

1. Změna chromatografické kolony Změnou kolony (jiný výrobce, jiná šarže) zpravidla dojde ke změně: a) účinnosti kolony (počet teoretických pater, n) b) selektivity (retenční poměr, r 12) Proto je vhodné při validaci metody určit chromatografické parametry kolony, které vyhovují pro danou chromatografickou separaci: a) účinnost kolony b) selektivitu c) silanolovou aktivitu Testy chromatografických charakteristik stacionární fáze: • kapacita kolony (účinnost) • hydrofobicita • silanolová aktivita Validace metody na zvolené chromatografické koloně Určení vhodné alternativní chromatografické varianty Metoda maximální chromatografické variability, která zahrnuje: 1. optimalizaci chromatografických podmínek 2. předvídání použití různých chromatografických kolon 3. výběr podobných kolon 63

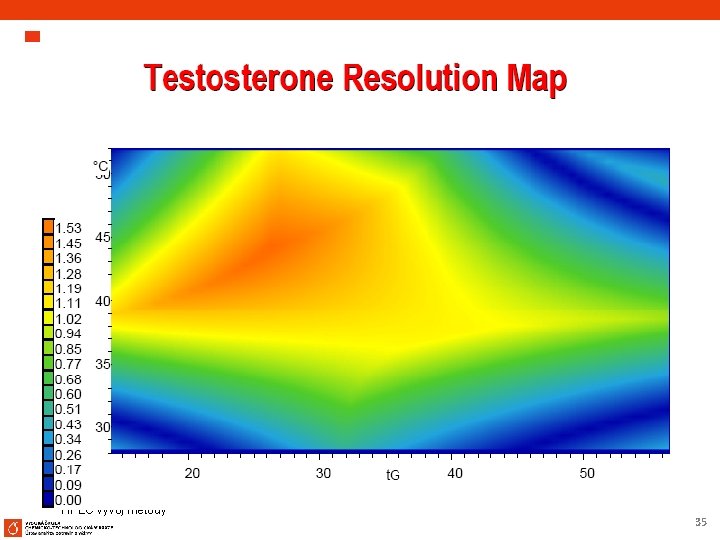
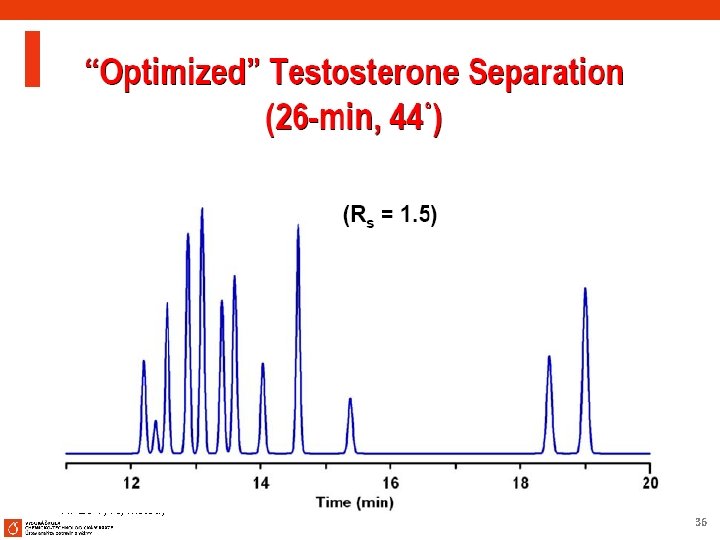
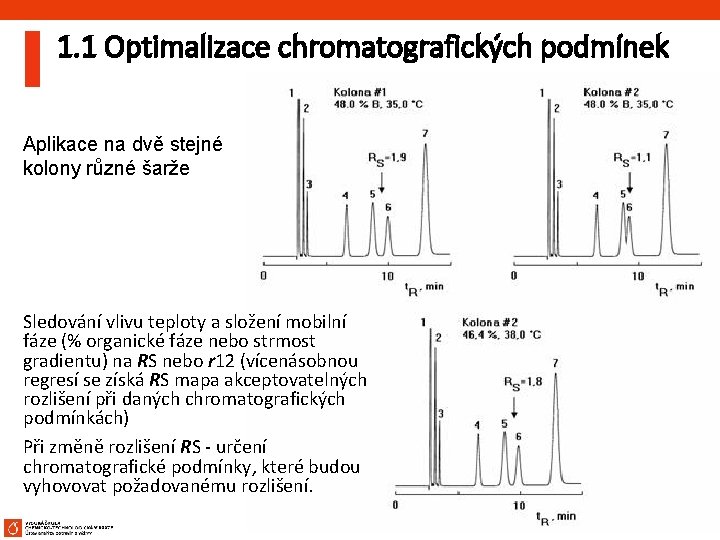
1. 1 Optimalizace chromatografických podmínek Aplikace na dvě stejné kolony různé šarže Sledování vlivu teploty a složení mobilní fáze (% organické fáze nebo strmost gradientu) na RS nebo r 12 (vícenásobnou regresí se získá RS mapa akceptovatelných rozlišení při daných chromatografických podmínkách) Při změně rozlišení RS - určení chromatografické podmínky, které budou vyhovovat požadovanému rozlišení. 64

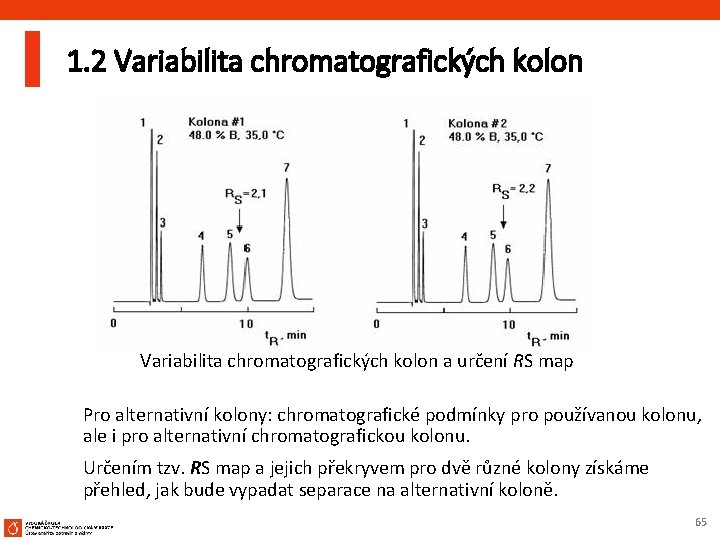
1. 2 Variabilita chromatografických kolon a určení RS map Pro alternativní kolony: chromatografické podmínky pro používanou kolonu, ale i pro alternativní chromatografickou kolonu. Určením tzv. RS map a jejich překryvem pro dvě různé kolony získáme přehled, jak bude vypadat separace na alternativní koloně. 65

1. 3 Výběr podobných kolon K celkové selektivitě stacionární fáze přispívají: kapacitní faktor k a dále hydrofobicita (H), stérická selektivita (shape selektivity; S), silanolová aktivita (non-ionized silanol acidity nebo také silanol group capacity, A), kolonová basicita (column basicity; B) a iontověvýměnná kapacita (cation-exchange capacity; C). Pro logaritmus kapacitního faktoru pak platí: Kde κ, α, β , δ, jsou příspěvky solutu a H, S, A, B a C jsou příspěvky stacionární fáze a kde je kapacitní faktor daný distribuční konstantou a fázovým poměrem. Příspěvek hydrofobicity H souvisí s nespecifickými interakcemi solutu se stacionární fází (methylenová selektivita αCH 2), příspěvky silanolové aktivity A a kolonové basicity B souvisí s možností tvorby vodíkových vazeb mezi solutem a zbytkovými silanolovými skupinami silikagelu. Určením selektivity různých chromatografických kolon (Tanakovy a Engelhardtovy testy) tak můžeme získat přehled o podobných kolonách, které je možné použít pak jako alternativní kolony ke koloně používané (validované). 66

2. Změna HPLC systému vede ve většině případech ke změnám: 1. mrtvého objemu systému (při gradientu mobilní fáze) 2. změna mimokolonových příspěvků k rozšíření chromatografické zóny Mrtvý objem systému Změna mrtvého objemu systému (konstrukce pumpy, změna vnitřního průměru kapilár) vede ke změně mrtvého objemu systému, která může mít vliv na strmost gradientu (zpoždění gradientu, které má vliv na separaci kritických analytů). Na separaci má vliv i tvorba gradientu – změna tvorby gradientu vede ke zpoždění gradientu a to má pak vliv na separaci kritických analytů. Mimokolonové příspěvky k rozšíření chromatografické zóny mají vliv na účinnost systému a změna objemu nástřiku, objemu cely detektoru, vnitřního průměru kapilár nebo jejich délky, může mít vliv na účinnost kolony a to vede ke snížení rozlišení kritických analytů. 67

3. Změna v chromatografickém postupu Ke změně v chromatografickém postupu (metodě) může dojít: a) ve změně složení mobilní fáze (změna objemové frakce organického rozpouštědla, p. H, koncentrace aditiv [pufry, iontové páry]) b) změnou teploty na chromatografické koloně c) změnou gradientu (použití jiného tvorby gradientu, přechod z vysokotlakého gradientu na nízkotlaký a naopak) 68
 Didaktika slovenského jazyka
Didaktika slovenského jazyka Didaktické zásady
Didaktické zásady Principy pocitacoveho inzinierstva tuke
Principy pocitacoveho inzinierstva tuke Kompozičné princípy umeleckého rozprávania
Kompozičné princípy umeleckého rozprávania Zamonaviy axloqiy tarbiya
Zamonaviy axloqiy tarbiya Metod kandidatuppsats
Metod kandidatuppsats Metody pracy
Metody pracy Gausova
Gausova Delfi metoda
Delfi metoda Podział metod instrumentalnych
Podział metod instrumentalnych Kabinet diagnostických metod fss
Kabinet diagnostických metod fss Kombine antrenman nedir
Kombine antrenman nedir Rättssociologisk metod
Rättssociologisk metod Metoda suprotnih koeficijenata zadaci
Metoda suprotnih koeficijenata zadaci Metody aktywizujące podział
Metody aktywizujące podział Dogmatski metod
Dogmatski metod Ta'limiy metodlar
Ta'limiy metodlar Oblici nastavnog rada
Oblici nastavnog rada Kvalitativ metod nackdelar
Kvalitativ metod nackdelar Kroneker kapelijeva teorema
Kroneker kapelijeva teorema Kvantitativ intervju
Kvantitativ intervju Ren metod
Ren metod Fiskbensdiagram exempel
Fiskbensdiagram exempel Odzysk chemia
Odzysk chemia Metod sociologije
Metod sociologije Gausova teorema matematika
Gausova teorema matematika Longityud
Longityud Kvalitativ metod intervju
Kvalitativ metod intervju Deduktioner
Deduktioner Cyril a metod 863
Cyril a metod 863 Kvantitativ metod
Kvantitativ metod Karta przebiegu materiału
Karta przebiegu materiału Kimyo o'qitish metodikasi
Kimyo o'qitish metodikasi Direct method شرح
Direct method شرح Fenomenografisk metod
Fenomenografisk metod Testimplikation
Testimplikation Ogʻzaki metodlar
Ogʻzaki metodlar Klaster usullari
Klaster usullari Metod sociologije
Metod sociologije Vad är komparativ
Vad är komparativ Amaliy metodlar turlari va tavsifi
Amaliy metodlar turlari va tavsifi Konstantin a metod matus kucera
Konstantin a metod matus kucera Degresivni
Degresivni Kramerov metod
Kramerov metod Rita en bild
Rita en bild 6 kapeluszy
6 kapeluszy Gap analys exempel
Gap analys exempel Podział metod chromatograficznych
Podział metod chromatograficznych Ped kengash bayonnomasi
Ped kengash bayonnomasi Tarbiya metodlari ppt
Tarbiya metodlari ppt Evidensbaserad metod
Evidensbaserad metod Triangulace dat
Triangulace dat Hzda
Hzda Osnovne operacije sa iskazima
Osnovne operacije sa iskazima Hypotetisk-deduktiv metod
Hypotetisk-deduktiv metod Metody aktywizujące przykłady
Metody aktywizujące przykłady Metody pracy z dzieckiem autystycznym w szkole
Metody pracy z dzieckiem autystycznym w szkole Metody badawcze w socjologii
Metody badawcze w socjologii Metody aktywizujące przykłady
Metody aktywizujące przykłady Plan dnia pecs
Plan dnia pecs Extrospekce
Extrospekce Kubarytmy
Kubarytmy Elektrografické vyšetřovací metody
Elektrografické vyšetřovací metody Metoda oglądowa
Metoda oglądowa Metoda francuska b
Metoda francuska b Metody numeryczne
Metody numeryczne Techniki uczenia się prezentacja
Techniki uczenia się prezentacja Metódy nácviku čítania
Metódy nácviku čítania Szereg eluotropowy rozpuszczalników
Szereg eluotropowy rozpuszczalników