Termodinamica Entalpia H una funzione di stato non


































































![Entalpia di legame HB H 0 B (X-Y) = [Hm°(X, g)+Hm°(Y, g)] - Hm°(XY, Entalpia di legame HB H 0 B (X-Y) = [Hm°(X, g)+Hm°(Y, g)] - Hm°(XY,](https://slidetodoc.com/presentation_image_h/a34fd09bd45340889d214837f7a673c9/image-83.jpg)
- Slides: 84

Termodinamica Entalpia H è una funzione di stato non dipende dal percorso che porta il mio sistema dallo stato S 1 allo stato S 2 Variazione di Entalpia H H= Qp Corrisponde al calore scambiato in una reazione a pressione costante. L’entalpia dipende dalla quantità di sostanza che si trasforma e dalla T e P a cui la trasformazione avviene (proprietà estensiva).

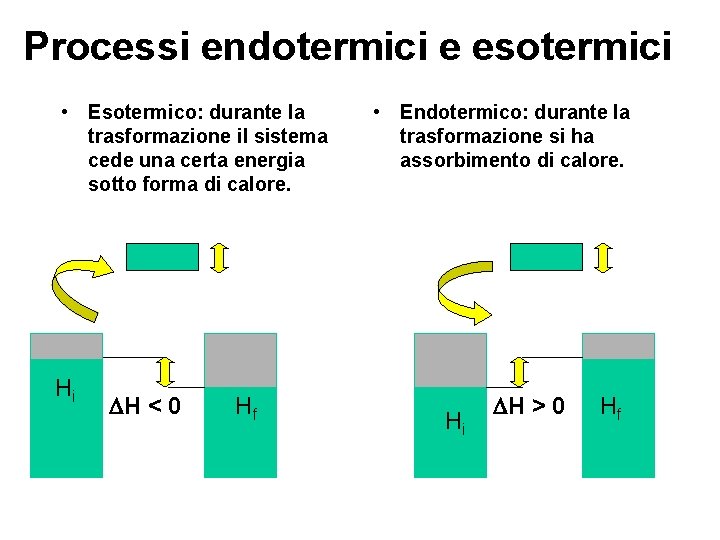
Processi endotermici e esotermici • Esotermico: durante la trasformazione il sistema cede una certa energia sotto forma di calore. Hi H < 0 Hf • Endotermico: durante la trasformazione si ha assorbimento di calore. Hi H > 0 Hf

Esempio di reazioni esotermiche La reazione che produce vapor d'acqua a partire da idrogeno e ossigeno è una reazione esotermica che avviene perciò con sviluppo di calore e diminuzione di entalpia: 2 H 2(g) + O 2(g) → 2 H 2 O(l) + Q Per questa reazione si ha che: Q = ∆H = - 136, 6 kcal ciò indica che 2 moli di H 2 O liquida hanno un contenuto termico complessivo inferiore di 136, 6 kcal rispetto al contenuto termico complessivo di 2 moli di H 2 + 1 mole di O 2 considerati allo stato di gas. Quindi la reazione è favorita verso destra perche’ H 2 O è energeticamente più stabile, ossia il contenuto energetico dei legami covalenti in 2 moli di H 2 O sono minori di quelli contenuti in 2 moli di H 2 + una mole di O 2.

H della trasformazione si puo’ misurare sperimentalmente misurando il calore sviluppato/acquisito dal sistema oppure se non è possibile:

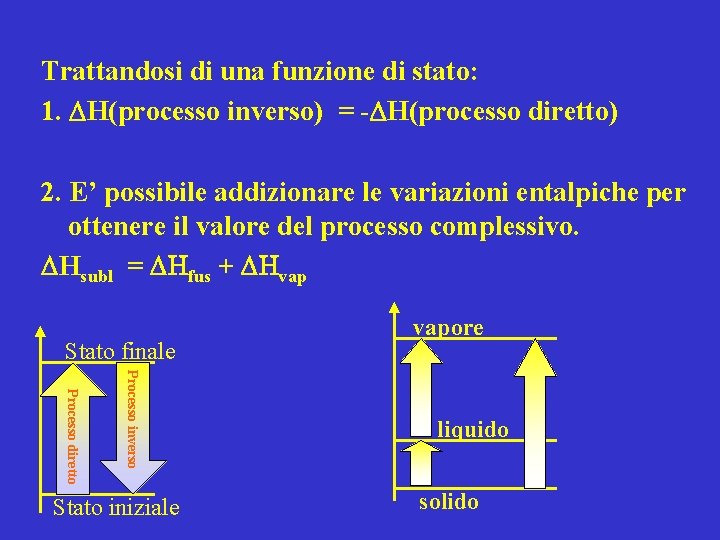
Trattandosi di una funzione di stato: 1. H(processo inverso) = - H(processo diretto) 2. E’ possibile addizionare le variazioni entalpiche per ottenere il valore del processo complessivo. Hsubl = Hfus + Hvap Stato finale Processo inverso Processo diretto Stato iniziale vapore liquido solido

LEGGE DI HESS Se un processo avviene per stadi (anche solo ipotetici), la variazione di entalpia per l’intero processo (totale) è la somma delle variazioni di entalpia dei singoli stadi. ½ N 2 + O 2 NO 2 H° = ? ½ N 2 + O 2 NO + ½ O 2 H° = +90. 25 k. J NO + ½ O 2 NO 2 H° = -57. 07 k. J ½ N 2 + O 2 NO 2 H° = +33. 18 k. J H° calore misurato alle condizioni standard di P = 1 bar

Legge di Hess Reazione complessiva Entalpia • L’entalpia di reazione è la somma delle entalpie di qualsiasi sequenza di reazioni (alla stessa T e alla stessa P) in cui la reazione generale può essere scomposta. e b a c prodotti d reagenti



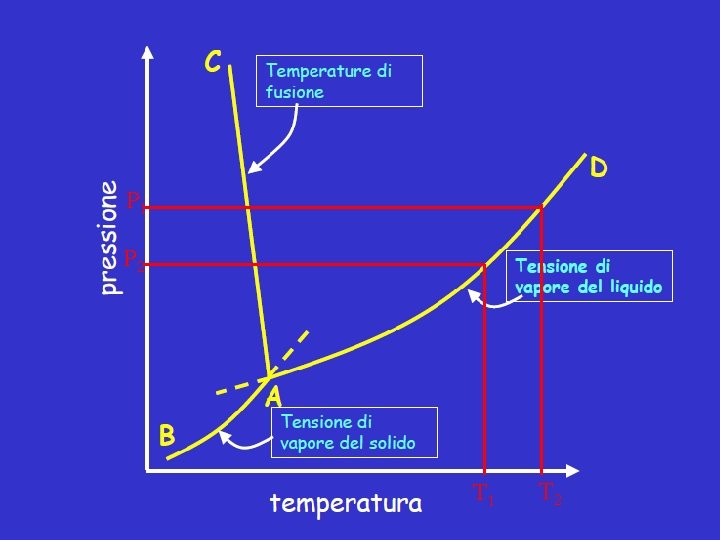
L’entalpia nei cambiamenti di stato • Si può definire un’entalpia molare standard di vaporizzazione, fusione e sublimazione che corrisponde al calore fornito a P costante di 1 bar ad una mole di sostanza per far avvenire il processo alle corrispondenti T di eb. , fus. e sub. , che non variano durante il passaggio di stato. • Il processo sarà sempre endotermico: Hvap 0 = Hvapore, m – H liquido, m alla T normale di vaporizzazione • Lo stesso vale per il processo di fusione: Hfus 0 = Hliquido, m – H solido, m alla T normale di fusione • e per quello di sublimazione: Hsub 0 = Hvapore, m – H solido, m alla T normale di sublimazione


sub

P 1 P 2 T 1 T 2


Entalpia molare standard di formazione H°f E’ la variazione di entalpia che si ha ad una certa temperatura nella formazione di una mole di una sostanza a partire dalle forme di riferimento degli elementi alle condizioni standard (P = 1 bar). Lo stato standard termodinamico dipende dalla temperatura d'interesse (normalmente temperatura ambiente). I valori sono in genere tabulati come entalpia di formazione standard alla temperatura di 298, 15 K (25°C) e sono espressi in k. J/mol. n/x Ax + m/y By An. Bm Le forme di riferimento sono (quasi sempre, rare eccezioni) le forme (allotropiche se ci sono) più stabili degli elementi alle condizioni standard.

Entalpia molare standard di formazione H°f Tutti gli elementi nel loro stato standard, quindi puri nella forma più stabile alla temperatura di interesse di 25°C e alla pressione di stato-standard 1 bar, hanno zero come valore di entalpia di formazione standard. Le forme più stabili dei seguenti elementi alle condizioni standard sono: Na(s), H 2(g), N 2(g), O 2(g), C(grafite), Br 2(l) e hanno H°f = 0 per definizione C(grafite) C(diamante) H°f = 1. 9 k. J mol-1 del diamante La grafite alle condizioni standard è la forma allotropica più stabile dell’elemento carbonio e quindi il suo H°f =0


Entalpia molare standard di formazione Hf° • Variazione di entalpia associata alla formazione di una mole di composto partendo dalle sostanze elementari che lo compongono, essendo tutti i reagenti e i prodotti alle condizioni standard. • Per convenzione Hf° di una qualunque sostanza elementare è uguale a zero. • Le entalpie molari standard di formazione permettono di calcolare le entalpie di reazioni alle condizioni standard, secondo tale relazione: H°= n Hf°(prodotti)- n Hf°(reagenti)

Entalpie standard di reazione 2 Na. HCO 3 (s) Na 2 CO 3(s) + H 2 O(l) +CO 2(g) H° = H°decomposizione + H°ricombinazione H°decomposizione = -2 x H°f(Na. HCO 3(s)) H°ricombinazione= H°f(Na 2 CO 3(s)) + H°f(H 2 O(l)) + H°f(CO 2(g)) Quindi: H° = H°f(Na 2 CO 3(s)) + H°f(H 2 O(l)) + H°f(CO 2(g)) - 2 x H°f(Na. HCO 3(s)) Generalizzando: H° = ∑ici H°f(prodotti) - ∑ici H°f(reagenti)

Entalpia standard di reazione a. A + b. B c. C + d. D H 0 reazione = c H 0 f (C) + d H 0 f (D) - a H 0 f (A) - b H 0 f (B) Ovvero: H 0 reazione = ∑i ci H 0 f i (PRODOTTI) - ∑i ci H 0 f i (REAGENTI) Il calore sviluppato o assorbito da un sistema nella trasformazione chimica di 1 mole di una sostanza alla T convenzionale di 25°C e alla P di 1 bar (lo stato standard termodinamico) è pari a una variazione di entalpia chiamata entalpia molare standard di reazione.

Entalpia Molare Standard di Formazione di CO C + 1/2 O 2 CO Difficile direttamente perchè si forma CO 2 Indirettamente, CO 2 si puo’ formare in due stadi: 1) C + 1/2 O 2 2) CO + 1/2 O 2 C + O 2 CO CO 2 H 0 f= ? ? ? H 0 r= -283 k. J mol-1 H 0 f= -394 k. J mol-1 Legge di Hess: H è indipendente dal cammino percorso, ma dipende solo dallo stato iniziale e finale, perchè H è funzione di stato H 0 f (CO 2) = H 0 f (CO) + H 0 r C + 1/2 O 2 H 0 f= -111 k. J mol-1 CO -394 = X - 283

Che cosa è la spontaneità di un processo? • La spontaneità è la capacità di un processo di avvenire senza interventi esterni che promuovano il processo • Accade “naturalmente”, anche se spesso i processi spontanei non è detto che siano necessariamente veloci. n Termodinamica: un processo è spontaneo se avviene senza che venga eseguito del lavoro/fornito calore sul sistema.

Cosa hanno in comune i processi spontanei? Entrambi i processi sono permessi dal primo principio della termodinamica (l’energia totale rimane invariata). Spontaneo Non Spontaneo Energia termica si distribuisce spontanemente fuori dal blocco metallico Spontaneo Non Spontaneo La materia gassosa si distrbuisce spontanemente su tutto il volume disponibile Energia e materia tendono a disporsi in modo disordinato!

Disordine termico: qunado l’energia termica si disperde dal corpo caldo all’ambiente, distribuisco l’energia termica in piu’ microstati e quindi ho aumento di disordine. Disordine posizionale/configurazionale: quando la materia si disperde in un volume piu’ grande o si mescola con altra materia, le molecole si disperdono su un maggior numero di posizioni possibili e distribuisco la materia su numero maggiore di microstati e quindi aumenta disordine.

Processo non spontanei • È possibile ‘forzare’ la natura verso processi non spontanei, per esempio comprimere un gas, ma si deve compiere del lavoro.

L’entalpia ci serve per prevedere se un processo è spontaneo ossia il processo termodinamico avviene sul sistema lasciato a se stesso senza fornire lavoro o calore dall’esterno? Cioè se processo esotermico mi aspetto che il processo è favorito entalpicamente e quindi avviene spontaneamente (diminuzione dell’energia del sistema), ma l’entalpia non basta perché ci sono anche processi endotermici (quindi determinano un aumento dell’energia del sistema) che sono spontanei

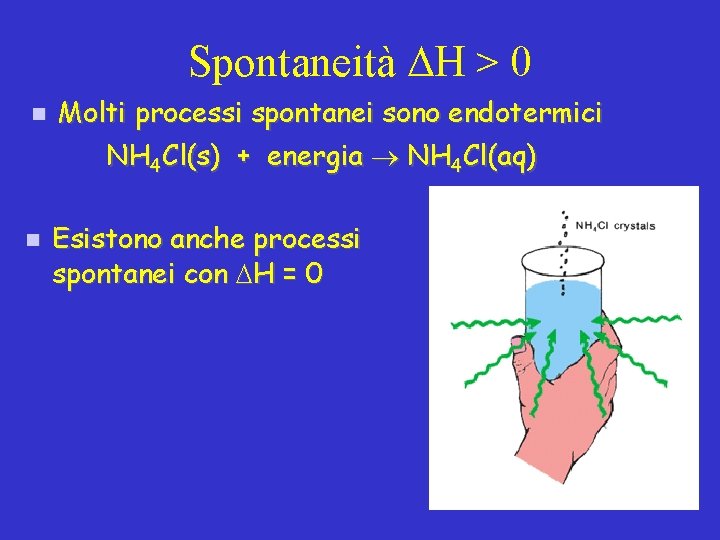
Spontaneità H > 0 n Molti processi spontanei sono endotermici NH 4 Cl(s) + energia NH 4 Cl(aq) n Esistono anche processi spontanei con H = 0

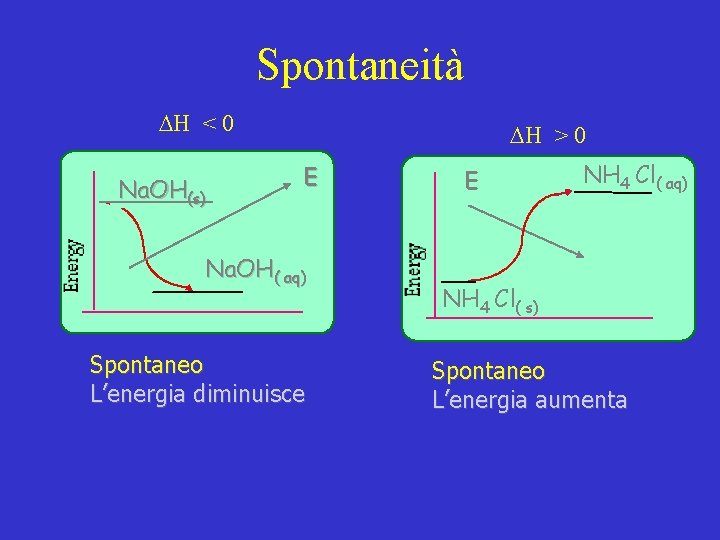
Spontaneità H < 0 Na. OH(s) H > 0 E Na. OH( aq) Spontaneo L’energia diminuisce E NH 4 Cl( aq) NH 4 Cl( s) Spontaneo L’energia aumenta

L’entropia • L’entropia, S, è una funzione di stato che misura il disordine del sistema: bassa entropia vuol dire poco disordine; alta entropia corrisponde a grande disordine. • L’entropia di un sistema isolato aumenta nel corso di qualsiasi processo spontaneo.

L’entropia di un sistema isolato aumenta nel corso di qualsiasi processo spontaneo. Per gas ideali, P è cambiata ma T no, quindi non ho scambio di calore con l’esterno Q=0 Le pareti sono rigide e quindi non ho scambiato lavoro con l’esterno, L= 0 Quindi Usis = Q + L = 0 non è variata l’energia interna dei gas e quindi si può dire che ho un sistema isolato! Ma il disordine è aumentato, ossia l’entropia è aumentata: S = Smix di gas – (SA(g)+ SB(g)) > 0

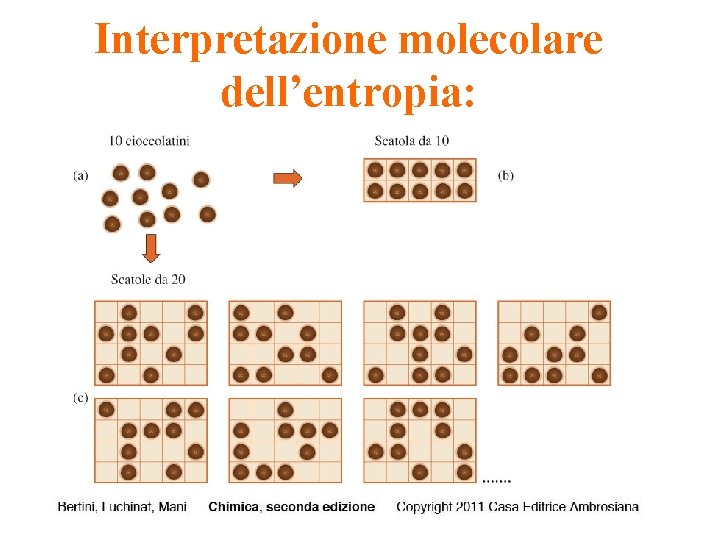
In (b) le molecole di gas hanno più possibilità di movimenti traslazionali che in (a) perché il volume è maggiore, quindi l’energia cinetica traslazionale correlata è più distribuita nel caso (b). La proprietà termodinamica collegata al modo in cui l’energia interna di un sistema è distribuita è detta ENTROPIA. Maggiori è il numero di configurazioni energetiche possibili delle particelle (definiti microstati), maggiore è l’entropia del sistema. Dato che l’espansione è spontanea, ne consegue che un aumento di entropia accompagna sempre i processi spontanei.

Interpretazione molecolare dell’entropia Una sostanza ideale possiede una sola disposizione delle particelle costituenti (solido ideale costituito da un solo stato microscopico). Un gas invece ha un numero estremamente grande di stati microscopici.

Interpretazione molecolare dell’entropia:

Per un dato sistema la probabilità di essere in uno qualsiasi dei pressoché infiniti stati microscopici corrispondenti allo stato gassoso è molto maggiore di quella di essere in uno dei relativamente pochi stati microscopici rappresentativa dello stato liquido e ancora maggiore di quella di essere nell’unico stato microscopico esistente per lo stato solido ideale.

Interpretazione molecolare dell’entropia L’entropia di un sistema è correlata al numero degli stati microscopici che lo descrivono secondo l’equazione: S = k ln. W k = costante di Boltzmann W = numero degli stati del sistema alla medesima energia Maggiore è il numero di microstati in cui ridistribuire l’energia del sistema, maggiore è l’entropia

La Seconda Legge della Termodinamica • E’ una legge ‘probabilistica’ – E’ molto improbabile che tutte le molecole d’aria vadano nello stesso istante nell’angolo della stanza, e io muoia soffocato • Correlata alla ‘probabilità di un ampia distribuzione di materia e energia’, ossia alla entropia

L’entropia • L’entropia, S, è una funzione di stato che misura il disordine del sistema: bassa entropia vuol dire poco disordine; alta entropia corrisponde a grande disordine. • Per il sistema isolato (sistema + ambiente) vale la relazione: ∆U (sistema isolato) = 0 per cui, ad una determinata variazione dell'energia del sistema corrisponde una identica - ma di segno opposto variazione di energia dell'ambiente. • L’entropia di un sistema isolato aumenta nel corso di qualsiasi processo spontaneo. ∆S (sistema isolato) > 0

Il secondo Principio della termodinamcica Il secondo principio della termodinamica, noto anche come enunciato di Clausius, afferma che: il calore non può spontaneamente fluire da un corpo freddo a uno più caldo. Ai nostri fini, puramente chimici, il secondo principio della termodinamica può essere enunciato in modo diverso: qualunque sistema, se abbandonato a se stesso, tenderà a portarsi in una condizione di massima probabilità energetica. Poiché la condizione di massima probabilità energetica coincide con quella di massimo disordine, ne segue che: qualunque sistema evolve spontaneamente verso lo stato di massimo disordine, ossia….

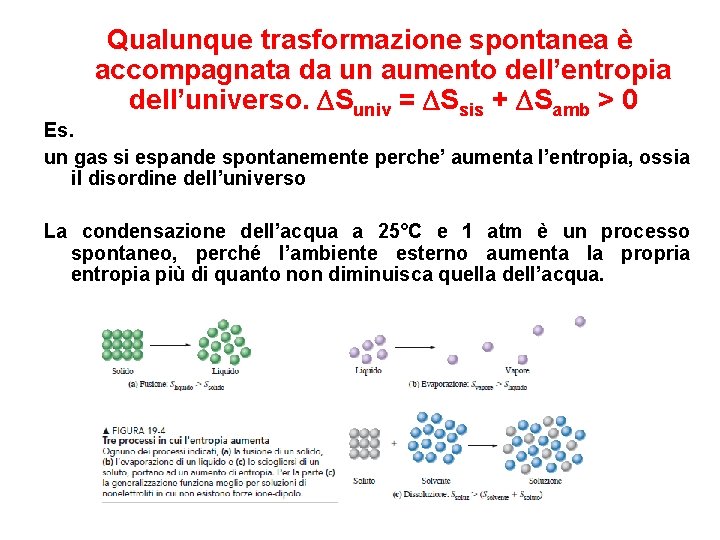
Qualunque trasformazione spontanea è accompagnata da un aumento dell’entropia dell’universo. Suniv = Ssis + Samb > 0 Es. un gas si espande spontanemente perche’ aumenta l’entropia, ossia il disordine dell’universo La condensazione dell’acqua a 25°C e 1 atm è un processo spontaneo, perché l’ambiente esterno aumenta la propria entropia più di quanto non diminuisca quella dell’acqua.

Considerato un sistema chiuso, la variazione di entropia del sistema è data dal calore fornito fratto la temperatura a cui è stato fornito: Ssis = Qrev/T unità di misura J K-1 Qrev calore transferito in modo reversibile, ossia la T dell’ambiente deve differire da quella del sistema in misura infinitesima. Intuitivamente: • se si trasferisce al sistema una certa quantità di calore, si promuove un considerevole disordine; • in una trasformazione il disordine aumenta in misura maggiore quanto più la temperatura è bassa.

Terzo principio della termodinamica • In un cristallo perfetto allo zero assoluto (0 K) l’entropia è uguale a zero ed è maggiore di zero a temperatura superiore a 0 K.

N. B. entropia assoluta di una sostanza si puo’ determinare (mentre si puo’ determinare solo una differenza di entalpia)

Entropia molare standard Sm° • L’entropia assoluta di una mole di sostanza nel suo stato standard è detta entropia standard molare, S°m. • Entropia molare standard: cresce con la complessità della sostanza considerata. • A parità di temperatura l’entropia molare standard dei gas è superiore a quella dei solidi e dei liquidi corrispondenti. Sm° delle sostanze elementari è diversa da zero.



Entropia standard di reazione La variazione di entropia in una reazione alle condizioni standard è: S°reazione = ∑ici. S°i(prodotti) - ∑ici. S°i(reagenti) Se non sono alle condizioni standard è analogo: Sreazione = ∑ici. Si(prodotti) - ∑ici. Si(reagenti)

Spontaneità e Energia interna/Entalpia/Entropia • La variazione di energia totale del sistema + ambiente (correlata a U e H) non può essere responsabile della direzione di un processo. • Il primo principio della termodinamica non dà informazioni sulla spontanetà di una reazione • Neppure la quantità di energia del sistema può essere la responsabile per determinare la spontaneità di un processo – Un gas ideale si espande, ma Usis = 0 Qualunque trasformazione spontanea è accompagnata da un aumento dell’entropia dell’universo. Suniv = Ssis + Samb > 0

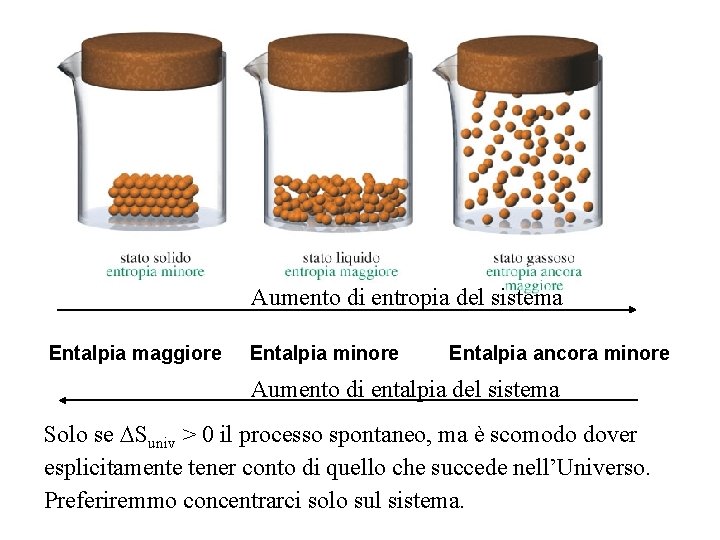
Aumento di entropia del sistema Entalpia maggiore Entalpia minore Entalpia ancora minore Aumento di entalpia del sistema Solo se Suniv > 0 il processo spontaneo, ma è scomodo dover esplicitamente tener conto di quello che succede nell’Universo. Preferiremmo concentrarci solo sul sistema.

L’energia libera di Gibbs Suniv > 0 Samb + Ssis > 0 dato che S = Qrev/T quando lo scambio di calore tra ambiente e sistema avviene in maniera reversibile: Ssis + Qamb/T > 0 ossia Ssis - Qsis/T > 0 e a P costante ho H=Q Ssis - Hsis/T > 0 Cambio di segno: - Ssis + Hsis/T < 0 Hsis - T Ssis < 0 Gsis = Hsis-TSsis La variazione finita di G è Gsis = Hsis- (TSsis) e a T costante ottengo: Gsis = Hsis-T Ssis -S Tsis e quindi Gsis < 0 Si vede quindi che, per processi che avvengano in condizioni di temperatura e pressione costanti, che sono condizioni estremamente comuni, si ha: ∆Suniverso > 0 ⇔ ∆Gsistema < 0

Trasformazioni quasi statiche � Il sistema durante la trasformazione passa solo attraverso stati di equilibrio. � Trasformazioni reversibili � La trasformazione si dice reversibile se si può eseguire una trasformazione che riporti il sistema allo stato iniziale passando per la stessa successione di stati intermedi, semplicemente invertendo il segno di calore e lavoro scambiati. Un esempio di trasformazione reversibile è il passaggio di stato. Una trasformazione quasi statica e senza effetti dissipativi è reversibile. � Trasformazione irreversibile � Non è possibile tornare allo stato iniziale invertendo il segno del calore e del lavoro.

Spontaneità 1. Un aumento dell’energia libera del sistema Gsis > 0 in una trasformazione corrisponde ad una diminuzione dell’entropia dell’universo, quindi la trasformazione non è spontanea. 2. Un processo è invece spontaneo quando corrisponde ad una diminuzione di energia libera del sistema ( Gsis < 0), perché in tal caso l’entropia dell’universo aumenta (II principio della termodinamica). 3. All’equilibrio dinamico (termico, meccanico, chimico-fisico), Gsis e Suniv = 0

Spontaneità A T e P costanti ho che: Gsis = Hsis-T Ssis • La variazione dell’energia libera del sistema è una misura della variazione dell’entropia totale del sistema e del suo ambiente (a T e P costanti). • I processi spontanei (a T e P costanti) si accompagnano alla diminuzione dell’energia libera del sistema.

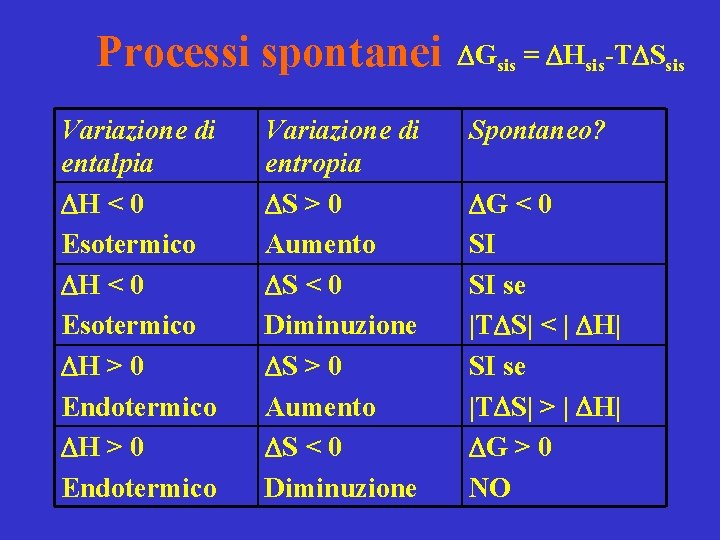
Processi spontanei Variazione di entalpia H < 0 Esotermico H > 0 Endotermico Variazione di entropia S > 0 Aumento S < 0 Diminuzione Gsis = Hsis-T Ssis Spontaneo? G < 0 SI SI se |T S| < | H| SI se |T S| > | H| G > 0 NO

Caso in cui H > 0 e S > 0 a tutte le temperature Il processo è spontaneo ad alte temperature

Energia libera molare standard di formazione Gf° • la variazione di energia libera di Gibbs associata al formazione di una mole di composto partendo dagli elementi che la costituiscono, nel loro stato di riferimento. Lo stato di riferimento di un elemento è la sua forma allotropica più stabile alla temperatura specificata (di solito 25 °C) e alla pressione standard di 1 bar. • Le energie libere standard di formazione delle sostanze elementari nella loro forma allotropica stabile a 25°C alla pressione di 1 bar sono prese per convenzione uguali a zero In generale, per una reazione qualsiasi: • I valori di H°(298) e S°(298) permettono di stimare G°(T) (sempre però alla P di 1 atm). G°(T) = H°-T S° solo se considero la variazione di entalpia e entropia indipendente dalla variazione di T


Termodinamica di reazione • Condizioni standard : 1 bar e 298. 15 K. come visto per entalpia, vale: Gr° = n Gf° (prodotti) - n Gf°(reagenti)

Domanda: Come posso sapere se la Grafite e’ piu’ stabile del Diamante? Risposta: Calcolando il G Calcoliamo il Gro(298 K) per la trasformazione da grafite in diamante r Go = r Ho - T r So Cgrafite Cdiamante Hof (k. J/mol) Som(J/mol K) Cgrafite Cdiamante 0 5. 740 1. 895 2. 377 r. Go = ((1895 -0) – 298. 15 (2. 377 – 5. 740))J mol-1 = 2. 898 k. J mol-1 Quindi la trasformazione diamante grafite e’ spontanea

• Calcolare il Go per la combustione dell’Acetilene C 2 H 2(g) + 5/2 O 2(g) 2 CO 2(g) + H 2 O(g) n Dalle entalpie standard di formazione: r. Ho = -1238 k. J n Dalle entropie molari standard: r. So = - 0. 0974 k. J/K n Calcolo r. Go n r. Go = -1238 k. J - (298 K)(-0. 0974 k. J/K) = -1209 k. J = r Ho - T r S o La reazione e’ spontanea, nonostante il valore negativo di r. So.

n Quando la reazione e’ spontanea ? 2 Fe 2 O 3(s) + 3 C(s) 4 Fe(s) + 3 CO 2(g) n r. Ho = +467. 9 k. J r. So = +560. 3 J/K n A 298 K r. Go = 467. 9 k. J - (298 K)(0. 560 k. J/K) = +300. 8 k. J n La reazione e’ sfavorita n Calcoliamo quando r. Go = 0 = r. Ho - T r. So T = r. Ho/ r. So ~ 468 k. J/0. 56 k. J/K = 836 K o 563 o. C È la temperatura alla quale si raggiunge l’equilibrio della reazione

Ca(s) + Cl 2(g) Ca. Cl 2(s) • H = 59. 8 k. J S = 273 J/K G = H T S La reazione e’ – Spontanea a basse T: G < 0 – Non spontanea a alte T, l’entropia prende il sopravvento • Quando G = 0 la reazione e’ spontanea in entrambe le direzioni. Abbiamo una situazione di equilibrio! • 59. 8 k. J T( 0. 273 k. J/K) = 0 • T = 219 K o 53 o. C • La reazione e’ spontanea per T < 53 o. C


Energia di Gibbs e Universo Se P e T sono costanti Gsis < 0 Suniverso > 0 Attenzione!! Se p e T NON sono costanti, G e’ ugualmente definita, ma G NON rappresenta piu’ la variazione di entropia dell’Universo Quindi: G=G(P, T)

In conclusione. .

Entalpia e Entropia Entalpia H Entropia S funzioni di stato non dipendono dal percorso che porta il mio sistema dallo stato S 1 allo stato S 2 Variazione di Entalpia del sistema Hsis = Qp • Corrisponde al calore scambiato in una reazione a pressione costante. • L’entalpia misura l’energia del sistema disponibile in forma di calore a P costante. • L’entalpia dipende dalla quantità di sostanza che si trasforma e dalla T e P a cui la trasformazione avviene (proprietà estensiva). Entropia del sistema La proprietà termodinamica collegata al modo in cui l’energia del sistema è distribuita in configurazioni equi-energetiche possibili (definiti microstati) è detta ENTROPIA, S.

Entalpia molare standard di formazione Hf° • Variazione di entalpia associata alla formazione di una mole di composto partendo dalle sostanze elementari che lo compongono, essendo tutte le sostanze elementari e il composto alle condizioni standard e le sostanze elementari nei loro stati più stabili alle condizioni standard. • Per convenzione Hf° di una qualunque sostanza elementare nel suo stato più stabile alle condizioni standard è preso uguale a zero. • Le entalpie molari standard di formazione permettono di calcolare le entalpie di reazioni alle condizioni standard, secondo tale relazione: H°reazione= n Hf°(prodotti)- n Hf°(reagenti) Entropia molare standard Sm° • L’entropia assoluta di una mole di sostanza nel suo stato standard è detta entropia standard molare, S°m. • La variazione di entropia in una reazione alle condizioni standard è: S°reazione = ∑ici. S°i(prodotti) - ∑ici. S°i(reagenti)


Processi Spontanei e Temperatura • La spontaneità in transizione di fase dipende sempre dalla temperatura. – Il ghiaccio si scioglie spontaneamente a T > 0 C. – L’acqua solidifica spontaneamente a T < 0 C.

Come varia entalpia? H 2 O(l) -> H 2 O(s) H<0 favorita dalla entalpia H 2 O(s) -> H 2 O(l) H>0 sfavorita dalla entalpia Come varia entropia? H 2 O(l) -> H 2 O(s) S<0 sfavorita dalla entropia H 2 O(s) -> H 2 O(l) S>0 favorita dalla entropia Quindi: H 2 O(l) -> H 2 O(s) H<0 e S<0 H 2 O(s) -> H 2 O(l) H>0 S>0

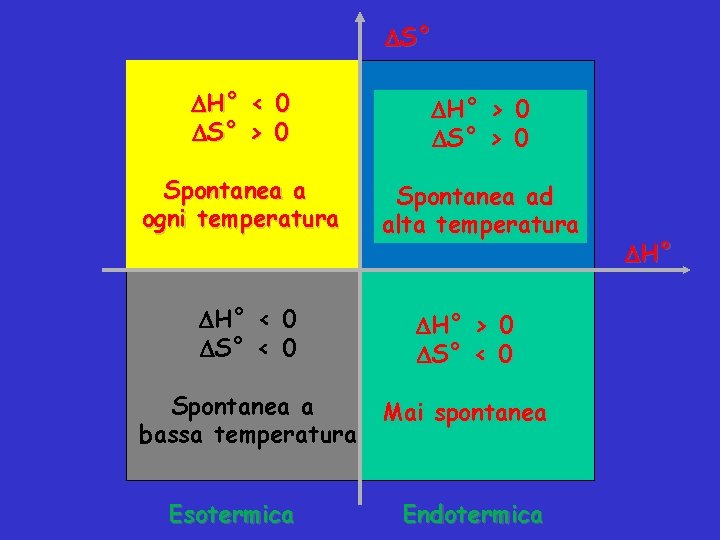
S° H° < 0 S° > 0 H° > 0 S° > 0 Spontanea a ogni temperatura Spontanea ad alta temperatura H° < 0 S° < 0 H° > 0 S° < 0 Spontanea a bassa temperatura Mai spontanea Esotermica Endotermica H°

Termodinamica dei passaggi di stato • Passando dallo stato solido a quello liquido e a quello gassoso si passa da uno stato più ordinato a uno meno ordinato. Corrispondentemente l’entropia del sistema aumenta. • Transizione solido-liquido: H > 0, S >0 • Transizione liquido-gas: H > 0, S >0 • Transizione solido-gas: H > 0, S >0 G può essere > o < 0, a seconda della T All’equilibrio G = 0 alla temperatura di fusione, ebollizione e sublimazione a P costante di 1 bar

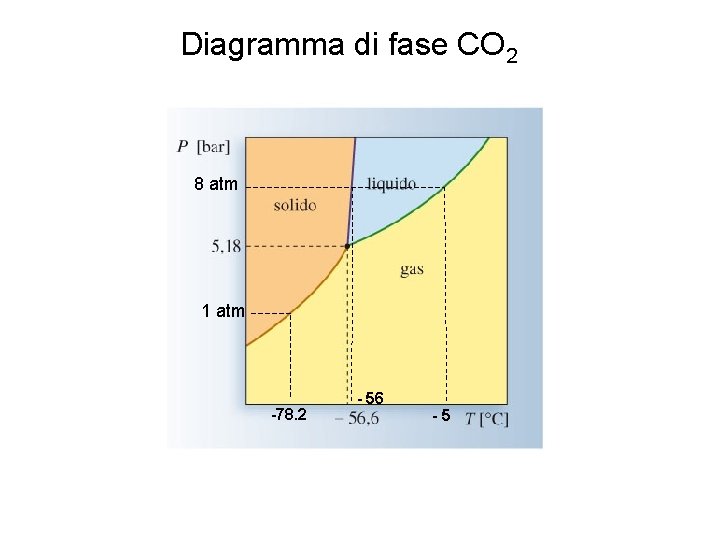
Diagramma di fase CO 2 8 atm 1 atm -78. 2 - 56 -5

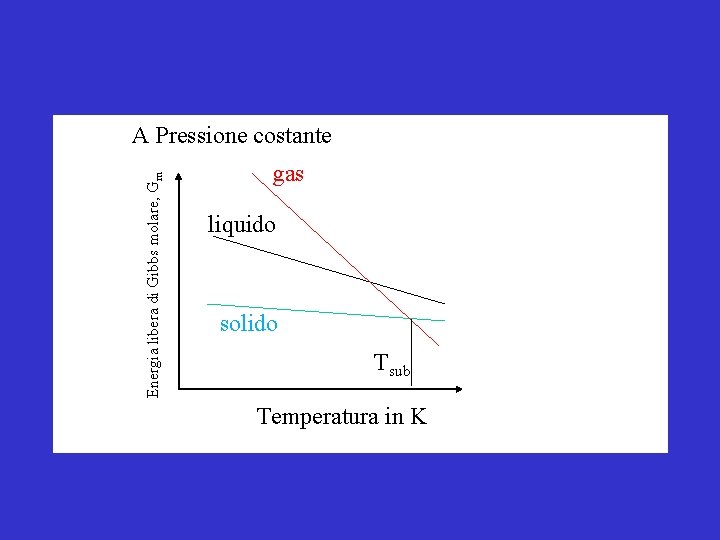
Energia libera di Gibbs molare, Gm G di una sostanza pura diminuisce sempre aumentando T perchè G = H-TS A Pressione costante Ecco spiegato il perche’ a basse T le sostanze solidificano!!

Energia libera di Gibbs molare, Gm A Pressione costante gas liquido solido Tsub Temperatura in K

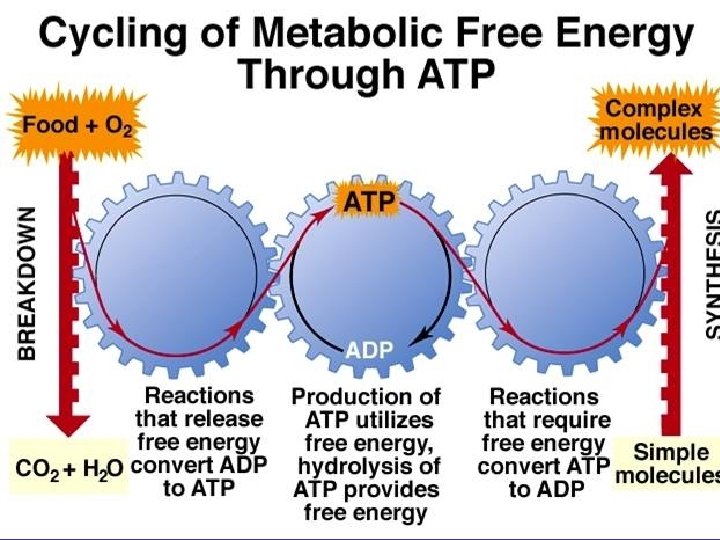
Vita e reazioni Spontanee • Negli esseri viventi avvengono milioni di reazioni non spontanee. Come e’ possibile?

Le reazioni che si generano quando metabolizzo il cibo generano una grande quantità di entropia e sono quindi spontanee. Se una di queste reazioni si accoppia a una reazione biochimica non spontanea, la variazione totale di entropia potrebbe risultare positiva e quindi il processo complessivo spontaneo

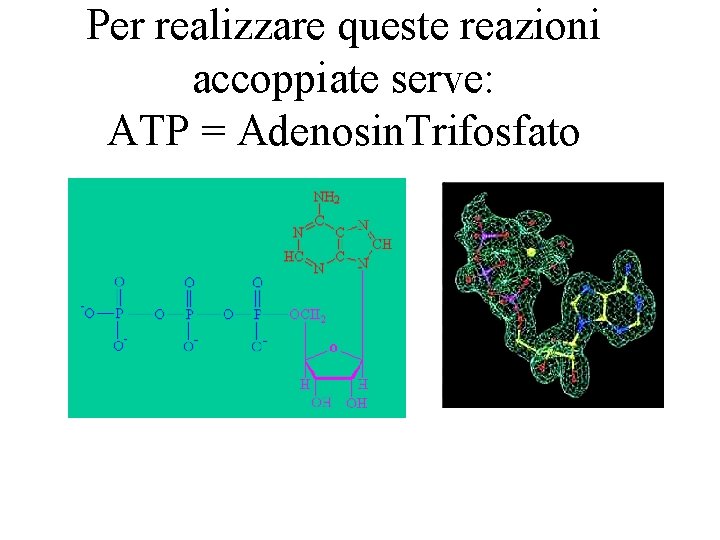
Per realizzare queste reazioni accoppiate serve: ATP = Adenosin. Trifosfato

ATP = Adenosin. Trifosfato • L’ATP e’ la banca di energia del corpo umano. • La reazione ATP ADP e’ spontanea. • Quando il corpo ha bisogno di energia (per flettere un muscolo, sintetizzare una proteina, etc…) accoppia una la reazione dell’ATP con la reazione desiderata non spontanea. • Il metabolismo del Glucosio ritrasforma ADP (Adenosin. Difosfato) in ATP, che viene immagazzinato

© Dario Bressanini

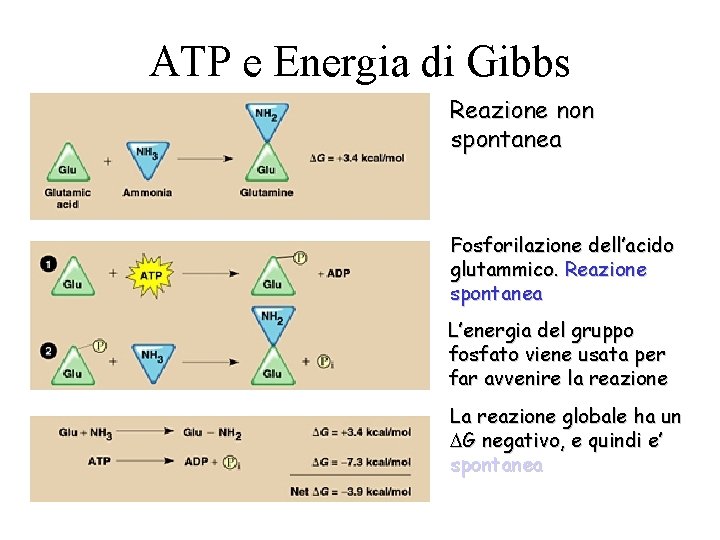
ATP e Energia di Gibbs –CH 2 COOH + NH 3 –CH 2 CONH 2 + H 2 O • La reazione tra acido glutammico (un aminoacido) e l’ammoniaca non e’ spontanea ( G > 0) n Nella cellula questa reazione avviene grazie all’accoppiamento con l’idrolisi dell’ATP che fornisce l’energia libera di Gibbs necessaria

ATP e Energia di Gibbs Reazione non spontanea Fosforilazione dell’acido glutammico. Reazione spontanea L’energia del gruppo fosfato viene usata per far avvenire la reazione La reazione globale ha un G negativo, e quindi e’ spontanea

ATP e Termodinamica Ilya Prigogine (Premio Nobel 1977) Termodinamica del Non Equilibrio. ATP Peter Mitchell (Premio Nobel 1978) Meccanismi di formazione dell’ATP
![Entalpia di legame HB H 0 B XY HmX gHmY g HmXY Entalpia di legame HB H 0 B (X-Y) = [Hm°(X, g)+Hm°(Y, g)] - Hm°(XY,](https://slidetodoc.com/presentation_image_h/a34fd09bd45340889d214837f7a673c9/image-83.jpg)
Entalpia di legame HB H 0 B (X-Y) = [Hm°(X, g)+Hm°(Y, g)] - Hm°(XY, g) X-Y(g) -> X(g) + y(g) Ossia calore richiesto a scindere una mole di legami X-Y a P costante di 1 bar. Sono sempre positive, quindi scissione legame endotermica, Se ho : X 2(l) -> 2 X(g) allora H 0 = H 0 vap (X 2, l) + H 0 B (X-X)

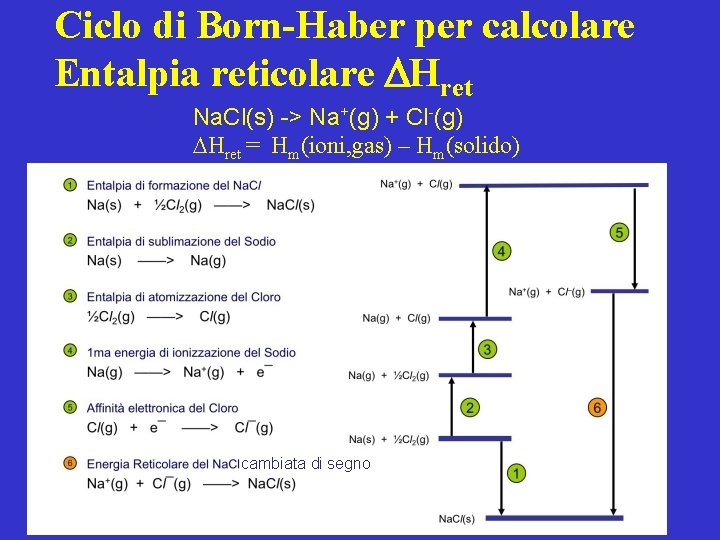
Ciclo di Born-Haber per calcolare Entalpia reticolare Hret Na. Cl(s) -> Na+(g) + Cl-(g) Hret = Hm(ioni, gas) – Hm(solido) cambiata di segno
 Ley de lavoisier laplace
Ley de lavoisier laplace Non piangere perche e finito sorridi perche c'e stato
Non piangere perche e finito sorridi perche c'e stato Tobera termodinamica
Tobera termodinamica Veux tu briser du péché le pouvoir parole
Veux tu briser du péché le pouvoir parole Esercizi sulle funzioni zanichelli
Esercizi sulle funzioni zanichelli Funzioni pari e dispari grafici
Funzioni pari e dispari grafici Funzione a una variabile
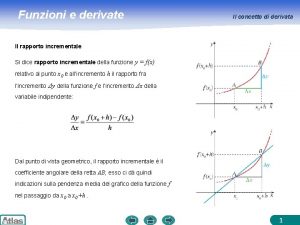
Funzione a una variabile Definizione derivata
Definizione derivata Asintoti
Asintoti La primitiva di una funzione
La primitiva di una funzione Punti di flesso
Punti di flesso Integrale di una costante
Integrale di una costante Periodo somma funzioni goniometriche
Periodo somma funzioni goniometriche Definizione limite finito
Definizione limite finito Punto di flesso orizzontale
Punto di flesso orizzontale Funzione segno di x
Funzione segno di x Termodinamica
Termodinamica Entalpia
Entalpia Entalpia reakcji zadania
Entalpia reakcji zadania Caotropos
Caotropos Entalpia reakcji wzór
Entalpia reakcji wzór Bero ahalmena
Bero ahalmena Entalpia reakcji wzór
Entalpia reakcji wzór Entalpia cp
Entalpia cp Entalpia
Entalpia Qumica
Qumica Standard reakcióentalpia
Standard reakcióentalpia Endotermica
Endotermica Entalpia de reactie reprezinta
Entalpia de reactie reprezinta Entalpia
Entalpia Reação endotérmica
Reação endotérmica Entalpia
Entalpia Entalpia
Entalpia Entalpia
Entalpia Entalpia de formação
Entalpia de formação Complesso attivato
Complesso attivato Puc mg sejam dadas as seguintes equações termoquimicas
Puc mg sejam dadas as seguintes equações termoquimicas Wzory termodynamika
Wzory termodynamika Entalpia
Entalpia Spontaneità reazione
Spontaneità reazione Entalpia
Entalpia Condizioni standard gas
Condizioni standard gas Entalpia
Entalpia Entalpia
Entalpia Los elementos de las ondas
Los elementos de las ondas Aplicaciones de la termodinámica
Aplicaciones de la termodinámica Termodinamica objetivos
Termodinamica objetivos Principio 0 della termodinamica
Principio 0 della termodinamica H termodinamica
H termodinamica Sistema aperto termodinamica
Sistema aperto termodinamica Principio de la termodinámica
Principio de la termodinámica Segundo principio de la termodinámica
Segundo principio de la termodinámica Sistemi aperti termodinamica
Sistemi aperti termodinamica Q es
Q es Mapa conceptual de la ley 031
Mapa conceptual de la ley 031 Unidades de peso del sistema inglés
Unidades de peso del sistema inglés Principi della termodinamica
Principi della termodinamica 3era ley de la termodinamica
3era ley de la termodinamica Primo principio della termodinamica enunciato
Primo principio della termodinamica enunciato Primo.principio della termodinamica
Primo.principio della termodinamica I principi della termodinamica
I principi della termodinamica Carta de compresibilidad
Carta de compresibilidad Primera ley para sistemas abiertos
Primera ley para sistemas abiertos Primera ley de la termodinámica ejemplos
Primera ley de la termodinámica ejemplos Principiul de functionare al motorului diesel
Principiul de functionare al motorului diesel Zemansky
Zemansky Terceira lei da termodinâmica
Terceira lei da termodinâmica Fugacidade termodinamica
Fugacidade termodinamica Tre leggi della termodinamica
Tre leggi della termodinamica Tre leggi della termodinamica
Tre leggi della termodinamica Poisson termodinamica
Poisson termodinamica Segundo principio de la termodinámica
Segundo principio de la termodinámica Sustancias puras termodinamica
Sustancias puras termodinamica Ciclo diesel trasformazioni
Ciclo diesel trasformazioni Fqcolindres 2 eso
Fqcolindres 2 eso Conceptos basicos de termodinamica
Conceptos basicos de termodinamica Terceira lei da termodinâmica
Terceira lei da termodinâmica Ciclo de carnot
Ciclo de carnot 2 principio della termodinamica formula
2 principio della termodinamica formula Termodinamica 2 bachillerato
Termodinamica 2 bachillerato 2 principio della termodinamica formula
2 principio della termodinamica formula Notiuni termodinamice de baza
Notiuni termodinamice de baza Arqumedes
Arqumedes 2 principio della termodinamica formula
2 principio della termodinamica formula Temperatura empirica
Temperatura empirica