Termokmia Az elads vzlata I III IV V
























- Slides: 30

Termokémia Az előadás vázlata: I. III. IV. V. VII. Termokémiai egyenletek. A reakcióhő termodinamikai definíciója. A standard állapot. Standard képződési entalpia. Hess-tétel. Reakcióentalpia számítása képződési entalpia (képződéshő) és az égési entalpia (égéshő) értékekből. A reakcióhő kísérleti meghatározása, kalorimetria. Hőkapacitás, moláris hőkapacitás és fajtái. A reakcióentalpia hőmérsékletfüggése: Kirchhofftétel. 1

I. Termokémiai egyenletek, a reakcióhő termodinamika definíciója �A termokémia a reakcióhők „régi” tudománya: a reakciókban, folyamatokban keletkező vagy elnyelt q hő mérése, alkalmazása számításokban és a gyakorlatban. � A termokémiát ma az I. főtétel alkalmazásának tekintjük. � Termokémiai egyenlet: a kémiai változás (reaktánsok, termékek) mellett tartalmazza a vele járó q hőváltozást is. � A q (rendszercentrikus) előjele szerint: exoterm a folyamat, ha hő szabadul fel (q < 0). endoterm a folyamat, ha hő nyelődik el (q > 0). � A q reakcióhő kifejezése termodinamikai fogalmakkal: 2 állandó térfogaton: q. V = ΔU,

II. A standard állapot. Standard képződési entalpia. Folyamatok standard entalpiaváltozása. �A H és U abszolút értékei nem ismertek és értékei(k) függenek a körülményektől. � Ezért megállapodásokra volt szükség: A standard állapot: Egy anyag standard állapota bármely hőmérsékleten maga a tiszta anyag pθ = 1 bar (1 105 Pa) nyomáson (per definitionem). Egy vegyület Δform. Hθ standard képződési entalpiája az adott vegyület standard állapotú elemeiből való képződését kísérő entalpiaváltozás. Az elemek standard képződési entalpiája nulla: Hmθ = 0 J – minden hőmérsékleten! 3

II. A standard állapot. Standard képződési entalpia. Folyamatok standard entalpiaváltozása. � Folyamatok ΔHθ standardentalpia-változásai: a fizikai változásokat és kémiai reakciókat kísérő entalpia-változás úgy, hogy (a nem összekevert) reaktánsok a folyamat kezdetén (i) és a (nem összekevert) termékek a folyamat végén (f) egyaránt standard állapotban vannak. ΔHθ = Hfθ – Hiθ A ΔHθ értékek 1 molra vonatkoznak A sokféle változás nevét (rövidített formában) alsó indexben szokás megadni: Δnév. Hθ � A kémiai folyamatok reakcióentalpiái (reakcióhői) közül a gyakorlatban a képződéshőnek és az égéshőnek kiemelt szerepe van, de természetesen 4

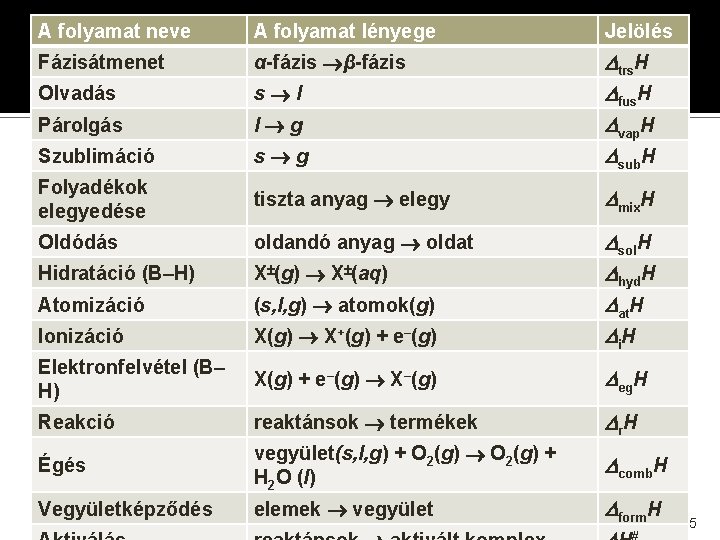
A folyamat neve A folyamat lényege Jelölés Fázisátmenet α-fázis β-fázis Olvadás s l Párolgás l g Szublimáció s g trs. H fus. H vap. H sub. H Folyadékok elegyedése tiszta anyag elegy mix. H Oldódás oldandó anyag oldat Hidratáció (B–H) X (g) X (aq) Atomizáció (s, l, g) atomok(g) Ionizáció X(g) X+(g) + e–(g) sol. H hyd. H at. H i. H Elektronfelvétel (B– H) X(g) + e–(g) X–(g) eg. H Reakció reaktánsok termékek r. H Égés vegyület(s, l, g) + O 2(g) + H 2 O (l) comb. H Vegyületképződés elemek vegyület form. H 5

A folyamat neve A folyamat lényege Jelölés Fázisátmenet α-fázis β-fázis Olvadás s l Párolgás l g Szublimáció s g trs. H fus. H vap. H sub. H Folyadékok elegyedése tiszta anyag elegy mix. H Oldódás oldandó anyag oldat Hidratáció (B–H) X (g) X (aq) Atomizáció (s, l, g) atomok(g) Ionizáció X(g) X+(g) + e–(g) sol. H hyd. H at. H i. H Elektronfelvétel (B– H) X(g) + e–(g) X–(g) eg. H Reakció reaktánsok termékek r. H Égés vegyület(s, l, g) + O 2(g) + H 2 O (l) comb. H Vegyületképződés elemek vegyület fizikai változások és kémiai form. H 6

Fizikai változások entalpiái �A termodinamikában a fázis az anyag csak fizikai tulajdonságaiban különböző állapota: g, l, s. � Szilárd fázisban egyes anyagoknak több módosulata (fázisa) is ismert [pl. fehér, vörös P; grafit, gyémánt, fullerén C; rombos, monoklin S stb. ] � Az ilyen fizikai változások neve fázisátalakulás, ill. fázisátmenet, kísérőjük (jellemzőjük) a Δtrs. Hθ standard fázisátmeneti entalpia. � Ismert példák: olvadás ⇌ fagyás párolgás ⇌ kondenzálás szublimáció ⇌ kondenzálás fázisátmenet (rombos ⇌ monoklin S) 7

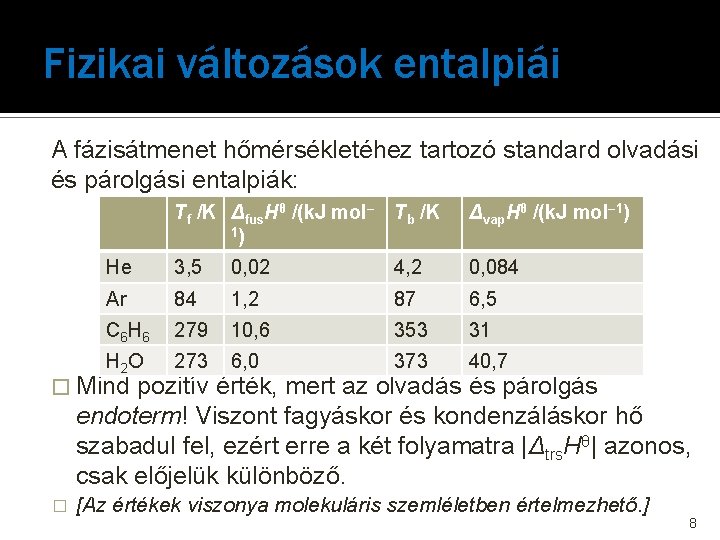
Fizikai változások entalpiái A fázisátmenet hőmérsékletéhez tartozó standard olvadási és párolgási entalpiák: Tf /K Δfus. Hθ /(k. J mol– Tb /K 1) Δvap. Hθ /(k. J mol– 1) He 3, 5 0, 02 4, 2 0, 084 Ar 84 1, 2 87 6, 5 C 6 H 6 279 10, 6 353 31 H 2 O 273 6, 0 373 40, 7 � Mind pozitív érték, mert az olvadás és párolgás endoterm! Viszont fagyáskor és kondenzáláskor hő szabadul fel, ezért erre a két folyamatra |Δtrs. Hθ| azonos, csak előjelük különböző. � [Az értékek viszonya molekuláris szemléletben értelmezhető. ] 8

III. Hess-tétel (különböző megfogalmazásokban) �A reakcióhő csak a kezdeti és végállapottól függ, de független a köztes úttól, annak közbülső állomásaitól. [A reakcióhő, azaz az entalpia állapotfüggvény. Nyilván több ilyen köztes út is van. ] � Az eredő (bruttó) reakció standardentalpiája bármely olyan egyedi reakciók standardentalpiájának összege, amelyekre a bruttó reakció felosztható. � Egy körfolyamat bruttó entalpiaváltozása = 0. [Ez az I. főtételnek (az energiamegmaradásnak) az érvényesülése a termokémiában. Ennek alapján egy (kísérletesen nem megvalósítható) részlépés Δr. Hθ-ja kiszámítható. Ezt alkalmazzuk majd a Born–Haberkörfolyamatban is. ] 9

IV. Reakcióentalpia számítása képződési entalpia, ill. égéshő értékekből. �A Δr. Hθ reakcióentalpia meghatározásának közvetlen módja a kalorimetriás mérés. Ez gyors folyamatoknál egyszerű, lassú folyamatoknál körülményes. H 2 + Cl 2 = 2 HCl C 3 H 6 + H 2 = C 3 H 8 egyszerű nehézkes. �A Δr. Hθ reakcióentalpia pontosan és kényelmesen számítható a reaktánsok és termékek Δform. Hθ képződési entalpiáiból (képződéshőiből). [Sem a C 3 H 6, sem a C 3 H 8 képződéshője nem mérhető közvetlenül. ] �A Δform. Hθ képződési entalpiák ritkán mérhetők jól, viszont a Hess-tétel alkalmazásával számíthatók a jól mérhető Δcomb. Hθ égési entalpiákból (égéshőkből). C 3 H 6(g) + 4, 5 O 2(g) 3 CO 2(g) + 3 H 2 O(l) égéshője és a

IV. Reakcióentalpia számítása képződési entalpia, ill. égéshő értékekből. A standard reakcióentalpia számítása standard képződési entalpia értékekből. � Az I. főtétel alkalmazásával: minden reakció standard entalpiája a termékek és a reaktánsok képződési standard entalpiájának különbsége: � „Elegánsabb”, de „burkoltabb” írásmódban: Ekkor a sztöchiometriai számoknak (νJ) előjele van és ezek figyelembevételével összegzünk. 11

IV. Reakcióentalpia számítása képződési entalpia, ill. égéshő értékekből. Példa a standard reakcióentalpia számítására standard képződéshőkből: 2 HN 3(l) + 2 NO(g) H 2 O 2(l) + 4 N 2(g) reakció standard reakcióentalpiájának számítása: �A 12

IV. Reakcióentalpia számítása képződési entalpia, ill. égéshő értékekből. Standard reakcióentalpia számítása standard égéshőkből: � Az előző számítási elv égéshőkre is alapozható. 13

IV. Reakcióentalpia számítása képződési entalpia, ill. égéshő értékekből. Példa a standard reakcióentalpia számítására standard égéshőkből: a C 3 H 6 + H 2 C 3 H 8 reakció Δr. Hθ-je? � Kaloriméterben elégethető mindhárom anyag: � Mennyi C 3 H 6 + 4, 5 O 2 3 CO 2 + 3 H 2 O Δcomb. Hθ(C 3 H 6)= -2058 k. J mol– 1 H 2 + 0, 5 O 2 H 2 O C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O – 1 �A Δcomb. Hθ(H 2)= -286 k. J mol– 1 Δcomb. Hθ(C 3 H 6)= -2220 k. J mol hidrogénezés reakcióhője (standard reakcióentalpiája): 14

IV. Reakcióentalpia számítása képződési entalpia, ill. égéshő értékekből. Példa a standard reakcióentalpia számítására standard égéshőkből: a C 3 H 6 + H 2 C 3 H 8 reakció Δr. Hθ-je? � Kaloriméterben elégethető mindhárom anyag: � Mennyi C 3 H 6 + 4, 5 O 2 3 CO 2 + 3 H 2 O Δcomb. Hθ(C 3 H 6)= -2058 k. J mol– 1 H 2 + 0, 5 O 2 H 2 O 3 CO 2 + 4 H 2 O C 3 H 8 + 5 O 2 – 1 �A Δcomb. Hθ(H 2)= -286 k. J mol– 1 -Δcomb. Hθ(C 3 H 6)= 2220 k. J mol hidrogénezés reakcióhője (standard reakcióentalpiája): 15

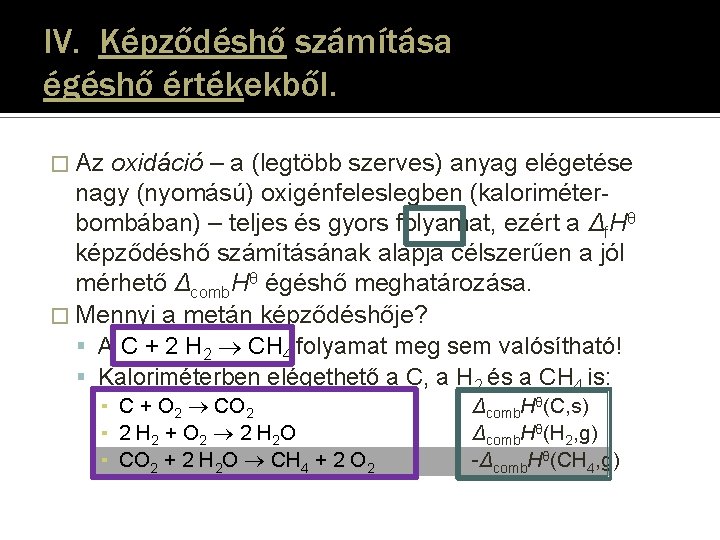
IV. Képződéshő számítása égéshő értékekből. � Az oxidáció – a (legtöbb szerves) anyag elégetése nagy (nyomású) oxigénfeleslegben (kaloriméterbombában) – teljes és gyors folyamat, ezért a Δf. Hθ képződéshő számításának alapja célszerűen a jól mérhető Δcomb. Hθ égéshő meghatározása. � Mennyi a metán képződéshője? A C + 2 H 2 CH 4 folyamat meg sem valósítható! Kaloriméterben elégethető a C, a H 2 és a CH 4 is: ▪ C + O 2 CO 2 ▪ 2 H 2 + O 2 2 H 2 O ▪ CH 4 + 2 O 2 CO 2 + 2 H 2 O Δcomb. Hθ(C, s) Δcomb. Hθ(H 2, g) Δcomb. Hθ(CH 4, g)

IV. Képződéshő számítása égéshő értékekből. � Az oxidáció – a (legtöbb szerves) anyag elégetése nagy (nyomású) oxigénfeleslegben (kaloriméterbombában) – teljes és gyors folyamat, ezért a Δf. Hθ képződéshő számításának alapja célszerűen a jól mérhető Δcomb. Hθ égéshő meghatározása. � Mennyi a metán képződéshője? A C + 2 H 2 CH 4 folyamat meg sem valósítható! Kaloriméterben elégethető a C, a H 2 és a CH 4 is: ▪ C + O 2 CO 2 ▪ 2 H 2 + O 2 2 H 2 O ▪ CO 2 + 2 H 2 O CH 4 + 2 O 2 Δcomb. Hθ(C, s) Δcomb. Hθ(H 2, g) -Δcomb. Hθ(CH 4, g)

V. A reakcióhő kísérleti meghatározása, kalorimetria. egyszerű kaloriméter (pl. hígítási vagy semlegesítési hő mérése) bombakaloriméter (hőkapacitás) lángkaloriméter � Az égéshő technikai és élettani jelentősége. 18

VI. Hőkapacitás, moláris hőkapacitás és fajtái. �Ezek korábban már részletesen előkerültek (múlt heti előadás): � Az állandó térfogaton vagy állandó nyomáson vett hőkapacitás „változatai”: CV, Cp: hőkapacitás (tetszőleges n-re); extenzív; J K– 1 CV, m, Cp, m: moláris hőkapacitás (1 mol-ra); intenzív; J mol– 1 K – 1 c. V, cp: fajlagos hőkapacitás (fajhő) (1 g-ra); intenzív; J g– 1 K– 1 19

VI. Hőkapacitás, moláris hőkapacitás és fajtái. �Ezek korábban már részben előkerültek (múlt heti előadás): � A hőkapacitás molekuláris egyatomos gázokra: értelmezése: CV, m = 3/2 R = [12, 47 J K-1 mol-1] kétatomos molekulákra: CV, m = 5/2 R = [20, 785 J K-1 mol-1] nemlineáris sokatomos molekulákra: CV, m = 3 R = [24, 94 J K-1 mol-1] • • http: //demonstrations. wolfram. com/The. Six. Degrees. Of. Freedom. Of. ADiatomic. Molecule/ https: //www. youtube. com/watch? v=0 xhtsz. Ej. NN 0 20

VII. A reakcióentalpiák hőmérsékletfüggése: Kirchhoff-tétel. Moláris hőkapacitás-értékek használata reakcióentalpiák számításában. �A Δr. Hθ értékek függenek T-től, és ennek ismerete fontos. � A meghatározás lehetséges módjai: a Δr. Hθ értékek közvetlen mérése több T-n, a vegyületek H entalpiájának T-függéséből (azaz Cpből): Cp = (∂H/∂T)p. Ebből d. H = ∫Cpd. T. � Ha ismerjük az entalpiát valamely T 1 hőmérsékleten, akkor H(T 1)-ből határozott integrálással megkapjuk a H(T 2)-t [feltéve, hogy nincs fázisátalakulás T 1 és T 2 21

VII. A reakcióentalpiák hőmérsékletfüggése: Kirchhoff-tétel. �Ezek korábban már előkerültek (múlt hét): �A Cp hőkapacitás ismeretében számítható egy adott rendszer H entalpiája egy újabb hőmérsékleten: �A gyakorlatban ennél fontosabb egy folyamat (egy kémiai reakció) Δr. H entalpiaváltozásának változása a hőmérséklettel. Ez a változásban részt vevő anyagok hőkapacitásának felhasználásával, azok előjellel vett (algebrai) összegéből számítható: �A termokémiában ez a Kirchhoff-tétel. 22

VII. A reakcióentalpiák hőmérsékletfüggése: Kirchhoff-tétel. �A határozott integrálás: � Ezt valamennyi anyagra összegezzük: Ez a (termodinamikai) Kirchhoff-tétel: A standard reakcióentalpia T 2 -n kiszámítható Δr. Hθ(T 1)-ből és a reakciókomponensek moláris hőkapacitásának hőmérsékletfüggéséből: 23

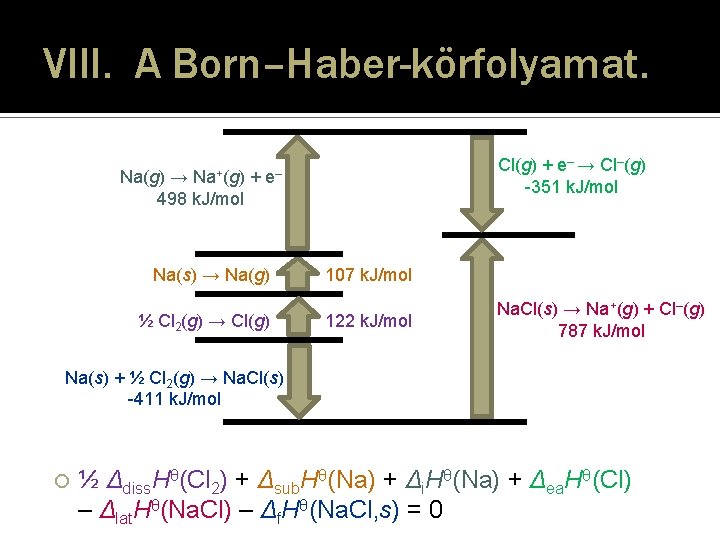
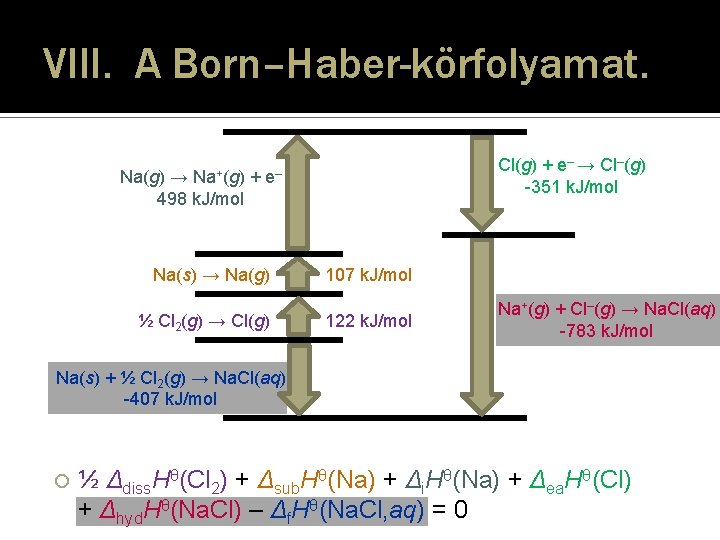
VIII. A Born–Haber-körfolyamat. � Az I. főtétel gyakorlati alkalmazása kristályok Δlat. Hθ rácsentalpiájának (rácsenergiájának) vagy Δhyd. Hθ hidratációs entalpiájának meghatározására, esetleg Δea. Hθ elektronaffinitások kiszámítására – a körfolyamat többi részlépésének kísérletesen megmért termodinamikai adataiból. � A körfolyamatban a bruttó entalpiaváltozás = 0! ½ Δdiss. Hθ(Cl 2) + Δsub. Hθ(Na) + Δi. Hθ(Na) + Δea. Hθ(Cl) + Δhyd. Hθ(Na. Cl) – Δf. Hθ(Na. Cl, aq) = 0 ½ Δdiss. Hθ(Cl 2) + Δsub. Hθ(Na) + Δi. Hθ(Na) + Δea. Hθ(Cl) – Δlat. Hθ(Na. Cl) – Δf. Hθ(Na. Cl, s) = 0 24

VIII. A Born–Haber-körfolyamat. Na+(g) Na(g) → + 498 k. J/mol Cl(g) + e– → Cl–(g) -351 k. J/mol e– Na(s) → Na(g) ½ Cl 2(g) → Cl(g) 107 k. J/mol 122 k. J/mol Na. Cl(s) → Na+(g) + Cl–(g) 787 k. J/mol Na(s) + ½ Cl 2(g) → Na. Cl(s) -411 k. J/mol ½ Δdiss. Hθ(Cl 2) + Δsub. Hθ(Na) + Δi. Hθ(Na) + Δea. Hθ(Cl) – Δlat. Hθ(Na. Cl) – Δf. Hθ(Na. Cl, s) = 0

VIII. A Born–Haber-körfolyamat. Na+(g) Na(g) → + 498 k. J/mol Cl(g) + e– → Cl–(g) -351 k. J/mol e– Na(s) → Na(g) ½ Cl 2(g) → Cl(g) 107 k. J/mol 122 k. J/mol Na+(g) + Cl–(g) → Na. Cl(aq) -783 k. J/mol Na(s) + ½ Cl 2(g) → Na. Cl(aq) -407 k. J/mol ½ Δdiss. Hθ(Cl 2) + Δsub. Hθ(Na) + Δi. Hθ(Na) + Δea. Hθ(Cl) + Δhyd. Hθ(Na. Cl) – Δf. Hθ(Na. Cl, aq) = 0

Rövid összefoglalás: �A termokémia a kémiai reakciókat kísérő hőváltozásokat (hőeffektusokat) méri, elemzi és használja. � A Hess-tétel az I. főtétel konkretizálása az állandó nyomású folyamatok entalpiaváltozásaira. � Minden anyagnak van meghatározott H entalpiája (ami állapotfüggvény, abszolút értéke nem ismert). � A számításokhoz szükséges megállapodások: a standard állapot fogalma: 1 bar és adott T; az elemek képződési entalpiája: Hmθ = 0; a vegyületek Hmθ entalpiája: elemeikből történő képződésük reakcióentalpiája = Δform. Hθ. 27

Entalpiák és entalpiaváltozások: � Ha egy (bonyolult) vegyület elemeiből közvetlenül nem szintetizálható, akkor a Δform. H érték, azaz a vegyület (képződési) entalpiája a Hess-tétellel az elemek és a vegyület jól mérhető Δcomb. H égéshőiből kiszámítható. � A fizikai változásokat és a kémiai reakciókat kísérő Δr. H entalpiaváltozás vagy ▪ a reakciót lejátszatva közvetlenül kimérhető, vagy ▪ a reakciópartnerek Hmθ standard moláris entalpiáiból, vagy Δform. Hθ képződési entalpiáiból számítható: 28

Az entalpiák és az entalpiaváltozások T-függése: � Mind az egyes anyagok entalpiája, mind a reakciókra jellemző reakcióentalpia függ a hőmérséklettől. � Valamely anyag entalpiájának hőmérsékletfüggése a moláris hőkapacitás: (∂H/ ∂T)p = Cp, m. � Ez konkretizálva egy adott hőmérsékletpárra: � „Sajnos” b. T+c/T 2 a Cp is függ a hőmérséklettől: Cp, m = a + Ezt a T-függést ki kell mérni, de Cp, m jól mérhető. �A reakcióhő (entalpiaváltozás) T-függését is Cp-kre alapozva kapjuk: 29

A termodinamikai adatok meghatározásának legfontosabb, jól mérhető kísérleti módszerei: � cp, c. V moláris hőkapacitások (fajhő) és más termodinamikai jellemzők (πT, α, μ, κT) mérése, * � égéshők mérése bomba- és gázkaloriméterekben, � egyensúlyok, egyensúlyi állandó meghatározása (koncentrációk sokféle mérésével)* [l. később], � galvánelemek cellapotenciáljának (elektromotoros erejének) mérése* [l. később]. A *-gal jelölt eljárásokkal a termodinamikai adatok hőmérsékletfüggése is jól és pontosan mérhető. 30
 Elads
Elads Elads crm
Elads crm Targeted sales elads
Targeted sales elads Hamlet act iii scene iii
Hamlet act iii scene iii Termelési vezérprogram
Termelési vezérprogram Erf for teacher 3
Erf for teacher 3 Basel iii liquidity coverage ratio
Basel iii liquidity coverage ratio Walter freeman
Walter freeman Tina(iv)oksiid valem
Tina(iv)oksiid valem This act contains much irony
This act contains much irony Trispropylcyclopentadienylcerium
Trispropylcyclopentadienylcerium Harmonogram mrp
Harmonogram mrp Tipo di discorso
Tipo di discorso Canto iii summary
Canto iii summary Cert 3 in pathology collection
Cert 3 in pathology collection Renew yourself regularly
Renew yourself regularly Title iii eligibility
Title iii eligibility Act 1 crucible characters
Act 1 crucible characters Article 4 code of ethics for teachers
Article 4 code of ethics for teachers Childerico iii
Childerico iii Iii istituto comprensivo giarre
Iii istituto comprensivo giarre Auribus teneo lupum iii
Auribus teneo lupum iii Itis vittorio emanuele iii palermo
Itis vittorio emanuele iii palermo Richard rouse iii
Richard rouse iii Faces iii puntaje
Faces iii puntaje Panowanie bolesława chrobrego tomaszewska
Panowanie bolesława chrobrego tomaszewska Iii. pál pápa
Iii. pál pápa Norma k iii
Norma k iii Sudan iii indicator biomolecules
Sudan iii indicator biomolecules Bisettrice piano cartesiano
Bisettrice piano cartesiano Ipfp phase iii
Ipfp phase iii