6 7 Elads Kmia reakcik lersa felttelei Termokmia









![2. Nukleofil szubsztitúció [SN] Nu-: --OH, -H 3 CO-, --CN, -Cl- R—Nu + Távozó 2. Nukleofil szubsztitúció [SN] Nu-: --OH, -H 3 CO-, --CN, -Cl- R—Nu + Távozó](https://slidetodoc.com/presentation_image_h/0cfd9feadc17024003316cc09dae397a/image-15.jpg)

![3. ELEKTROFIL SZUBSZTITÚCIÓ [SE] Példa: „Támadó” reagens: Elektrofil [X+, Xd+–Yd-] Szubsztrát: elektron-gazdag molekularészlet [aromás 3. ELEKTROFIL SZUBSZTITÚCIÓ [SE] Példa: „Támadó” reagens: Elektrofil [X+, Xd+–Yd-] Szubsztrát: elektron-gazdag molekularészlet [aromás](https://slidetodoc.com/presentation_image_h/0cfd9feadc17024003316cc09dae397a/image-21.jpg)
- Slides: 25

6 -7. Előadás Kémia reakciók leírása, feltételei. Termokémia. A szerves kémiai reakciómechanizmusok felosztása és terminológiája. Szubsztitució.

12. Kémiai reakcióképesség EGY KÉMIAI ÁTALAKULÁS MILYEN MÉRTÉKBEN ÉS MILYEN SEBESSÉGGEL MEGY VÉGBE A REAKCIÓK TERMODINAMIKAI LEÍRÁSA K Példa: CH 4 + Cl 2 CH 3 Cl + HCl (A) (B) K (C) (D) [CH 3 Cl][HCl] = [CH 4][Cl 2] (a) DG=Gvég-Gkezdeti= - 2, 303 x RT x log. K (b) DG=DH-TDS , ahol entrópia H – entalpia, G – szabadentalpia, S – G DG=DH-TDS A+B C+D Ha TDS kicsi, akkor DG DH Mivel DH=DEkötési + DEfeszültségi, DEkötési alapján becsülhető DG.

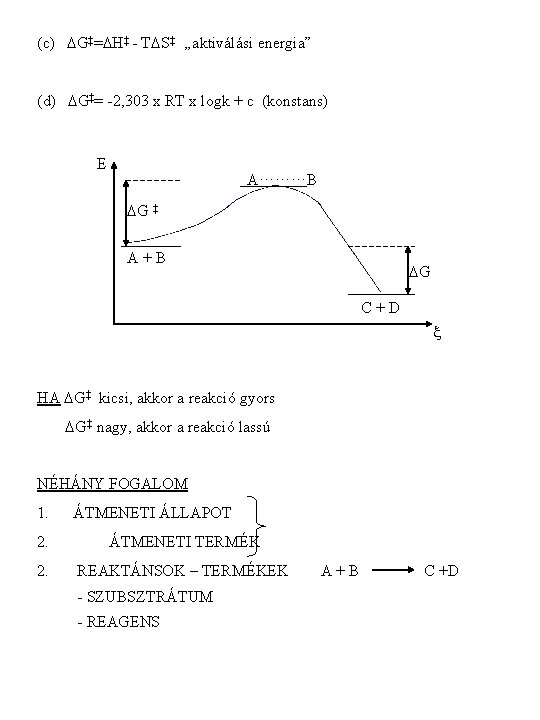
Példa: CH 4 + Cl 2 4 x 405 CH 3 Cl + HCl 238 3 x 405 -423 1 x -332 1858 -1970 DH= -1970 + 1858= -112 k. J/mól Exoterm reakció: hőfelszabadulás Endoterm reakció: hőbefektetés Tapasztalat: nincs reakció – RT van reakció – fény v. hő (500ºC) A REAKCIÓK KINETIKAI LEÍRÁSA A+B [A…. B] ÁTMENETI ÁLLAPOT d[A] (a) v= - dt RT = k[A][B] ‡ ‡ e-DH /RT · e DS /R h (b) (c) k= (d) Ahol DH‡ aktiválási entalpia (e) DS‡ aktiválási entrópia C+D K=1018

(c) DG‡=DH‡ - TDS‡ „aktiválási energia” (d) DG‡= -2, 303 x RT x logk + c (konstans) E A·····B DG ‡ A+B DG C+D HA DG‡ kicsi, akkor a reakció gyors DG‡ nagy, akkor a reakció lassú NÉHÁNY FOGALOM 1. ÁTMENETI ÁLLAPOT 2. ÁTMENETI TERMÉK 2. REAKTÁNSOK – TERMÉKEK - SZUBSZTRÁTUM - REAGENS A+B C +D

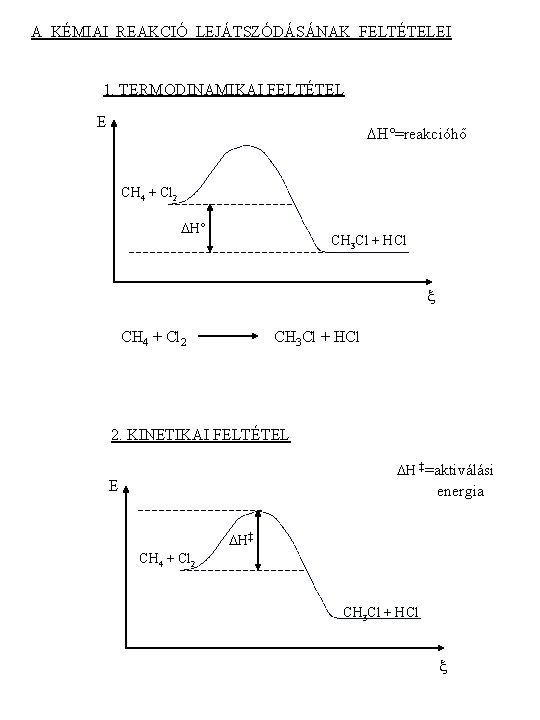
A KÉMIAI REAKCIÓ LEJÁTSZÓDÁSÁNAK FELTÉTELEI 1. TERMODINAMIKAI FELTÉTEL E DH°=reakcióhő CH 4 + Cl 2 DH° CH 3 Cl + HCl CH 4 + Cl 2 CH 3 Cl + HCl 2. KINETIKAI FELTÉTEL DH ‡=aktiválási E energia DH‡ CH 4 + Cl 2 CH 3 Cl + HCl

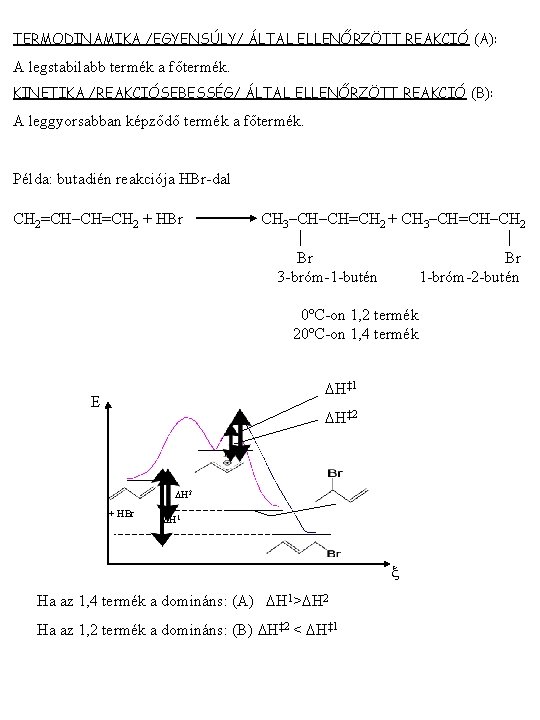
TERMODINAMIKA /EGYENSÚLY/ ÁLTAL ELLENŐRZÖTT REAKCIÓ (A): A legstabilabb termék a főtermék. KINETIKA /REAKCIÓSEBESSÉG/ ÁLTAL ELLENŐRZÖTT REAKCIÓ (B): A leggyorsabban képződő termék a főtermék. Példa: butadién reakciója HBr-dal CH 2=CH–CH=CH 2 + HBr CH 3–CH–CH=CH 2 + CH 3–CH=CH–CH 2 Br Br 3 -bróm-1 -butén 1 -bróm-2 -butén 0ºC-on 1, 2 termék 20ºC-on 1, 4 termék DH‡ 1 E DH‡ 2 DH 2 + HBr DH 1 Ha az 1, 4 termék a domináns: (A) DH 1>DH 2 Ha az 1, 2 termék a domináns: (B) DH‡ 2 < DH‡ 1

Reakciók felosztása REAGÁLÓ KOMPONENSEK FÁZISA SZERINT HOMOGÉN (pl. mindkét komponens oldatban) HETEROGÉN (pl. szilárd és oldott reagensek) ELEMI FOLYAMATOK SZÁMA SZERINT EGYSZERŰ - MONOMOLEKULÁS - BIMOLEKULÁS - TRIMOLEKULÁS ÖSSZETETT - LÁNCREAKCIÓ (POLIMERIZÁCIÓ) - PÁRHUZAMOS REAKCIÓK (főreakció és mellékreakció) A LEJÁTSZÓDÁSHOZ SZÜKSÉGES ENERGIA FORRÁSA SZERINT TERMIKUS (D, pl. karbonsavak dekarboxilezése) FOTOKÉMIAI (hn, pl. CH 4 + Cl 2) RADIOKÉMIAI melanin, D-vitamin-képződés AKUSZTOKÉMIAI (KI + keményítő + 20 k. Hz)

A REAKTÁNSOK „ATOMI” ÁLLAPOTA SZERINT KOVALENS KÖTÉSBŐL: gyök, kation, anion homolitikus bomlás R-H R • • H heterolitikus bomlás R-H R+ + HIONOS KÖTÉSBŐL: kation, anion gyökös reakciók vs. ionos reakciók A: Ionos reakciók B: Gyökös reakciók

PÉLDA: C-H KÖTÉS FELBONTÁSA A DISSZOCIÁCIÓS ENERGIA ÉS A C-ATOM RENDŰSÉGE KÖZÖTTI ÖSSZEFÜGGÉS HOMOLITIKUS HETEROLITIKUS C-H C • + H • C-H C+ + H- k. J/mól H 3 C-H 142 1088 H 3 C-H 2 C-H 107, 2 916 74, 5 799 31, 4 699 H 3 C HC-H H 3 C H 3 C-C-H H 3 C STABILITÁS ALKIL-GYÖK: • CH 3 < • CH 2 CH 3 < • CH(CH 3)2 < • C(CH 3)3 „ALKIL” KATION (KARBÉNIUMION, KARBOKATION): +CH 3 < +CH 2 CH 3 < +CH(CH 3)2 < +C(CH 3)3

REAKCIÓ „FAJTÁK” 1. Oxidáció elektronleadás, , O’-felvétel; , H’-leadás 2. Redukció elektronfelvétel, , O’-leadás; , H’-felvétel 3. Sav-bázis reakciók 4. Szubsztitúció [S] példa: CH 4 + Cl 2 CH 3 Cl + HCl típusai: nukleofil elektrofil gyökös SN [X-, Y: ] d+ SE [Z+, Z-Q] SR [R • ] 5. Addíció [Ad] példa: CH 2=CH 2 + H 2 CH 3 -CH 3 típusai: nukleofil Ad. N elektrofil Ad. E gyökös Ad. R 6. Elimináció példa: CH 2 -CH 3 CH 2=CH-CH 3 + H 2 O | OH típusai: a-b ; a-g ; a-a 7. Átrendeződés 8. Polimerizáció

Termokémia (A. L. Lavoisier) A kémiai reakció során bekövetkező hőváltozás tanulmányozása a) számítással (kötési energiából) b) méréssel (kalorimetria) Alkalmazás - reakciók értelmezése - izomerek stabilitása - energiatárolás - energiaátalakítás 1. példa: C-H energia metán égéshőjéből a) C + 4 H + 4 O CH 4 + 2 O 2 b) CH 4 + 2 O 2 CO 2 + 2 H 2 O DHk=képződési DHé=égési E C + 4 H + 4 O (gáz) E 1 4 E(C-H) 2 E(C=O) 2 E(O-O) 4 E(H-O) CH 4 + 2 O 2 (gáz) DHé CO 2 + 2 H 2 O E 2 4 E(C-H) + 2 E(O-O) + DHé = 2 E(C=O) + 4 E(H-O) O képződéshő C égéshő H 2 égéshő

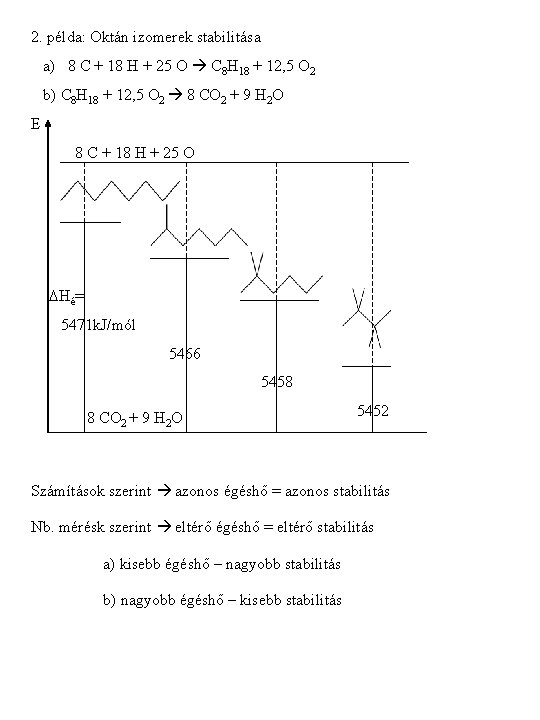
2. példa: Oktán izomerek stabilitása a) 8 C + 18 H + 25 O C 8 H 18 + 12, 5 O 2 b) C 8 H 18 + 12, 5 O 2 8 CO 2 + 9 H 2 O E 8 C + 18 H + 25 O DHé= 5471 k. J/mól 5466 5458 8 CO 2 + 9 H 2 O 5452 Számítások szerint azonos égéshő = azonos stabilitás Nb. mérésk szerint eltérő égéshő = eltérő stabilitás a) kisebb égéshő – nagyobb stabilitás b) nagyobb égéshő – kisebb stabilitás

Szubsztitució Definíció: A C-atomról egy atom (csoport) eltávozik és helyébe más atom (csoport) lép, miközben a C-atom koordinációs száma nem változik meg. 1. Gyökös hn* példa: CH 4 + Cl 2 CH 3 Cl+HCl RT Láncindítás, homolízis Cl 2 2 Cl • hn Láncvívő elemi lépés** CH 4 + Cl • CH 3 • + HCl CH 3 • + Cl 2 CH 3 Cl + Cl • Lánc letörés, rekombináció CH 3 • + CH 3 • CH 3 -CH 3 Cl • + Cl • Cl 2 CH 3 • + Cl • CH 3 Cl * hn helyett 300°C-on, katalizátor jelenlétében is végbemegy ** Láncvívő lépés lehet: CH 3 Cl + Cl • CH 2 Cl • + HCl etc.

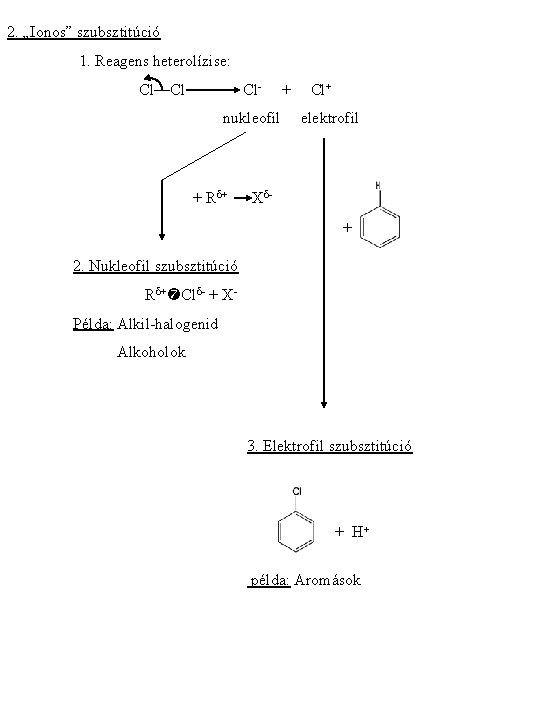
2. „Ionos” szubsztitúció 1. Reagens heterolízise: Cl—Cl Clnukleofil + Rd+ + Cl+ elektrofil Xd+ 2. Nukleofil szubsztitúció Rd+ Cld- + XPélda: Alkil-halogenid Alkoholok 3. Elektrofil szubsztitúció + H+ példa: Aromások
![2 Nukleofil szubsztitúció SN Nu OH H 3 CO CN Cl RNu Távozó 2. Nukleofil szubsztitúció [SN] Nu-: --OH, -H 3 CO-, --CN, -Cl- R—Nu + Távozó](https://slidetodoc.com/presentation_image_h/0cfd9feadc17024003316cc09dae397a/image-15.jpg)
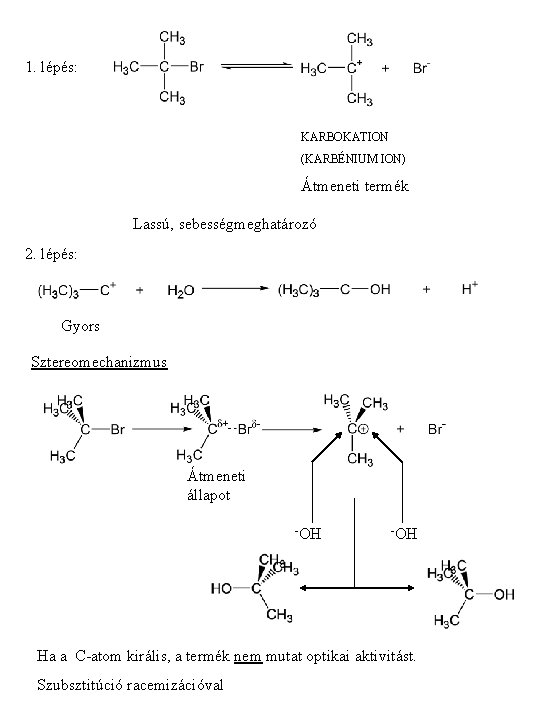
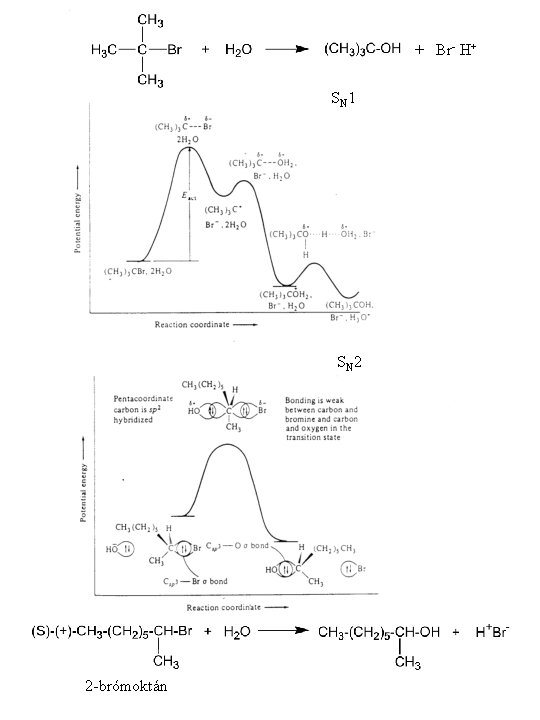
2. Nukleofil szubsztitúció [SN] Nu-: --OH, -H 3 CO-, --CN, -Cl- R—Nu + Távozó csoport R X Nu: R—Nu+ + H 2 O: , CH 3, : OH, : NH 3 Példák: CH 3 Cl + -OH CH 3 -OH + Cl- CH 3 -CH 2 -Br + : NH 3 CH 3 -CH 2 -+NH 3 CH 3 -CH 2 -NH 3+ + Br-Bázis CH 3 -CH 2 -NH 2 + HBázis Mechanizmus: Az R-X heterolízis és a Nu: támadás egyidejű történés vagy nem. Alaptípusok: R-X R+ + S N 1 : Nu- + R+ R-Nu első lépés/heterolízis második lépés Bizonyítás: Kinetikai vizsgálatok v=k[R-X] Elsőrendű sebességi egyenlet „Monomolekulás” Két lépés Példa: t. Butil-bromid t. Butanol

1. lépés: KARBOKATION (KARBÉNIUM ION) Átmeneti termék Lassú, sebességmeghatározó 2. lépés: Gyors Sztereomechanizmus Átmeneti állapot -OH Ha a C-atom királis, a termék nem mutat optikai aktivitást. Szubsztitúció racemizációval

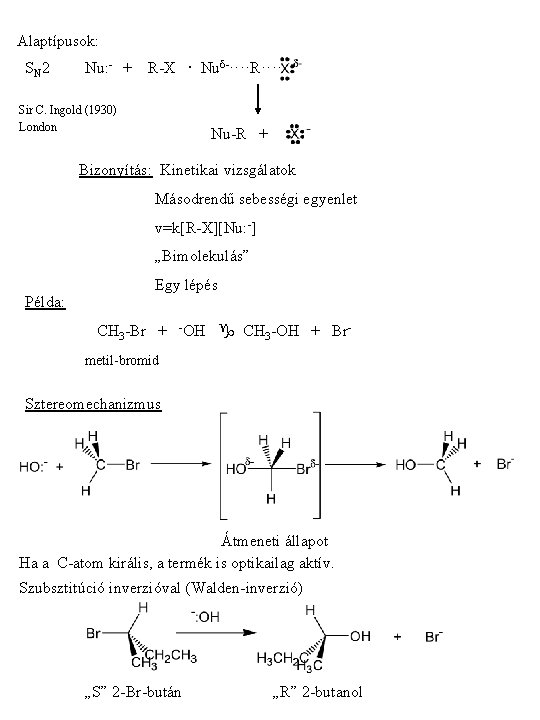
Alaptípusok: S N 2 Nu: - + R-X Nud-····R···· Sir C. Ingold (1930) London Nu-R + Bizonyítás: Kinetikai vizsgálatok Másodrendű sebességi egyenlet v=k[R-X][Nu: -] „Bimolekulás” Példa: Egy lépés CH 3 -Br + -OH CH 3 -OH + Brmetil-bromid Sztereomechanizmus Átmeneti állapot Ha a C-atom királis, a termék is optikailag aktív. Szubsztitúció inverzióval (Walden-inverzió) „S” 2 -Br-bután „R” 2 -butanol

+ Br- H+ S N 1 S N 2 2 -brómoktán

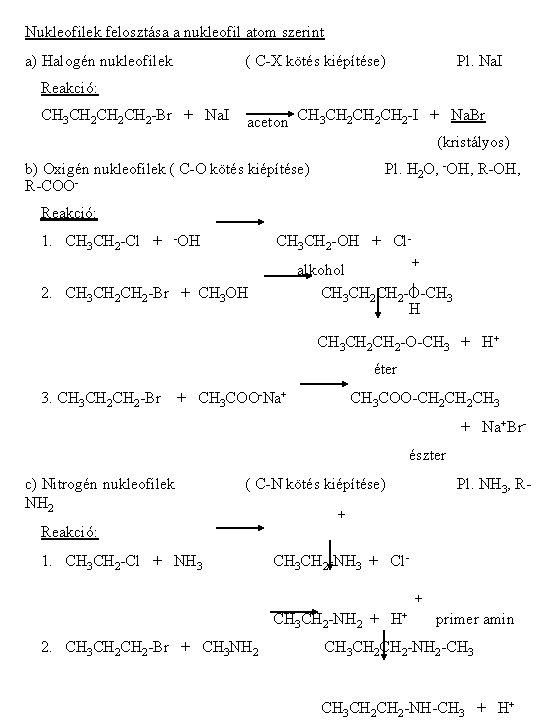
Nukleofilek felosztása a nukleofil atom szerint a) Halogén nukleofilek ( C-X kötés kiépítése) Pl. Na. I Reakció: CH 3 CH 2 CH 2 -Br + Na. I aceton CH 3 CH 2 CH 2 -I + Na. Br (kristályos) b) Oxigén nukleofilek ( C-O kötés kiépítése) R-COO- Pl. H 2 O, -OH, R-OH, Reakció: 1. CH 3 CH 2 -Cl + -OH CH 3 CH 2 -OH + Cl+ alkohol | CH 3 CH 2 -O-CH 3 H 2. CH 3 CH 2 -Br + CH 3 OH CH 3 CH 2 -O-CH 3 + H+ éter 3. CH 3 CH 2 -Br + CH 3 COO-Na+ CH 3 COO-CH 2 CH 3 + Na+Brészter c) Nitrogén nukleofilek NH 2 ( C-N kötés kiépítése) Pl. NH 3, R- + Reakció: 1. CH 3 CH 2 -Cl + NH 3 CH 3 CH 2 -NH 3 + Cl+ CH 3 CH 2 -NH 2 + H+ 2. CH 3 CH 2 -Br + CH 3 NH 2 primer amin CH 3 CH 2 -NH 2 -CH 3 CH 2 -NH-CH 3 + H+

A szubsztitúció sebességét befolyásoló tényezők 1. A szubsztrát szerkezete 2. A nukleofil reaktivitása (csak SN 2) 3. Az oldószer polaritása 4. A távozó csoport szerkezete 1. A szubsztrát szerkezete (Pl. : alkil halogenid) SN 2 reakciók relatív sebesség alkil szerkezet CH 3 -Br 30 metil CH 3 CH 2 -Br 1 primer szénatom (CH 3)2 CH-Br 0, 02 szekunder szénatom (CH 3)3 C-Br ~0 tercier szénatom Térbeli hozzáférhetőség SN 1 reakciók (CH 3)3 C-Br > (CH 3)2 CH-Br > CH 3 CH 2 -Br > CH 3 -Br Az átmeneti termék stabilitása 2. A nukleofil reaktivitása „jó” / „rossz” nukleofilek: sav a) A negatív töltéssel bíró nukleofilek mindig jobbak, mint konjugált származékuk (pl. -OH jobb, mint H 2 O) b) Azonos nukleofil atomot tartalmazó nukleofilek között a „jó” nukleofilitás a bázicitással párhuzamosan változik. (pl. RO- > HO- >> RCOO- > ROH > H 2 O) c) Nem azonos atomoknál: a) jó polarizálhatóság b) könnyű deszolválhatóság
![3 ELEKTROFIL SZUBSZTITÚCIÓ SE Példa Támadó reagens Elektrofil X XdYd Szubsztrát elektrongazdag molekularészlet aromás 3. ELEKTROFIL SZUBSZTITÚCIÓ [SE] Példa: „Támadó” reagens: Elektrofil [X+, Xd+–Yd-] Szubsztrát: elektron-gazdag molekularészlet [aromás](https://slidetodoc.com/presentation_image_h/0cfd9feadc17024003316cc09dae397a/image-21.jpg)
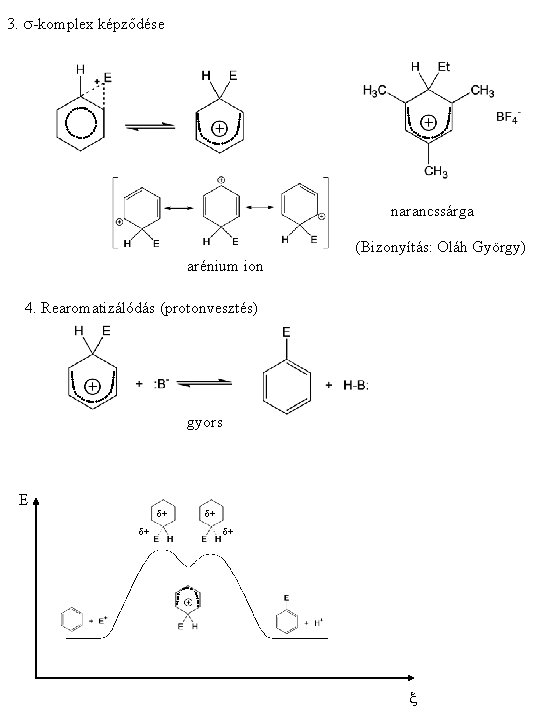
3. ELEKTROFIL SZUBSZTITÚCIÓ [SE] Példa: „Támadó” reagens: Elektrofil [X+, Xd+–Yd-] Szubsztrát: elektron-gazdag molekularészlet [aromás p-rendszer, elektron-donor] Elemi lépések 1. Elektrofil reagens képződése - közvetlenül, pl. BF 4 -NO 2+ - reakcióban, pl. 2 H 2 SO 4 + HNO 3 - katalizátor, pl. Fe. Br 3 + Br 2 NO 2+ + H 3 O+ + 2 HSO 4 Fe. Br 4 -Br+ 2. p-komplex képződése Arónium ion (spektroszkópia) Lassú!

3. s-komplex képződése narancssárga (Bizonyítás: Oláh György) arénium ion 4. Rearomatizálódás (protonvesztés) gyors E d+ d+

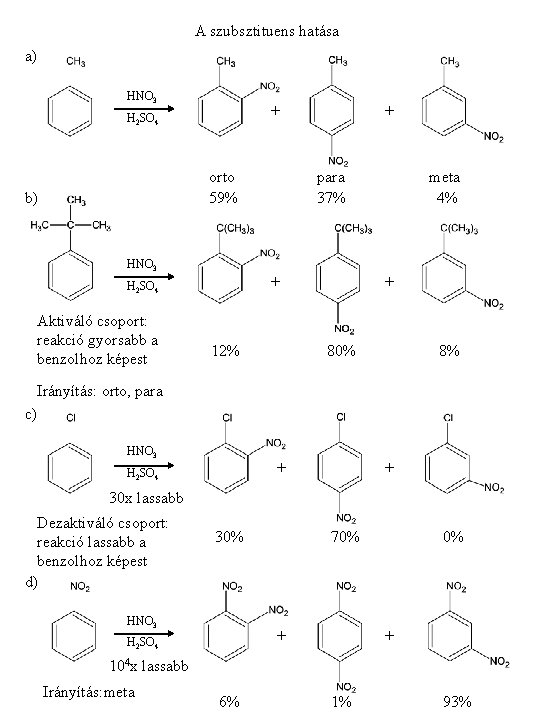
A szubsztituens hatása a) HNO 3 + H 2 SO 4 orto 59% b) + para 37% meta 4% HNO 3 + H 2 SO 4 Aktiváló csoport: reakció gyorsabb a benzolhoz képest 12% + 80% 8% Irányítás: orto, para c) HNO 3 + H 2 SO 4 + 30 x lassabb Dezaktiváló csoport: reakció lassabb a benzolhoz képest d) 30% HNO 3 70% + H 2 SO 4 0% + 104 x lassabb Irányítás: meta 6% 1% 93%

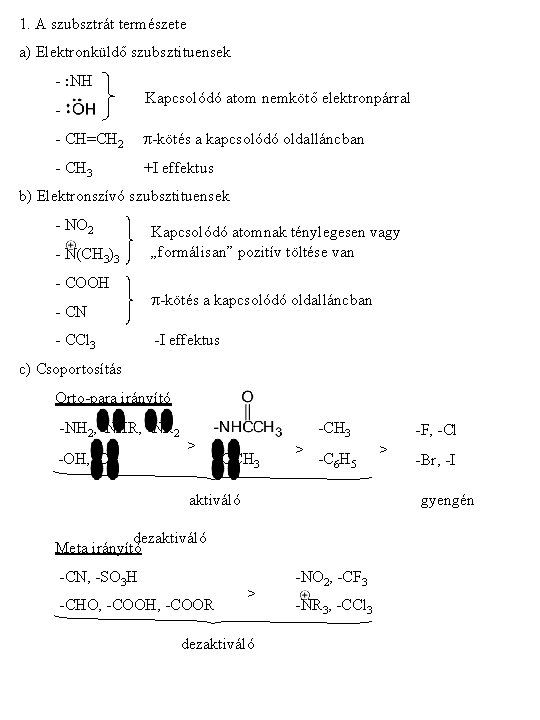
1. A szubsztrát természete a) Elektronküldő szubsztituensek - : NH Kapcsolódó atom nemkötő elektronpárral - CH=CH 2 p-kötés a kapcsolódó oldalláncban - CH 3 +I effektus b) Elektronszívó szubsztituensek - NO 2 - N(CH 3)3 - COOH - CN - CCl 3 Kapcsolódó atomnak ténylegesen vagy „formálisan” pozitív töltése van p-kötés a kapcsolódó oldalláncban -I effektus c) Csoportosítás Orto-para irányító -NH 2, -NHR, -NR 2 -OH, -O - > -CH 3 -OCH 3 > -C 6 H 5 aktiváló -CHO, -COOH, -COOR > -Br, -I gyengén dezaktiváló Meta irányító -CN, -SO 3 H -F, -Cl > dezaktiváló -NO 2, -CF 3 -NR 3, -CCl 3

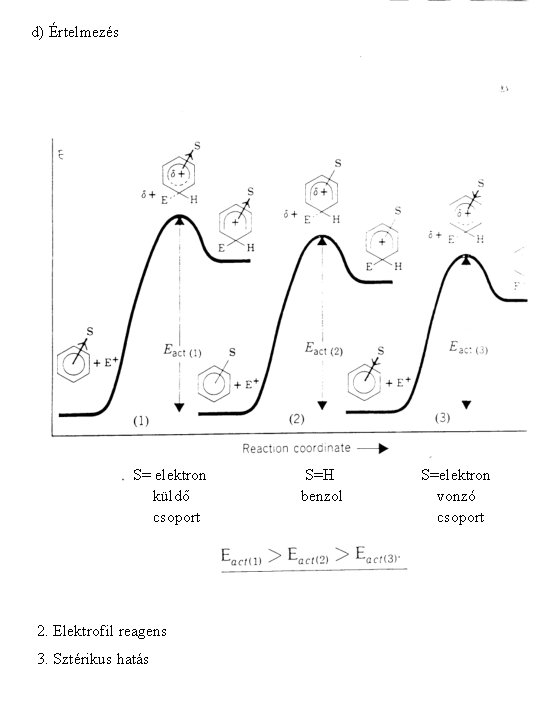
d) Értelmezés S= elektron küldő csoport 2. Elektrofil reagens 3. Sztérikus hatás S=H benzol S=elektron vonzó csoport