Redukcisoxidcis redox reakcik Elektrontadssal jr reakcik Elektronleads pl






- Slides: 10

Redukciós-oxidációs (redox) reakciók • Elektronátadással járó reakciók: – Elektronleadás (pl. Na Na+ + e-): oxidáció, oxidálódás – Elektronfelvétel (pl. Cl 2 +2 e- 2 Cl-): redukció, redukálódás – Együttjáró részfolyamatok (oxidálódás/redukálódás, avagy ráhatással oxidálás/redukálás): töltésmegmaradási, ill. elektron(anyag)megmaradási elvek érvényesek! • A számbavételt segítő fogalom: oxidációs fok, ill. (átlagos) oxidációs szám, amely azonos – Egyszerű ionos vegyületekben az egyes ionok töltésének az értékeivel – Poláros kovalens kötésű molekulákban az egyes atomok képzeletbeli töltésével, ha a kötéseket létrehozó egyébként közös elektronpárokat az elektronegativabb atom(ok)hoz rendeljük hozzá. – Azonos elektronnegativitású atomok közti kovalens kötés esetén a kötő elektronpárt megosztva, egy-egy elektronként rendeljük mindkettőhöz! – Az elemek oxidációs foka megállapodás szerint nulla, 0! • Oxidáció, az oxidációs szám növekedésével, redukció az oxidációs szám csökkenésével járó részfolyamat.

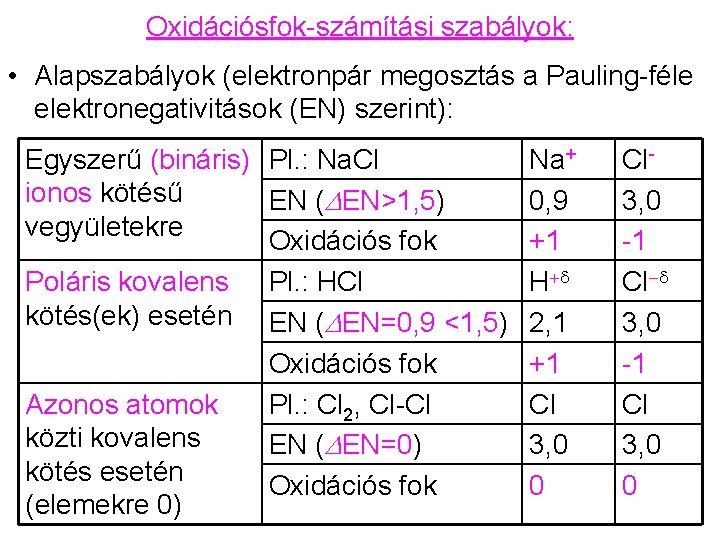
Oxidációsfok-számítási szabályok: • Alapszabályok (elektronpár megosztás a Pauling-féle elektronegativitások (EN) szerint): Egyszerű (bináris) Pl. : Na. Cl ionos kötésű EN (DEN>1, 5) vegyületekre Oxidációs fok Poláris kovalens Pl. : HCl kötés(ek) esetén EN (DEN=0, 9 <1, 5) Oxidációs fok Azonos atomok Pl. : Cl 2, Cl-Cl közti kovalens EN (DEN=0) kötés esetén Oxidációs fok (elemekre 0) Na+ 0, 9 +1 H+d 2, 1 +1 Cl 3, 0 0 Cl 3, 0 -1 Cl-d 3, 0 -1 Cl 3, 0 0

Oxidációsfok-számítási szabályok: • Alapszabályok következményei: – Elemek az oxidációs foka 0, pl. atomos nemes gázok, H 2, O 2, N 2, Br 2, I 2, P 4, S 8, C 60, fémek, atomrácsos elemek. – Vegyületeikben az alkáli fémek (1 A csoport) +1, míg az alkáli földfémek (2 A oszlop) +2 oxidációs fokúak. – A fluor (F, max. EN!) minden vegyületében -1 ox. fokú. – A halogének kisebb EN-ű elemekkel képzett bináris vegyületeikben -1 oxidációs fokúak. – Az oxigén vegyületeiben általában -2 ox. fokú, kivéve a peroxidokat és a szuperoxidokat. – A hidrogén oxidációs foka általában +1, kivéve amikor fémes elemekkel hidrideket képez, amikor is -1. – Az oxidációs számok összege a vegyületekben mindig 0, míg sokatomos összetett ionokban megegyezik az ion töltésével.

Oxidációsfok-számítási szabályok: • Az oxidációs számok összege: • Pl. 1: HCl. O 4, ox. fok(Cl)=? • +1+x(Cl)+4(-2)=0, x(Cl)=+7 • Pl. 2: [SO 4]2 -, ox. fok(S)=? • x(S)+4(-2)=-2, x(S)=+6

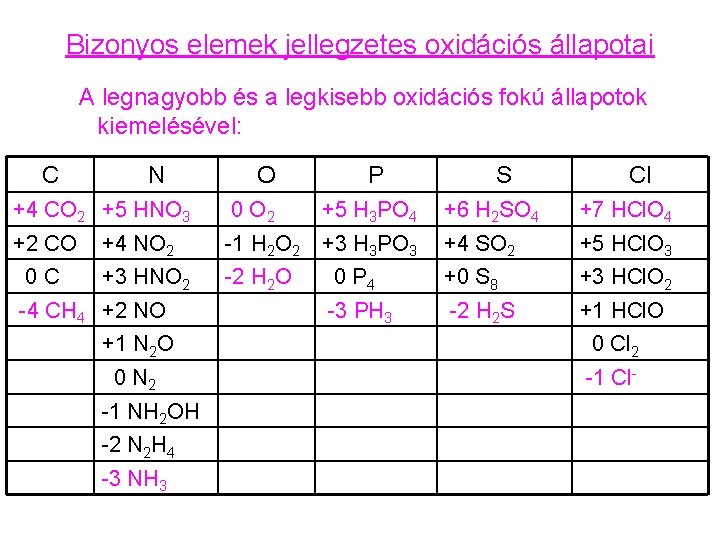
Bizonyos elemek jellegzetes oxidációs állapotai A legnagyobb és a legkisebb oxidációs fokú állapotok kiemelésével: C N O P S Cl +4 CO 2 +5 HNO 3 0 O 2 +5 H 3 PO 4 +6 H 2 SO 4 +7 HCl. O 4 +2 CO +4 NO 2 -1 H 2 O 2 +3 H 3 PO 3 +4 SO 2 +5 HCl. O 3 +3 HNO 2 -2 H 2 O 0 P 4 +0 S 8 +3 HCl. O 2 -3 PH 3 -2 H 2 S +1 HCl. O 0 C -4 CH 4 +2 NO +1 N 2 O 0 Cl 2 0 N 2 -1 Cl- -1 NH 2 OH -2 N 2 H 4 -3 NH 3

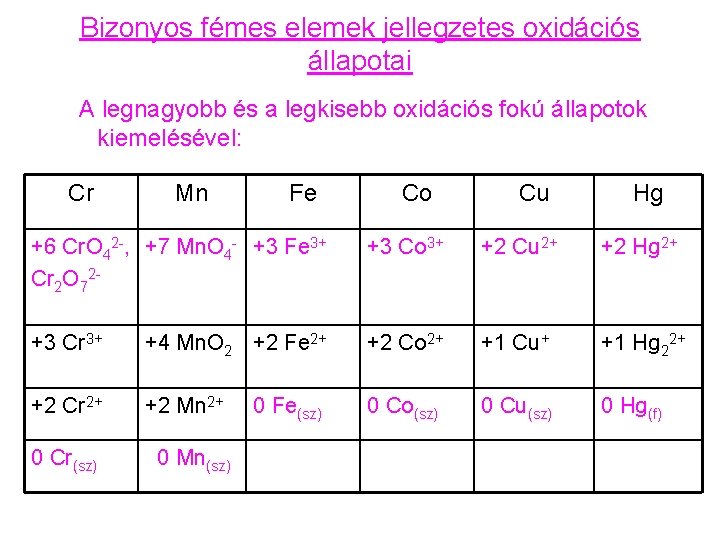
Bizonyos fémes elemek jellegzetes oxidációs állapotai A legnagyobb és a legkisebb oxidációs fokú állapotok kiemelésével: Cr Mn Fe Co Cu Hg +6 Cr. O 42 -, +7 Mn. O 4 - +3 Fe 3+ Cr 2 O 72 - +3 Co 3+ +2 Cu 2+ +2 Hg 2+ +3 Cr 3+ +4 Mn. O 2 +2 Fe 2+ +2 Co 2+ +1 Cu+ +1 Hg 22+ +2 Cr 2+ +2 Mn 2+ 0 Co(sz) 0 Cu(sz) 0 Hg(f) 0 Cr(sz) 0 Mn(sz) 0 Fe(sz)

Redox-egyenletek rendezése: a) (fél)részreakciók módszerével • Cu. SO 4(aq) + Fe(sz) = Fe. SO 4(aq) + Cu(sz) Cu 2+(aq)+SO 42 -(aq)+Fe(sz) = Fe 2+(aq)+SO 42 -(aq)+Cu(sz) +2 0 Cu 2+(aq)+ Fe(sz) = Fe 2+(aq) + Cu(sz) +2 0 Részreakciók módszere (elektronszámváltozások számbavételével: Cu 2+(aq)+ 2 e- = Cu(sz) : 2 e--os redukciós részfolyamat Fe(sz) = Fe 2+(aq) + 2 e- : 2 e--os oxidációs részfolyamat A részreakciókat itt az elektronok megmaradásához 1: 1 arányban kell összeadni.

Redox-egyenletek rendezése: a) (fél)részreakciók módszerével • HCl(aq) + Zn(sz) ↔ Zn. Cl 2(aq) + H 2(g) H+(aq) + Cl-(aq)+ Zn(sz) ↔ Zn 2+(aq) + 2 Cl-(aq) + H 2(g) +1 0 +2 0 H+(aq) + Zn(sz) ↔ Zn 2+(aq) + H 2(g) +1 0 +2 0 Részreakciók módszere (elektronszámváltozások számbavételével): H+(aq)+ e- = 0, 5 H 2(g : 1 e--os redukciós részfolyamat Zn(sz) = Zn 2+(aq) + 2 e- : 2 e--os oxidációs részfolyamat A részreakciókat itt az elektronok megmaradásához 2: 1 arányban kell összeadni. 2 H+(aq) + Zn(sz) ↔ Zn 2+(aq) + H 2(g)

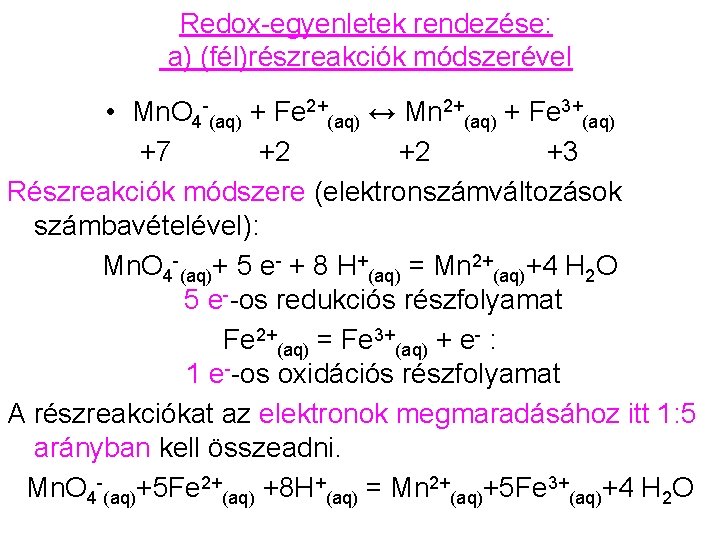
Redox-egyenletek rendezése: a) (fél)részreakciók módszerével • Mn. O 4 -(aq) + Fe 2+(aq) ↔ Mn 2+(aq) + Fe 3+(aq) +7 +2 +2 +3 Részreakciók módszere (elektronszámváltozások számbavételével): Mn. O 4 -(aq)+ 5 e- + 8 H+(aq) = Mn 2+(aq)+4 H 2 O 5 e--os redukciós részfolyamat Fe 2+(aq) = Fe 3+(aq) + e- : 1 e--os oxidációs részfolyamat A részreakciókat az elektronok megmaradásához itt 1: 5 arányban kell összeadni. Mn. O 4 -(aq)+5 Fe 2+(aq) +8 H+(aq) = Mn 2+(aq)+5 Fe 3+(aq)+4 H 2 O

Redox-egyenletek rendezése: b) az oxidációs számváltozások módszerével • Mn. O 4 -(aq) + Fe 2+(aq) ↔ Mn 2+(aq) + Fe 3+(aq) +7 +2 +2 +3 Oxidációs számváltozások: Dox. fok: -5 +1 (+5 -1) Az elektronszámváltozások arányok számbavételével: Mn. O 4 -(aq) + 5 Fe 2+(aq) ↔ Mn 2+(aq) + 5 Fe 3+(aq) Az oxigénfelesleget protonok (8 H+(aq)) hozzáadásával vízzé konvertáljuk. (Az esetleges oxigénhiányt vízzel vagy OH-ionokkal kompenzáljuk, amelyek a vizesközegben rendelkezésre állnak. ) Az elemenkénti (H, O, egyéb atomok szerinti) anyagmérlegeket mindenesetben kiegyensúlyozzuk. Ha jól dolgoztunk az egyenlet töltésmérlege is rendben lesz (mindig ellenőrizzük!): (17+) Mn. O 4 -(aq)+5 Fe 2+(aq) +8 H+(aq) = Mn 2+(aq)+5 Fe 3+(aq)+4 H 2 O (17+)