G Valitutti A Tifi A Gentile Le idee




















- Slides: 22

G. Valitutti A. Tifi A. Gentile Le idee della chimica Seconda edizione Copyright © 2009 Zanichelli editore Le idee della chimica

Capitolo 20 Le reazioni di ossido-riduzione 1. L’importanza delle reazioni di ossido-riduzione 2. Il numero di ossidazione 3. Ossidazione e riduzione: cosa sono e come si riconoscono 4. Reazioni redox molto particolari 5. Come si bilanciano le reazioni redox 6. Equivalenti e normalità nelle reazioni redox Copyright © 2009 Zanichelli editore Le idee della chimica

1. L’importanza delle reazioni di ossido-riduzione Gli organismi viventi possono immagazzinare o consumare energia attraverso, rispettivamente, la fotosintesi e la respirazione cellulare secondo le reazioni: Copyright © 2009 Zanichelli editore Le idee della chimica

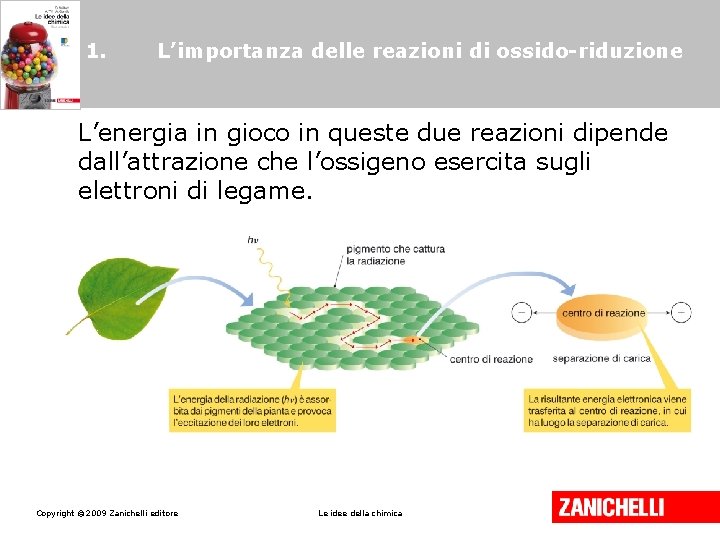
1. L’importanza delle reazioni di ossido-riduzione L’energia in gioco in queste due reazioni dipende dall’attrazione che l’ossigeno esercita sugli elettroni di legame. Copyright © 2009 Zanichelli editore Le idee della chimica

1. L’importanza delle reazioni di ossido-riduzione Tutte le reazioni in cui gli elettroni di legame si avvicinano all’atomo più elettronegativo dei due, allontanandosi dall’altro, si definiscono reazioni di ossido-riduzione. Copyright © 2009 Zanichelli editore Le idee della chimica

2. Il numero di ossidazione (n. o. ) è la carica formale (cioè convenzionale) che viene attribuita a un atomo all’interno di una molecola o di uno ione poliatomico, assegnando gli elettroni di legame all’atomo più elettronegativo. Copyright © 2009 Zanichelli editore Le idee della chimica

2. Il numero di ossidazione Le regole per assegnare il n. o. sono le seguenti. 1. Allo stato elementare tutti gli atomi hanno n. o. zero. 2. La somma dei n. o. di tutti gli atomi deve risultare zero per una molecola neutra e pari alla carica per uno ione poliatomico. 3. Gli ioni monoatomici hanno tutti n. o. pari alla loro carica. Copyright © 2009 Zanichelli editore Le idee della chimica

2. Il numero di ossidazione 4. In un legame covalente si assegnano formalmente i due elettroni di legame all’atomo più elettronegativo. 5. L’idrogeno ha sempre n. o. +1 tranne negli idruri che è – 1. 6. In tutti i composti l’ossigeno ha n. o. – 2, tranne nei perossidi che è – 1 e in OF 2 che è +2. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Ossidazione e riduzione: cosa sono e come si riconoscono L’ossidazione provoca un aumento del numero di ossidazione di una specie. La riduzione provoca la diminuzione del numero di ossidazione di una specie. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Ossidazione e riduzione: cosa sono e come si riconoscono La specie che si ossida è un agente riducente, perché ossidandosi induce la riduzione dell’altra specie. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Ossidazione e riduzione: cosa sono e come si riconoscono La specie che si riduce è un agente ossidante, perché riducendosi induce l’ossidazione dell’altra specie. Copyright © 2009 Zanichelli editore Le idee della chimica

4. Reazioni redox molto particolari Alcune reazioni redox avvengono solo in determinati ambienti e sono regolate dal p. H. Copyright © 2009 Zanichelli editore Le idee della chimica

4. Reazioni redox molto particolari La dismutazione è una reazione redox in cui una stessa specie chimica in parte si ossida e in parte si riduce. Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come si bilanciano le reazioni redox A seconda che la redox presa in esame venga o meno influenzata dalle variazioni di p. H, si possono utilizzare due metodiche di bilanciamento per la reazione. Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come si bilanciano le reazioni redox Metodo della variazione del n. o. I passaggi sono i seguenti: 1. Riconoscimento della specie che si ossida e di quella che si riduce. 2. Si scrivono le semireazioni per ciascuna specie, bilanciando, se necessario le masse. 3. Si calcola il m. c. m delle variazioni di n. o. , riportando i coefficienti davanti ai rispettivi elementi. Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come si bilanciano le reazioni redox 4. Si riportano i coefficienti così determinati nella reazione completa, davanti alle formule dell’ossidante e del riducente. 5. Si opera il normale bilanciamento della reazione, bilanciando per ultimi idrogeno e ossigeno. Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come si bilanciano le reazioni redox Metodo ionico-elettronico 1. Si individuano la specie che si ossida e la specie che si riduce. 2. Si scrivono le semireazioni. 3. Si bilanciano le masse tenendo conto che in ambiente acido (basico) gli atomi di ossigeno si bilanciano con molecole di H 2 O (OH–) e gli atomi di idrogeno con gli ioni H+ (molecole di H 2 O). Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come si bilanciano le reazioni redox 4. Si bilanciano le cariche elettriche delle semireazioni, aggiungendo o togliendo elettroni a seconda che le specie si riducano o si ossidino. 5. Si sommano membro a membro le specie delle semireazioni. Copyright © 2009 Zanichelli editore Le idee della chimica

6. Equivalenti e normalità nelle reazioni redox Un equivalente di agente ossidante è la quantità di sostanza che acquista una mole di elettroni. Un equivalente di agente riducente è la quantità di sostanza che cede una mole di elettroni. Copyright © 2009 Zanichelli editore Le idee della chimica

6. Equivalenti e normalità nelle reazioni redox In qualsiasi reazione redox, un equivalente di ossidante reagisce sempre con un equivalente di riducente. Copyright © 2009 Zanichelli editore Le idee della chimica

6. Equivalenti e normalità nelle reazioni redox In una reazione redox, la massa equivalente di ossidante o di riducente è pari al rapporto fra la sua massa molare e il numero di elettroni scambiati. Copyright © 2009 Zanichelli editore Le idee della chimica

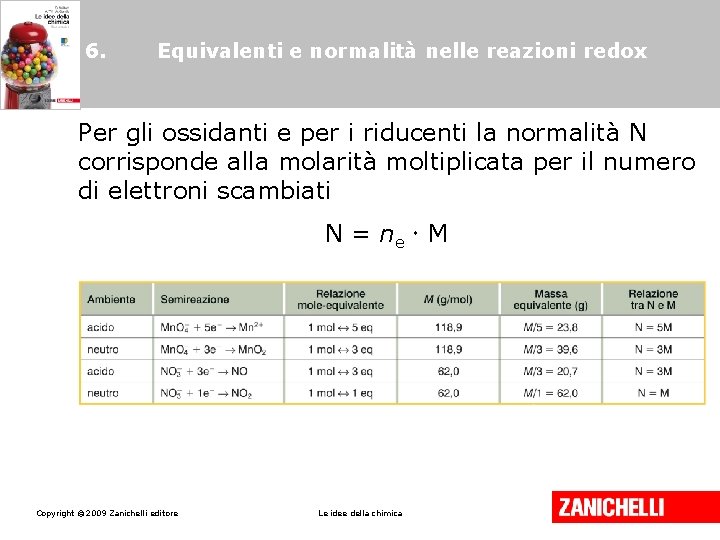
6. Equivalenti e normalità nelle reazioni redox Per gli ossidanti e per i riducenti la normalità N corrisponde alla molarità moltiplicata per il numero di elettroni scambiati N = ne M Copyright © 2009 Zanichelli editore Le idee della chimica
 La ley de dios es como un espejo
La ley de dios es como un espejo Paratif a va b
Paratif a va b Gentile da fabriano adorazione dei magi analisi
Gentile da fabriano adorazione dei magi analisi Andorre gentilé
Andorre gentilé Tanto gentile e tanto onesta pare
Tanto gentile e tanto onesta pare Un'intera nottata buttato vicino a un compagno massacrato
Un'intera nottata buttato vicino a un compagno massacrato Tim gentile
Tim gentile Krysten gentile sap
Krysten gentile sap Thomas c gentile
Thomas c gentile Riforma gentile 1923
Riforma gentile 1923 Simonetta gentile
Simonetta gentile The composition of the solar nebula was 98%
The composition of the solar nebula was 98% Riforma gentile schema
Riforma gentile schema Breughl
Breughl Ciri kemahiran tertutup
Ciri kemahiran tertutup Dina gentile
Dina gentile Laura gentile
Laura gentile Riforma gentile schema
Riforma gentile schema Soluzioni zanichelli chimica capitolo 11
Soluzioni zanichelli chimica capitolo 11 Struttura delle proteine
Struttura delle proteine Valitutti soluzioni
Valitutti soluzioni Whatsapp web
Whatsapp web Soluzioni chimica piu capitolo 14
Soluzioni chimica piu capitolo 14











































