Szervetlen kmia Szervetlen kmia Nevezktan A kmiai vegyletek

















































- Slides: 55

Szervetlen kémia

Szervetlen kémia Nevezéktan A kémiai vegyületek szisztematikus elnevezése, lehetővé téve a rendszerezést. IUPAC (International Union of Pure and Applied Chemistry = Tiszta és Alkalmazott Kémia Nemzetközi Uniója) nemzetközi elnevezési szabályai alapján http: //www. chem. qmul. ac. uk/iupac/ Az elnevezés szabályai az alkotórészek elektronegativitásának és oxidációs számainak figyelembevételével, azok alkalmazásán alapulnak. Kivétel a triviális (hétköznapi) nevek néhány anyagra, pl. : • • • H 2 O – víz (hidrogén-oxid) NH 3 – ammónia (trihidrogén-mononitrid) HNO 3 – salétromsav (nitrogénsav) Cu. SO 4⋅5 H 2 O – rézgálic (réz(II)-szulfát; kristályvizes) Na 3 PO 4 – trisó (nátrium-foszfát)

Szervetlen kémia Nevezéktan 1. Vegyület két ”elemből” áll: • fém-nemfém (általában ionosak): a fémion alkotórész az elem teljes nevével, első helyen szerepel, a nemfém szótöve -id toldalékot kap és nem jelöljük a kapcsolódó komponensek számát • fém-oxidációs száma állandó: Mg. Br 2 - magnézium-bromid Al 2 O 3 - alumínium-oxid Na 2 S - nátrium-szulfid (latin) Ca. C 2 - kalcium-karbid (latin) NH 4 Br - ammónium-bromid (NH 4+: alkálifémekhez soroljuk) KOH - kálium-hidroxid (nem bomló összetett anionok elnevezése analóg) Na. CN - nátrium-cianid Ca(SCN)2 - kalcium-rodanid • fémnek több oxidációs számú formája létezik: a fém neve után római számmal jelezzük az ion töltését Fe. Cl 2 - vas(II)-klorid Fe 2 O 3 - vas(III)-oxid Hg. O - higany(II)-oxid Hg 2 Cl 2 - higany(I)-klorid (nem ionos, hanem molekula, ezért nem Hg. Cl)

Szervetlen kémia Nevezéktan 1. Vegyület két ”elemből” áll: • nemfém-nemfém vagy metalloid (általában kovalens kötésű molekulák): úgy mint a fém-nemfém esetben, csak itt a névben görög számnevekkel jelezzük mind a két összetevő számát (bár a mono- sokszor elmarad). 1 – mono; 2 – di, 3 – tri; 4 – tetra, 5 – penta; 6 – hexa; 7 – hepta; 8 – okta; 9 – nona; 10 – deka A két atom közül melyik legyen az első ill. második helyen: az alábbi, periódusos rendszeren alapuló, sorrend alapján: B Si C Sb As P N H Te Se S I Br Cl O F A balra elhelyezkedő megnevezése kationnal analóg módon történik, míg a jobbra található az anion mintájára -id toldalékot kap. CO - szén-monoxid CS 2 - szén-diszulfid N 2 O - dinitrogén-oxid N 2 O 3 - dinitrogén-trioxid HBr - hidrogén-bromid HCN - hidrogén-cianid H 2 O 2 - hidrogén-peroxid (dihidrogén-dioxid) PH 3 - foszfor-hidrogén (trihidrogén-foszfid)

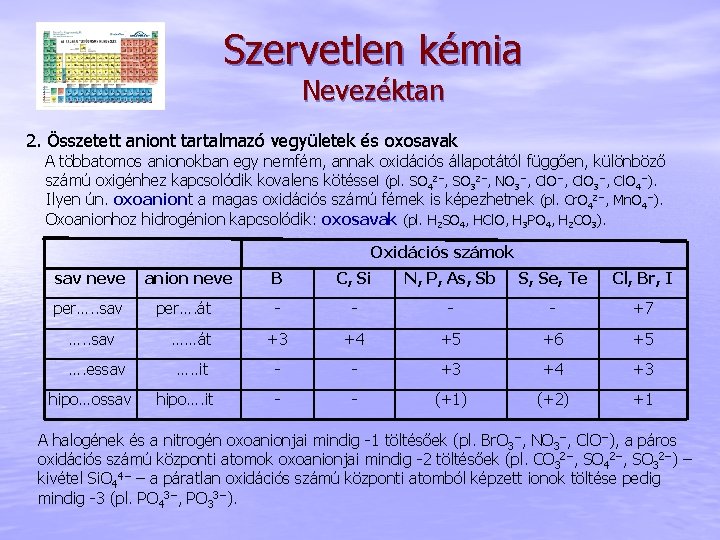
Szervetlen kémia Nevezéktan 2. Összetett aniont tartalmazó vegyületek és oxosavak A többatomos anionokban egy nemfém, annak oxidációs állapotától függően, különböző számú oxigénhez kapcsolódik kovalens kötéssel (pl. SO 42−, SO 32−, NO 3−, Cl. O 4−). Ilyen ún. oxoaniont a magas oxidációs számú fémek is képezhetnek (pl. Cr. O 42−, Mn. O 4−). Oxoanionhoz hidrogénion kapcsolódik: oxosavak (pl. H 2 SO 4, HCl. O, H 3 PO 4, H 2 CO 3). Oxidációs számok sav neve per…. . sav …. essav hipo…ossav anion neve B C, Si N, P, As, Sb S, Se, Te Cl, Br, I - - +7 ……át +3 +4 +5 +6 +5 …. . it - - +3 +4 +3 - - (+1) (+2) +1 per…. át hipo…. it A halogének és a nitrogén oxoanionjai mindig -1 töltésőek (pl. Br. O 3−, NO 3−, Cl. O−), a páros oxidációs számú központi atomok oxoanionjai mindig -2 töltésőek (pl. CO 32−, SO 42−, SO 32−) – kivétel Si. O 44− – a páratlan oxidációs számú központi atomból képzett ionok töltése pedig mindig -3 (pl. PO 43−, PO 33−).

Szervetlen kémia Nevezéktan 2. Összetett aniont tartalmazó vegyületek és oxosavak. Példák: HCl. O 4 – perklórsav HBr. O 3 - brómsav H 2 Se. O 4 - szelénsav HCl. O 2 - klórossav HCl. O - hipoklórossav Na. Cl. O 4 - nátrium-perklorát KBr. O 3 - kálium-bromát K 2 Se. O 4 - ammónium-szelenát KCl. O 2 - kálium-klorit Ca(Cl. O)2 - kalcium-hipoklorit Kivételek: A nitrogén és a szilícium oxosavjának nevét egy-egy ásványuk alapján képezzük (salétrom, kova), a szén és a kén oxoanionját pedig latin nevükből (karbon, szulf(ur)) származtatjuk. H 2 SO 4 – kénsav HNO 3 - salétromsav H 4 Si. O 4 - orto-kovasav H 2 CO 3 - szénsav H 2 SO 3 - kénessav HNO 2 - salétromossav Cu. SO 4 - réz(II)-szulfát Bi(NO 3)3 - bizmut(III)-nitrát Mg 2 Si. O 4 - magnézium-ortoszilikát Ca. CO 3 - kalcium-karbonát Mg. SO 3 - magnézium-szulfit NH 4 NO 2 - ammónium-nitrit

Szervetlen kémia Nevezéktan 2. Összetett aniont tartalmazó vegyületek és oxosavak. Savanyúsók: többértékű savak azon sói, melyekben nincs minden hidrogén fémionra cserélve. Nevüket a sóalak nevéből származtatjuk, a maradék hidrogének számának jelölésével: Na 2 CO 3 - nátrium-karbonát K 3 PO 4 - kálium-foszfát (NH 4)3 Sb. O 4 - ammónium-antimonát Na. HCO 3 - nátrium-hidrogén-karbonát K 2 HPO 4 - kálium-hidrogén-foszfát (NH 4)H 2 Sb. O 4 - ammónium-dihidrogén-antimonát Vegyes sók: egyértékű sav + sója Na. HF 2 - nátrium-hidrogén-fluorid (Na. F + HF) KH(IO 3)2 – kálium-hidrogén-jodát (KIO 3 + HIO 3) Fémeket tartalmazó összetett anionok: HMn. O 4 – permangánsav H 2 Cr. O 4 – krómsav H 2 Cr 2 O 7 - dikrómsav Mn. O 4 - - permanganát ion Cr. O 42 - - kromát ion Cr 2 O 72 - - dikromát ion

Szervetlen kémia Hidrogén 1. oszlop (alkálifémek), 1. sor – nem minden tulajdonsága illik az alkálifémekhez • • Elektronszerkezet: 1 s 1; rendszám: 1; atomtömeg: 1 Előfordulás: 93% a világegyetemben; 61% az emberi testben Vegyérték: 1; oxidációs szám: +1, -1 Elektronegativitás: 2. 1 Természetes körülmények között kétatomos molekulákat alkot, kötési energia: -436 k. J/mol Természetes körülmények között gáz, legkönnyebb, 14, 4 -szer könnyebb a levegőnél Könnyen ad le elektront (oxidációs szám: +1), de szabad proton természetes körülmények között nem marad meg önállóan (H 3 O+, NH 4+). Ez a gyakoribb ionos formája. • EN<1 fémekkel sószerű hidrideket képez (oxidációs szám: -1). H--ion csak kristályban létezik, vízben oldva: H- + H 3 O+ = H 2 + H 2 O • Hasonló elektronegativitású elemekkel (nemfémes elemek) kovalens kötésű molekulákat képez (elsősorban a C: szerves vegyületek) • Redukálószer: oxidokat, halidokat • Előállítás: labor: Zn + HCl; ipari méretben: földgáz + vízgőz reakciójával • Felhasználás: ammóniagyártás, hidrogénezés (pl. folyékony olajokat szilárd zsírokká), redukálószer (pl. ásványokból nyert oxidokat fémmé) • Hidrogén alapú gazdaság: energiatermelés (gépjárműmotor, fúziós reaktor) !!!drága előállítás, oxigén jelenlétében robbanékony!!!

Szervetlen kémia Hidrogén Nemzetközi Kísérleti Termonukleáris Reaktor (ITER) • Cadarache (Franciaország) • • • Építés: 2009 - 2018 Kísérleti üzemeltetés: 20 év Hőmérséklet: 150 millió ºC Elektromos fűtés+mágneses térrel való összenyomás → plazma állapot • Teljesítmény: 500 MW 400 s-on keresztül • Ezalatt fél gramm deutérium/trícium keverék fúzionál a 840 m 3 -es reaktorban.

Szervetlen kémia Alkálifémek I. oszlop • Elektronszerkezet: ns 1 • Vegyérték: 1; oxidációs szám: +1 • Elektronegativitás: 0. 7 -1 (ionvegyületeket képeznek, +1 töltésű ionjaik elektronszerkezete nemesgázszerű, nagyon stabil, ionizációs energia kicsi) • Természetes körülmények között szilárd halmazállapotúak, térközepes kockarácsot alkotnak • Oxigénnel, vízzel azonnal reagálnak, védőfolyadék (pl. petróleum) alatt tartják • Sűrűségük, keménységük kicsi Nátrium • • Nagyon reaktív: 2 Na + 2 H 2 O = 2 Na. OH + H 2 Természetben fő előfordulási formája: Na. Cl, Na 2 CO 3 Előállítás: Na. Cl olvadék elektrolízisével Felhasználás: redukálószer, nátriumgőzlámpa Nátrium-hidroxid (Na. OH) • • Fehér kristály (vizes oldata színtelen), nagyon erős bázis Kristályos állapotban rendkívül higroszkópos, levegőből H 2 O-t, CO 2 -t megköti Előállítás: Na. Cl-oldat elektrolízisével Felhasználás: textil- és papíriparban, szappan és mosószergyártás

Szervetlen kémia Na fontosabb vegyületei Nátrium-klorid (Na. Cl) • Színtelen kristály • Előfordulás: tengervízben (2. 7%), kősótelepeken, állati szervezetben (emberi vérben 0. 85%) • Előállítás: sóbányákból • Felhasználás: fémnátrium, nátriumvegyületek, klórvegyületek előállítására Olvadékelektrolízis: 2 Na. Cl = 2 Na + Cl 2 (T<700 ºC) Oldatelektrolízis: 2 Na. Cl + 2 H 2 O = 2 Na. OH + Cl 2 + H 2 Nátrium-hipoklorit (Na. OCl, Hypo) • Fertőtlenítő- tisztító-, illetve mosószer • Előállítás: Na. Cl-oldat elektrolízisével: 2 Na. OH + Cl 2 = Na. OCl + Na. Cl + H 2 O Diszproporcionálódás: olyan redoxireakció, melyben egy elem adott oxidációs számú formája két különböző oxidációs számú formává alakul. 0 +1 -1 A fenti reakcióban: Cl 2 = OCl- + Cl. Szinproporcionálódás: két különböző oxidációs formából lesz egy. +5 IO 3 - + -1 5 I- 0 = 3 I 2 + 3 O 2 -

Szervetlen kémia Na fontosabb vegyületei Nátrium-karbonát (Na 2 CO 3. 10 H 2 O) • Színtelen kristály → 100ºC-on hevítve fehér por (kristályvíz elvesztés) • Előfordulás: talajban (sziksó); ha túl sok, terméketlenné teszi a talajt • Felhasználás: szappan-, mosószer-, üveggyártás, vízlágyítás Oldata lúgos kémhatású: Na 2 CO 3 + 2 H 2 O = 2 Na. OH + H 2 CO 3 (hidrolízis) Nátrium-hidrogén-karbonát (Na. HCO 3, szódabikarbóna) • Fehér kristály • Felhasználás: gyógyászatban fölös gyomorsav lekötésére Oldata enyhén lúgos kémhatású: Na. HCO 3 + H 2 O = Na. OH + H 2 CO 3 (hidrolízis) Nátrium-foszfát (Na 3 PO 4, trisó) • Fehér kristály • Vizes oldata lúgos: Na 3 PO 4 + 3 H 2 O = 3 Na. OH + H 3 PO 4 (hidrolízis) • Felhasználás: mosószerek, vízlágyítás Nátrium-tioszulfát (Na 2 S 2 O 3. 5 H 2 O, fixírsó) • Színtelen kristály • Felhasználás: analitikában jodometriában: 2 Na 2 S 2 O 3 + I 2 = Na 2 S 4 O 6 + 2 Na. I ill. kép rögzítésére fényképészetben: Ag. Br + Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. Br

Szervetlen kémia K és fontosabb vegyületei Kálium • • Nátriumhoz hasonló, de nála reakcióképesebb (kisebb EN miatt) Természetben fő előfordulási formája: KCl kősótelepeken Na. Cl kísérőjeként Előállítás: KCl, KOH vagy K 2 CO 3 olvadék elektrolízisével Felhasználás: műtrágyagyártás, pirotechnika, robbanóanyag-gyártás Kálium-klorid (KCl) • Jelentőség: növényi szervezetben • Felhasználás: műtrágyagyártás, K és KOH előállítás, méreginjekció, gyógyászat: mániákus depresszió kezelése Kálium-hidroxid (KOH) • • • Fehér kristály (vizes oldata színtelen), Na. OH-nál is erős bázis Kristályos állapotban rendkívül higroszkópos, levegőből H 2 O-t, CO 2 -t megköti Oldja az üveget. Előállítás: KCl-oldat elektrolízisével Felhasználás: textil- és papíriparban, szappan és mosószergyártás, élelmiszeriparban gyümölcs héjának eltávolítása Kálium-nitrát (KNO 3) • Felhasználás: műtrágya, feketelőpor, füstbomba, élelmiszer tartósítószer (E 252)

Szervetlen kémia Alkáliföldfémek II/A. oszlop • Elektronszerkezet: ns 2 • Vegyérték: 2; oxidációs szám: +2 • Elektronegativitás: 0. 9 -1. 5 (Mg-tól lefelé ionvegyületeket képeznek, +2 töltésű ionjaiknak nemesgáz elektronszerkezete van, ionizációs energia kicsi) • Berillium nagyobb elektronegativitása (1. 5) miatt inkább kovalens vegyületet képez, bizonyos esetekben a Mg is • Természetes körülmények között szilárd halmazállapotúak • Oxigénnel, vízzel reagálnak (kevésbé intenzíven mint az alkálifémek), aktivitásuk a rendszámmal nő (ahogy EN csökken) • Sűrűségük, keménységük kicsi (nagyobb mint az alkálifémeké) • Redukálószerek (gyengébbek mint az alkálifémek)

Szervetlen kémia Mg és fontosabb vegyületei Magnézium • Ezüstfehér, könnyű fém. • Természetben csak vegyületben fordul elő: magnezit (Mg. CO 3), a dolomit (Ca. CO 3. Mg. CO 3), • Felületén védő oxidréteg (Mg. O) képződik • Jellegzetes az égése, vakító fehér fényt bocsát ki (égéshő -603 k. J/mol)

Szervetlen kémia Mg és fontosabb vegyületei Magnézium • Ezüstfehér, könnyű fém. • Természetben csak vegyületben fordul elő: magnezit (Mg. CO 3), a dolomit (Ca. CO 3. Mg. CO 3), • Felületén védő oxidréteg (Mg. O) képződik • Jellegzetes az égése, vakító fehér fényt bocsát ki (égéshő -603 k. J/mol) • Előállítás: Mg. Cl 2 olvadék elektrolízisével, karbonát hevítésével kapott oxid redukciójával • Felhasználás: villanófény, víz alatti fáklya, ötvözetek előállítása repülőgépekhez Magnézium ötvözetek: kis sűrűségű, de nagy szilárdságúak • Magnálium: Al + 5 -50% Mg + nyomokban egyéb elemek kevés Mg: szilárd: repülőgép és autó alkatrészek sok Mg: törékeny, a por gyúlékony: pirotechnikában csillagszóró • Duralumínium: repülőgépek szerkezeti anyagának nagy része

Szervetlen kémia Mg és fontosabb vegyületei Magnézium-hidroxid (Mg(OH)2) • Gyenge lúg, vízben rosszul oldódik (Mg-O kötés erősen kovalens jellegű) • Előállítás: természetben ásvány formájában előfordul • Felhasználás: gyomorsav megkötő, konzerv gyümölcsök, zöldségek színének tartósítása (E 528) Magnézium-klorid (Mg. Cl 2) • Gyenge sav (savasan hidrolizál): Mg 2+ + 2 H 2 O = Mg(OH)2 + 2 H+ (2 H 3 O+) • Előfordulás: természetben ásvány formájában • Felhasználás: Mg illetve Mg vegyületek előállítására, cementgyártás, USA-ban utak jégtelenítésére • Hidrogéntárolás egy formája: Mg(NH 3)6 Cl 2 formájában sok ammóniát köt meg, mely hevítés hatására könnyen távozik Magnézium-szulfát (Mg. SO 4) keserűsó, Epson-só • Előállítás: természetben heptahidrát formájában (Mg. SO 4. 7 H 2 O) előfordul • Felhasználás: nagy magnézium-igényű növények (burgonya, bors, rózsa) trágyázása, gyógyászatban bélmozgás elősegítő, hashajtó

Szervetlen kémia Ca és fontosabb vegyületei Kalcium • Ezüstfehér színű, könnyű fém. • Lángfestés: téglavörös • Természetben csak vegyületben fordul elő: mészkő, kalcit, márvány (Ca. CO 3), dolomit (Ca. CO 3. Mg. CO 3), fluorit (Ca. F 2) • Előállítás: Ca. Cl 2 ill. Ca. Cl 2+Ca. F 2 olvadék elektrolízisével • Felhasználás: redukálószer, ötvözetek (csapágyfémben 0. 7 %) fluorit kalcit kristályon

Szervetlen kémia Ca és fontosabb vegyületei Kalcium-karbonát (Ca. CO 3) • Természetben leggyakrabban előforduló Ca-vegyület • Felhasználás: építőipar, csiszolópor, tisztítószer • CO 2 -t tartalmazó vízben hidrokarbonát képződése formájában oldódik, az analóg módon képződő Mg(HCO 3)2 -vel együtt a víz változó keménységét okozva. CO 3 + H 2 O + CO 2 Ca(HCO 3)2 • változó: forralással megszüntethető (visszaalakulás, CO 2 gáz eltávozik) Állandó keménységet okozó sók: Ca. Cl 2, Ca(NO 3)2, Ca. SO 4, Mg. Cl 2, Mg(NO 3)2, Mg. SO 4 Megszüntetés (vízlágyítás): Ca 2+ és Mg 2+ ionokat csapadék formájában leválasztani, majd szűréssel eltávolítani: Ca 2+ + Na 2 CO 3 = Ca. CO 3 + 2 Na+ 3 Ca 2+ + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 6 Na+ Ioncserélővel: • lágyvíz: lecserélni a Ca 2+ és Mg 2+-ionokat Na+-ionokra • ionmentes víz: a víz összes idegen ionját lecserélni H 3 O+ illetve OH—ionokra.

Szervetlen kémia Ca és fontosabb vegyületei 1 Kalcium-szulfát (Ca. SO 4. 2 H 2 O) = gipsz • Természetben gipsz 1 ill. evaporit 2 ásványok formájában • Felhasználás: építőipar (cement), iskolai kréta, gyógyászat (gipszelés), tűzálló fal • 100 -150 ºC-ra hevítve a kristályvíz 75%-a távozik (cement, orvosi gipsz): Ca. SO 4. 2 H 2 O → Ca. SO 4. ½H 2 O + 1½H 2 O (tűzálló falban lassan melegszik, mert előbb a kristályvíz távozására fordítódik a hő) • teljesen kiégetett gipsz már nem tud vizet felvenni Kalcium-hidroxid Ca(OH)2 • Ca. CO 3 → CO 2 + Ca. O (égetett mész) • Égetett mészből vízzel (mészoltás): Ca. O + H 2 O → Ca(OH)2 (oltott mész) • Felhasználás: építőiparban habarcs készítésre: Ca(OH)2 + CO 2 → Ca. CO 3 + H 2 O (megkötés a csapadékként kiváló Ca. CO 3 miatt) 2

Szervetlen kémia Ba és Ra Bárium (Ba) és fontosabb vegyületei: • • Természetben Ba. SO 4 (barit) ill. Ba. CO 3 formájában Lángfestés: sárgászöld Előállítás: Ba. Cl 2 elektrolízisével Felhasználás: kontrasztanyagként Ba. SO 4 formájában (jól elnyeli a Röntgen sugarakat) és tűzijátékban. Rádium (Ra) és fontosabb vegyületei • Ritka elem, urán és tóriumásványok mellett, mint azok radioaktív bomlásának terméke • 28 izotópja van, mind radioaktív • A szervezetbe került rádium a csontokba beépül • Felhasználás: régebben sugárterápiára, ma már vannak olcsóbb sugárforrások neutronforrás: Be + a-sugárzás(Ra-ból) → neutronok

Szervetlen kémia Földfémek, bór III/A. oszlop • • Elektronszerkezet: ns 2 np 1 Vegyérték általában: 3 ill. 1 (Ga, In, Tl); oxidációs szám: +3, +1 (Ga, In, Tl) B félfém, a többi fém. Elektronegativitás: 1. 5 -2. 0 (B és Al gyakran képez kovalens kötéseket, a többiek viszont elsősorban ionosat) • Természetes körülmények között szilárd halmazállapotúak Bór (B) és fontosabb vegyületei • Atomrácsos kristályszerkezet, gyémánt után legkeményebb • Természetben vegyületei formájában található, leggyakoribb a bórax, a bórsav Na sója: Na 2 B 4 O 7 • 10 H 2 O • Elektromos szigetelő, de jól vezeti a hőt. • Felhasználás: 1) acélötvöző szerként növeli annak keménységét, kopásállóságát, korrózióval szembeni ellenállását 2) bórszálakat űrrepülőgépek gyártásánál, kis súlyuk és nagy szakítószilárdságuk miatt. • Bórax felhasználása: acélgyártásban – csökkenti a vas-oxid olvadáspontját, így az könnyebben eltávolítható az acélból.

Szervetlen kémia Al és vegyületei Alumínium (Al) • Természetben főként bauxitban (Al. O(OH)) ill. agyagásványokban fordul elő, míg a korund tiszta Al 2 O 3 ásvány . • 3. leggyakoribb elem a Föld kérgében • levegővel gyorsan reagál, de a felületén összefüggő Al 2 O 3 réteg képződik, mely óvja a további oxidációtól. Eloxálás: e réteg mesterséges vastagítása anódos oxidációval híg savban (foszforsav, kénsav, krómsav, stb. ) • Amfoter: oldják híg savak és lúgok, de tömény savak nem 2 Al + 3 H 2 SO 4 = Al 2(SO 4)3 + 3 H 2 2 Al + 2 Na. OH + 6 H 2 O = 3 H 2 + 2 Na. Al(OH)4 nátrium[tetrahidroxo-aluminát] • Szakítószilárdsága kicsi, rosszul önthető • Előállítás: bauxitból Al. O(OH) bauxit lúgos feltárás Al(OH)3 1300 ºC timföldhidrát Al 2 O 3 timföld elektrolízis Al tiszta fém • Felhasználás: vezeték (elektromosság), repülőgépek, vasúti kocsik gyártása.

Szervetlen kémia Al és vegyületei Al ötvözetek • Magnálium, duralumínium (lásd magnéziumnál) • Csoportosítás: - Alakítható (sajtolható) ötvözetek: nagy szilárdság a cél. A keverékek jellege (koncentrációk!) szilárd oldat. Fő ötvözők: Cu, Mn, Mg Duralumínium (4, 5% Cu + 0, 5% Mg + 0, 6% Mn). Cu-ra túltelített, ezért Cu. Al 2 halmazok keletkeznek. Megfelelő kezeléssel ezek finoman eloszolt kis szemcsék formájában válnak ki, → nagy szakítószilárdság. Al-Cu-Ni ötvözetek: magasabb hőmérsékleten nagy szakítószilárdság. A fenti ötvözetek a Cu miatt nem korrózióállóak. Al-Mg-Si ötvözetek (1% Si, 1% Mg, 0. 7%Mn): nagy szilárdságúak, korrózióállóak Al-Mn ötvözetek: kitűnő korrózióállóság, képlékenység, hegeszthetőség. - Önthető ötvözetek: Al öntészeti tulajdonságai nem jók. Eutektikus összetételhez közel álló keverékek, alacsony op. Al-Si ötvözetek (sziluminok, 9 -14% Si): jól önthetők, gyenge szakítószilárdságúak. Al-Si-Cu ötvözetek (4% Cu, 2. 5 %Si): önthetőség mellett nagy szilárdságúak. Al-Cu-Mg ötvözetek (4% Cu, 1. 5 % Mg): önthetők, nagy szilárdságúak, kis Ni-t, hozzáadva magas hőmérsékleten igénybevett alkatrészek (dugattyú).

Szervetlen kémia Al és vegyületei Alumínium-oxid (Al 2 O 3) • Természetben: korund, rubin (+Cr 2 O 3), zafír (+Fe. O, Ti 2 O 3) • Al por hevítve: 4 Al + 3 O 2 = 2 Al 2 O 3 (DH=-1687 k. J/mol) • Az oxid nagy képződési entalpiájának köszönhetően az Al gyakran alkalmazott redukálószer (aktivási energiagátat a fejlődő hő leküzdi). Fémek (Cr, Mn) előállítása oxidból: 1. fém-oxid + Al por + gyújtókeverék (Al+Ba. O 2) 2. begyújtva Mg szalaggal: 800 ºC 3. 3 Ba. O 2 + 4 Al = 3 Ba + 2 Al 2 O 3 reakcióból: 2000 ºC 4. pl. Cr 2 O 3 + 2 Al = Al 2 O 3 + 2 Cr • Felhasználás: csiszolópapír - vas-oxiddal szennyezett korund Alkáli-alumínium-szilikátok (Al 2 Si 2 O 7. 2 H 2 O) kaolinit vagy porcelánföld Agyag: Ca. CO 3, Fe 2 O 3 szennyeződésekkel. Mészkővel keverve → portlandcement.

Szervetlen kémia Széncsoport IV/A. oszlop • • Elektronszerkezet: ns 2 np 2 Vegyérték: C, Si, Ge - 4; Sn, Pb – 2 (ritkábban 4) C nemfém; Si, Ge félfém; Sn, Pb fém. Elektronegativitás: 2. 5 -1. 8 (C, Si, Ge kovalens kötések, Sn, Pb inkább ionos) Szén (C) módosulatai • Kristályos: gyémánt, grafit, fullerének • Ásványokban (70 -10%, amorf): antracit, kőszén, barnaszén, lignit, tőzeg • Mesterséges: faszén, vérszén, csontszén, korom, koksz (szénégetés, száraz lepárlás: ~500 ºC-on, O 2 kizárásával hevítve) Felhasználás: - gyémánt (legkeményebb ásvány): ékszeripar, üvegvágás, fúrófejek, vágóélek grafit: elektródok, olvasztótégelyek (jó vezetőképesség), kenőanyagokban ásványi szenek, koksz: tüzelés faszén, vérszén, csontszén: sok apró pórus nagy fajlagos felület → adszorbens aktivált szén - korom: töltőanyag (pl. gumiban) molekulák

Szervetlen kémia Széncsoport Fullerének: mesterséges szén módosulatok (XX. sz. vége) • páros számú (60, 72, 84 stb. ) szénatomból álló molekulák • Felfedezés: 1985 -ben Harold Kroto, Robert Curl, Richard Smalley 1996 -ban kémiai Nobel-díj. • A molekulákat kizárólag öt- és hattagú gyűrűk építik fel. • C atom három másik C atomhoz kapcsolódik (1 kettős, 2 egyes kötés). • Az ötszögek száma mindig 12. • A C 60 (backminsterfullerén) molekula futball-labda alakú. C 60 Felhasználás: - C 540 szén nanocső: hengeres fullerén molekulák könnyű elmozdulása: jó kenési tulajdonságok 160 atm, 25 ºC-on gyémánttá alakítható: gyémántbevonat fénnyel besugározva vezetik az elektromosságot: optikai áramkörben intersticiális C 60 Rb-só: 30 K alatt ellenállás nélkül vezeti az áramot (szupravezető) nanocsövek: nagy szakítószilárdság, jó el. vezetés, kémiai inaktivitás (űrtechnológia)

Szervetlen kémia Szén vegyületei Szerves vegyületek: 5 millió Fontosabb szervetlen vegyületek: • Szén-monoxid (CO): színtelen, szagtalan gáz, szén tökéletlen égésekor Vér hemoglobinja megköti: fejfájás, szédülés, fulladás Szintézisgáz (CO + 3 H 2): metanol, műbenzin előállítása • Szén-dioxid (CO 2): színtelen szagtalan gáz, égést elfojtja (0. 035%) Folyadék: csak 5 barnál nagyobb nyomás alatt Szárazjég: szilárd CO 2 (folyékony CO 2 párolgása nagy hőelvonásal jár → megfagy) hűtésre használják • Szénsav (H 2 CO 3): instabil, vizes oldata kétbázisú gyenge sav H 2 CO 3 HCO 3 - + H+ (H 3 O+) K 1= 4. 3. 10 -7 mol/dm 3 CO 32 - + H+ (H 3 O+) K 2= 5. 6. 10 -11 mol/dm 3 • Szénsav sói, a karbonátok stabilak Karbonátion (CO 32 -): 6 delokalizált elektron

Szervetlen kémia Széncsoport többi eleme Szilícium (Si) • Föld szilárd kérgének 30 %-a. Kvarc és szilikátok a vulkáni kőzetek 98%-a. • Kvarc (Si. O 2): hegyikristály, ametiszt, füstkvarc, rózsakvarc • Si vízzel, savval nem, lúggal reagál: Si + 4 OH- = Si. O 44 - + 2 H 2 • Előállítás kálium-szilikofluoridból: 3 K 2 Si. F 6 + 4 Al = 3 Si + KAl. F 4 + K 3 Al. F 6 • Félvezető: vegyértéksáv és vezetési sáv közötti tiltott sáv 1. 1 e. V széles. Csak magasabb hőmérsékleten vezet. Adalékok segítségével alacsonyabb T-n is. N-típus: adaléknak több elektronja van: vezetési sávban vannak a fölös elektronok P-típus: adaléknak kevesebb elektronja van: vegyértéksávban pozitív lyukak • Alkalmazás az elektronikában, számítástechnikában. • Si. O 2: üvegyártás Germánium (Ge): ritka elem, félvezető Ón (Sn): fehérbádog (ónbevonatú vas), bronz ötvözet (Cu+Sn) Ólom (Pb): csővezetékek (védő Pb. O 2 oxidréteg, híg sav nem oldja), akkumulátor, radioaktív sugárvédelem, ötvözetek (betűfém: Pb + Sn)

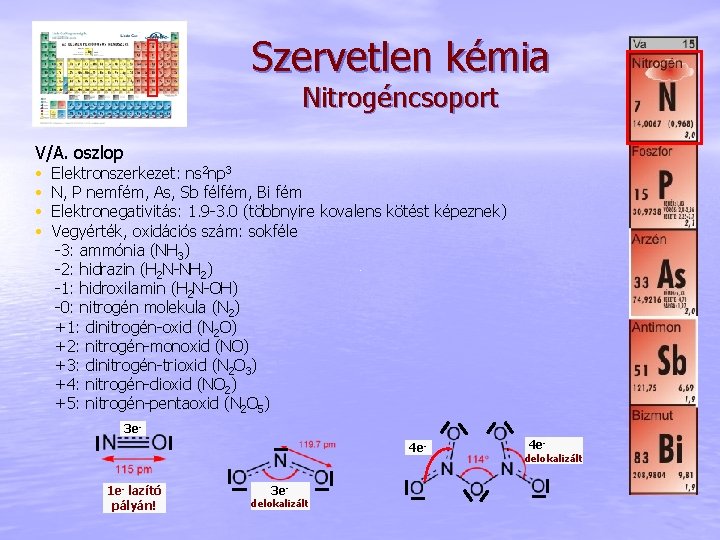
Szervetlen kémia Nitrogéncsoport V/A. oszlop • • Elektronszerkezet: ns 2 np 3 N, P nemfém, As, Sb félfém, Bi fém Elektronegativitás: 1. 9 -3. 0 (többnyire kovalens kötést képeznek) Vegyérték, oxidációs szám: sokféle -3: ammónia (NH 3) -2: hidrazin (H 2 N-NH 2) -1: hidroxilamin (H 2 N-OH) -0: nitrogén molekula (N 2) +1: dinitrogén-oxid (N 2 O) +2: nitrogén-monoxid (NO) +3: dinitrogén-trioxid (N 2 O 3) +4: nitrogén-dioxid (NO 2) +5: nitrogén-pentaoxid (N 2 O 5) 3 e 4 e 1 e- lazító pályán! 3 e- delokalizált 4 e- delokalizált

Szervetlen kémia Nitrogéncsoport Nitrogén (N) • Gáz, levegő 78%-a. N 2 nagyon stabil. • 3 p elektronnal kötés, negyediket datív módon (NH 4+) N fontosabb vegyületei: • Ammónia (NH 3): színtelen, szúrós szagú, nagy párolgáshő, vízben jól oldódik. Felhasználás: salétromsav és műtrágyagyártás, hűtőgép (helyette ma HCFC, HFC) • Ammónium-hidroxid (NH 4 OH) Csak vizes oldatban létezik, gyenge bázis: NH 3 + H 2 O NH 4 OH NH 3 vízben való oldódása exoterm: hevítés hatására NH 3 eltávozik. • Ammónium-klorid (NH 4 Cl) Kristályos, vízben jól oldódik, oldata kissé savas Hevítés hatására bomlik: NH 4 Cl → NH 3 + HCl Felhasználás: lágyforrasztáskor fémfelület tisztítására, HCl és NH 3 oldja a fém-oxidokat • Ammónium-nitrát (NH 4 NO 3) Kristályos, higroszkópos, könnyen bomlik (robbanásveszély) Felhasználás: mészkőporral keverve műtrágya

Szervetlen kémia Nitrogéncsoport • Nitrogén-dioxid (NO 2): vörösesbarna, párosítatlan elektron miatt paramágneses. Vízzel reagálva: 2 NO 2 + H 2 O = HNO 3 + HNO 2 Egyensúlyban van a dimerjével: 2 NO 2 N 2 O 4 • Dinitrogén-tetroxid (N 2 O 4): könnyen cseppfolyósítható gáz. Felhasználás: kovalens vegyületek jó aprotonos oldószere. • Salétromsav (HNO 3): színtelen, szúrós szagú, erős sav Állás közben bomlik: 2 HNO 3 → 2 NO 2 + H 2 O + O Oxidálószer: N 5+ → N 4+-re redukálódik, ill. naszcensz oxigén képződik Fémeket oldja (választóvíz: ezüst): 2 Ag + 2 HNO 3 = Ag 2 O + 2 NO 2 + H 2 O Ag 2 O + 2 HNO 3 = 2 Ag. NO 3 + H 2 O Királyvíz: cc. HNO 3 és cc. HCl 1: 3 arányú keveréke (aranyat is oldja) HNO 3 + 3 HCl = 2 H 2 O + NO + 3 Cl (atomos klór oxidál) HCl + 3 Cl + Au = H[Au. Cl 4] (hidrogén-tetrakloro-aurát) cc. HNO 3 a vasat és alumíniumot nem oldja, mert passzív oxidréteget csinál (de: a híg HNO 3 oldja őket!!

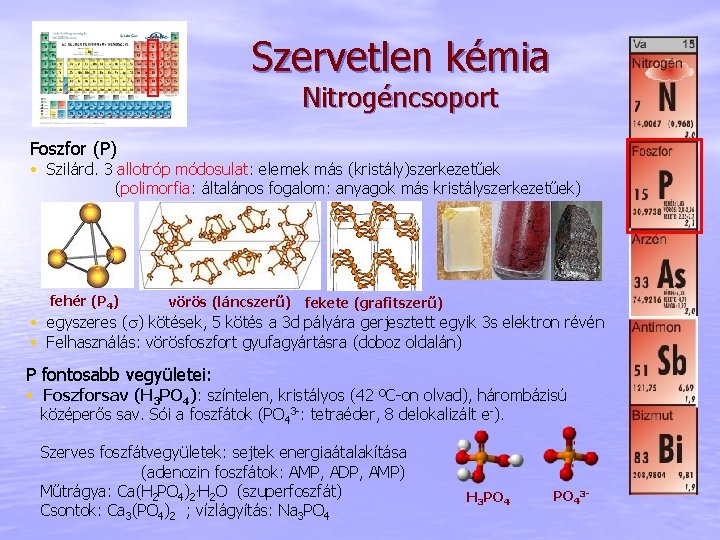
Szervetlen kémia Nitrogéncsoport Foszfor (P) • Szilárd. 3 allotróp módosulat: elemek más (kristály)szerkezetűek (polimorfia: általános fogalom: anyagok más kristályszerkezetűek) fehér (P 4) vörös (láncszerű) fekete (grafitszerű) • egyszeres (s) kötések, 5 kötés a 3 d pályára gerjesztett egyik 3 s elektron révén • Felhasználás: vörösfoszfort gyufagyártásra (doboz oldalán) P fontosabb vegyületei: • Foszforsav (H 3 PO 4): színtelen, kristályos (42 ºC-on olvad), hárombázisú középerős sav. Sói a foszfátok (PO 43 -: tetraéder, 8 delokalizált e-). Szerves foszfátvegyületek: sejtek energiaátalakítása (adenozin foszfátok: AMP, ADP, AMP) Műtrágya: Ca(H 2 PO 4)2. H 2 O (szuperfoszfát) Csontok: Ca 3(PO 4)2 ; vízlágyítás: Na 3 PO 4 H 3 PO 43 -

Szervetlen kémia Oxigéncsoport VI/A. oszlop • • Elektronszerkezet: ns 2 np 4 O, S, Se nemfém, Te, Po félfém Elektronegativitás: 2. 0 -3. 5 (többnyire kovalens kötést képeznek) Vegyérték: 2, 4, 6 Oxigén (O) • • • 3. leggyakoribb elem a világegyetemben Leggyakoribb elem a Földön, a földkéreg (30 -40 km) súlyának fele oxigén. Gáz, levegő 20. 9 %-a. Cseppfolyós és szilárd halmazállapotban kék. Kétatomos molekula (O 2), kevésbé stabilabb mint N 2. Egy s kötés, és két azonos spinű magános p elektron (két fél p kötés) O O • Előállítás: cseppfolyós levegő frakcionált desztillációjával, ill. vízből elektrolízissel • Legjelentősebb allotróp módosulata az ózon (O 3): O O Fertőtlenítő hatású, légkörben UV védelem 4 e- O

Szervetlen kémia Oxigéncsoport Oxigén vegyületei Víz (H 2 O) • Erős hidrogénkötés, vízben legstabilabbak a négyes asszociátumok (H 8 O 4) • Jég: folyadéknál lazább szerkezete miatt sűrűsége kisebb mint a vízé (térfogata nagyobb 9%-al). Víz sűrűsége is +4 ºC-on a legnagyobb. Hidrogén-peroxid (H 2 O 2) • Színtelen, szagtalan, nem éghető folyadék • Erős hidrogénkötést képez, vízzel korlátlanul elegyedik • Peroxokötés gyenge, erősen bomlékony: H 2 O 2 = H 2 O + O A felszabaduló naszcensz (atomos) oxigén miatt erős oxidálószer. 2 HCl + H 2 O 2 = Cl 2 + H 2 O • Előállítása: Ba. O 2 + H 2 SO 4 = Ba. SO 4 + H 2 O 2 (Ba. O + O 2 = Ba. O 2 500 ºC-on) • Fontosabb alkalmazásai: fertőtlenítőszer, színtelenítőszer, rakéták üzemanyaga Bomlását nehézfémek és sóik katalizálják

Szervetlen kémia Oxigéncsoport Kén (S) • Sárga, szilárd, 8 -atomos molekulák (s-kötés) • Természetben elemi állapotban vulkángőzökben. • Kőolajfinomítás mellékterméke • Felhasználás: borászat (baktériumölő), kénsav előállítás Antal István: A kén Egy sárga úr vagyok, Megismerhetsz nyomban, Megtalálsz a hatodik főcsoportban. Távol áll tőlem bohém élet, pia, Jellemzőm az allotrópia. Egy lóugrás a szén, ki mindig , , kormos'', Iker vagyok, monoklin és rombos. Nem vagyok túl kemény, De mégis sármos, Egész testem molekularácsos. Testem látszik, nem poláros, Nyolc atomos gyűrű, apoláros. Ha oldani akarsz, vízzel ne próbálkozz, Erre inkább, szén-diszulfid, te ajánlkozz! Hevítgetnek gyakran, megolvadok, folyok, Sűrű, sötét gyűrű leszek, majd folyékony vagyok. Ha ilykor lehűtenek orvul, Nem érzem jól magam, csak amorful. Egyéb elemekkel reagálok sorba', Ekképp stabilizálódom három rácstípusba. Atom, molekula, s ionrács e három, Soulfour vagyok, magamat ajánlom.

Szervetlen kémia Oxigéncsoport Kén vegyületei: Hidrogén-szulfid (H 2 S, kén-hidrogén) • Előfordulás: vulkáni gázok, kénes ásványvizek, záptojás (fehérjék bomlásterméke) • Savas jellege miatt fémekkel reagál (pl. ezüst: fekete Ag 2 S) Kén-dioxid (SO 2) • Vulkáni tevékenységből, szén és kőolajszármazékok elégetésekor → savas esők • Redukálható (oxidáló tulajdonság): SO 2 + 2 H 2 S = 3 S + 2 H 2 O • Oxidálható (redukáló tulajdonság): 2 SO 2 + O 2 = 2 SO 3 Ezen reakció vanádium-pentoxid (V 2 O 5) katalizátorral a kénsavgyártás fő lépése. • Borászatban hasznos tulajdonságok: antioxidáns, antiszeptikus (mikroorganizmus ölő), íz, zamat és színalakító hatás Kén-trioxid (SO 3) O • S elektronszerkezete: 3 s 2 3 p 4 = csak 2 párosítatlan, kovalens 6 ekötést képző elektron S Promóció: a párosított elektronokból 1 -1 a 3 d pályára gerjesztődik (energia fedeződik az utána kialakuló kovalens O O kötés során felszabaduló energiából) Hibridizáció: pályák energiája kiegyenlítődik, hogy ekvivalens kötéseket alkothassanak: SO 3 -ban: 3 ekvivalens s-kötés + delokalizált p pályák

Szervetlen kémia Kén vegyületei Kénsav (H 2 SO 4) • Egyik legnagyobb mennyiségben előállított vegyszer (szinte minden vegyiipari ágazatban használt alapanyag) Max. 98 %-os vizes oldatát használják (efölött SO 3 párolog ki belőle). Akkumulátorban 33. 5 %-os van. • Kétértékű nagyon erős sav. Tömény H 2 SO 4 erősen vízelvonó, még szerves vegyületekből is elvonja a H és O-t → elszenesíti őket.

Szervetlen kémia Kén vegyületei Kénsav (H 2 SO 4) • Egyik legnagyobb mennyiségben előállított vegyszer (szinte minden vegyiipari ágazatban használt alapanyag) Max. 98 %-os vizes oldatát használják (efölött SO 3 párolog ki belőle). Akkumulátorban 33. 5 %-os van. • Kétértékű nagyon erős sav. Tömény H 2 SO 4 erősen vízelvonó, még szerves vegyületekből is elvonja a H és O-t → elszenesíti őket. • Tömény forró kénsav erős oxidálószer, de HNO 3 -nál gyengébb. • Autoprotolízis: 2 H 2 SO 4 H 3 SO 4+ + HSO 4 K=2. 7. 10 -4 (mol/dm 3)2 sokkal erősebb mint a vízben (10 -14), vezeti az áramot. • Vízben disszociációja: H 2 SO 4 + H 2 O = H 3 O+ + HSO 4 - (hidrogén-szulfátion) HSO 4 - + H 2 O = H 3 O+ + SO 42(szulfátion) • Szulfátok (SO 42 -) • Tetraéderes szerkezetű, de – a sok helyen látható ábrával ellentétben - a 4 oxigén ekvivalens, 8 e--ból álló delokalizált p-rendszer van a 4 s S-O kötés körül. • Fontosabb szulfátok: Pb. SO 4, Ca. SO 4, Mg. SO 4, Cu. SO 4. 5 H 2 O (növényvédőszer)

Szervetlen kémia Halogéncsoport VII/A. oszlop • • • Elektronszerkezet: ns 2 np 5 F, Cl, Br, I nemfém, At (mesterséges elem) félfém Elektronegativitás: 4. 0 -2. 2 Kis EN-ú elemekkel ionos, nagy EN-ú elemekkel kovalens kötésű vegyületeket alkotnak. Vegyérték: 1, 3, 5, 7 (oxidációs szám: -1, +3, +5, +7) kivéve a F, aminek oxidációs száma csak -1 lehet. Erős oxidálószerek (anionná redukálódnak) Kétatomos molekulákat képeznek. Színesek: molekuláik a látható fény hatására gerjesztődnek. Szobahőmérsékleten F, Cl gáz, Br folyékony, I szilárd. Előfordulás: tengervízben, ásványvizekben, többnyire Na-só formájában. Fluor (F) • Legerősebb oxidáló elem, nemesgázokkal is (Kr, Xe, Rn) reagál. • Megtámadja a legtöbb elemet: esetenként a fejlődő hő mellett fényeffektus.

Szervetlen kémia Halogéncsoport Fluor fontosabb vegyületei • Hidrogén-fluorid (HF): középerős sav, üvegmaratásra használják Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O Erős hidrogénkötés: H 2 F 2, H 4 F 4, H 6 F 6 asszociátumokat képez • Nátrium-fluorid (Na. F): fogpasztában • Nátrium-[hexafluoro-aluminát] = kriolit (Na 3[Al. F 6]) Al gyártásban elektrolízisnél: 1000 ºC-os olvadéka oldja a timföldet (enélkül 2000 ºC kellene) Klór (Cl) • • Fojtó szagú gáz, elemi állapotban vulkáni gázokban Reaktivitása hasonló (csak gyengébb) a fluoréhoz Előállítás: Na. Cl vizes oldatának elektrolízise → Cl 2 + H 2 Felhasználás: fertőtlenítés (víz, gyógyászat) Cl 2 + H 2 O HCl + HCl. O → HCl + O Hidrogén-klorid (HCl) • Szúrós szagú gáz, vizes oldata a sósav (erős sav), kis koncentrációban gyomorban • Előállítás: Na. Cl + H 2 SO 4 = Na. HSO 4 + HCl • Felhasználás: PVC gyártás, gyógyszeripar + sok egyéb iparágban

Szervetlen kémia Halogéncsoport Bróm (Br) • Vörösbarna, rossz szagú folyadék (büzeny) • Klóréhoz hasonló jellegű reaktivitás (de gyengébb) • Felhasználás: KBr, Na. Br-t nyugtatóként a gyógyászatban Ag. Br-t a fényképészetben Jód (I) • Szürke kristály, sárgásbarna vizes oldat, lila gőz

Szervetlen kémia Halogéncsoport Jód (I) • Vízben rosszul oldódik, de KI-os oldatban már jól: I 2 + I- = I 3 - komplex ion • Oxidálószer (leggyengébb a halogének közül) • Fontos élettani szerep: pajzsmirigy által termelt tiroxin növekedési hormon Hiánya: pajzsmirigy megnagyobbodás (golyva), törpeség, szellemi visszamaradottság Napi szükséglet felnőttkorban: 0. 15 mg (jódozott só) De: 2 -3 g már halálos méreg • Előfordulás: tengervíz, édesvíz (század mg/dm 3), Na. IO 3 salétrombányákban • Radioaktív jód: 131 I (urán maghasadásakor), felezési ideje 8 nap Illékony, levegőben relatíve nagy koncentráció katasztrófa esetén. Pajzsmirigyben összegyűlik → daganatos betegség. Védekezés: napi 130 mg KI tabletta • Előállítás: Na. IO 3 + 3 Na. HSO 3 = Na. I + 3 Na. HSO 4 Na. IO 3 + 5 Na. I + 3 H 2 O = 3 I 2 + 6 Na. OH • Felhasználás: halogén izzólámpákban W szál párolgásának csökkentésére Ag. I felhőkbe porlasztása: eső indítás 3 %-os alkoholos—vizes oldatát fertőtlenítésre (oxidáló hatása miatt) analitikai laborokban: reagens

Szervetlen kémia Nemesgázok Általános tulajdonságok • Elektronszerkezet: ns 2 np 6 • Egyedüli elemek, amelyek atomos állapotban természetben előfordulnak • A zárt elektronhéj miatt meglehetősen inertek, a magasabb rendszámúak laboratóriumi körülmények között reakcióba vihetők: Xe[Pt. F 6], Xe. F 2, Kr. F 4, Ba. Kr. O 4 • Szilárd halmazállapot: „molekularács” – diszperziós kölcsönhatásokkal • Legelterjedtebb felhasználás: fénycsövek, izzólámpák töltése - kisnyomású nemesgáz (általában keverék) + többnyire kevés Hg vagy fémsó - feszültség hatására elektromos kisülés → ionizálja a gázt - szabaddá váló elektronok gyorsulnak a feszültség hatására, ütköznek a gázfázisban levő atomokkal, ionokkal, ezzel gerjesztik elektronjaikat. A gerjesztett elektronok visszakerülve az alapállapotba UV és látható fotonokat sugároznak ki. Hélium (He) • • H után a leggyakoribb a világegyetemben, s legkönnyebb → léghajók, léggömbök Előállítás: földgáz cseppfolyósításakor gázfázisban marad, uránkőzetek hevítése Hűtőanyag szupravezető mágnesekben, kriogenikában (< -150 ºC) He-Ne lézer különböző műszerekben

Szervetlen kémia Nemesgázok Argon (Ar) • • • Föld légkörének 0. 93 %-át alkotja Előállítás: cseppfolyós levegő frakcionált lepárlásával Védőgáz fémkohászatban, ívhegesztésnél Hőszigetelt üvegben az üveglapok között Élelmiszeriparban csomagológáz Kripton (Kr) • Előállítás: cseppfolyós levegő frakcionált lepárlásával • Izzólámpa töltőgáza (Bródy Imre, TUNGSRAM) Xenon (Xe) • • Elsőként előállított nemesgáz vegyület: Xe[Pt. F 6]. Előállítás: cseppfolyós levegő frakcionált lepárlásával Xeonlámpa töltőgáza (vakuk) Űreszközök ionhajtóművének hajtóanyaga (ionizációs kamrában ionizálják, majd az ionokat elektromos térben felgyorsítva kilövik. Kis, de hosszú ideig egyenletes tolóóerő: bolygóközi utazásra optimális. Radon (Rn) • Radioaktív háttérsugárzás 40 %-a, forrása a kőzetekben levő rádium. Összegyűlik a lakóhelyiségek légterében. Tüdőrák 2. leggyakoribb okozója.

Szervetlen kémia Átmeneti fémek Általános tulajdonságok • • Elektronszerkezet: (n-1)s 2 (n-1)p 6 (n-1)d 1 -10 ns 1 -2 np 0 Szilárd halmazállapotúak, kivéve Hg Fémes tulajdonságok: fémrács, áram- és hővezetés, szürkés szín (kivéve Cu, Au) A nyílt vegyértékhéj miatt (kivétel Zn, Cd) több oxidációs számmal képezhetnek vegyületeket. Vegyületeik általában színesek. Az részben betöltött d-pályák miatt szervetlen ill. szerves ligandumokkal datív kötéssel komplexeket képeznek. vascsoport Vascsoport (triád: Fe, Co, Ni) • Nagyon hasonló tulajdonságokkal rendelkeznek: nagy sűrűség, magas op, mágnesezhetők, legszorosabb illeszkedésű fémrács, könnyen alakíthatók (kis keménység), ötvözhetők, oxidációs szám +2 és +3.

Szervetlen kémia Vas (Fe) Előfordulás • Föld magját alkotja (Ni-el együtt): szilárd belső mag, folyékony külső mag • Vegyületei formájában fordul elő a földkéregben (4. 8 %, 4. leggyakoribb a földkéregben), ill. tiszta állapotban a Földre került meteoritokban. Pirit (Fe. S 2) Hematit (Fe 2 O 3) Kalkopirit (Cu. Fe. S 2) Magnetit (Fe 3 O 4) Sziderit (Fe. CO 3) Limonit (Fe 2 O 3. 1. 5 H 2 O)

Szervetlen kémia Fizikai tulajdonságok: • Olvadáspont: 1538 ºC. Lehűtve térben középpontos kockarács: d-vas (0. 293 nm élhossz. ) 1394 -912 ºC: g-vas – lapon középpontos kockarács (0. 368 nm élhossz) – kisebb sűrűség 912 ºC alatt: a-vas – térben középpontos kockarács (0. 290 nm élhossz) 770 ºC: mágnesezhetőség határa Kémiai tulajdonságok: • Elektronegativitása: 1. 8, általában ionos vegyületeke képez +2 és +3 oxidációs számmal • Fe 2+ vegyületek: zöld szín, többségük nem stabil, levegőn lassan oxidálódnak Fe 3+ formává emiatt redukáló tulajdonságú • Fe 3+ vegyületek: sárga-vörös, természetben ez fordul elő • Oxigénnel reagál: 4 Fe + 3 O 2 = 2 Fe 2 O 3 • Halogénekkel: Fe. F 3, Fe. Cl 3, Fe. Br 3, Fe. I 2 (jód oxidáló hatása a legkisebb, Fe. I 3 instabil) • Kénnel: Fe. S (kén is gyenge oxidálószer) • Vízzel nem reagál, csak ha van benne oldott O 2 → rozsda Fe. O(OH) ill. Fe(OH)3. Fe 2 O 3 • Híg savak H 2 fejlődés közben oldják • Tömény savak (HNO 3, H 2 SO 4, H 3 PO 4) passzív védőréteget képeznek a felületen.

Szervetlen kémia Nyersvasgyártás: redukció • Fe 2 O 3/Fe 3 O 4 Fe • vasérc megfelelő méretre aprítása • tüzelő/redukáló anyag: koksz v. szénhidrogén - reakcióhoz, olvadáshoz szükséges hő - redukálószer, ill. redukáló CO képződik - adja a vasak széntartalmát - kb. 1 % kén: el kell távolítani • salakképző (mészkő, dolomit) hozzákeverése: kén eltávolítása Ca. S-ként (minőséget ront) • levegő (égéshez): fúvószél; forrószél= égéstermékekkel 1100 -1300 ºC-ra felmelegítik Direkt redukció: • Fe 2 O 3 + 3 C = 2 Fe + • Fe 3 O 4 + 4 C = 3 Fe + • Fe. O + C = Fe + endoterm, hőt fogyaszt, A nagyolvasztó részei: 1 – meleg levegő befúvás; 2 – olvasztó zóna; 3 CO 3 – redukáló zóna 1; 4 – redukáló zóna 2; 4 CO 5 – előmelegítő zóna; 6 – elegy adagoló; CO 7 – torokgáz; 8 – elegyoszlop; 9 – salak és több tüzelőanyag kell salakcsapoló nyílás; 10 – medence és a nyersvas csapolónyílása; 11 – távozó kohógáz.

Szervetlen kémia Nyersvasgyártás: Indirekt redukció: • • 3 Fe 2 O 3 + CO = 2 Fe 3 O 4 + CO 2 Fe 3 O 4 + CO = 3 Fe. O + CO 2 Fe 3 O 4 + 4 CO = 3 Fe + 4 CO 2 Fe. O + CO = Fe + CO 2 exoterm reakciók, kevesebb tüzelőanyag kell. CO keletkezése: C + CO 2 C + (CO O 2 = CO 2 + C = 2 CO H 2 O = CO + H 2 O = CO 2 + H 2) H 2 is képes redukálni: • • • 3 Fe 2 O 3 + H 2 = 2 Fe 3 O 4 + H 2 O Fe 2 O 3 + 3 H 2 = 2 Fe + 3 H 2 O Fe 3 O 4 + H 2 = 3 Fe. O + H 2 O Fe 3 O 4 + 4 H 2 = 3 Fe + 4 H 2 O Fe. O + H 2 = Fe + H 2 O magasabb hőmérsékleten redukál mint a CO, de gyorsabban Nyersvas tulajdonságai: • 3 -5 % szén + kisebb mennyiségben egyéb elemek (1. 5 -4 % Mn, 0. 5 -1 % Si, kevés P, S • képlékenyen nem alakítható a magas széntartalom miatt Öntöttvas tulajdonságai: • 2 -3. 6 % szén + Si, Mn, P, S • nyersvasból ócskavas hozzáadásával, olvasztással gyártják • könnyen megmunkálható, korrózióálló, rezgéscsill. (szerszámgépállvány) • rideg, könnyen törik, acélnál kisebb szilárdságú C

Szervetlen kémia Acél: • Széntartalom max. 2. 11 % • Könnyen megmunkálható (kovácsolás, hengerlés) • Acélgyártás: oxidációval a széntartalom lecsökkentése, ötvözetkészítés: keménység, rugalmasság, hajlékonyság, szilárdság, hőállóság, savállóság, korróziómentesség - olvadt nyersvasba nagy nyomással oxigént fúvatnak (30 perc) régebben Siemens-Martin eljárás: rozsdás ócskavassal olvasztották (O rozsdából – 6 -8 óra) - ötvöző anyag oldása az olvadékban: lehűlve szilárd oldat • Ezután hőkezeléssel mechanikai tulajdonságok módosíthatók - lágyítás: belső feszültség megszüntetése; pár fokkal 727 ºC alá melegítik, lassan lehűtik - edzés: keménység növelése; hevítés kb. 1300 ºC-ra, egy ideig ott tartják, majd gyorsan lehűtik. Ezzel befagyasztják az 1300 ºC-on levő kristályszerkezetet – de belső feszültségek keletkeznek. Megeresztés: ugyanez kb. 100 -700 ºC-on; feszültség csökken, keménység is. - kérgesítés: kemény kopásálló külső réteg; felületi edzéssel vagy ötvözéssel Ötvözetek: • Helyettesítés (szubsztitúció): atomok hasonló méretűek, azonos rácsban kristályosodnak. • Beékelődéses (interszticiós): ötvözőfém atomjai kisebbek helyettesítés beékelődés

Szervetlen kémia Vas nem ötvöződik: nemesgázokkal, halogénekkel, s-mező elemeivel, higannyal, kadmiummal, ezüsttel. Nehezen elegyíthető bizmuttal, ólommal, cinkkel. Fontosabb ötvözők: • C 0. 6 % alatt = szerkezeti acélok: szilárdság, szívósság, ellenállás lökésszerű igénybevétellel szemben C 0. 6 % felett = szerszámacélok: keménység, kopásállóság • Ni, Mn: szilárdságot növelik, magas hőmérsékleten is (hőálló acél) • Vanádium (V): keménységet, kifáradással szembeni ellenállást növeli • Cr, Ni: rozsdamentessé, savállóvá teszi • Cr, Al, Si: magas hőmérsékleten is korrózióálló (Fe. Cr 2 O 4 réteg van a felületen) • W: nagyon kemény un. gyorsacélok (forgácsolószerszámokhoz) • Bór (B, ezred %): acél edzhetőségét növeli • Nióbium (Nb, század %): acél rugalmasságát növeli • N, S, P: káros ötvözőanyagok, acélt törékennyé teszik

Szervetlen kémia Réz(Cu): • • • színesfém, vörös színű (vörösréz) vegyértékhéj: 4 s 1 3 d 10 vegyületeiben többnyire +2, esetenként +1 oxidációs számú Kémiai aktivitása kicsi: híg savakban nem, oxidáló savakban oldódik Nedves levegőn bázisos réz-karbonát (Cu. CO 3) = patina képződik, mely védi a további korróziótól • Ötvözetek: - sárgaréz (Cu + Zn). Hamis arany 80 % réz. - bronz (Cu + Sn): disztárgyak, szobrok, harang - újezüst=alpakka (Cu + Ni): pénz, evőkészlet • Felhasználás (fentieken felül): - elektromos vezeték - Cu. SO 4. 5 H 2 O (rézgálic): permetezőszer Cink (Zn): Minneapolis városháza (Cu tető) • Vegyértékhéj: 4 s 2 3 d 10 → +2 oxidációs szám vegyületeiben • Felhasználás: korrózióvédelem (horganyzott bádog), galvánelem, ötvözetek

Szervetlen kémia Ezüst: • Természetben elemi állapotban (ritka) és ércásványokban (többnyire szulfidok) • Vegyértékhéj: 5 s 1 4 d 10 → oxidációs száma +1 • Klasszikus előállítás: Ag 2 S + 2 Na. Cl = 2 Ag. Cl + Na 2 S • • 2 Ag. Cl + 2 Hg = 2(Ag. Hg)Cl hevítés 2 Ag + Hg 2 Cl 2 Oxidáló savak (salétromsav, tömény kénsav) oldják Levegőn oxigénnel nem reagál, csak H 2 S-el → fekete Ag. S a felületen Hővezető és fényvisszaverő képessége a fémek között a legjobb → tükör Felhasználás: ékszerek, étkészletek, egészségügyi műszerek, fertőtlenítő hatás gyógyászat elektronikai ipar: nyomtatott áramkörök, kapcsolók, Ag-Zn, Ag-Cd gombelemek

Szervetlen kémia Arany: • • Természetben elemi állapotban és ércásvány formájában is előfordul Vegyértékhéj: 6 s 1 5 d 10 → oxidációs száma +1 és +3 Híg/tömény savak nem oldják. Oldja: királyvíz, folyékony Br, Cl, Hg, alkáli-cianid olvadék Előállítás: meddő kőzetekből cianidokkal való kioldással lúgos közegben: 4 Au + 8 Na. CN + O 2 +2 H 2 O = 4 Na[Au(CN)2] + 4 Na. OH 2 Na[Au(CN)2] + Zn = Na 2[Zn(CN)4] + 2 Au • Nem korrodeálódik: ékszer alapanyag és fizetőeszköz (volt) • Ipari felhasználás: elektromos kontaktus, aranyfüsttel bevont egyirányban átlátszó ablakok Higany: • • • Cseppfolyós, könnyen párolog (mérgező gőzök) Természetben ércásvány formájában fordul elő (Hg. S, vulkáni tevékenység helyein) Vegyértékhéj: 6 s 2 5 d 10 → oxidációs száma +1 és +2 Fémeket hidegen oldja: amalgám ötvözetek Felhasználás: hőmérő, barométer, higanygőzlámpa Ag-, Zn-amalgámok: fogtömés • Hg 2 Cl 2: lineáris molekula Cl-Hg-Hg-Cl elektrokémiában referenciaelektród