TERMOCHIMICA Studia essenzialmente le trasformazioni dellenergia durante una














- Slides: 23

TERMOCHIMICA Studia essenzialmente le trasformazioni dell’energia durante una reazione chimica e consente altresì di prevederne lo svolgimento. Tali previsioni possono essere fatte mediante misurazione di proprietà macroscopiche della reazione in studio quali ad esempio temperatura, pressione, concentrazione, natura dei reagenti e prodotti ecc. , prescindendo quindi dalla conoscenza microscopica e dettagliata dei processi in esame. La termodinamica però non fornisce alcuna indicazione riguardo la velocità con la quale una data trasformazione può procedere. Argomenti trattati sono: Scambio di energia nelle reazioni chimiche Misura del calore di reazione Energia Interna Entalpia, Legge di Hess, Entalpia standard di formazione, Energia di legame ed entalpia di rezione Entropia Variazione di energia libera e Spontaneità di un processo.

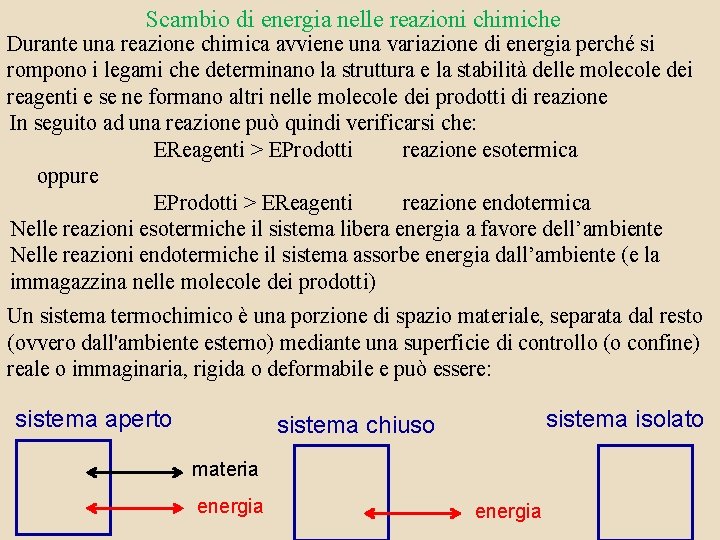
Scambio di energia nelle reazioni chimiche Durante una reazione chimica avviene una variazione di energia perché si rompono i legami che determinano la struttura e la stabilità delle molecole dei reagenti e se ne formano altri nelle molecole dei prodotti di reazione In seguito ad una reazione può quindi verificarsi che: EReagenti > EProdotti reazione esotermica oppure EProdotti > EReagenti reazione endotermica Nelle reazioni esotermiche il sistema libera energia a favore dell’ambiente Nelle reazioni endotermiche il sistema assorbe energia dall’ambiente (e la immagazzina nelle molecole dei prodotti) Un sistema termochimico è una porzione di spazio materiale, separata dal resto (ovvero dall'ambiente esterno) mediante una superficie di controllo (o confine) reale o immaginaria, rigida o deformabile e può essere: sistema aperto sistema isolato sistema chiuso materia energia

Calore di reazione Le reazioni chimiche liberano o assorbono calore. Q è la quantità di calore scambiata dalla reazione stessa H 2 (g) + 1/2 O 2 (g) H 2 O(l) + Q CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(1) + Q Se facciamo reagire 10 moli di H 2 saranno richieste 5 moli di O 2; si formeranno 10 moli di acqua e si libererà una quantità di calore pari a 10 volte Q. Il calore può essere visto come uno dei prodotti (o reagenti) di certe reazioni chimiche. Misura del calore di reazione l'unità di misura energia nel S. I. è il joule (j): l J =1 kg m 2/s 2 Una unità di misura largamente utilizzata in chimica è la caloria (cal): quantità di energia necessaria per aumentare di l°C la temperatura di 1 g di acqua. 1 cal = 4. 184 j

Misura del calore scambiato Se forniamo calore ad un corpo si ha un aumento di temperatura q = C x T La costante di proporzionalità C è la capacità termica; 1 g di acqua ha una capacità termica di 1 cal/°C o 4, 18 J/°K g capacità termica specifica c (spesso indicata anche come «calore specifico» ): capacità termica per grammo o per mole di sostanza.

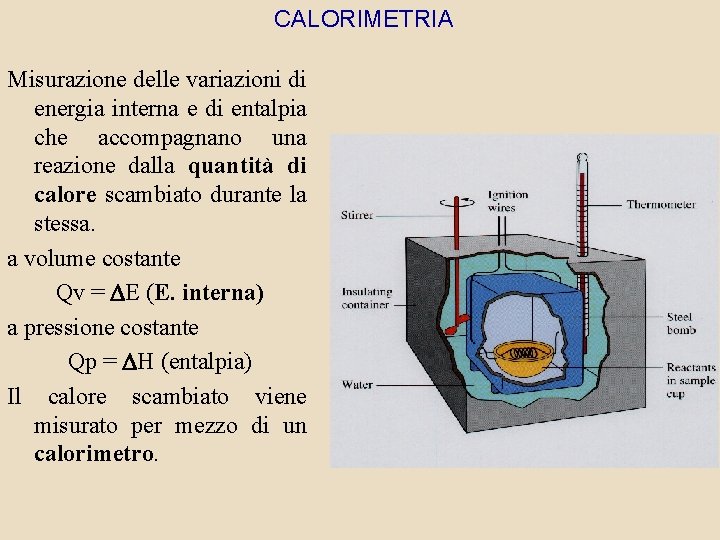
CALORIMETRIA Misurazione delle variazioni di energia interna e di entalpia che accompagnano una reazione dalla quantità di calore scambiato durante la stessa. a volume costante Qv = E (E. interna) a pressione costante Qp = H (entalpia) Il calore scambiato viene misurato per mezzo di un calorimetro.

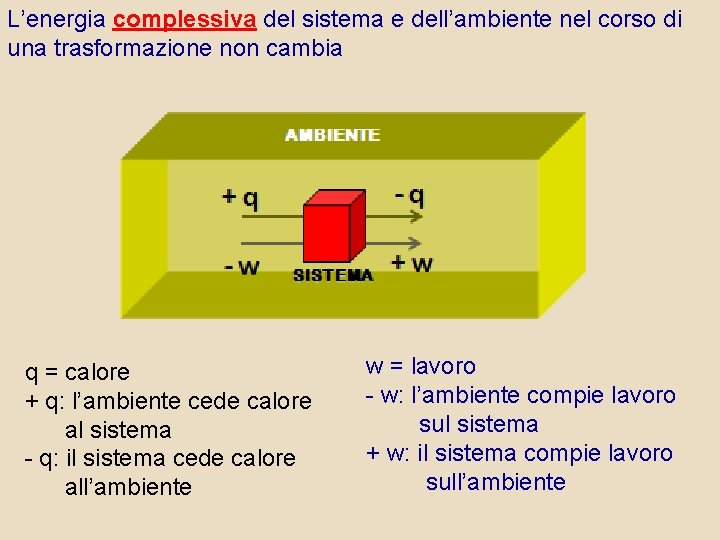
L’energia complessiva del sistema e dell’ambiente nel corso di una trasformazione non cambia q = calore + q: l’ambiente cede calore al sistema - q: il sistema cede calore all’ambiente w = lavoro - w: l’ambiente compie lavoro sul sistema + w: il sistema compie lavoro sull’ambiente

Scambi di Energia Un sistema può scambiare energia con l’esterno mediante scambio lavoro e/o di calore. se l'energia contenuta nelle molecole dei prodotti è > di quella dei reagenti occorre fornire energia: es. della fotosintesi per la biosintesi di glucosio, (C 6 H 12 O 6) a partire da biossido di carbonio e acqua: 6 CO 2(g) + 6 H 2 O(1) + energia C 6 H 12 O 6(s) + 6 O 2(g) se l'energia delle molecole dei prodotti è < a quella dei reagenti la differenza di energia viene liberata nell'ambiente. es. combustione. C 6 H 12 O 6(s) + 6 O 2(g) 6 CO 2(g) + 6 H 2 O(1) + energia L’energia posseduta dalle particelle presenti in un campione è nota come energia interna E (o anche U) legge di conservazione dell'energia: l'energia non può essere creata né distrutta

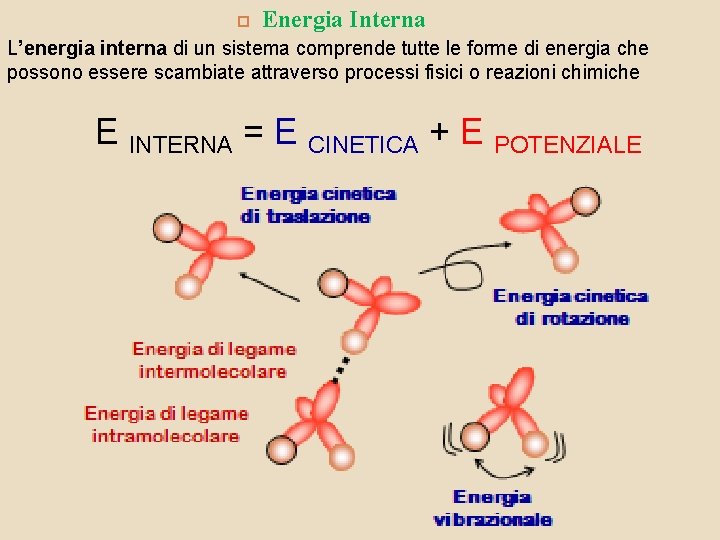
Energia Interna L’energia interna di un sistema comprende tutte le forme di energia che possono essere scambiate attraverso processi fisici o reazioni chimiche E INTERNA = E CINETICA + E POTENZIALE

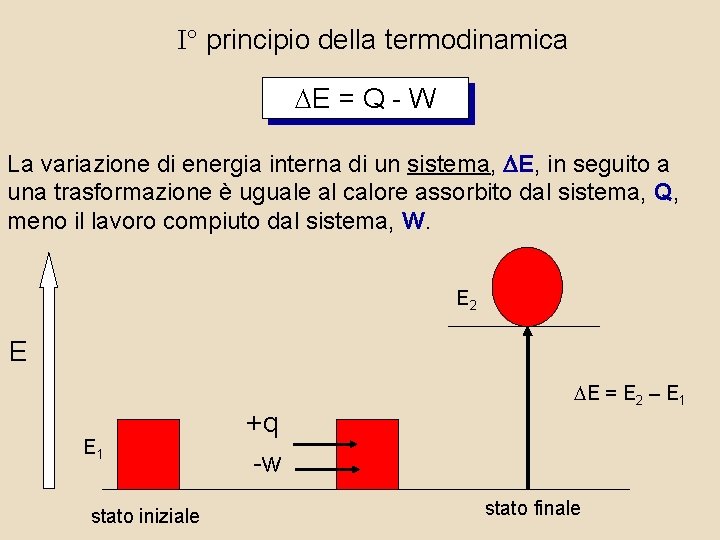
I° principio della termodinamica DE = Q - W La variazione di energia interna di un sistema, E, in seguito a una trasformazione è uguale al calore assorbito dal sistema, Q, meno il lavoro compiuto dal sistema, W. E 2 E E 1 stato iniziale +q -w DE = E 2 – E 1 stato finale

Entalpia Dal primo principio della termodinamica, si è visto che la variazione di energia interna di un sistema termodinamico, può essere calcolata con la seguente formula: ∆E = Q - L Nel caso di trasformazioni fatte avvenire a pressione la variazione di energia del sistema corrisponde al calore scambiato in quanto il lavoro meccanico prodotto è trascurabile e viene definita Entalpia. Per un processo endotermico DH > 0 Per un processo esotermico DH < 0 DH = Q A pressione costante l’entalpia corrisponde al calore di reazione (relazione importante poiché nei sistemi biologici la maggior parte delle reazioni biochimiche avvengono a pressione costante) Esempio: Data una reazione REAGENTI PRODOTTI il calore scambiato sarà: Se DH < 0 la reazione è esotermica Se DH > 0 la reazione è endotermica DH = HPRODOTTI - HREAGENTI

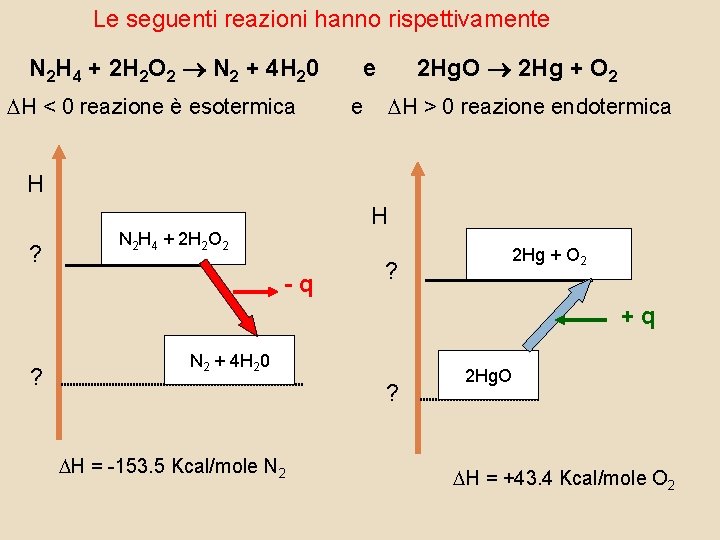
Le seguenti reazioni hanno rispettivamente N 2 H 4 + 2 H 2 O 2 N 2 + 4 H 20 2 Hg. O 2 Hg + O 2 e DH < 0 reazione è esotermica e DH > 0 reazione endotermica H ? H N 2 H 4 + 2 H 2 O 2 -q 2 Hg + O 2 ? +q ? N 2 + 4 H 20 ? DH = -153. 5 Kcal/mole N 2 2 Hg. O DH = +43. 4 Kcal/mole O 2

Entalpia delle trasformazioni chimiche quando 1 mol di CH 4 (16 g) brucia all'aria vengono liberati 890 kj di calore; cioe’ la reazione: CH 4(g) + 202(g) C 02(g) + 2 H 20 si accompagna a una diminuzione totale di entalpia del sistema (la miscela di reazione) pari a 890 kj per ogni mole di molecole di CH 4 Questa diminuzione di entalpia rappresenta l'entalpia di reazione, CH 4(g) + 202(g) C 02(g) + 2 H 20 DH = - 890 kj Per 2 mol di metano la variazione di entalpia e’ il doppio: 2 CH 4(g) + 402(g) 2 C 02(g) + 4 H 20 DH = - 1780 kj

Entalpie di formazione l'entalpia standard di formazione di un composto corrisponde all'entalpia standard per mole di unità formula della reazione di sintesi di quel composto a partire dai suoi elementi costitutivi nella loro forma più stabile alla temperatura di 25°C e alla pressione di 1 atm. 2 H 2(g)+O 2(g) 2 H 2 O(1) DH° = - 571, 6 kj DH° = - 285, 8 kj/mol H 20

Leggi di Hess Per calcolare l'entalpia di formazione di un composto, si calcolano le entalpie di reazione di tutti i passaggi con cui è possibile ottenerlo e si sommano. Calcola DH di 2 C(s) +2 O 2(g) 2 CO 2(g) Dato che la reazione avviene in due fasi 1) 2 C(s) + O 2(g) 2 CO(g) DH°=- 221 kj 2) 2 CO (g) + O 2(g) 566 kj 2 CO 2(g) 2 C(s) +2 O 2(g) 2 CO 2(g) DH°=- DHx = - 221, 0 kj + (- 566, 0 kj) = - 787, 0 kj

ENTROPIA E’ l’indicatore del «disordine» di un sistema ovvero il numero di modi in cui è possibile disporre atomi o molecole in un dato stato tenendo conto dell’energia totale. Rappresenta Il livello di dispersione dell’energia, cioè il disordine del sistema, può essere espresso per mezzo di una grandezza chiamata entropia, che indichiamo con S e misuriamo in J/K. La variazione di entropia ΔS° corrisponde alla differenza tra l’entropia dei prodotti e quella dei reagenti. ΔS° = S°prodotti – S°reagenti In generale, una qualsiasi trasformazione chimica o fisica spontanea è caratterizzata da ΔSuniverso > 0 Quando nell’universo si ha un evento spontaneo, è sempre accompagnato da un aumento di entropia. L’entropia dell’universo è in costante aumento. Questo è il secondo principio della termodinamica. Infatti un qualsiasi sistema chiuso tende a raggiungere la max. entropia, ossia la massima quantità di energia non utilizzabile e non disponibile.

Secondo principio della termodinamica Affichè una reazione chimica avvenga occorre considerare oltre alle variazioni di temperatura di un sistema anche la variazione dello stato di disordine cioè dell’ entropia : S) Le reazioni spontanee avvengono quando si verifica una diminuzione di entalpia (esotermicità), ed un aumento di entropia (disordine del sistema) L’entropia rappresenta quella parte di energia non più utilizzabile. esempio si prenda un tizzone di carbone ardente, durante la combustione rilascia calore ed emissioni di carbonio. Una parte del calore viene convertito in energia lavoro (es. turbine mosse dal vapore) un'altra parte del calore viene però dispersa nell'ambiente senza essere più recuperabile. Allo stesso modo l'energia presente nelle emissioni carbonio si identifica come un'energia non disponibile. In breve, durante ogni conversione di energia se ne perde per sempre una parte in modo non reversibile. L’entropia, quindi, è la misura di questa energia dispersa che si distribuisce su tutte le particelle uniformandone il contenuto energetico. Dato che il calore passa sempre da un corpo caldo ad uno più freddo, e il processo è irreversibile e continua fino a quando i due corpi non raggiungono la stessa temperatura. A quel punto viene raggiunta una condizione omeostatica, cioè nessun trasferimento di energia è più possibile ( «morte termica» ).

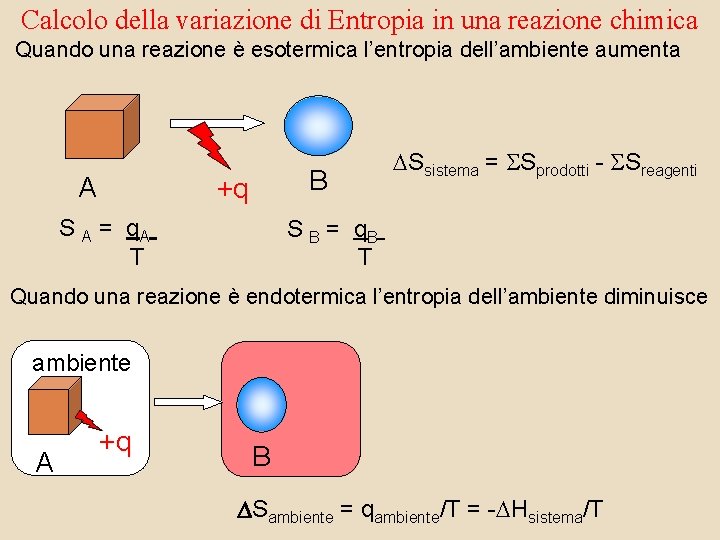
Calcolo della variazione di Entropia in una reazione chimica Quando una reazione è esotermica l’entropia dell’ambiente aumenta A B +q S A = q. A T DSsistema = SSprodotti - SSreagenti S B = q. B T Quando una reazione è endotermica l’entropia dell’ambiente diminuisce ambiente A +q B Sambiente = qambiente/T = -DHsistema/T

Energia libera di Gibbs L’energia libera: il «motore» delle reazioni chimiche Per valutare se una reazione avviene spontaneamente dobbiamo tenere conto d’eltalpia, dell’entropia e anche della temperatura, tutte combinate nella relazione: ΔG = ΔH - T ΔS che dà appunto la variazione di energia libera da cui dipende la spontaneità o meno di una reazione Analizziamo i casi possibili Se ΔH <0 (aspetto entalpico favorevole) ΔS> 0 (aspetto entropico favorevole) ΔG non può che essere negativo. Se ΔH <0 (aspetto entalpico favorevole) ΔS <0 (aspetto entropico sfavorevole) ΔG ha un segno che dipende dai valori reciproci. Il fattore che decide tutto è la temperatura che moltiplica il fattore entropico. In altre parole, una reazione che avvenga con liberazione di calore e aumento del disordine è sempre spontanea, indipendentemente dalla temperatura. C 3 H 8(g) + 5 O 2(g) 3 CO 2(g) + 4 H 2 O(g)

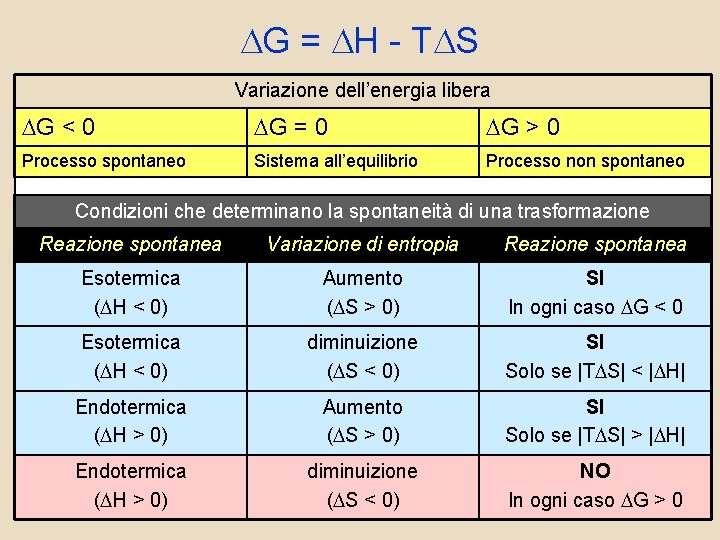
DG = DH - TDS Variazione dell’energia libera DG < 0 DG = 0 DG > 0 Processo spontaneo Sistema all’equilibrio Processo non spontaneo Condizioni che determinano la spontaneità di una trasformazione Reazione spontanea Variazione di entropia Reazione spontanea Esotermica (DH < 0) Aumento (DS > 0) SI In ogni caso DG < 0 Esotermica (DH < 0) diminuizione (DS < 0) SI Solo se |TDS| < |DH| Endotermica (DH > 0) Aumento (DS > 0) SI Solo se |TDS| > |DH| Endotermica (DH > 0) diminuizione (DS < 0) NO In ogni caso DG > 0

Esempi Fermentazione del glucosio ad etanolo C 6 H 12 O 2(s) 2 C 2 H 5 OH(l) + 2 CO 2(g) H = - 82 -T S = - 136 G = - 218 Combustione dell’etanolo -T S = + 82 C 2 H 5 OH(l) + 3 O 2(g) 2 CO 2(g) + 3 H 2 O(l) H = - 1376 Decomposizione del pentossido d’azoto N 2 O 5(s) 2 NO 2(g) + 1/2 O 2(g) G = - 1326 H = + 110 G = - 30 -T S = - 140

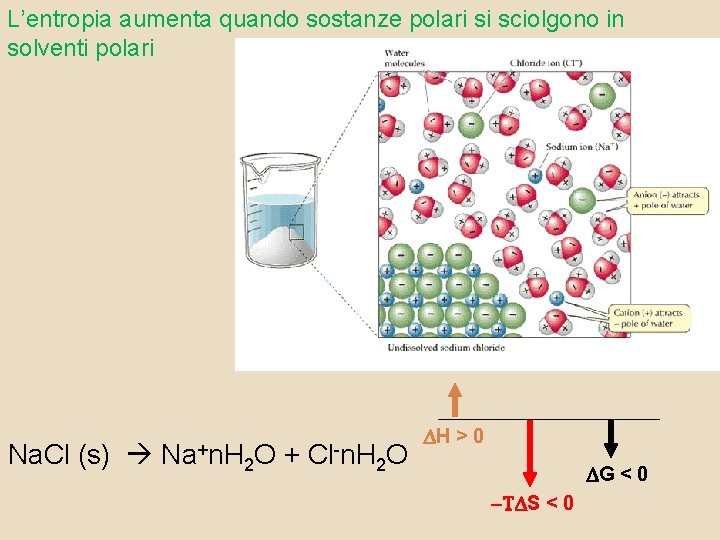
L’entropia aumenta quando sostanze polari si sciolgono in solventi polari Na. Cl (s) Na+n. H 2 O + Cl-n. H 2 O H > 0 G < 0 -T S < 0

Sintesi Il 1° principio non è in grado di escludere il passaggio di calore da un corpo più freddo ad uno più caldo; richiede soltanto che le quantità di calore scambiate siano uguali. Il 2° principio ci fornisce un criterio per identificare la direzione nella quale ha luogo una trasformazione fisica o chimica. Esso ci dice che i fenomeni naturali tendono ad evolvere verso lo stato di massimo disordine. Il disordine di un sistema è misurato con una funzione di stato detta Entropia; si indica con la lettera S ed ha come unità di misura J/°K. mol. Entropi a Esprime la tendenza di sistemi chiusi e termicamente isolati ad evolvere verso equilibrio termodinamico. È definita matematicamente e può essere calcolata d. Q/T È un indice della: Reversibilità di una reazione Disordine microscopico di un sistema Probabilità di esistenza in un determinato stato

3° Principio della termodinamica Il 3° principio ci dice che l’Entropia di una sostanza allo stato cristallino, allo zero assoluto è zero (il disordine è nullo essendo perfettamente definite le posizioni dei costituenti). L’Entropia di una reazione chimica può essere calcolata come differenza tra l’entropia dei prodotti e quella dei reagenti. Energia libera di Gibbs Il 1 e 2° principio stabiliscono 2 tendenze della natura: a) tendenza ad assumere un valore minimo dell’energia interna E b) tendenza ad assumere la conformazione di massimo disordine e cioè il massimo valore di Entropia S Queste due tendenze, accoppiate con la temperatura del sistema, permettono di definire una nuova funzione di stato capace di indicarci in quale direzione evolverà il sistema: . Energia libera di Gibbs (G) G= H -TS Durante una reazione G = H – T S Se DG negativo la reazione chimica è esoergonica (ci dà lavoro utile); Se DG positivo la reazione chimica è endoergonica. Se DG = 0 il sistema è all’equilibrio La variazione di energia libera per la reazione di formazione si chiama DG°f. I suoi valori sono tabellati per un grande numero di composti.
 Equazione termochimica
Equazione termochimica Riscaldamenti termochimica
Riscaldamenti termochimica En una clinica infantil se ha ido anotando
En una clinica infantil se ha ido anotando Uda l'energia e le sue trasformazioni
Uda l'energia e le sue trasformazioni Affinità trasformazioni geometriche
Affinità trasformazioni geometriche Grafico trasformazione ciclica
Grafico trasformazione ciclica Trasformazioni grafici esercizi
Trasformazioni grafici esercizi Trasformazioni grafici esercizi
Trasformazioni grafici esercizi Definizione isometria
Definizione isometria Trasformazioni termodinamiche
Trasformazioni termodinamiche Entropia
Entropia Otto von diesel
Otto von diesel Dalle trasformazioni chimiche alla teoria atomica
Dalle trasformazioni chimiche alla teoria atomica Dalla materia all'atomo soluzioni capitolo 3
Dalla materia all'atomo soluzioni capitolo 3 Trasformazioni fisiche e chimiche zanichelli
Trasformazioni fisiche e chimiche zanichelli Trasformazione di lorentz
Trasformazione di lorentz Intervallo invariante
Intervallo invariante Equazioni di lorentz
Equazioni di lorentz Trasformazioni lorentz
Trasformazioni lorentz Trasformazioni omogenee
Trasformazioni omogenee Zielarstwo i fitoterapia bydgoszcz
Zielarstwo i fitoterapia bydgoszcz Che cosa studia la tassonomia
Che cosa studia la tassonomia Ochrona danych osobowych studia podyplomowe
Ochrona danych osobowych studia podyplomowe Polonistyczno-filozoficzne studia nauczycielskie
Polonistyczno-filozoficzne studia nauczycielskie