LA TERMODINAMICA Che cos Parte della fisica che































- Slides: 62

LA TERMODINAMICA Che cos’è? Parte della fisica che studia i processi macroscopici implicanti scambi e conversioni di calore; lo studio termodinamico, puramente fenomenologico, descrive i sistemi fisici con un numero limitato di parametri, misurabili macroscopicamente e tra i quali sussistono relazioni determinabili sperimentalmente. Alla base della t. è l’equivalenza fra calore e lavoro.

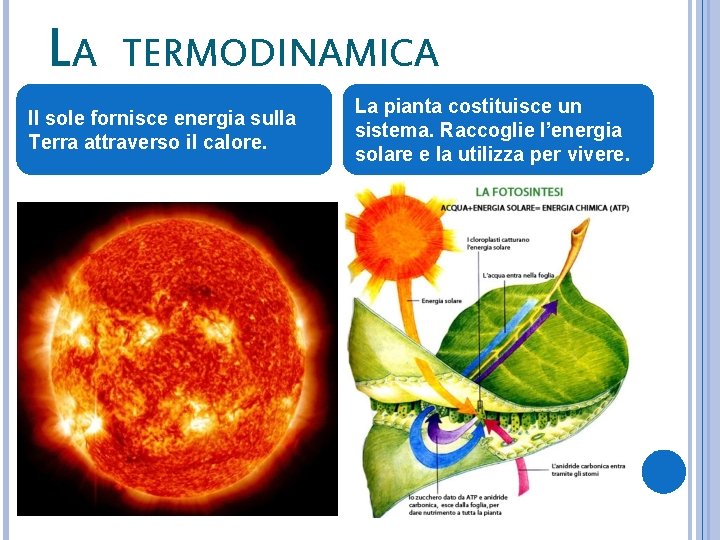
LA TERMODINAMICA Il sole fornisce energia sulla Terra attraverso il calore. La pianta costituisce un sistema. Raccoglie l’energia solare e la utilizza per vivere.

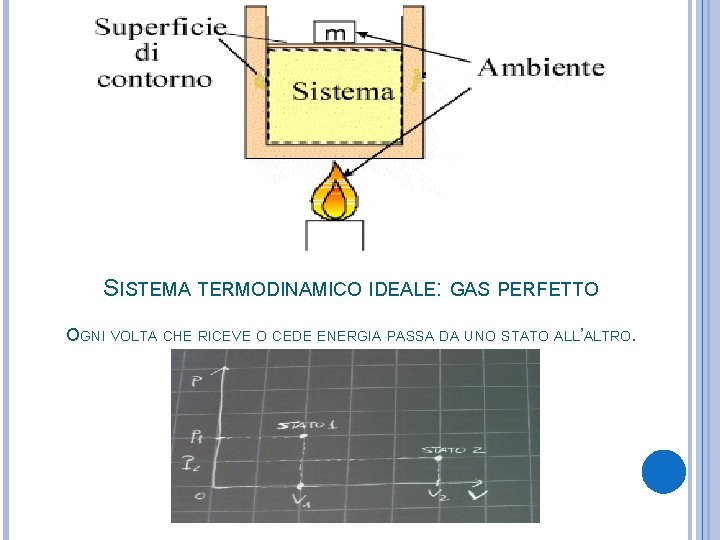
SISTEMA TERMODINAMICO IDEALE: GAS PERFETTO OGNI VOLTA CHE RICEVE O CEDE ENERGIA PASSA DA UNO STATO ALL’ALTRO.


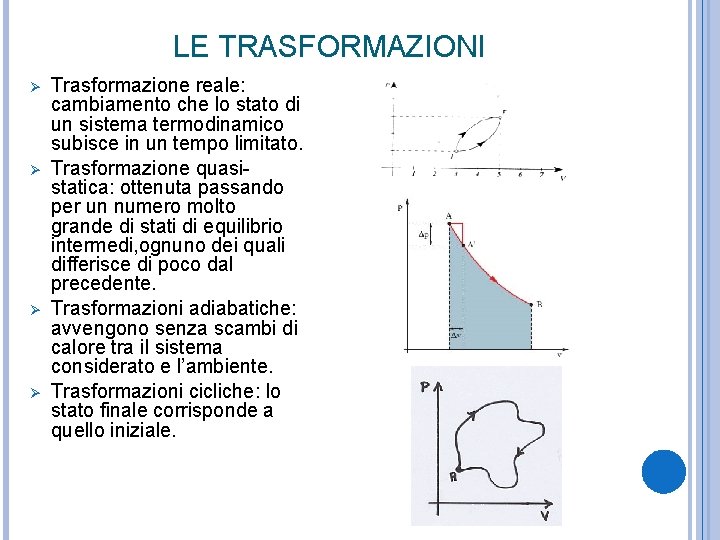
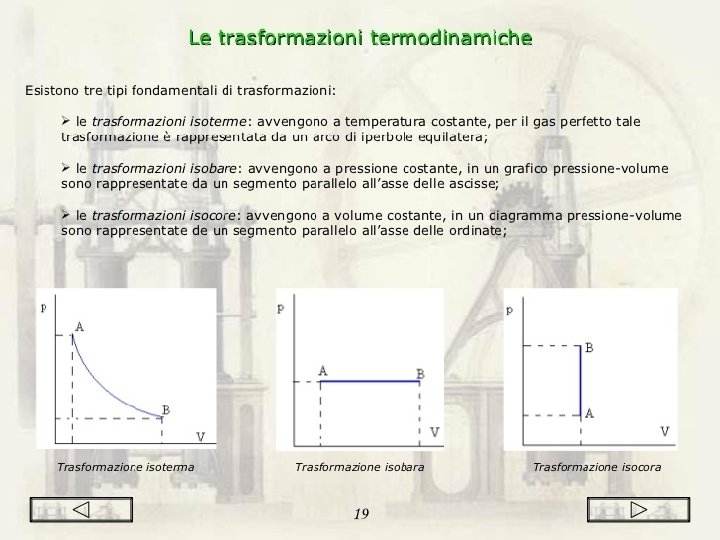
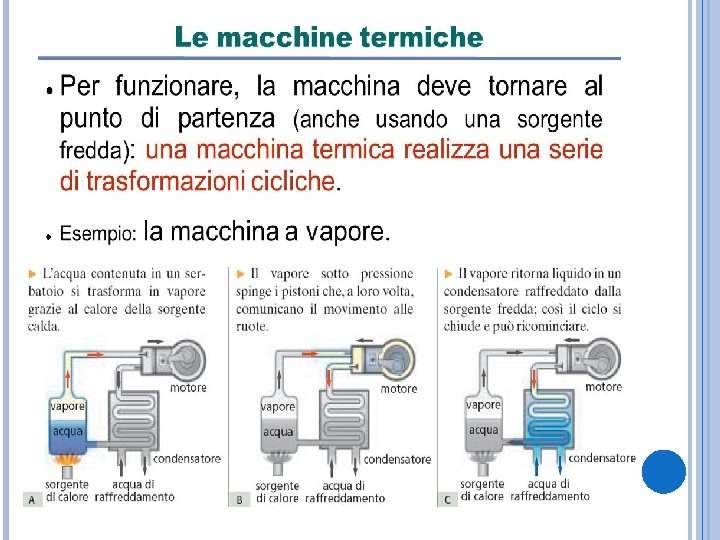
LE TRASFORMAZIONI Ø Ø Trasformazione reale: cambiamento che lo stato di un sistema termodinamico subisce in un tempo limitato. Trasformazione quasistatica: ottenuta passando per un numero molto grande di stati di equilibrio intermedi, ognuno dei quali differisce di poco dal precedente. Trasformazioni adiabatiche: avvengono senza scambi di calore tra il sistema considerato e l’ambiente. Trasformazioni cicliche: lo stato finale corrisponde a quello iniziale.


I PRINCIPI DELLA TERMODINAMICA Ø Principio zero: se i corpi A e B sono entrambi in equilibrio termico con un terzo corpo C, allora lo sono anche fra loro. Questo principio, in sostanza, dichiara che due sistemi in equilibrio termico sono detti avere la stessa temperatura Con equilibrio termodinamico si intende un fluido le cui variabili termodinamiche lo descrivono (pressione, volume ecc. ) hanno lo stesso valore in tutti i suoi punti e non variano nel tempo. Affinché ci sia equilibrio termodinamico devono essere verificate 4 condizioni: -Equilibrio termico -Equilibrio meccanico -Equilibrio chimico -Equilibrio nucleare.


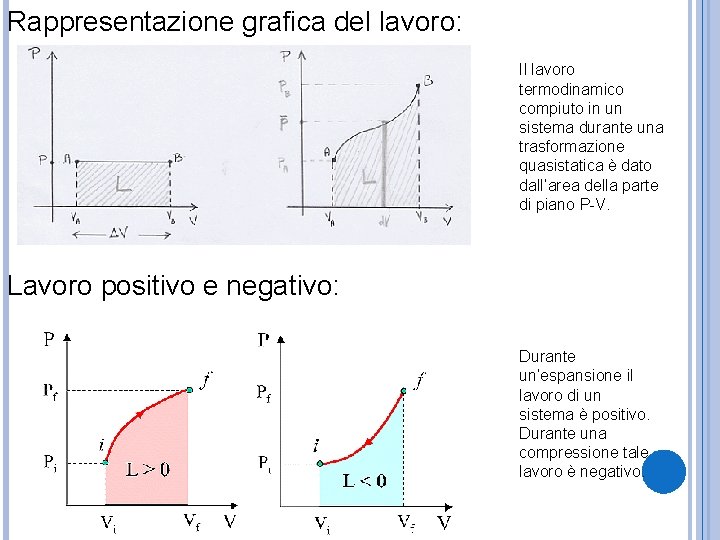
Rappresentazione grafica del lavoro: Il lavoro termodinamico compiuto in un sistema durante una trasformazione quasistatica è dato dall’area della parte di piano P-V. Lavoro positivo e negativo: Durante un’espansione il lavoro di un sistema è positivo. Durante una compressione tale lavoro è negativo.

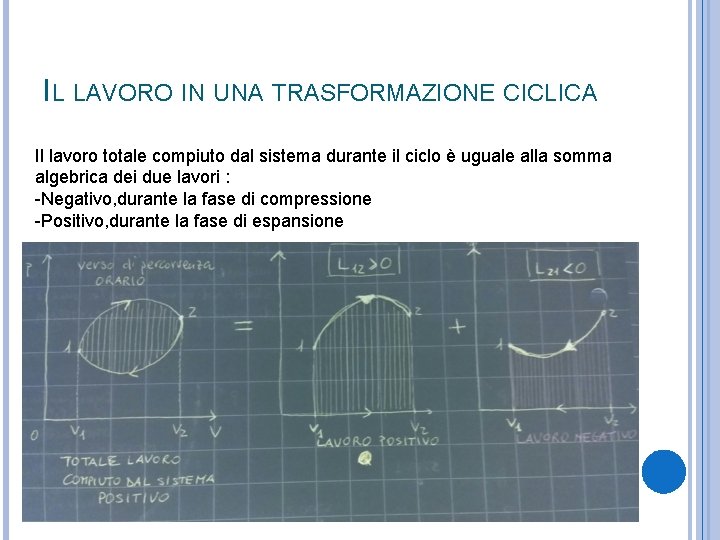
IL LAVORO IN UNA TRASFORMAZIONE CICLICA Il lavoro totale compiuto dal sistema durante il ciclo è uguale alla somma algebrica dei due lavori : -Negativo, durante la fase di compressione -Positivo, durante la fase di espansione

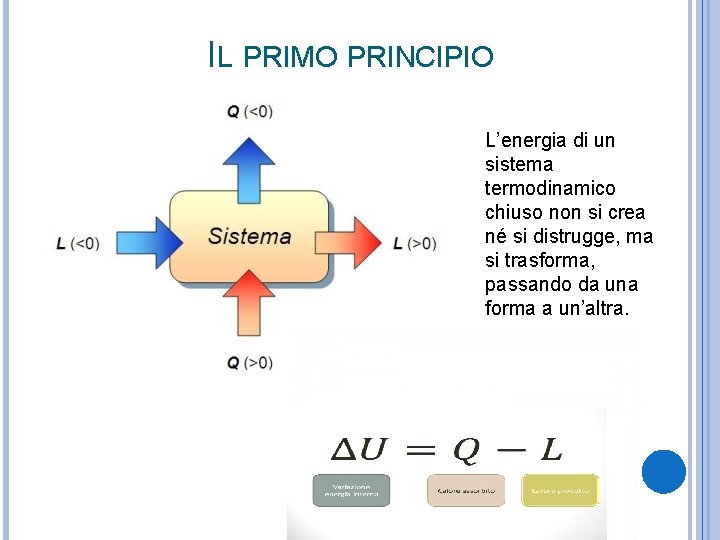
IL PRIMO PRINCIPIO L’energia di un sistema termodinamico chiuso non si crea né si distrugge, ma si trasforma, passando da una forma a un’altra.

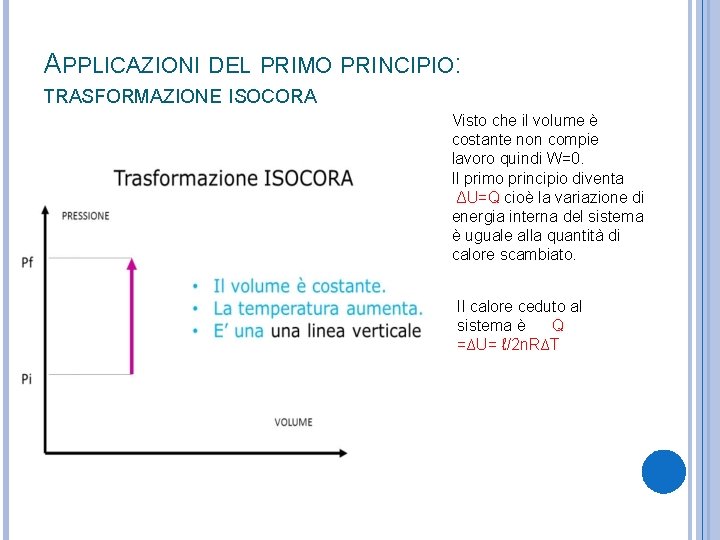
APPLICAZIONI DEL PRIMO PRINCIPIO: TRASFORMAZIONE ISOCORA Visto che il volume è costante non compie lavoro quindi W=0. Il primo principio diventa ΔU=Q cioè la variazione di energia interna del sistema è uguale alla quantità di calore scambiato. Il calore ceduto al sistema è Q =∆U= ℓ/2 n. R∆T

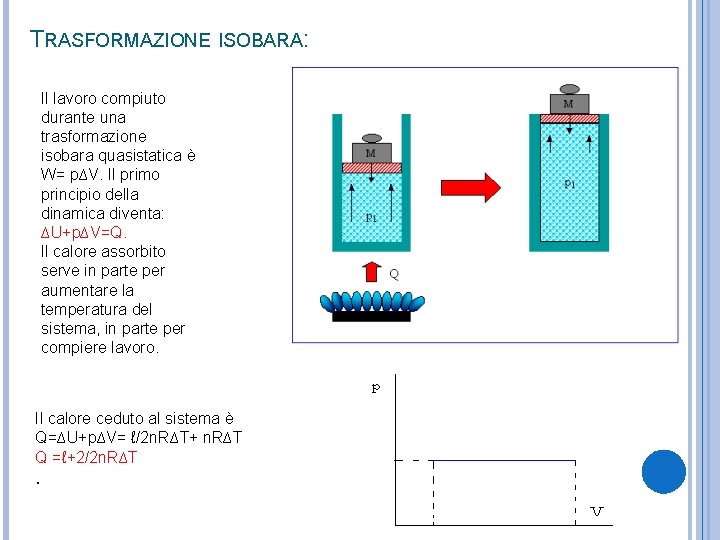
TRASFORMAZIONE ISOBARA: Il lavoro compiuto durante una trasformazione isobara quasistatica è W= p∆V. Il primo principio della dinamica diventa: ∆U+p∆V=Q. Il calore assorbito serve in parte per aumentare la temperatura del sistema, in parte per compiere lavoro. Il calore ceduto al sistema è Q=∆U+p∆V= ℓ/2 n. R∆T+ n. R∆T Q =ℓ+2/2 n. R∆T .

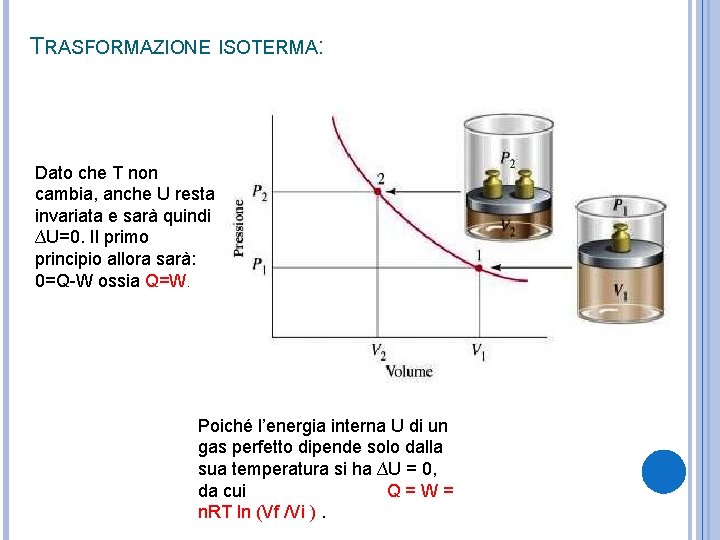
TRASFORMAZIONE ISOTERMA: Dato che T non cambia, anche U resta invariata e sarà quindi ∆U=0. Il primo principio allora sarà: 0=Q-W ossia Q=W. Poiché l’energia interna U di un gas perfetto dipende solo dalla sua temperatura si ha ∆U = 0, da cui Q = W = n. RT ln (Vf /Vi ).


CALORI SPECIFICI DEL GAS PERFETTO: Il primo principio della termodinamica permette di capire perché, a parità di massa e di aumento di temperatura non è la stessa cosa scaldare un gas a volume costante e a pressione costante. Infatti nel primo caso tutto il calore va ad incrementare l’energia interna del gas; nel secondo una parte del calore serve a far compiere al gas un lavoro esterno e perciò ne occorre di più. Vogliamo mostrare che esiste una relazione tra l’energia interna e i calori specifici dei gas perfetti. Sappiamo che il calore specifico di una sostanza è definito come: c=Q/m∆T ∆ Poiché il calore non è una funzione di stato, quando un gas scambia calore, la quantità di calore scambiata sarà diversa a seconda del tipo di trasformazione termodinamica alla quale il gas è sottoposto; in particolare, risultano interessanti i due casi in cui lo scambio di calore avviene rispettivamente a pressione costante e a volume costante. Definiamo: cp=Q/m∆T ISOBARA cv=Q/m∆T ISOCORA Il calore specifico a pressione costante è maggiore del calore specifico a volume costante.

FORMULE PER IL CALCOLO DEI CALORI SPECIFICIC V E CP: Dall’applicazione del modello del gas perfetto ricaviamo Cv e Cp che dipendono dal numero di gradi di libertà ℓ e dalla massa molare M. cv= ℓ/2 *R/M cp= ℓ+2/2 *R/M Il rapporto tra Cp e Cv si indica con γ (gamma). Per il gas perfetto si ha: γ= cp/cv= ℓ+2/2*R/M*2/ℓ*M/R= ℓ+2/ℓ Questo rapporto è maggiore di 1 poiché cp è sempre maggiore di cv.

DIMOSTRAZIONE DELLE FORMULE CV E CP I calori specifici del gas perfetto si ottengono sostituendo in Cv=(Q/m∆T) e Cp=(Q/m∆T) in Q=ℓ/2 n. R∆T e Q=ℓ+2/2*n. R∆T, rispettivamente in una trasformazione isocora e in una isobara. Trasformazione isocora: Q=ℓ/2 n. R∆T espressione del calore assorbito dal gas perfetto durante la trasformazione isocora. Cv=(Q/m∆T)= ℓ/2 n. R∆T / m∆T= ℓ/2*R / m/n Trasformazione isobara: Q=ℓ+2/2*n. R∆T calore assorbito dal gas perfetto durante una trasformazione isobara. Cp=(Q/m∆T) = ℓ+2/2 n. R∆T / m∆T= ℓ+2/2*R / m/n= ℓ+2/2*R/M

Il primo principio diventa: ∆U= -W

Un’espansione adiabatica è un processo di raffreddamento poiché l’energia interna di un gas che si espande senza assorbire calore è diminuisce e quindi diminuisce anche la temperatura. In una bomboletta a spray il gas si espande in modo adiabatico perché non ha il tempo di assorbire calore dall’esterno e si raffredda. La trasformazione non può essere considerata quasistatica, ma continua a valere: ∆U= -W

Una compressione adiabatica è un processo di riscaldamento: Se comprimiamo un gas nel thermos spingendo lentamente il pistone verso il basso con ad esempio sabbia, il pistone esercita una spinta sul gas riducendone il volume. Si ha una compressione adiabatica quasistatica in cui W<0 e ∆U>0. Al termine l’energia interna è maggiore quindi lo è anche T. Una compressione di questo tipo avviene gonfiando le ruote di una bici. L’aria dentro la pompa è compressa velocemente e non riesce a cedere calore all’esterno quindi, secondo il primo principio, si riscalda.

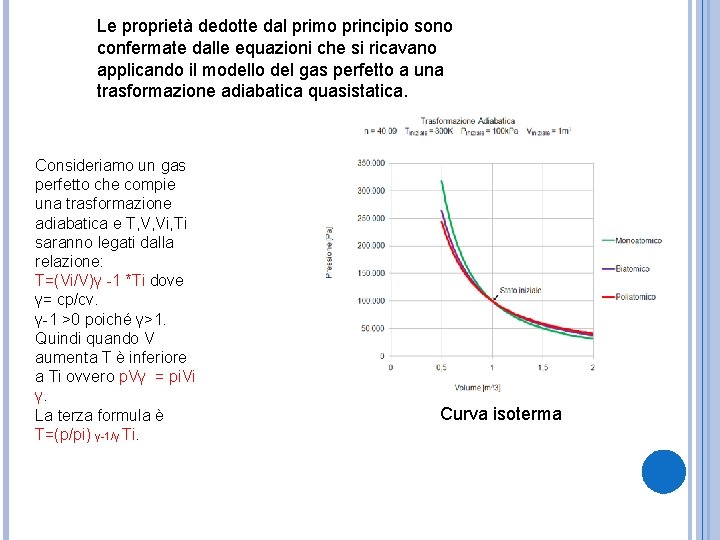
Le proprietà dedotte dal primo principio sono confermate dalle equazioni che si ricavano applicando il modello del gas perfetto a una trasformazione adiabatica quasistatica. Consideriamo un gas perfetto che compie una trasformazione adiabatica e T, V, Vi, Ti saranno legati dalla relazione: T=(Vi/V)γ -1 *Ti dove γ= cp/cv. γ-1 >0 poiché γ>1. Quindi quando V aumenta T è inferiore a Ti ovvero p. Vγ = pi. Vi γ. La terza formula è T=(p/pi) γ-1/γ Ti. Curva isoterma

Da una qualsiasi di questa equazioni per le adiabatiche del gas perfetto si ricavano le altre due. Abbiamo p. V= n. RT e pi. Vi=n. RTi e le dividiamo membro a membro. p. V/pi. Vi=T/Ti quindi T=p. VTi/pi. Vi Se sostituiamo questa in T=(Vi/V)γ -1 *Ti otteniamo p. Vγ = pi. Vi γ. Oppure se abbiamo Vi/V=p. Ti/pi. T sostituendo questa in T=(Vi/V)γ -1 *Ti otteniamo T=(p/pi) γ-1/γ Ti.

IL SECONDO PRINCIPIO

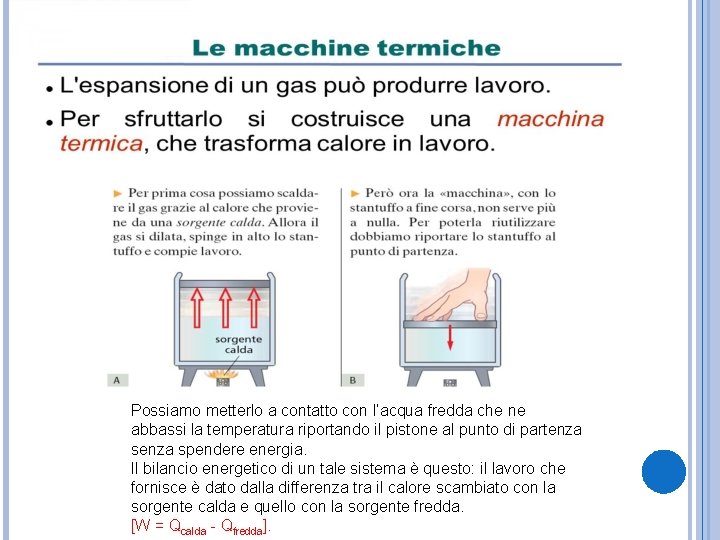
Possiamo metterlo a contatto con l’acqua fredda che ne abbassi la temperatura riportando il pistone al punto di partenza spendere energia. Il bilancio energetico di un tale sistema è questo: il lavoro che fornisce è dato dalla differenza tra il calore scambiato con la sorgente calda e quello con la sorgente fredda. [W = Qcalda - Qfredda].



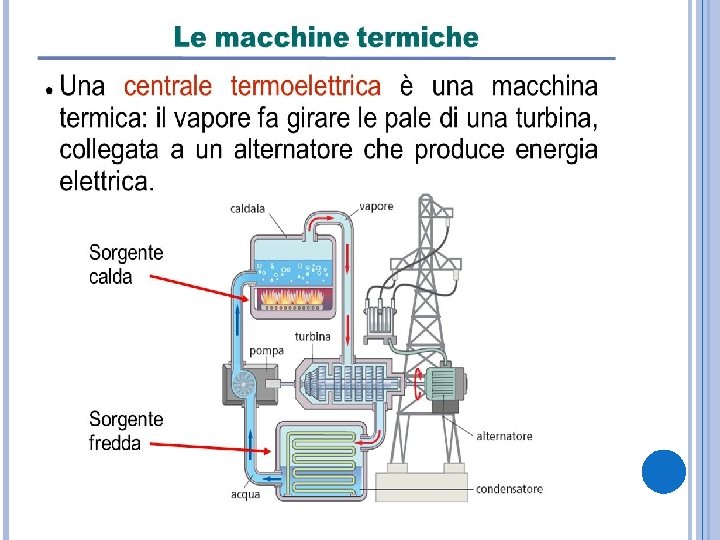
LE SORGENTI DI CALORE IN TERMODINAMICA Per semplificare si stabilisce che le due sorgenti di calore abbiamo temperature fissate. In realtà non è così infatti l’acqua del radiatore di un’automobile raffredda il motore, ma si scalda nello stesso momento. Questo avviene anche ad esempio in una miscela di acqua e ghiaccio a 0 gradi centigradi. Quando essa riceve o cede calore parte del ghiaccio fonde o parte dell’acqua solidifica, ma se la temperatura non permette di compiere completamente le trasformazioni, la temperatura rimane 0 gradi centigradi. Una sorgente ideale di calore è un sistema capace di mantenere una temperatura fissata qualunque sia la quantità di calore che esso cede o acquista.

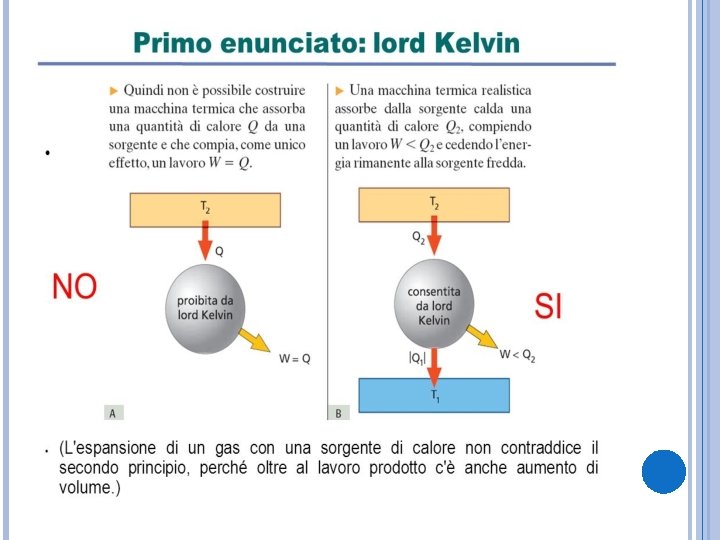
PRIMO ENUNCIATO: LORD KELVIN È impossibile realizzare una trasformazione il cui unico risultato sia quello di assorbire una determinata quantità di calore da un’unica sorgente a temperatura uniforme e trasformarla integralmente in lavoro. William Thomson nominato Lord Kelvin, fisico e ingegnere britannico (1824 -1907).


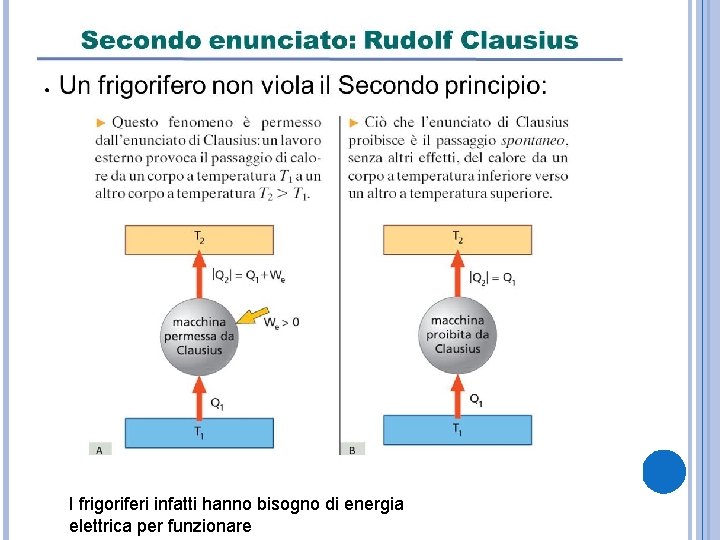
SECONDO ENUNCIATO: RUDOLF CLAUSIUS È impossibile realizzare una trasformazione il cui unico risultato sia quello di far passare calore da un corpo più freddo a uno più caldo. Rudolf Clausius fisico e matematico tedesco (1822 -1888).

I frigoriferi infatti hanno bisogno di energia elettrica per funzionare

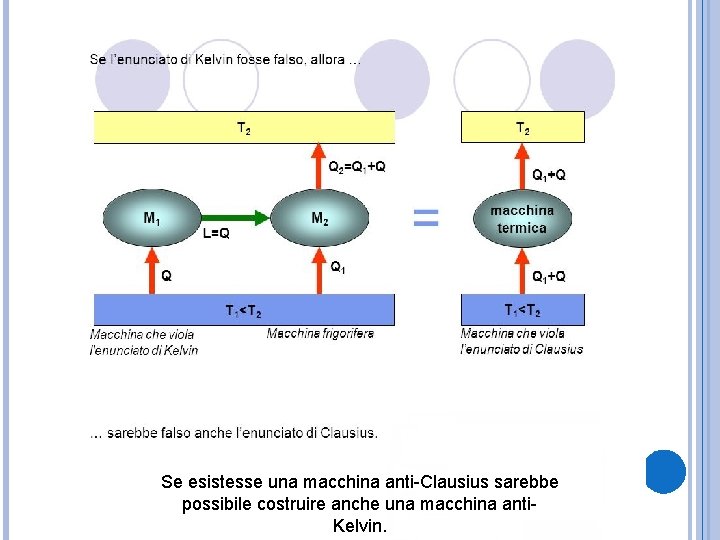
Se esistesse una macchina anti-Clausius sarebbe possibile costruire anche una macchina anti. Kelvin.

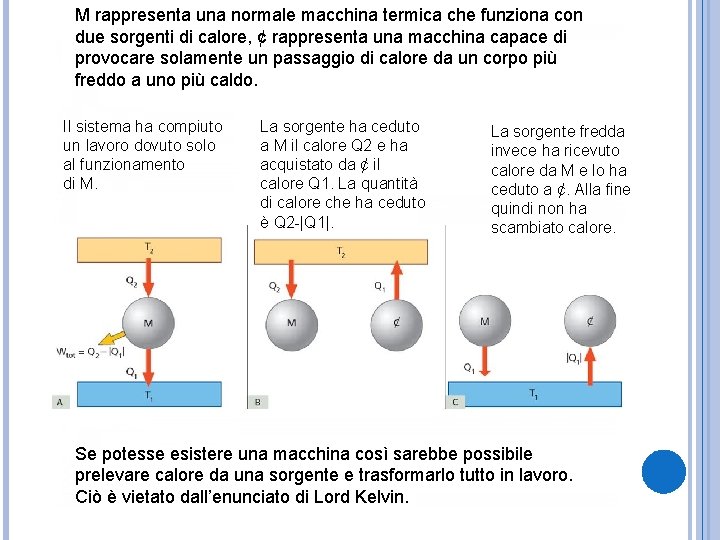
M rappresenta una normale macchina termica che funziona con due sorgenti di calore, ¢ rappresenta una macchina capace di provocare solamente un passaggio di calore da un corpo più freddo a uno più caldo. Il sistema ha compiuto un lavoro dovuto solo al funzionamento di M. La sorgente ha ceduto a M il calore Q 2 e ha acquistato da ¢ il calore Q 1. La quantità di calore che ha ceduto è Q 2 -|Q 1|. La sorgente fredda invece ha ricevuto calore da M e lo ha ceduto a ¢. Alla fine quindi non ha scambiato calore. Se potesse esistere una macchina così sarebbe possibile prelevare calore da una sorgente e trasformarlo tutto in lavoro. Ciò è vietato dall’enunciato di Lord Kelvin.

Se solleviamo i pesi della macchina di Joule grazie al lavoro della macchina anti-Kelvin e poi li rilasciamo cadere fino alla posizione di partenza questi farebbero aumentare l’energia interna dell’acqua della quantità ∆U=W=Q. Quindi se esistesse questa macchina sarebbe in grado di trasferire una quantità di energia da un corpo a temperatura minore a un corpo a temperatura maggiore.

TERZO ENUNCIATO: IL RENDIMENTO Il rendimento di una macchina termica è dato dal rapporto tra il lavoro W prodotto dalla macchina in un ciclo e la quantità di calore Q 2 che, nel ciclo, essa assorbe dalla sorgente calda. η= W/Q 2 Il rendimento indica l’efficienza con la quale una macchina termica è capace di convertire calore in lavoro. Per una macchina termica che funziona con due sorgenti di calore si ha:

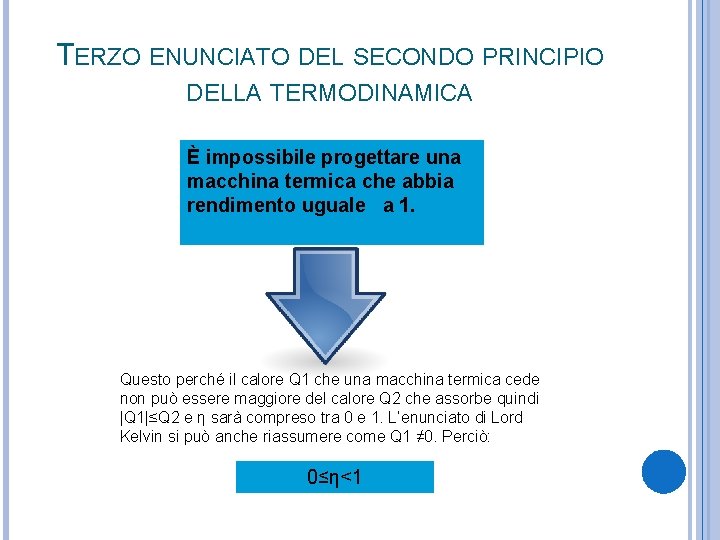
TERZO ENUNCIATO DEL SECONDO PRINCIPIO DELLA TERMODINAMICA È impossibile progettare una macchina termica che abbia rendimento uguale a 1. Questo perché il calore Q 1 che una macchina termica cede non può essere maggiore del calore Q 2 che assorbe quindi |Q 1|≤Q 2 e η sarà compreso tra 0 e 1. L’enunciato di Lord Kelvin si può anche riassumere come Q 1 ≠ 0. Perciò: 0≤η<1

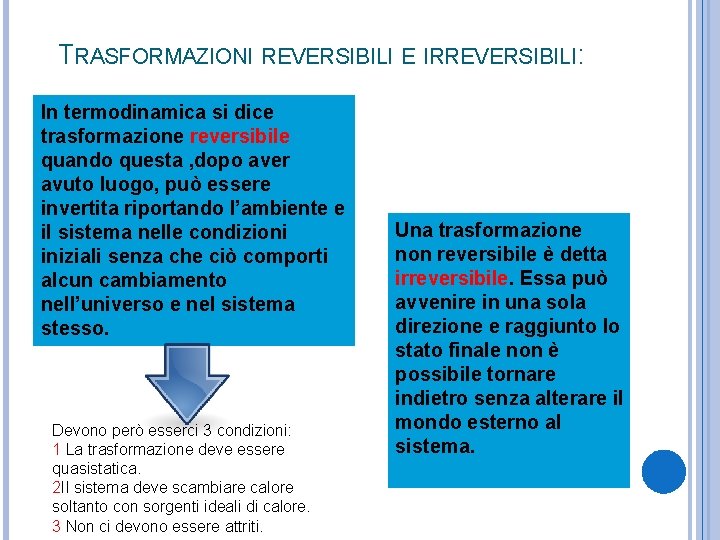
TRASFORMAZIONI REVERSIBILI E IRREVERSIBILI: In termodinamica si dice trasformazione reversibile quando questa , dopo aver avuto luogo, può essere invertita riportando l’ambiente e il sistema nelle condizioni iniziali senza che ciò comporti alcun cambiamento nell’universo e nel sistema stesso. Devono però esserci 3 condizioni: 1 La trasformazione deve essere quasistatica. 2 Il sistema deve scambiare calore soltanto con sorgenti ideali di calore. 3 Non ci devono essere attriti. Una trasformazione non reversibile è detta irreversibile. Essa può avvenire in una sola direzione e raggiunto lo stato finale non è possibile tornare indietro senza alterare il mondo esterno al sistema.

IL TEOREMA DI CARNOT Una macchina reversibile è un dispositivo che compie una trasformazione ciclica reversibile. Se tale trasformazione è composta di più fasi, ognuna di esse deve essere una trasformazione reversibile. Sadi Carnot fisico, ingegnere e matematico francese (1796 -1832).

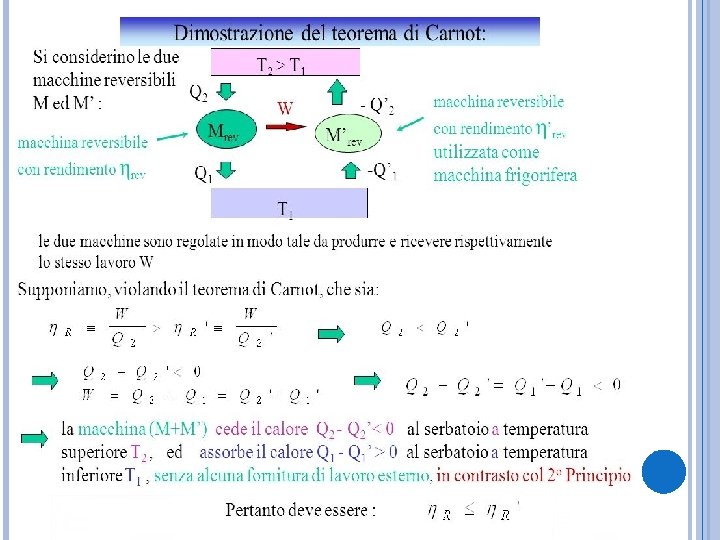
ENUNCIATO DEL TEOREMA Date due macchine, una reversibile R e una qualunque S il teorema di Carnot stabilisce che: Il rendimento ηr della macchina reversibile è sempre maggiore o uguale al rendimento ηs dell’altra macchina e i due rendimenti sono uguali soltanto se anche la macchina S è reversibile. ηr≥ηs Possiamo quindi dire che tutte le macchine reversibili che funzionano con due sorgenti di calore e lavorano tra le stesse temperature hanno lo stesso rendimento.


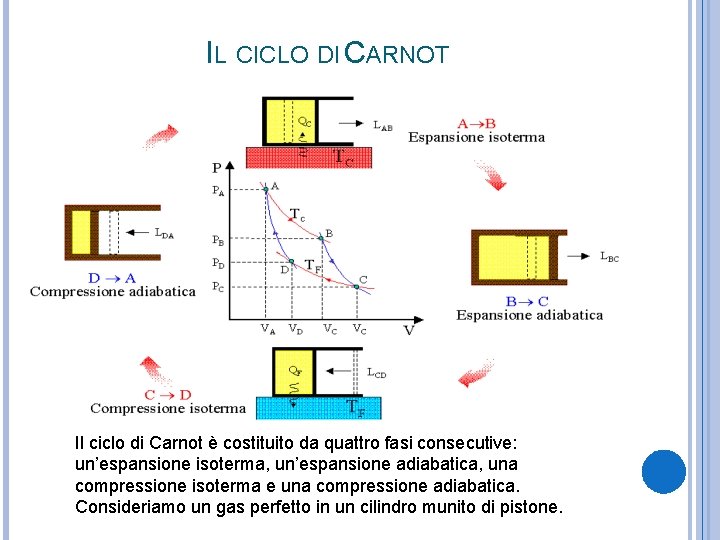
IL CICLO DI CARNOT Il ciclo di Carnot è costituito da quattro fasi consecutive: un’espansione isoterma, un’espansione adiabatica, una compressione isoterma e una compressione adiabatica. Consideriamo un gas perfetto in un cilindro munito di pistone.

1) Espansione isoterma: contatto con la sorgente di calore T 2, riduzione del peso sul pistone per favorire l’espansione del gas. All’aumentare del volume diminuisce la pressione. Lavoro W positivo e assorbimento da parte del 2) Espansione adiabatica: l’espansione continua, ma non c’è scambio di calore gas dalla sorgente di calore Q 2=W. poiché il cilindro viene isolato. All’aumentare del volume la pressione diminuisce più rapidamente e il gas compie lavoro W positivo. 3) Compressione isoterma: lo si porta a contatto con una sorgente e il gas viene compresso aumentando il peso sul pistone. Al diminuire del volume, la pressione aumenta. Il gas compie 4) Compressione adiabatica: il lavoro W negativo e scambia con la cilindro viene isolato e sul sorgente il calore Q 1=W(negativo pistone è aggiunto altro peso. Il perché ceduto). volume diminuisce fino a tornare allo stato iniziale e la pressione aumenta più velocemente. Il gas torna allo stato A e compie lavoro negativo.

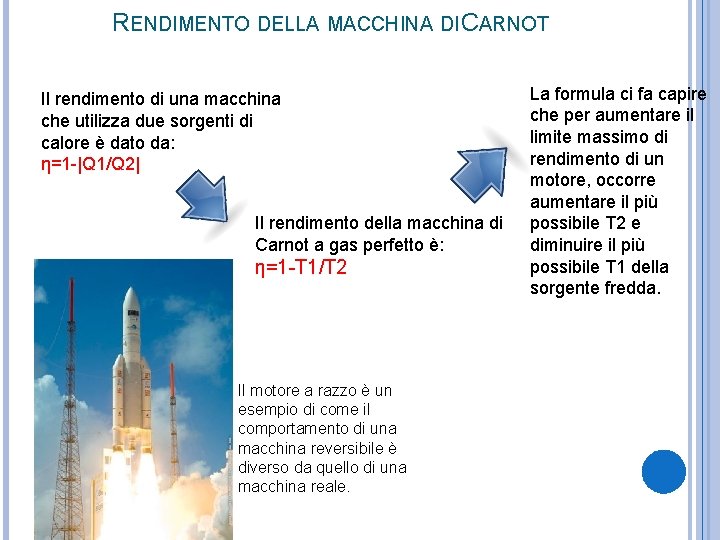
RENDIMENTO DELLA MACCHINA DI CARNOT Il rendimento di una macchina che utilizza due sorgenti di calore è dato da: η=1 -|Q 1/Q 2| Il rendimento della macchina di Carnot a gas perfetto è: η=1 -T 1/T 2 Il motore a razzo è un esempio di come il comportamento di una macchina reversibile è diverso da quello di una macchina reale. La formula ci fa capire che per aumentare il limite massimo di rendimento di un motore, occorre aumentare il più possibile T 2 e diminuire il più possibile T 1 della sorgente fredda.

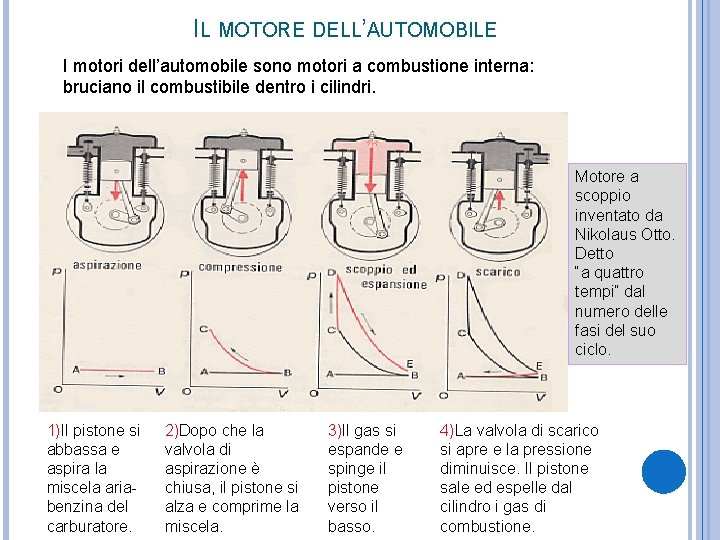
IL MOTORE DELL’AUTOMOBILE I motori dell’automobile sono motori a combustione interna: bruciano il combustibile dentro i cilindri. Motore a scoppio inventato da Nikolaus Otto. Detto “a quattro tempi” dal numero delle fasi del suo ciclo. 1)Il pistone si abbassa e aspira la miscela ariabenzina del carburatore. 2)Dopo che la valvola di aspirazione è chiusa, il pistone si alza e comprime la miscela. 3)Il gas si espande e spinge il pistone verso il basso. 4)La valvola di scarico si apre e la pressione diminuisce. Il pistone sale ed espelle dal cilindro i gas di combustione.

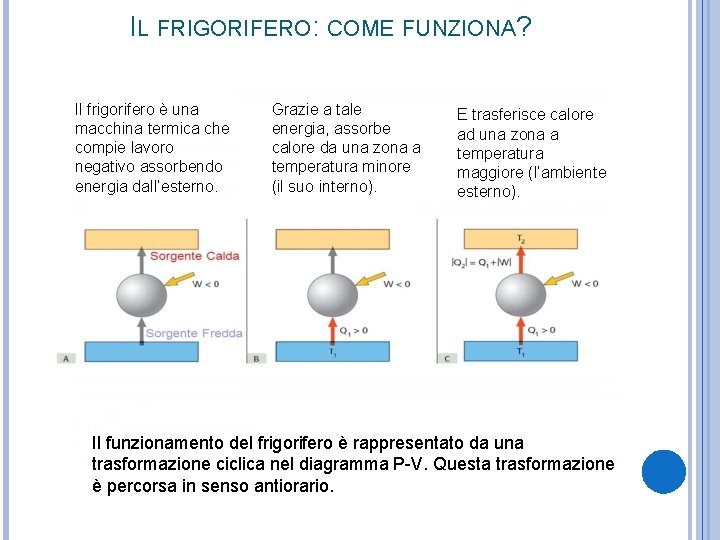
IL FRIGORIFERO: COME FUNZIONA? Il frigorifero è una macchina termica che compie lavoro negativo assorbendo energia dall’esterno. Grazie a tale energia, assorbe calore da una zona a temperatura minore (il suo interno). E trasferisce calore ad una zona a temperatura maggiore (l’ambiente esterno). Il funzionamento del frigorifero è rappresentato da una trasformazione ciclica nel diagramma P-V. Questa trasformazione è percorsa in senso antiorario.

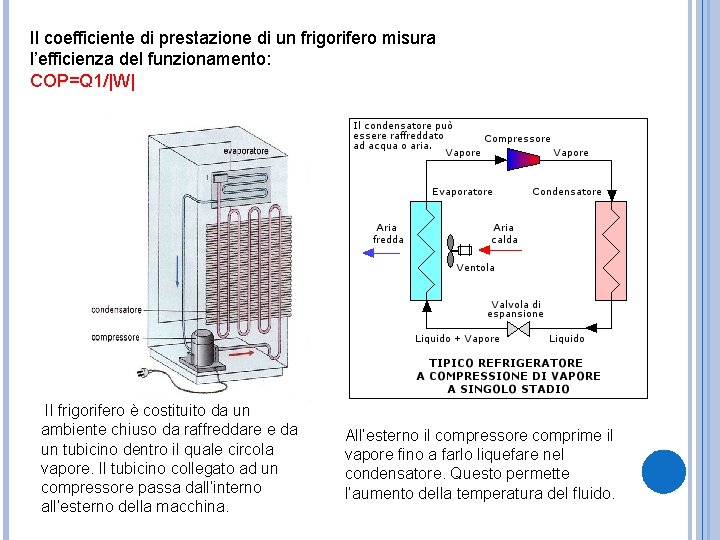
Il coefficiente di prestazione di un frigorifero misura l’efficienza del funzionamento: COP=Q 1/|W| Il frigorifero è costituito da un ambiente chiuso da raffreddare e da un tubicino dentro il quale circola vapore. Il tubicino collegato ad un compressore passa dall’interno all’esterno della macchina. All’esterno il compressore comprime il vapore fino a farlo liquefare nel condensatore. Questo permette l’aumento della temperatura del fluido.

IL CONDIZIONATORE: COME FUNZIONA? Un condizionatore è come un frigorifero che deve raffreddare tutto un appartamento. Per non ottenere il contrario, il motore viene posto all’esterno e riscalda l’aria della città. Quando questo non è possibile, il motore si pone in un ambiente isolato e viene raffreddato da aria o acqua che proviene dall’esterno.

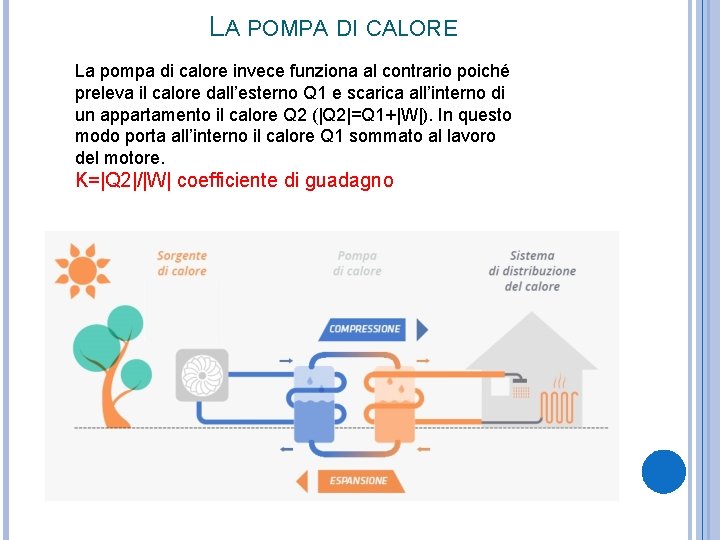
LA POMPA DI CALORE La pompa di calore invece funziona al contrario poiché preleva il calore dall’esterno Q 1 e scarica all’interno di un appartamento il calore Q 2 (|Q 2|=Q 1+|W|). In questo modo porta all’interno il calore Q 1 sommato al lavoro del motore. K=|Q 2|/|W| coefficiente di guadagno

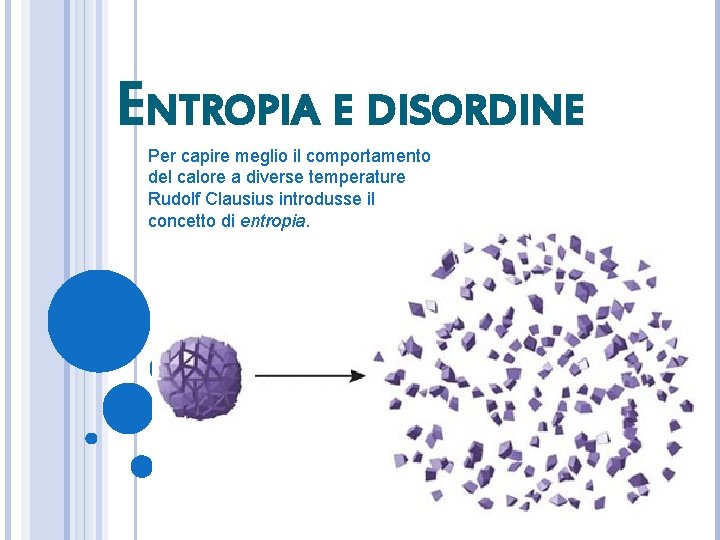
ENTROPIA E DISORDINE Per capire meglio il comportamento del calore a diverse temperature Rudolf Clausius introdusse il concetto di entropia.

LA DISUGUAGLIANZA DI CLAUSIUS La disuguaglianza di Clausius stabilisce che : La sommatoria, su tutto il ciclo di funzionamento, dei quozienti tra i calori scambiati e le temperature a cui, rispettivamente avvengono gli scambi di calore è sempre minore o uguale a 0.

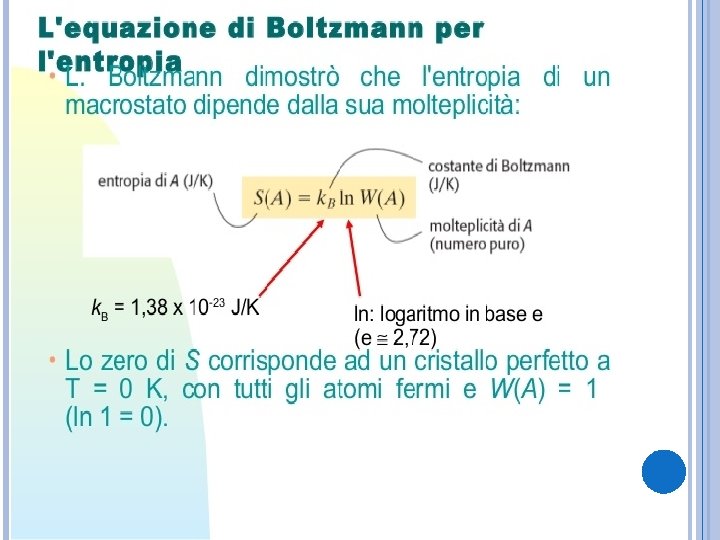
ENTROPIA Per generalizzare il secondo principio con gli enunciati di Lord Kelvin e Clausius e far sì che non si riferisca solo quindi a macchine termiche, bisogno introdurre il concetto di entropia (S). Variazione di entropia: L’entropia è una funzione di stato poiché la quantità ∆S dipende solo dagli stati A e B e non dalla particolare trasformazione reversibile che fa passare da A a B. Per calcolare quindi ∆S bisogna scegliere una qualunque trasformazione che passi da A a B e calcolare la sommatoria di tutti gli addendi ∆Qi/Ti per questa trasformazione. L’entropia è quindi definita per tutti gli stati di equilibrio di un sistema dal momento che è una funzione di stato. L’unità di misura nel SI è J/K.

Definizione di entropia: L’entropia S (C) di uno stato C è data dalla variazione di entropia nel passaggio dallo stato R di riferimento allo stato C stesso. L’entropia è una grandezza estensiva: L’entropia del sistema Ω è data dalla somma delle entropie dei due sottosistemi Ω 1 e Ω 2 che lo compongono; quindi, l’entropia è una grandezza estensiva.

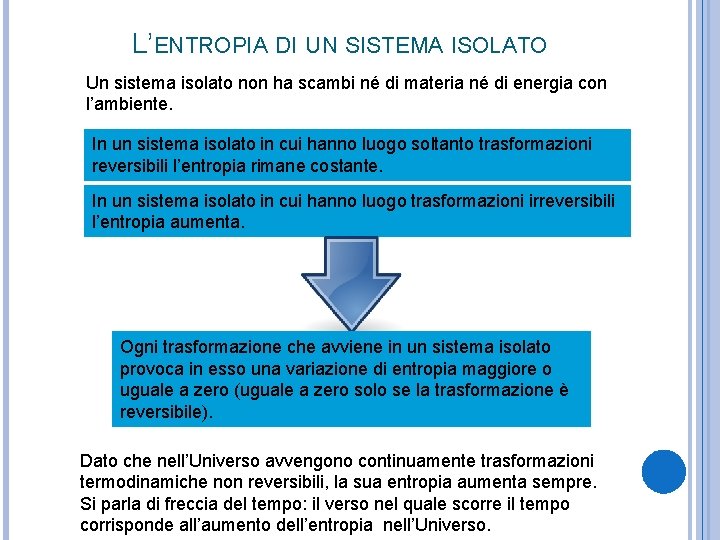
L’ENTROPIA DI UN SISTEMA ISOLATO Un sistema isolato non ha scambi né di materia né di energia con l’ambiente. In un sistema isolato in cui hanno luogo soltanto trasformazioni reversibili l’entropia rimane costante. In un sistema isolato in cui hanno luogo trasformazioni irreversibili l’entropia aumenta. Ogni trasformazione che avviene in un sistema isolato provoca in esso una variazione di entropia maggiore o uguale a zero (uguale a zero solo se la trasformazione è reversibile). Dato che nell’Universo avvengono continuamente trasformazioni termodinamiche non reversibili, la sua entropia aumenta sempre. Si parla di freccia del tempo: il verso nel quale scorre il tempo corrisponde all’aumento dell’entropia nell’Universo.

IL QUARTO ENUNCIATO DEL SECONDO PRINCIPIO Il primo principio (conservazione dell’energia) non basta da solo a definire lo stato finale B per un sistema che evolve da uno stato iniziale A: esistono vari stati finali con la stessa energia di A. Sia l’esperimento che la teoria dimostrano che: L’entropia spontanea di un sistema isolato giunge a uno stato di equilibrio a cui corrisponde il massimo aumento di entropia (compatibile con il primo principio della dinamica).

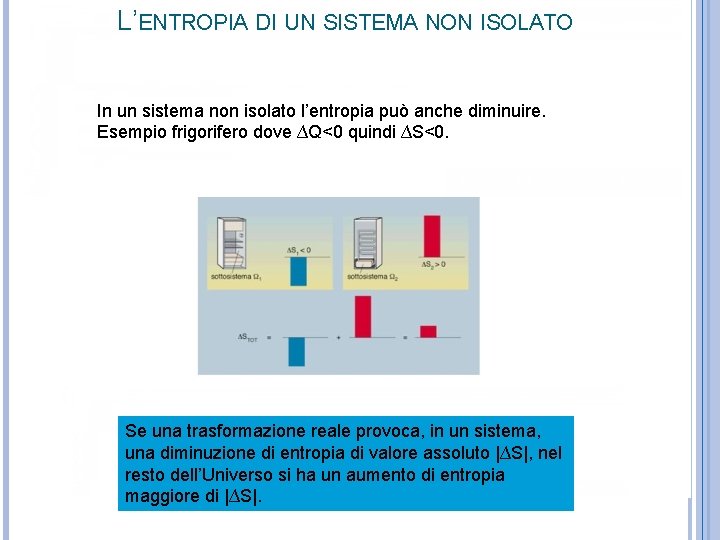
L’ENTROPIA DI UN SISTEMA NON ISOLATO In un sistema non isolato l’entropia può anche diminuire. Esempio frigorifero dove ∆Q<0 quindi ∆S<0. Se una trasformazione reale provoca, in un sistema, una diminuzione di entropia di valore assoluto |∆S|, nel resto dell’Universo si ha un aumento di entropia maggiore di |∆S|.

IL SECONDO PRINCIPIO DAL PUNTO DI VISTA MOLECOLARE L’energia interna è disordinata quando i moti delle molecole avvengono in tutte le direzioni e con valori di velocità diversi tra loro e le forze intermolecolari hanno direzioni e intensità distribuite in tutti i modi possibili. Nel corso del tempo, le forme ordinate di energia si trasformano spontaneamente in energia disordinata. È improbabile che si possa passare dalla forma disordinata alla forma ordinata e in pratica questo fenomeno non avviene mai. Il secondo principio è in accordo con ciò perché i fenomeni che lo violerebbero sono così improbabili da non essere mai osservati in natura.

STATI MACROSCOPICI E MICROSCOPICI Microstato: una ben precisa configurazione dei costituenti microscopici di un sistema (masse, posizioni, velocità delle molecole). Ad ogni microstato si può associare un solo macrostato. A ogni macrostato si possono associare molti microstati. Più un microstato è disordinato, maggiore è la probabilità con la quale esso si possa realizzare spontaneamente.



IL TERZO PRINCIPIO DELLA TERMODINAMICA Gli esperimenti e la teoria dimostrano che più la temperatura di un campione si avvicina allo zero assoluto, più risulta difficile raffreddarlo ancora fino a quando diventa impossibile. Quindi: È impossibile raffreddare un corpo fino allo zero assoluto mediante un numero finito di trasformazioni. Dimostra che è impossibile anche raffreddare un corpo fino allo zero assoluto. È anche detta legge di Nernst dal nome di Walther Hermann Nernst, fisico tedesco.

GRAZIE PER L’ATTENZIONE! Alessia Cristofaro Ш B Prof. ssa Vittoria Cinzia
 Parte della fisica che studia il moto dei corpi
Parte della fisica che studia il moto dei corpi Calore ceduto e calore assorbito
Calore ceduto e calore assorbito Parte della linguistica che studia i nomi di strade e paesi
Parte della linguistica che studia i nomi di strade e paesi Elementi di fisica meccanica e termodinamica mazzoldi
Elementi di fisica meccanica e termodinamica mazzoldi Primo principio della termodinamica sistemi aperti
Primo principio della termodinamica sistemi aperti Primo principio della termodinamica enunciato
Primo principio della termodinamica enunciato Tre leggi della termodinamica
Tre leggi della termodinamica Tre leggi della termodinamica
Tre leggi della termodinamica 2 principio della termodinamica formula
2 principio della termodinamica formula Termodinamica objetivos
Termodinamica objetivos Sistema hidrostatico termodinamica
Sistema hidrostatico termodinamica 2 principio della termodinamica formula
2 principio della termodinamica formula 2 principio della termodinamica formula
2 principio della termodinamica formula Storia della termodinamica
Storia della termodinamica Trasformazioni reversibili e irreversibili zanichelli
Trasformazioni reversibili e irreversibili zanichelli Principio 0 della termodinamica
Principio 0 della termodinamica Terzo principio della termodinamica
Terzo principio della termodinamica Prima legge della termologia
Prima legge della termologia Formule inverse legge fondamentale della termologia
Formule inverse legge fondamentale della termologia Primo principio della termodinamica
Primo principio della termodinamica Primo principio della termodinamica enunciato
Primo principio della termodinamica enunciato Il secondo principio della termodinamica
Il secondo principio della termodinamica Missa parte por parte slide catequese
Missa parte por parte slide catequese Te invitamos a ser parte
Te invitamos a ser parte Este parte aquele parte
Este parte aquele parte Escribe el número 15 enteros 204 milésimos
Escribe el número 15 enteros 204 milésimos Cos'è il tempo in fisica
Cos'è il tempo in fisica Fisica dei sistemi complessi cos'è
Fisica dei sistemi complessi cos'è Catene montuose spagna cartina
Catene montuose spagna cartina Tabula peutingeriana campania
Tabula peutingeriana campania Crisi della fisica classica
Crisi della fisica classica Cartina fisica della norvegia
Cartina fisica della norvegia Calabria cartina politica
Calabria cartina politica Parte della linguistica
Parte della linguistica Cos'è la vernalizzazione
Cos'è la vernalizzazione Eustele atactostele
Eustele atactostele La fattura economia aziendale
La fattura economia aziendale Mastro don gesualdo mappa concettuale
Mastro don gesualdo mappa concettuale Numero atomico
Numero atomico Diketahui sin a = 0
Diketahui sin a = 0 Cos c -cos d
Cos c -cos d Bentuk sederhana dari 2 cos 80 sin 50 adalah
Bentuk sederhana dari 2 cos 80 sin 50 adalah Num vão entre duas paredes deve-se construir uma rampa
Num vão entre duas paredes deve-se construir uma rampa Fabula e intreccio
Fabula e intreccio Struttura di una storia
Struttura di una storia Sin inverse formula
Sin inverse formula Nilai sin 22 5° adalah
Nilai sin 22 5° adalah Koordinat kartesius dari. 10 315 derajat adalah
Koordinat kartesius dari. 10 315 derajat adalah Rette sghembe definizione
Rette sghembe definizione Rulli mungitori
Rulli mungitori Cos'è la questione della lingua
Cos'è la questione della lingua Che cos'è la valutazione dei rischi
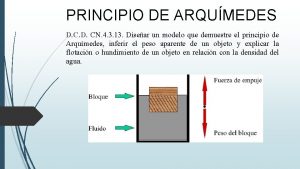
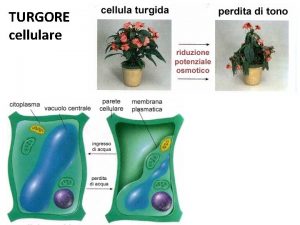
Che cos'è la valutazione dei rischi Turgore cellulare significato
Turgore cellulare significato Cosa sono le tic?
Cosa sono le tic? Le sudate carte figura retorica
Le sudate carte figura retorica Preposizioni
Preposizioni Pecuo
Pecuo Cosa è un encoder
Cosa è un encoder Nella narrazione epica prevale la coordinazione
Nella narrazione epica prevale la coordinazione Prossemica comunicazione
Prossemica comunicazione Che cosa è una novella
Che cosa è una novella Trinomio
Trinomio Cos'è la congiunzione
Cos'è la congiunzione