CHE COS LA TERMODINAMICA USANDO SPECIFICI FORMALISMI MATEMATICI



















![Clausius fu uno dei fondatori della termodinamica. [1] Con la riformulazione del principio di Clausius fu uno dei fondatori della termodinamica. [1] Con la riformulazione del principio di](https://slidetodoc.com/presentation_image/317b954a14076d20d0e3bc1d7b2988af/image-27.jpg)





















- Slides: 50

CHE COS’ È LA TERMODINAMICA? USANDO SPECIFICI FORMALISMI MATEMATICI, LA TERMODINAMICA E’ LA SCIENZA DELL’ENERGIA E DELLE SUE TRASFORMAZIONI. STUDIA LE LEGGI CON CUI I SISTEMI SCAMBIANO ENERGIA CON L’AMBIENTE.

PARLANDO DI ENERGIA, E’ INEVITABILE FAR CENNO AL SOLE CHE NE E’ IL SUO PRINCIPALE EMISSORE. IL SOLE, INFATTI, DIFFONDE ENERGIA E MATERIA NELLO SPAZIO A SPESE DELLA PROPRIA ENERGIA CHE LENTAMENTE DIMINUISCE

L’ESEMPIO PIU’ SEMPLICE DI SISTEMA CHE SCAMBIA ENERGIA CON L’AMBIENTE E’ QUELLO DI UNA PIANTA, CHE SFRUTTANDO LA LUCE SOLARE INCREMENTA LA SUA ENERGIA INTERNA E GRAZIE AD ESSA SOSTIENE LA RESPIRAZIONE CELLULARE.

INCOMINCIANDO QUINDI A PARLARE DI SISTEMI TERMODINAMICI, IN CHE MODO ESSI CAMBIANO? UN SISTEMA CHE CAMBIA NELLO SPAZIO E NEL TEMPO È INTERESSATO DA UNA “TRASFORMAZIONE REALE”. DUE ESEMPI CHE FACILITANO LA SPIEGAZIONE DI QUESTA SPECIFICA TRASFORMAZIONE SONO: • LO SCOPPIO DI UN PALLONCINO PIENO DI ACQUA • L’ESPLOSIONE DISTRUTTIVA DELLE STELLE, LA SUPERNOVA. IN AMBEDUE I CASI I VALORI DELLA TEMPERATURA E DELLA PRESSIONE NE’ OMOGENEI NELLO SPAZIO NE’ COSTANTI NEL TEMPO.

IN BASE ALLE TRASFORMAZIONI TERMODINAMICHE INTERESSANO UN SISTEMA, E’ POSSIBILE DEFINIRE IL SUO STATO DI EQUILIBRIO O NON EQUILIBRIO. CONSIDERANDO UN FLUIDO OMOGENEO, ESSO SI TROVA IN EQUILIBRIO TERMODINAMICO SOLO SE OGNUNA DELLE VARIABILI CHE LO DESCRIVONO HA LO STESSO VALORE IN TUTTI I SUOI PUNTI. L’EQUILIBRIO TERMODINAMICO COMPRENDE TRE DIVERSI TIPI DI EQUILIBRIO: 1. EQUILIBRIO MECCANICO: NON DEVONO ESSERE PRESENTI FORZE NON EQUILIBRATE. 2. EQUILIBRIO CHIMICO: LA STRUTTURA COMPOSIZIONE CHIMICA DEL SISTEMA. 3. EQUILIBRIO TERMICO: LA UNIFORME IN TUTTO IL FLUIDO. INTERNA TEMPERATURA DEVE E LA ESSERE

�FACENDO SEMPRE RIFERIMENTO ALLE TRASFORMAZIONI CHE INTERESSANO I SISTEMI TERMODINAMICI, ALLE TRASFORMAZIONI REALI SEGUONO LE TRASFORMAZIONI QUASISTATICHE. QUESTE ULTIME SONO DELLE TRASFORMAZIONI IDEALI OTTENUTE PASSANDO PER UN NUMERO MOLTO GRANDE DI STATI DI EQUILIBRIO INTERMEDI, OGNUNO DEI QUALI DIFFERISCE POCHISSIMO DA QUELLO PRECEDENTE.

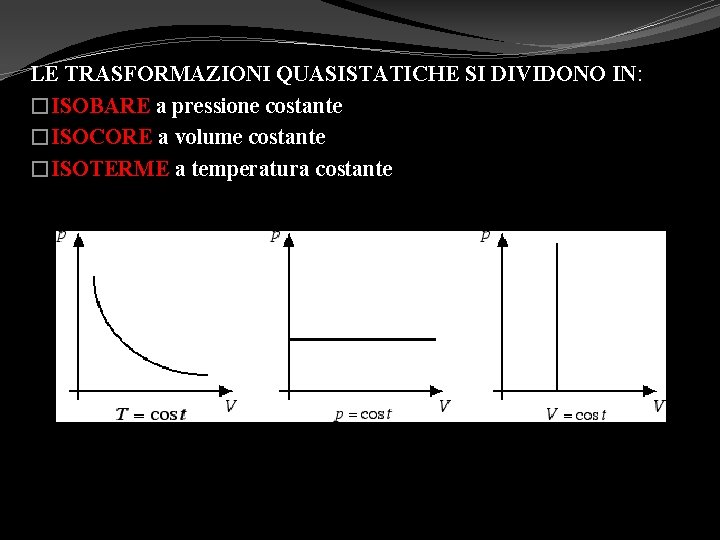
LE TRASFORMAZIONI QUASISTATICHE SI DIVIDONO IN: �ISOBARE a pressione costante �ISOCORE a volume costante �ISOTERME a temperatura costante

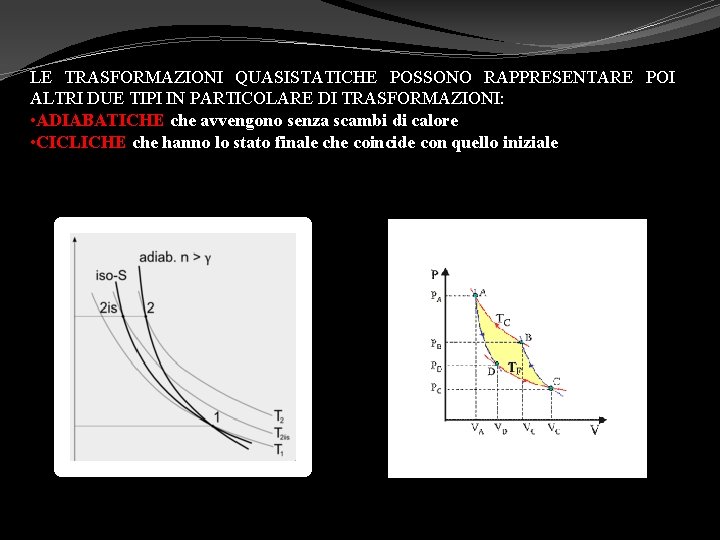
LE TRASFORMAZIONI QUASISTATICHE POSSONO RAPPRESENTARE POI ALTRI DUE TIPI IN PARTICOLARE DI TRASFORMAZIONI: • ADIABATICHE che avvengono senza scambi di calore • CICLICHE che hanno lo stato finale che coincide con quello iniziale

LAVORO TERMODINAMICO È L’ENERGIA TRASFERITA DALL’AMBIENTE AL SISTEMA O VICEVERSA A SEGUITO DI UNA MODIFICA DELLA FORMA DEL SISTEMA, CAUSATA DALLE VARIE FORZE AGENTI SU DI ESSO. CONSIDERANDO IL GA S CONTENUTO IN UN CILINDRO, UN’ESPANSIONE QUASISTATICA A PRESSIONE COSTANTE, PRODURREBBE UN LAVORO UGUALE AL PRODOTTO DELL’INTENSITA’ DELLA FORZA CHE SPINGE VERSO L’ALTO IL PISTONE DEL CILINDRO PER L’ALTEZZA DI CUI ESSO SI INNALZA. LA FORMULA CHE PRECISA TALE DEFINIZIONE E’: W=Fh Questa formula può essere tuttavia scritta in un altro modo: W=p. Sh=Pv W=Pv

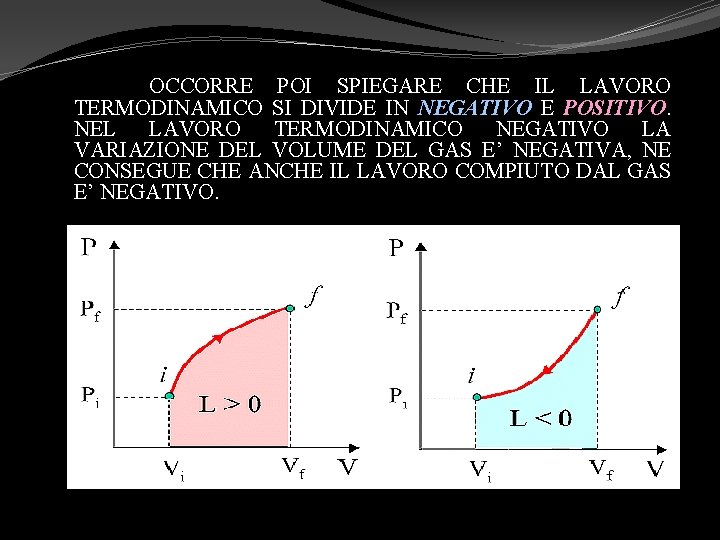
OCCORRE POI SPIEGARE CHE IL LAVORO TERMODINAMICO SI DIVIDE IN NEGATIVO E POSITIVO. NEL LAVORO TERMODINAMICO NEGATIVO LA VARIAZIONE DEL VOLUME DEL GAS E’ NEGATIVA, NE CONSEGUE CHE ANCHE IL LAVORO COMPIUTO DAL GAS E’ NEGATIVO.

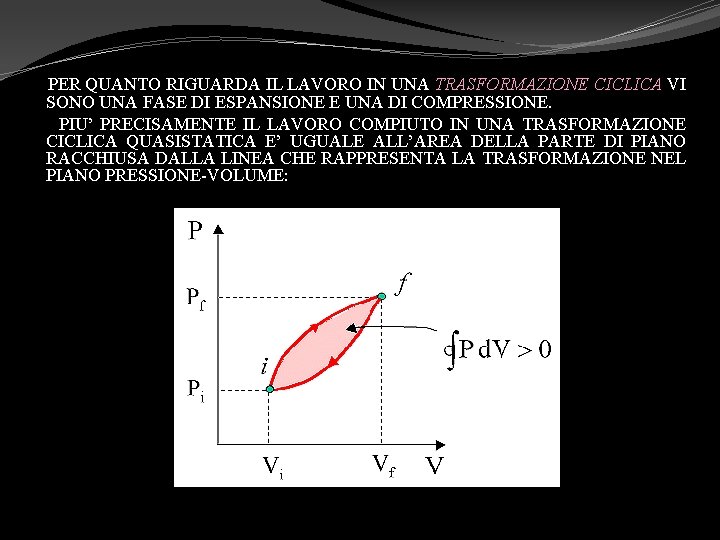
PER QUANTO RIGUARDA IL LAVORO IN UNA TRASFORMAZIONE CICLICA VI SONO UNA FASE DI ESPANSIONE E UNA DI COMPRESSIONE. PIU’ PRECISAMENTE IL LAVORO COMPIUTO IN UNA TRASFORMAZIONE CICLICA QUASISTATICA E’ UGUALE ALL’AREA DELLA PARTE DI PIANO RACCHIUSA DALLA LINEA CHE RAPPRESENTA LA TRASFORMAZIONE NEL PIANO PRESSIONE-VOLUME:

PROBLEMA PER IL CALCOLO DEL LAVORO IN UNA TRASFORMAZIONE CICLICA: UN GAS PERFETTO ESEGUE UNA TRASFORMAZIONE TERMODINAMICA CICLICA. INIZIALMENTE NELLO STATO A IL VOLUME OCCUPATO DAL GAS è DI 15 DM E LA PRESSIONE è DI 50 KPa. NELLO STATO B IL VOLUME RAGGIUNGE IL VALORE DI 20 DM E LA PRESSIONE DI 70 KPa. IL VOLUME OCCUPATO ALLO STATO C è IL DOPPIO DEL VOLUME IN B E IL VOLUME OCCUPATO ALLO STATO D è IL QUADRUPLO DEL VOLUME NELLO STATO INIZIALE. -CALCOLARE IL LAVORO COMPIUTO DAL GAS DURANTE LA TRASFORMAZIONE ABCD. -CALCOLARE IL LAVORO COMPIUTO DURANTE LA TRASFORMAZIONE DA. DA CHI VIENE COMPIUTO QUESTO LAVORO? DATI: VOLUME NELLO STATO A: Va=15 VOLUME NELLO STATO B: Vb=20 PRESSIONE NELLO STATO A: Pa=50 PRESSIONE NELLO STATO B: Pb=70 VOLUME NELLO STATO C: Vc=2 Vb VOLUME NELLO STATO D: Vd=4 Va INCOGNITE: LAVORO COMPIUTO DAL GAS: W=? LAVORO COMPIUTO TRA D E A: Wda=? SOLUZIONE: -CALCOLO DEI VOLUMI NEGLI STATI C E D. Vc=2*Vb=2*20=40 dm Vd=4*Va=4*15=60 dm -CALCOLO DEL LAVORO COMPIUTO DAL GAS DURANTE LA TRASFORMAZIONE CICLICA. Il lavoro è pari all’area del trapezio scaleno che si è creato: W=1/2[(Vd-Va)+(Vc-Vb)](Pb-Pa)=1/2*65*20=0, 65 Kj -CALCOLO DEL LAVORO COMPIUTO SUL SISTEMA DURANTE LA TRASFORMAZIONE ISOBARA DA D AD A. In questo caso il lavoro è negativo: poiché c’è una compressione la variazione di V è negativa. Wda=Pa*V=Pa(Va-Vd)=50*10^3*(15 -60)*10^-3=-2, 3 Kj Il lavoro è negativo infatti è l’ambiente a compiere lavoro sul sistema.

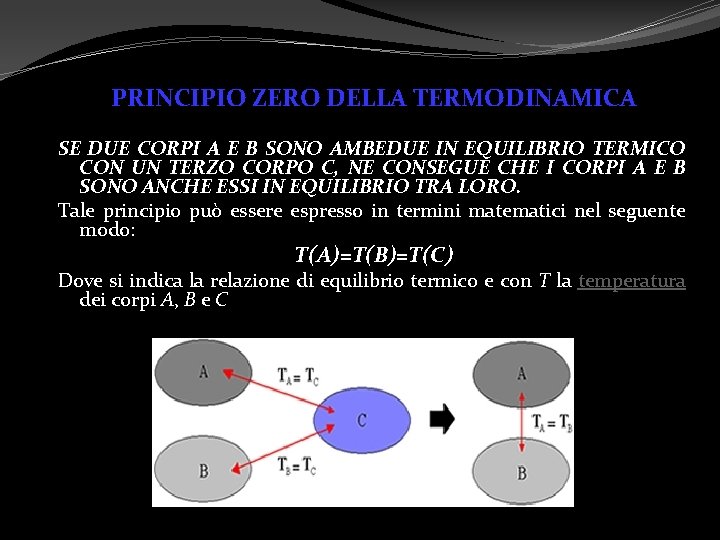
PRINCIPIO ZERO DELLA TERMODINAMICA SE DUE CORPI A E B SONO AMBEDUE IN EQUILIBRIO TERMICO CON UN TERZO CORPO C, NE CONSEGUE CHE I CORPI A E B SONO ANCHE ESSI IN EQUILIBRIO TRA LORO. Tale principio può essere espresso in termini matematici nel seguente modo: T(A)=T(B)=T(C) Dove si indica la relazione di equilibrio termico e con T la temperatura dei corpi A, B e C

PRIMO PRINCIPIO CONSIDERARIAMO L’ESPANSIONE DI UN GAS IN UN CILINDRO CON PISTONE. IN QUESTO MODO IL GAS PASSA DA UNO STATO A AD UNO STATO B, VARIA COSI’ ANCHE LA SUA ENERGIA INTERNA DA UA A UB. SEGUE CHE ∆U = UB-UA DURANTE QUESTA TRASFORMAZIONE IL GAS GUADAGNA ENERGIA PERCHE’ ASSORBE CALORE Q E AL CONTEMPO PERDE ENERGIA PERCHE’ COMPIE UN LAVORO W. IN BASE A QUESTO PRINCIPIO SAPPIAMO CHE L’ENERGIA SI CONSERVA, QUIMDI LA VARIAZIONE DELL’ENERGIA INTERNA E’ UGUALE AL CALORE ASSORBITO MENO IL LAVORO COMPIUTO: △U = Q - W SI TRATTA DI UNA DELLE LEGGI PIU’ IMPORTANTI DELLA FISICA, PERCHE’ HA UN AMBITO DI VALIDITA’ UNIVERSALE. INTERESSA INFATTI TUTTI I SISTEMI TERMODINAMICI E NON SOLO IL GAS PERFETTO.

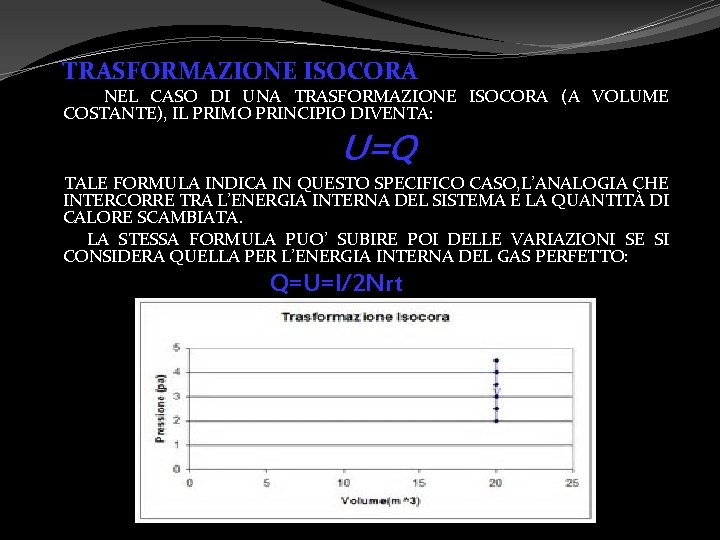
TRASFORMAZIONE ISOCORA NEL CASO DI UNA TRASFORMAZIONE ISOCORA (A VOLUME COSTANTE), IL PRIMO PRINCIPIO DIVENTA: U=Q TALE FORMULA INDICA IN QUESTO SPECIFICO CASO, L’ANALOGIA CHE INTERCORRE TRA L’ENERGIA INTERNA DEL SISTEMA E LA QUANTITÀ DI CALORE SCAMBIATA. LA STESSA FORMULA PUO’ SUBIRE POI DELLE VARIAZIONI SE SI CONSIDERA QUELLA PER L’ENERGIA INTERNA DEL GAS PERFETTO: Q=U=l/2 Nrt

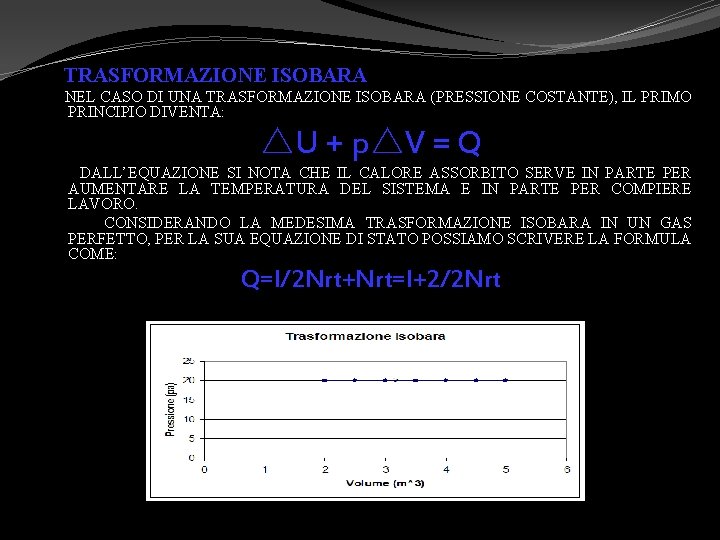
TRASFORMAZIONE ISOBARA NEL CASO DI UNA TRASFORMAZIONE ISOBARA (PRESSIONE COSTANTE), IL PRIMO PRINCIPIO DIVENTA: △U + p△V = Q DALL’EQUAZIONE SI NOTA CHE IL CALORE ASSORBITO SERVE IN PARTE PER AUMENTARE LA TEMPERATURA DEL SISTEMA E IN PARTE PER COMPIERE LAVORO. CONSIDERANDO LA MEDESIMA TRASFORMAZIONE ISOBARA IN UN GAS PERFETTO, PER LA SUA EQUAZIONE DI STATO POSSIAMO SCRIVERE LA FORMULA COME: Q=l/2 Nrt+Nrt=l+2/2 Nrt

TRASFORMAZIONE ISOTERMA IN UNA TRASFORMAZIONE ISOTERMA(A TEMPERATURA COSTANTE)T NON CAMBIA, NE CONSEGUE CHE ANCHE U RESTA INVARIATA. PERCIò ∆U=0 E IL PRIMO PRINCIPIO DELLA TERMODINAMICA ASSUME LA FORMA: Q=W IN UNA TRASFORMAZIONE ISOTERMA DEL GAS PERFETTO IL CALORE ASSORBITO è UGUALE AL LAVORO COMPIUTO. UN ALTRO MODO PER SCRIVERE TALE FORMULA è: W=Q=n. RTln(Vb/Va)

TRASFORMAZIONE CICLICA NEL CASO IN CUI UN SISTEMA TERMODINAMICO SIA INTERESSATO DA UNA TRASFORMAZIONE CICLICA, IL CALORE TOTALE ASSORBITO E’ UGUALE AL LAVORO TOTALE COMPIUTO. COSI’ IL PRIMO PRINCIPIO DELLA TERMODINAMICA DIVENTA: Q=W

PROBLEMA CON L’APPLICAZIONE DEL PRIMO PRINCIPIO DELLA TERMODINAMICA: IL MOTORE DI UNA LOCOMOTIVA A VAPORE COMPIE UN LAVORO DI 1, 3 Kl SE GLI VIENE FORNITA UNA QUANTITà DI CALORE PARI A 500 J. -CALCOLA LA VARIAZIONE DI ENERGIA INTERNA DEL SISTEMA. L’ENERGIA INTERNA AUMENTA O DIMINUISCE? Immagina che a un certo punto l’energia aumenti di 650 J. La quantità di calore aumenta del 70%. -CALCOLA IL LAVORO SVOLTO. DA CHI VIENE SVOLTO QUESTO LAVORO? DATI: LAVORO INIZIALE: W=1, 3 CALORE 1: Q=500 ENERGIA INTERNA FINALE: Uf=Ui+650 CALORE 2: Q=Q 1+70%Q INCOGNITE: VARIAZIONE DI ENERGIA INTERNA 1: ? LAVORO SVOLTO: ? LA SOLUZIONE: -CALCOLO LA VARIAZIONE DI ENERGIA INTERNA. Il calore iniziale Q 1 è positivo perché viene assorbito dalla locomotiva e il lavoro W 1 è positivo in quanto svolto dalla locomotiva, quindi: U=Q 1 -W 1=500 -1300=-800 J -CALCOLO DEL LAVORO SVOLTO NELLA SECONDA TRASFORMAZIONE DEL SISTEMA. U 2=Q 2 -W 2 W 2=Q 2 -U 2 La variazione di energia in questa trasformazione è U=650 J Il calore assorbito è: Q 2=Q 1+70%Q 1=500*1, 7=850 J Otteniamo che W 2=Q 2 -U 2=850 -650=200 J Il lavoro è positivo ed è quindi svolto dalla locomotiva.

CALORI SPECIFICI Per i gas, la variazione di temperatura dovuta a uno scambio di calore è sensibilmente diversa a seconda che, durante la trasformazione, si mantenga costante il volume o la pressione; è necessario, quindi, distinguere il calore specifico a volume costante e il calore specifico a pressione costante cv e cp dipendono entrambi dal numero di gradi di libertà delle molecole e dalla massa molare dei gas. cv = l/2 R/ℳ cp = l+2/2 R/ℳ Il rapporto tra cv e cp si indica con la lettera greca γ γ = cp/cv = l+2/2 R/ℳ 2/l ℳ/R = l+2/l

TRASFORMAZIONE ADIABATICA IN UNA TRASFORMAZIONE ADIABATICA UN GAS COMPIE UN LAVORO POSITIVO E LA SUA ENERGIA INTERNA DIMINUISCE. IL PRIMO PRINCIPIO DELLA TERMODINAMICA DIVENTA: U=-W POICHE’ L’ENERGIA INTERNA DI UN GAS CHE SI ESPANDE SENZA ASSORBIRE CALORE DIMINUISCE, DURANTE LA TRASFORMAZIONE ANCHE LA TEMPERATURA DEL GAS DIMINUISCE, PER QUESTA RAGIONE UN’ ESPANSIONE ADIABATICA E’ UN PROCESSO DI RAFFREDDAMENTO. UN ESEMPIO DI NATURA QUOTIDIANA CHE CONFERMA QUESTA DEFINIZIONE E’ L’USO COMUNE DI UNA BOMBOLETTA SPRAY. QUANDO SI FA USCIRE IL CONTENUTO INFATTI IL GAS DEL GETTO SI ESPANDE IN MODO ADIABATICOE SI RAFFREDDA.

MACCHINE TERMICHE UNA MACCHINA TERMICA È UN DISPOSITIVO CHE SFRUTTANDO IL LAVORO DI UN GAS CONTENUTO IN UN CILINDRO DATO DALLA SUA ESPANSIONE, TRASFORMA CONTINUATIVAMENTE IL CALORE IN LAVORO REALIZZANDO DELLE TRASFORMAZIONI CICLICHE. UNA MACCHINA TERMICA DEVE RISULTARE CARATTERIZZATA: -dalla temperatura della sorgente calda T 2; -dalla temperatura della sorgente fredda T 1; -dal calore (POSITIVO)che la macchina termica scambia con la sorgente calda in un ciclo Q 2; -dal calore(NEGATIVO) che la macchina termica scambia con la sorgente fredda in un ciclo. Q 1; -dal lavoro compiuto dalla macchina termica in un ciclo W; ESSENDOCI QUINDI BEN DUE SCAMBI DI CALORE, IL LAVORO RISULTANTE SARA’ UGUALE A: W=Q 2+Q 1=Q 2 -(Q 1).

PRIMO ENUNCIATO DEL SECONDO PRINCIPIO DELLA TERMODINAMICA: LORD KELVIN All'Università di Glasgow compì importanti lavori nell'analisi matematica dell'elettricità e della termodinamica, e diede un ampio contributo per unificare l'emergente disciplina della fisica nella sua forma moderna. È conosciuto per aver sviluppato la scala Kelvin, che misura la temperatura assoluta. Il titolo di Barone Kelvin gli fu conferito per merito delle sue scoperte, e deriva dal fiume Kelvin, che scorre presso la sua università scozzese di Glasgow. In seguito fece carriera come ingegnere ed inventore del telegrafo elettrico, che gli procurò una maggiore considerazione da parte dell'opinione pubblica e gli assicurò fama e ricchezza.

“E’ IMPOSSIBILE REALIZZARE UNA TRASFORMAZIONE IL CUI UNICO RISULTATO SIA QUELLO DI ASSORBIRE UNA DETERMINATA QUANTITA’ DI CALORE DA UN’UNICA SORGENTE A TEMPERATURA UNIFORME E TRASFORMARLA INTEGRALMENTE IN LAVORO. ” -Non è possibile quindi costruire una macchina termica che assorba una quantità di calore Q da una sorgente e compia, come unico effetto, un lavoro W=Q. SECONDO LUI INVECE: -Una macchina termica assorbe una quantità di calore Q 2 da una sorgente calda compie un lavoro e cede l’energia rimanente a una sorgente fredda.

SE FOSSE FALSO L’ENUNCIATO DI LORD KELVIN… AMMETTIAMO PER ASSURDO L’ESISTENZA DI UNA MACCHINA”ANTIKELVIN”. ESSA PER DEFINIZIONE, E’ IN GRADO DI PRODURRE LAVORO A SPESE DEL CALORE PRELEVATO DA UNA SOLA SORGENTE A TEMPERATURA T 1.

SECONDO ENUNCIATO CONTRADDICENDO QUESTO PRIMO ENUNCIATO, DI CONSEGUENZA ASSUMIAMO COME FALSO ANCHE IL SECONDO ENUNCIATO DEL PRINCIPIO ELABORATO DA RUDOLF CLAUSIUS, CHE CON IL PRIMO, E’ IN UNA RELAZIONE STRINGENTE. SECONDO RUDOLF CLAUSIUS “E’ IMPOSSIBILE REALIZZARE UNA TRASFORMAZIONE IL CUI UNICO RISULTATO SIA QUELLO DI FAR PASSARE CALORE DA UN CORPO Più FREDDO A UNO PIU’ CALDO”
![Clausius fu uno dei fondatori della termodinamica 1 Con la riformulazione del principio di Clausius fu uno dei fondatori della termodinamica. [1] Con la riformulazione del principio di](https://slidetodoc.com/presentation_image/317b954a14076d20d0e3bc1d7b2988af/image-27.jpg)
Clausius fu uno dei fondatori della termodinamica. [1] Con la riformulazione del principio di Carnot (allora formulata nell'ambito del ciclo di Carnot) contemporaneamente a Lord Kelvin- mise la teoria del calore su basi assai più solide. Nella sua opera più importante (1850), sulla teoria meccanica del calore, gettò le basi per la formulazione del secondo principio della termodinamica postulando l'impossibilità del passaggio spontaneo del calore da un corpo freddo a un corpo caldo. Nel 1865 indotto a porre una distinzione tra le trasformazioni reversibili e quelle irreversibili, introdusse il principio di entropia. Per definirlo si basò sulle interazioni tra le molecole di un gas descritto da un modello puramente probabilistico delle collisioni. Asserendo che il calore tendeva a indebolire il legame tra le particelle e ad accrescere le distanze medie, introducendo questa nuova grandezza veniva espresso il grado di dispersione delle molecole e quindi l'effetto del calore come tendenza ad aumentare il disordine. Successivamente, utilizzando i rapporti tra energia e entropia, giunse alla conclusione che l'entropia dell'universo aumenta sempre e tende ad un massimo, raggiunto il quale si troverà in uno «stato di morte immodificabile» (morte termica dell'universo).

TERZO ENUNCIATO: IL RENDIMENTO IL TERZO ENUNCIATO DEL SECONDO PRINCIPIO DELLA TERMODINAMICA PROVVEDE A SPECIFICARE LE FUNZIONALITà DI UNA MACCHINA TERMICA, IN MODO PARTICOLARE IL SUO RENDIMENTO. UNA MACCHINA TERMICA: -preleva una quantità di calore Q 2 dalla sorgente calda. -compie un lavoro W<Q 2. -per concludere il ciclo di funzionamento, cede alla sorgente fredda la parte di calore restante. Per specificare la qualità di una macchina termica, cioè l’efficenza con la quale essa è capace di convertire calore in lavoro, definiamo una nuova grandezza termodinamica: il rendimento η = W/ Q 2 η = Q 2 - |Q 1| / Q 2 = 1 - Q 1/Q

SE SI CONSIDERA COME NON VALIDO L’ENUNCIATO DI CLAUSIUS, ESISTEREBBE UNA MACCHINA CAPACE DI PRELEVARE CALORE DA UNA SOLA SORGENTE E TRASFORMARLO TUTTO IN LAVORO. MA Ciò è FERMAMENTE VIETATO DALL’ENUNCIATO DI LORD KELVIN. GLI ENUNCIATI DI KELVIN E CLAUSIUS ESPRIMONO INFATTI CON PAROLE DIVERSE LO STESSO CONTENUTO FISICO. SE ESISTESSE UNA MACCHINA <<ANTI-CLAUSIUS>>, GRAZIE AD ESSA SAREBBE POSSIBILE COSTRUIRE UNA MACCHINA <<ANTI-KELVIN>>.

PROBLEMA: RENDIMENTO DI UNA MACCHINA TERMICA LAVORA CON UN RENDIMENTO DEL 32% E PRODUCE UNA POTENZA DI 240 Kw COMPIENDO 30 CICLI AL SECONDO. -CALCOLARE IL CALORE ASSORBITO DALLA SORGENTE CALDA E QUELLO CEDUTO ALLA SORGENTE FREDDA IN UN CICLO. -IL LAVORO PRODOTTO AUMENTA DEL 5, 0% A PARITà DI CALORE ASSORBITO: COME DIVENTA IL RENDIMENTO? DATI: LRENDIMENTO INIZIAE: R=32% POTENZA: P=240 CICLI AL SECONDO: n=30 INCOGNITE: CALORE ASSORBITO IN UN CICLO? CALORE CEDUTO IN UN CICLO? RENDIMENTO? SOLUZIONE: CALCOLARE IL CALORE ASSORBITO IN UN CICLO. W=P/n=240/30=8, 0*10^3 J QUINDI IL CALORE ASSORBITO IN UN CICLO SARà: Q 2=W/R=8, 0*10^3/0, 32=2, 5*10^4 J CALCOLARE IL CALORE CEDUTO IN UN CICLO. Q 1=Q 2 -W=2, 5*10^4 -8, 0*10^3=1, 7*10^4 J CALCOLARE L’AUMENTO DI RENDIMENTO. W 1/R 1=W 2/R 2 CIOè: R 2=R 1 W 2/W 1=R 1(W 1+5, 0%W 1)/W 1=1, 050 R 1=1, 050*0, 32=0, 34=34%

TRASFORMAZIOMI REVERSIBILI SE DOPO L’URTO TRA DUE BIGLIE, POTESSIMO INVERTIRE ESATTAMENTE I LORO VETTORI VELOCITA’, ESSE SI URTEREBBERO IN MANIERA SIMMETRICA RISPETTO A PRIMA E TORNEREBBERO ESATTAMENTE NELLE POSIZIONI DI PARTENZA. TUTTO Ci. O’ SI RIASSUME DICENDO CHE IL FENOMENO CHE ABBIAMO DESCRITTO E’ REVERSIBILE DAL PUNTO DI VISTA MECCANICO. Una trasformazione termodinamica è reversibile se è possibile riportare sia il sistema sia l’ambiente nello stato iniziale, ripercorrendo la trasformazione a ritroso. Per realizzare una trasformazione reversibile devono essere soddisfatte 3 condizioni: • Non ci devono essere attriti. Il sistema deve scambiare calore soltanto con sorgenti ideali di calore; • La trasformazione deve essere quasistatica; •

TRASFORMAZIONI IRREVERSIBILI I FENOMENI TERMICI SONO MOLTO PIÙ COMPLESSI. PER ESEMPIO, LA COTTURA DEL PANE NON PUÒ ESSERE RIPERCORSA ALL’INDIETRO: DAL PANE NON SI TORNA MAI ALL’IMPASTO, COME ANCHE LA COMBUSTIONE DI UN GAS.

SADI CARNOT Sadi Carnot è figlio di Lazare Carnot, generale, matematico, fisico e politico francese (membro della Convenzione Nazionale e del Direttorio). Sadi Carnot è considerato uno dei padri fondatori della termodinamica, grazie agli studi sulla macchina termica, contenuti nell'opera Réflexions sur la puissance motrice du feu (Riflessioni sulla potenza motrice del fuoco), pubblicata a soli 28 anni, al Ciclo di Carnot e al Secondo principio della termodinamica. Le conclusioni a cui giunse in quest'opera, anche se basate ancora sull'ammissione dell'esistenza di un fluido ipotetico denominato calorico, sono estremamente importanti e vengono considerate il punto di partenza dal quale Clausius e Lord Kelvin giunsero a stabilire in forma rigorosa il secondo principio della termodinamica. Suo fratello era lo statista Lazare Hippolyte Carnot. Suo padre chiamò in questo modo Carnot in onore del poeta persiano Saadi. Sadi Carnot morì a soli 36 anni durante un'epidemia di colera. Per evitare il contagio, subito dopo la sua morte, i suoi effetti personali vennero bruciati, cosicché andarono distrutti quasi tutti i suoi scritti non ancora pubblicati.

TEOREMA DI CARNOT Il rendimento ηR della macchina reversibile è sempre maggiore o uguale al rendimento ηS dell’altra macchina e i due rendimenti sono uguali soltanto se anche la macchina S è reversibile. ηR ≥ ηS

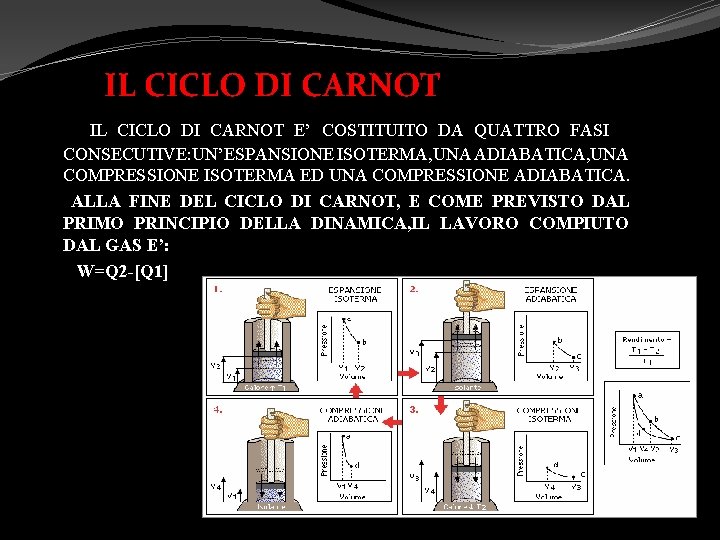
IL CICLO DI CARNOT IL CICLO DI CARNOT E’ COSTITUITO DA QUATTRO FASI CONSECUTIVE: UN’ESPANSIONE ISOTERMA, UNA ADIABATICA, UNA COMPRESSIONE ISOTERMA ED UNA COMPRESSIONE ADIABATICA. ALLA FINE DEL CICLO DI CARNOT, E COME PREVISTO DAL PRIMO PRINCIPIO DELLA DINAMICA, IL LAVORO COMPIUTO DAL GAS E’: W=Q 2 -[Q 1]

FORMULA DEL RENDIMENTO PER IL TEOREMA DI CARNOT, IL RENDIMENTO DELLA MACCHINA A GAS PERFETTO PUO’ ESSERE CALCOLATO COME: η =1 -T 1/T 2 UN ESEMPIO DI MACCHINA TERMICA è RAPPRESENTATO DAL FUNZIONAMENTO DI UN MOTORE A IL SUO COEFFICIENTE DI PRESTAZIONE E’ IL RAPPORTO TRA IL CALORE ASSORBITO E IL LAVORO ESTERNO COMPIUTO A TALE SCOPO. ]

LA DISUGUAGLIANZA DI CLAUSIUS UNA MACCHINA TERMICA QUALUNQUE, NEL SUO CICLO DI FUNZIONAMENTO, SCAMBIA CON N ALLE TEMPERATURE T 1, T 2…, LE QUANTITA’ DI CALORE Q 1, Q 2…, CHE POSSONO ANCHE ESSERE INFINITESIME. LA DISUGUAGLIANZA DI CLAUSIUS STABILISCE CHE: LA SOMMATORIA, SU TUTTO IL CICLO DI FUNZIONAMENTO, DEI QUOZIENTI TRA I CALORI SCAMBIATI E LE TEMPERATURE A CUI, RISPETTIVAMENTE, AVVENGONO GLI SCAMBI DI CALORE è SEMPRE MINORE O UGUALE A ZERO. IN FORMULA: GLI SCAMBI DI CALORE HANNO IL SEGNO DI UGUALE SE E SOLO SE SI TRATTA DI UNA MACCHINA TERMICA REVERSIBILE. IN QUESTO CASO SI OTTIENE QUINDI L’UGUAGLIANZA DI CLAUSIUS SECONDO CUI LA SOMMATORIA DI (Q 1/T 1)rev È UGUALE A ZERO.

CHE COS’E’ L’ENTROPIA? NELLA TERMODINAMICA CLASSICA L’ENTROPIA ASSUME UN SIGNIFICATO BEN PIU’ COMPLESSO. PRENDIAMO COME SEMPLICE ESEMPIO L’IMBRUNIMENTO DELLA POLPA DI UNA MELA. TALE ‘EVENTO’ E’ UNA CONSEGUENZA DELLE REAZIONI DI OSSIDAZIONE CHE COMPIONO ALCUNI COMPOSTI PRESENTI NELLE CELLULE DEL FRUTTO QUANDO VENGONO IN CONTATTO CON L’ARIA. QUESTE REAZIONI SONO ASSOLUTAMENTE SPONTANEE, MA NONOSTANTE CI Ò RAPPRESENTANO CHIARAMENTE UNA TRASFORMAZIONE IRREVERSIBILE: NON ACCADE MAI INFATTI CHE MEZZA MELA OSSIDATA, TORNI BIANCA COME APPENA TAGLIATA. NOTIAMO DALL’ESEMPIO CHE GLI ENUNCIATI DI KELVIN E CLAUSIUS NON SI ADATTANO BENE ALLA DESCRIZIONE DI UN PROCESSO COME QUESTO, NONOSTANTE IL SECONDO PRINCIPIO SIA RITENUTO UNIVERSALE. ALLO SCOPO DI MANTENERE UNA FORMULAZIONE GENERALE DEL SECONDO PRINCIPIO APPROPRIATA A OGNI TIPO DI TRASFORMAZIONE, SI INTRODUCE UNA NUOVA GRANDEZZA FISICA, L’ENTROPIA, INDICATA CON LA LETTERA S.

L’ENTROPIA E’ UNA FUNZIONE DI STATO, LA CUI VARIAZIONE E’ DATA DALLA FORMULA: S(B)-S(A)=∑(Q 1/T 1) LA SOMMATORIA E’ CONDOTTA SU TUTTI GLI SCAMBI DI CALORE CHE CONDUCONO DA A A B LUNGO LA TRASFORMAZIONE REVERSIBILE PRESCELTA. LA QUANTITà S(B)-S(A), DIPENDE SOLTANTO DAGLI STATI A E B E NON DALLA PARTICOLARE TRASFORMAZIONE REVERSIBILE CHE FA PASSARE DALL’UNO ALL’ALTRO, QUESTO CERTIFICA IL FATTO CHE SI TRATTA DI UNA FUNZIONE DI STATO. PER CALCOLARE LA QUANTITA’ S(B)-S(A) OCCORRE: -SCEGLIERE UNA QUALUNQUE TRASFORMAZIONE REVERSIBILE. -CALCOLARE LA SOMMATORIA DI TUTTI GLI ADDENDI Q 1/T 1 PER TALE TRASFORMAZIONE. ENTROPIA DIVENTA ANALOGIA DI DISORDINA, UN AUMENTO DI DISORDINE PROVOCA INFATTI UNA MAGGIORE ENTROPIA. Rappresentazione di un sistema (costituito da due gas differenti) in cui si ha aumento di entropia.

L’ENTROPIA COME GRANDEZZA ESTENSIVA SUPPONIAMO CHE UN SISTEMA TERMODINAMICO SIA L’UNIONE DI DUE SOTTOSISTEMI INDIPENDENTI. SI DIMOSTRA, QUINDI, CHE: L’ENTROPIA DEL SISTEMA E’ DATA DALLA SOMMA DELLE ENTROPIE DEI DUE SOTTOSISTEMI CHE LO COMPONGONO, L’ENTROPIA QUINDI E’ UNA GRANDEZZA ESTENSIVA. INFATTI, QUANDO IL SISTEMA SI TROVA IN UNO STATO QUALUNQUE C, POSSIAMO ESPRIMERE LA SUA ENTROPIA S(C), COME: S(C)=S 1(C)+S 2(C)

PROBLEMA ENTROPIA UN BLOCCO DI GHIACCIO CHE HA UNA MASSA DI 450 g ALLA TEMPERATURA DI 0 FONDE COMPLETAMENTE. -QUANTO VALE LA VARIAZIONE DI ENTROPIA DOVUTA ALLA FUSIONE DEL GHIACCIO? In seguito l’entropia del sistema diminuisce e diventa la metà. -QUANTO GHIACCIO SI CREA? DATI: MASSA GHIACCIO: m=0, 45 kg TEMPERATURA GHIACCIO: T=0°C=273 K DIMINUIZIONE DI ENTROPIA: S/2 S’=-S/2 INCOGNITE: VARIAZIONE DI ENTROPIA? MASSA DI GHIACCIO APPLICARE LCHE SI FORMA DOPO UN’ALTRA VARIAZIONE DI ENTROPIA? SOLUZIONE: -CALCOLARE IL CALORE NECESSARIO PER FONDERE IL GHIACCIO. Qf=Lf*m=3, 34*10^5*0, 450=1, 50*10^5 J -A DEFINIZIONE DI ENTROPIA. S=Qf/T=1, 50*10^5/273=549 J/K -CALCOLARE LA NUOVA ENTROPIA E LA NUOVA MASSA. S’=-S*0, 50=-549*0, 50=-275 J/K Q=S’T=-275*273=7, 51*10^4 J Mf=Qf/Lf=7, 51/3, 34=0, 225 kg

L’ENTROPIA IN UN SISTEMA ISOLATO -IN UN SISTEMA ISOLATO IN CUI HANNO LUOGO SOLTANTO TRAFORMAZIONI REVERSIBILI, L’ENTROPIA RIMANE COSTANTE. -IN UN SISTEMA ISOLATO IN CUI HANNO LUOGO TRASFORMAZIONI IRREVERSIBILI, L’ENTROPIA AUMENTA. UNENDO LE DUE AFFERMAZIONI, NE CONSEGUE CHE: OGNI TRASFORMAZIONE CHE AVVIENE IN UN SISTEMA ISOLATO PROVOCA IN ESSO UNA VARIAZIONE DI ENTROPIA MAGGIORE O UGUALE A ZERO (uguale se è reversibile).

L’ENTROPIA NELL’UNIVERSO UN PARTICOLARE SISTEMA ISOLATO E’ L’UNIVERSO. PER DEFINIZIONE ESSO E’ ‘TUTTO Ci. O’ CHE ESISTE’ E QUINDI NON HA UN AMBIENTE ESTERNO CON IL QUALE SCAMBIARE ENERGIA. DATO CHE NELL’UNIVERSO AVVENGONO CONTINUAMENTE TRASFORMAZIONI TERMODINAMICHE NON REVERSIBILI, LA SUA ENTROPIA AUMENTA SEMPRE.

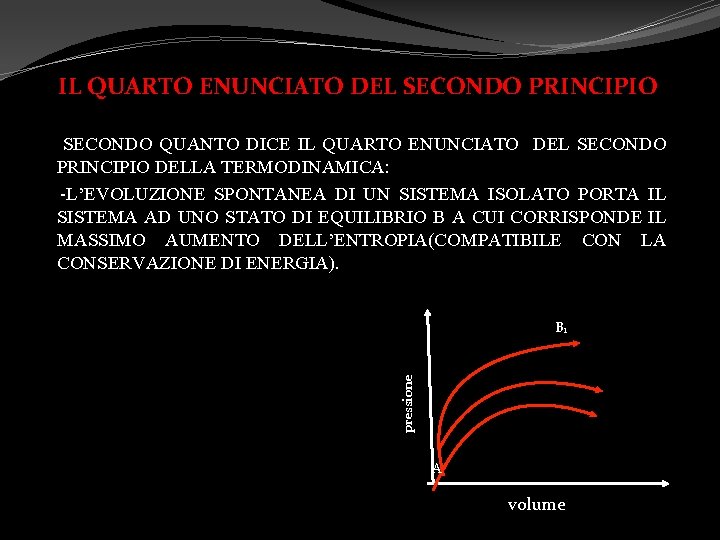
IL QUARTO ENUNCIATO DEL SECONDO PRINCIPIO SECONDO QUANTO DICE IL QUARTO ENUNCIATO DEL SECONDO PRINCIPIO DELLA TERMODINAMICA: -L’EVOLUZIONE SPONTANEA DI UN SISTEMA ISOLATO PORTA IL SISTEMA AD UNO STATO DI EQUILIBRIO B A CUI CORRISPONDE IL MASSIMO AUMENTO DELL’ENTROPIA(COMPATIBILE CON LA CONSERVAZIONE DI ENERGIA). pressione B 1 A volume

L’ENTROPIA IN UN SISTEMA NON ISOLATO IN UN SISTEMA NON ISOLTATO, QUALE Può ESSERE UN FRIGORIFERO, L’ENTROPIA Può DIMINUIRE. IN UN FRIGORIFERO CHE SI RAFFREDDA INFATTI, Q<0 E, DI CONSEGUENZA, S<0. IN GENERALE: “SE UNA TRASFORMAZIONE REALE, PROVOCA IN UN SISTEMA UNA DIMINUIZIONE DI ENTROPIA, NEL RESTO DELL’UNIVERSO SI HA INVECE UN AUMENTO DI ENTROPIA. ”

PRINCIPIO DAL PUNTO DI VISTA MOLECOLARE IL SECONDO “NEL CORSO DEL TEMPO, LE FORME ORDINATE DI ENERGIA SI TRASFORMANO SPONTANEAMENTE IN ENERGIA DISORDINATA. ” QUESTO AVVIENE, PER ESEMPIO, NEL CASO DI UN SISTEMA COSTITUITO DA UN DISCO DA HOCKEY.

L’EQUAZIONE DI BOLTZMANN NELL’ENTROPIA LUDWIG BOLTZMANN DIMOSTRO’ CHE L’ENTROPIA S(A) DI UN MACROSTATO A(INSIEME DELLE VARIABILI MACROSCOPICHE) E’ DATA DALLA FORMULA: S(A) = k. B ln W(A) CHE E’ DETTA ‘EQUAZIONE DI BOLTZMANN’ LA FORMULA E’ OTTENUTA FACENDO UNA PRECISA SCELTA PER LO ZERO DELL’ENTROPIA, CIOE’ ASSEGNANDO IL VALORE 0 J/K ALL’ENTROPIA DI UN CRISTALLO PERFETTO, CHE E’ FORMATO DA ATOMI TUTTI UGUALI TRA LORO E SI TROVA ALLA TEMPERATURA DI 0 K.

Ludwig Eduard Boltzmann è stato uno dei più grandi fisici teorici di tutti i tempi. La sua fama è dovuta alle ricerche in termodinamica e meccanica statistica (l'equazione fondamentale della teoria cinetica dei gas e il secondo principio della termodinamica). Diede importanti contributi anche in meccanica, elettromagnetismo, matematica e filosofia. Fu un personaggio controverso e le sue idee innovative (sull'atomismo, l'irreversibilità, ecc. ) furono spesso fraintese e osteggiate. In particolare, il suo amore per la matematizzazione più estrema gli valse il soprannome di "terrorista algebrico". A Ludwig Eduard Boltzmann la UAI ha intitolato un cratere lunare.

TERZO PRINCIPIO DELLA TERMODINAMICA NEL CORSO DEGLI ANNI SI E’ RIUSCITI A RAFFREDDARE LA MATERIA A TEMPERATURE SEMPRE PIU’ BASSE. NONOSTANTE CIO’ IL TERZO PRINCIOPIO DELLA TERMODINAMICA CI INSEGNA CHE: “ E’ IMPOSSIBILE RAFFREDDARE UN CORPO FINO ALLO ZERO ASSOLUTO MEDIANTE UN NUMERO FINITO DI TRASFORMAZIONI. ” IL TERZO PRINCIPIO E’ DETTO ANCHE ‘LEGGE DI NERNST’ DAL NOME DEL FISICO TEDESCO NERNST, CHE SCRISSE UN ARTICOLO SCIENTIFICO CHE APRI’ LA STRADA ALLA COMPRENSIONE DI QUESTA LEGGE DELLA NATURA.

GRAZIE PER L’ATTENZIONE Professoressa: Cinzia Vittoria Alunna: FEDERICA PALAIA III^ B.
 Bayer prodotti
Bayer prodotti Ciclo di carnot
Ciclo di carnot Obiettivi generali e specifici di un progetto esempio
Obiettivi generali e specifici di un progetto esempio F 83 disturbi evolutivi specifici misti
F 83 disturbi evolutivi specifici misti Osa obiettivi specifici di apprendimento
Osa obiettivi specifici di apprendimento Bisogni innati specifici esempi
Bisogni innati specifici esempi Facesti come quei che va di notte che porta il lume
Facesti come quei che va di notte che porta il lume Frasi subordinata oggettiva
Frasi subordinata oggettiva La vita che avrai non sarà mai distante dall'amore che dai
La vita che avrai non sarà mai distante dall'amore che dai Che che kooley
Che che kooley Studia con metodi matematici fenomeni collettivi
Studia con metodi matematici fenomeni collettivi Dn u matematici
Dn u matematici Distributivnost množenja prema zbrajanju i oduzimanju
Distributivnost množenja prema zbrajanju i oduzimanju Vicevi o matematici
Vicevi o matematici Programski jazici
Programski jazici Prof significato
Prof significato Sta su prirodni brojevi u matematici
Sta su prirodni brojevi u matematici Alfa beta gama delta matematika
Alfa beta gama delta matematika Brojevi na latinskom izgovor
Brojevi na latinskom izgovor N u matematici
N u matematici Oblici u matematici
Oblici u matematici Proporcija glave
Proporcija glave Zlatni presek u umetnosti
Zlatni presek u umetnosti Multipli e sottomultipli
Multipli e sottomultipli Potpuna indukcija
Potpuna indukcija Testo teatrale
Testo teatrale Che cos'è la preghiera
Che cos'è la preghiera Encoder tachimetrico
Encoder tachimetrico Schema narrativo
Schema narrativo Figura retorica significato
Figura retorica significato Cos'è l'analessi
Cos'è l'analessi Cos'è lo spazio geografico
Cos'è lo spazio geografico Organigramma verticale
Organigramma verticale Le proposizioni
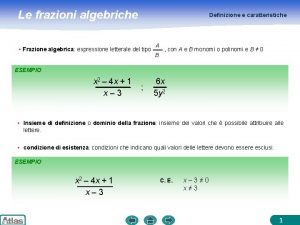
Le proposizioni Semplificazione frazioni algebriche
Semplificazione frazioni algebriche Che cos'è una sostanza pura
Che cos'è una sostanza pura Cos'è un areogramma
Cos'è un areogramma Significato del sacramento della cresima
Significato del sacramento della cresima Plutone che cos'è
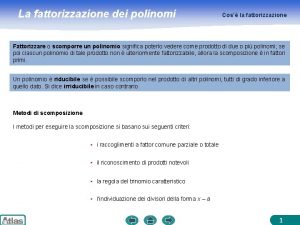
Plutone che cos'è Scomposizione polinomi schema
Scomposizione polinomi schema Come si fa una parafrasi
Come si fa una parafrasi Che cos'è la valutazione dei rischi
Che cos'è la valutazione dei rischi Tipi di carte tematiche
Tipi di carte tematiche Verbo modo indicativo
Verbo modo indicativo Che cos'è la lettera di vettura
Che cos'è la lettera di vettura Antefatto testo narrativo
Antefatto testo narrativo Metacomunicazione cos'è
Metacomunicazione cos'è Poesia di 4 versi con rima alternata
Poesia di 4 versi con rima alternata Complemento di vocazione
Complemento di vocazione Schema narrativo fabula
Schema narrativo fabula Che cos'è la preposizione
Che cos'è la preposizione