Termoqumica Lays Omena Termoqumica o estudo das trocas








































- Slides: 51

Termoquímica Lays Omena

Termoquímica É o estudo das trocas de energia, na forma de calor, envolvidas nas reações químicas e nas mudanças de estado físico das substâncias. São dois os processos em que há troca de energia na forma de calor: o processo exotérmico e o endotérmico.

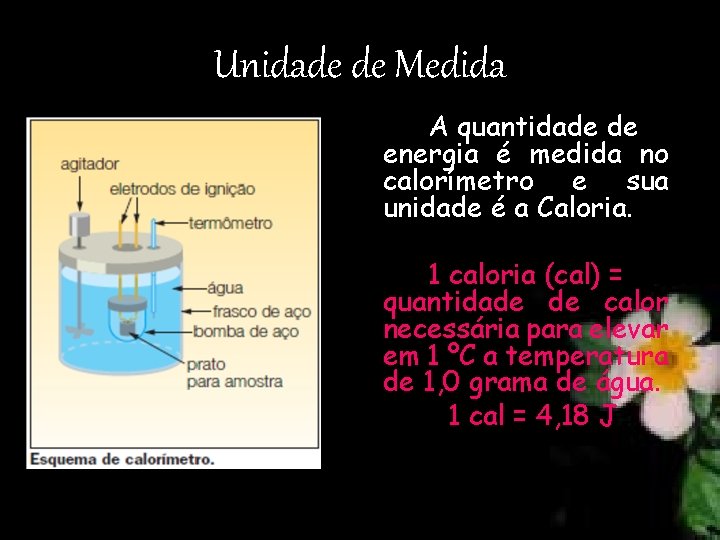
Unidade de Medida A quantidade de energia é medida no calorímetro e sua unidade é a Caloria. 1 caloria (cal) = quantidade de calor necessária para elevar em 1 ºC a temperatura de 1, 0 grama de água. 1 cal = 4, 18 J

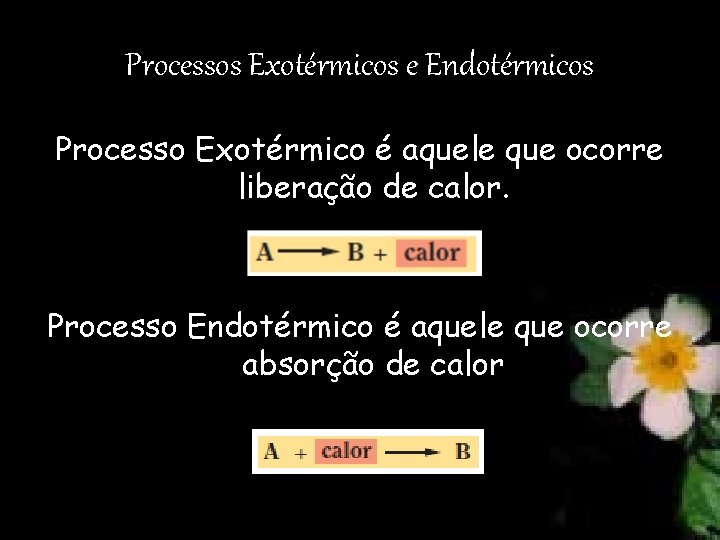
Processos Exotérmicos e Endotérmicos Processo Exotérmico é aquele que ocorre liberação de calor. Processo Endotérmico é aquele que ocorre absorção de calor

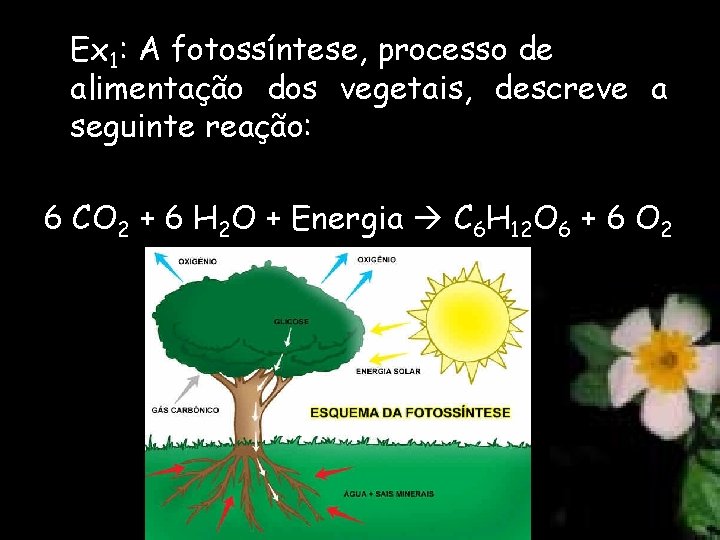
Ex 1: A fotossíntese, processo de alimentação dos vegetais, descreve a seguinte reação: 6 CO 2 + 6 H 2 O + Energia C 6 H 12 O 6 + 6 O 2

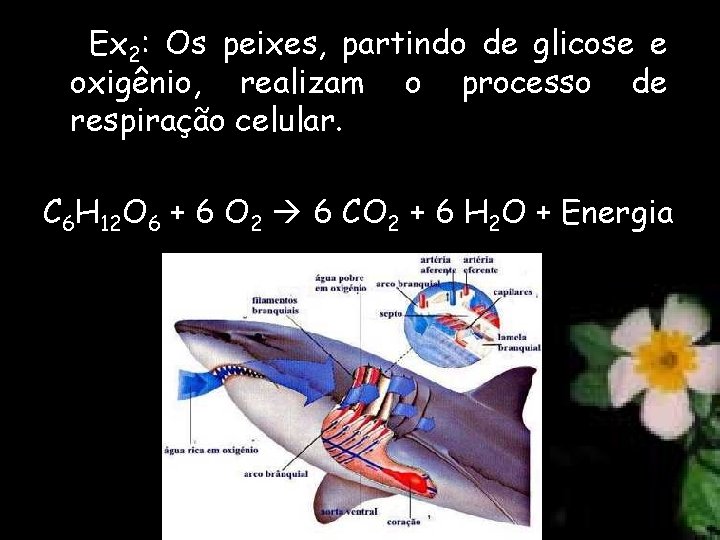
Ex 2: Os peixes, partindo de glicose e oxigênio, realizam o processo de respiração celular. C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + Energia

Ex 3: Na câmara de combustão de um motor de um carro, o combustível é queimado em presença de oxigênio, produzindo CO 2 e água, liberando energia mecânica, e o restante é perdido na forma de calor. C 2 H 6 O + 3 O 2 2 CO 2 + 3 H 2 O + energia

Ex 4: Processo de ebulição H 2 O(l) + Energia H 2 O(V)

Entalpia A foto mostra uma reação de combustão que pode ser representada por: madeira + oxigênio gás carbônico + água + calor Uma pergunta interessante sobre essa reação é: “De onde vem essa energia ou esse calor? ”.

Essa energia é a entalpia, e a representamos por (H). Na prática, conseguimos medir a variação de entalpia (ΔH).

ΔH em reações Exotérmicas Nas reações exotérmicas, como ocorre liberação de calor, a entalpia dos produtos (HP) é menor do que a entalpia do reagentes (HR). Genericamente, temos:


1. (UA-AM) Reação exotérmica é aquela na qual: 1 — há liberação de calor. 2 — há diminuição de energia. 3 — a entalpia dos reagentes é maior que a dos produtos. 4 — a variação de entalpia é negativa. Estão corretos os seguintes complementos: a) Somente 1. d) Somente 1 e 4. b) Somente 2 e 4. e) 1, 2, 3 e 4. c) Somente 1 e 3.

1. (UA-AM) Reação exotérmica é aquela na qual: 1 — há liberação de calor. 2 — há diminuição de energia. 3 — a entalpia dos reagentes é maior que a dos produtos. 4 — a variação de entalpia é negativa. Estão corretos os seguintes complementos: a) Somente 1. d) Somente 1 e 4. b) Somente 2 e 4. e) 1, 2, 3 e 4. c) Somente 1 e 3.

Se considerarmos a síntese da amônia (NH 3), teremos: N 2(g) + 3 H 2(g) 2 NH 3(g) + 92, 2 k. J Pelas equações ou pelo gráfico, devemos entender que na síntese de 2 mol de NH 3 ocorre a liberação de 92, 2 k. J.

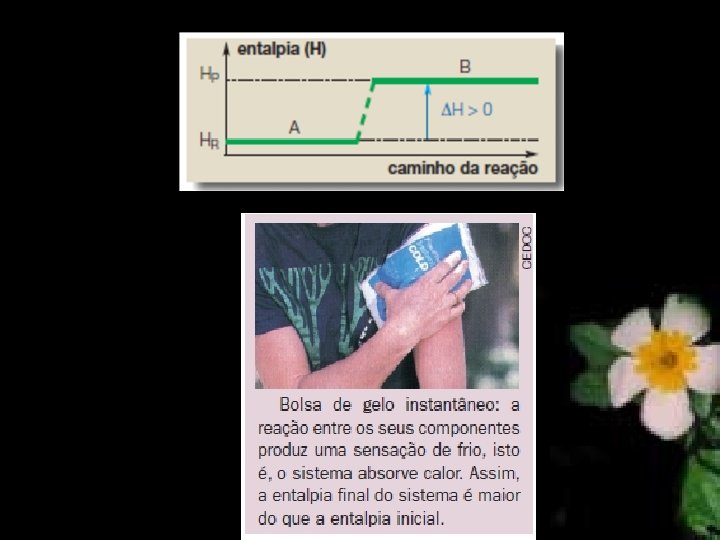
ΔH EM REAÇÕES ENDOTÉRMICAS Nas reações endotérmicas, como ocorre absorção de calor, a entalpia dos produtos (HP) é maior do que a entalpia dos reagentes (HR).


Se considerarmos a decomposição da amônia (NH 3), teremos: 2 NH 3(g) + 92, 2 KJ N 2(g) + 3 H 2(g) Pelas equações ou pelo gráfico, devemos entender que na decomposição de 2 mol de NH 3 ocorre a absorção de 92, 2 k. J.

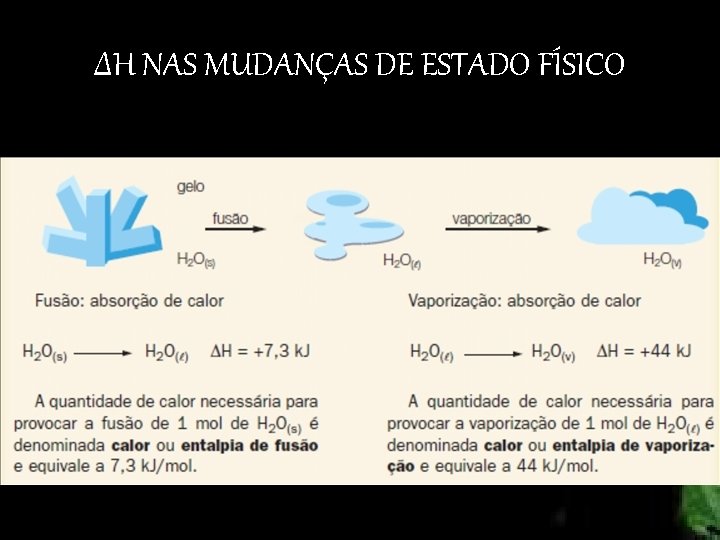
ΔH NAS MUDANÇAS DE ESTADO FÍSICO

2. (UFJF-MG) Considere os processos a seguir: I — queima do carvão II — fusão do gelo à temperatura de 25 ºC III — combustão da madeira a) Apenas o primeiro é exotérmico. b) Apenas o segundo é exotérmico. c) Apenas o terceiro é exotérmico. d) Apenas o primeiro é endotérmico. e) Apenas o segundo é endotérmico.

2. (UFJF-MG) Considere os processos a seguir: I — queima do carvão II — fusão do gelo à temperatura de 25 ºC III — combustão da madeira a) Apenas o primeiro é exotérmico. b) Apenas o segundo é exotérmico. c) Apenas o terceiro é exotérmico. d) Apenas o primeiro é endotérmico. e) Apenas o segundo é endotérmico.

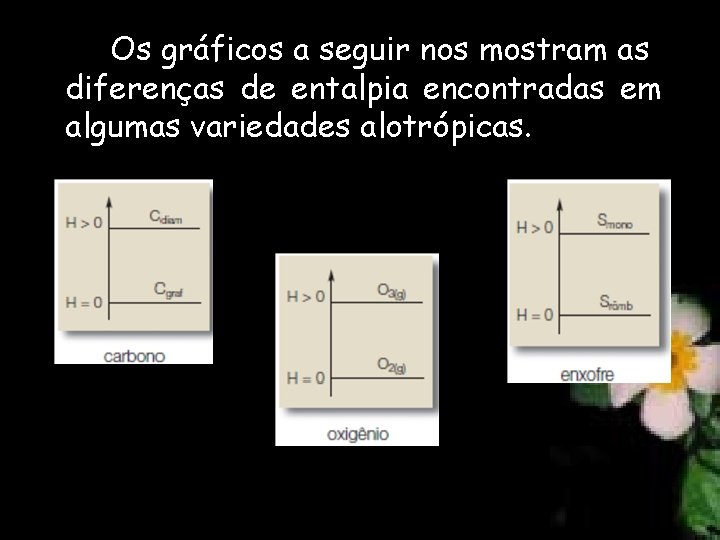
Entalpia Padrão Hº O estado padrão de uma substância corresponde à sua forma mais estável, a 1 atm, a 25 °C. A entalpia padrão de uma substância é indicada por Hº. Toda substância simples, no estado padrão e na sua forma alotrópica mais estável (mais comum), tem entalpia (H) igual a zero.

Os gráficos a seguir nos mostram as diferenças de entalpia encontradas em algumas variedades alotrópicas.

Entalpia de Formação ΔHºf Entalpia de formação é o calor liberado ou absorvido na formação de 1 mol de uma substância a partir de substâncias simples, no estado padrão, com H = 0.

3. (PUC-MG) Sejam dadas as seguintes equações termoquímicas: Nas condições citadas, a equação que representa a reação mais exotérmica é: a) I. b) II. c) III. d) IV. e) V.

3. (PUC-MG) Sejam dadas as seguintes equações termoquímicas: Nas condições citadas, a equação que representa a reação mais exotérmica é: a) I. b) II. c) III. d) IV. e) V.

Entalpia de Combustão ΔHºC Entalpia de combustão é a energia liberada na combustão completa de 1 mol de uma substância no estado padrão.

Entalpia de Neutralização Entalpia de neutralização é o calor liberado na formação de 1 mol de H 2 O (l), a partir da reação entre 1 mol de H+ (aq) e 1 mol de OH- (aq) nas condições padrão.

Energia de Ligação Energia de ligação é a energia absorvida na quebra de 1 mol de ligações, no estado gasoso, a 25 ºC e 1 atm.

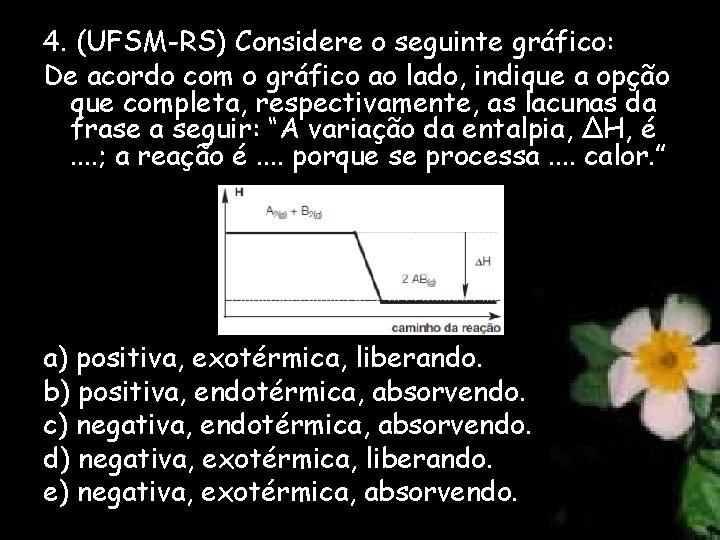
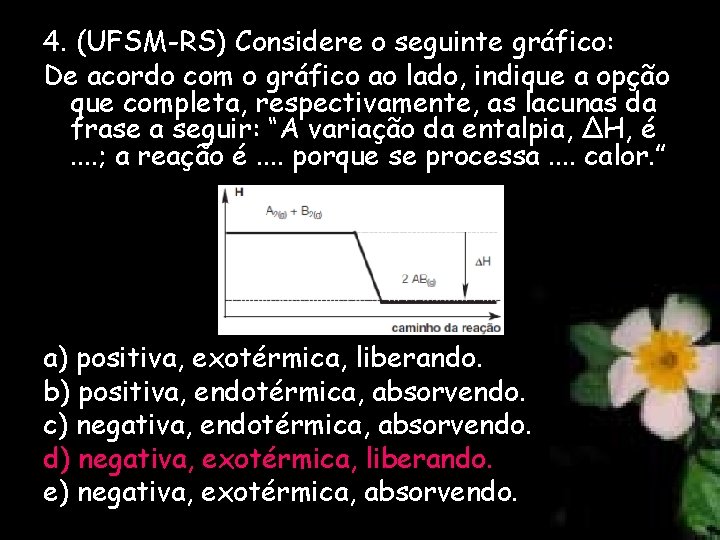
4. (UFSM-RS) Considere o seguinte gráfico: De acordo com o gráfico ao lado, indique a opção que completa, respectivamente, as lacunas da frase a seguir: “A variação da entalpia, ΔH, é. . ; a reação é. . porque se processa. . calor. ” a) positiva, exotérmica, liberando. b) positiva, endotérmica, absorvendo. c) negativa, endotérmica, absorvendo. d) negativa, exotérmica, liberando. e) negativa, exotérmica, absorvendo.

4. (UFSM-RS) Considere o seguinte gráfico: De acordo com o gráfico ao lado, indique a opção que completa, respectivamente, as lacunas da frase a seguir: “A variação da entalpia, ΔH, é. . ; a reação é. . porque se processa. . calor. ” a) positiva, exotérmica, liberando. b) positiva, endotérmica, absorvendo. c) negativa, endotérmica, absorvendo. d) negativa, exotérmica, liberando. e) negativa, exotérmica, absorvendo.

5. Combustão completa do álcool comum (etanol): a) Qual é a quantidade de calor liberado ou absorvido na queima de 5 mol de C 2 H 5 OH? b) Se ocorresse a formação de 1 mol de CO 2 na reação, qual seria a quantidade de calor liberado ou absorvido? c) Calcule a quantidade de calor liberado ou absorvido na queima de 460 g de C 2 H 5 OH.

Solução a) Se observarmos a reação percebemos que: 1 mol de C 2 H 5 OH ------- Calor -1373 KJ 5 mol de C 2 H 5 OH ------- Calor X Logo; X = 5. (- 1373) X = - 6865 KJ

b) 2 mol de CO 2 ----- Calor – 1373 KJ 1 mol de CO 2 -----X Logo; 2 X = - 1373 / 2 X = - 686, 5 KJ Serão liberados 686, 5 KJ na formação de 1 mol de CO 2.

c) 1 mol de C 2 H 5 OH ------- 46 g X ------- 460 g Logo; 46 X = 460 ; X = 460 / 46 ; X = 10 mol 1 mol de C 2 H 5 OH ------ Calor – 1373 KJ 10 mol de C 2 H 5 OH -----Logo; X = - 1373. 10 X = - 13730 KJ X

6. Considere a reação de combustão das variedades alotrópicas do carbono, representadas no gráfico: Resolva as seguintes questões: I — As duas combustões são exotérmicas ou endotérmicas? II — Calcule o ΔH das combustões da grafite e do diamante. III —Em qual delas ocorre maior liberação de calor?

Solução I. Exotérmicas. II. ΔH = HP – HR 1. C(graf) ΔH = -394 – 0 = -394 KJ 2. C(diam) ΔH = -394 – 1, 9 = - 395, 9 KJ III. Carbono Diamante.

7. (Fatec-SP) A combustão do gás hidrogênio pode ser representada pela equação:

Solução Sempre, em qualquer galáxia, uma reação de combustão completa terá como produtos H 2 O(l) e CO 2(g). Portanto, alternativa “a” de abestalhado!

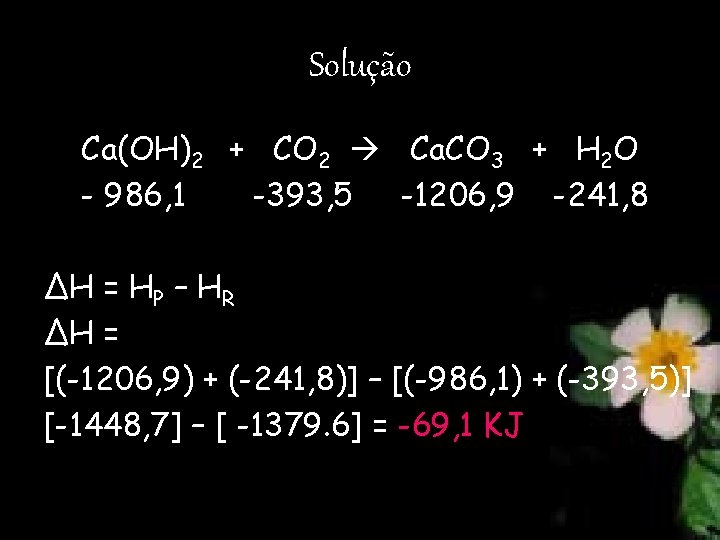
9. (UNI-RIO) Os romanos utilizavam Ca. O como argamassa nas construções rochosas. O Ca. O era misturado com água, produzindo Ca(OH)2, que reagia lentamente com o CO 2 atmosférico, dando calcário: A partir dos da tabela, a variação de entalpia da reação, em k. J/mol, será igual a: a) +138, 2. b) – 69, 1. c) – 2 828, 3 d) +69, 1. e) – 220, 8.

Solução Ca(OH)2 + CO 2 Ca. CO 3 + H 2 O - 986, 1 -393, 5 -1206, 9 -241, 8 ΔH = HP – HR ΔH = [(-1206, 9) + (-241, 8)] – [(-986, 1) + (-393, 5)] [-1448, 7] – [ -1379. 6] = -69, 1 KJ

• Alternativa ‘b’ de Besta!

Lei Hess

Lei de Hess: para uma dada reação, a variação de entalpia é sempre a mesma, esteja essa reação ocorrendo em uma ou em várias etapas. Ex: Reação de combustão do Carbono para a formação do monóxido de carbono: C(g) + ½ O 2 CO(g) Reação difícil de ocorrer. . .

Ex: Determine a entalpia de formação do CO 2 sabendo-se que: C(gr) + ½ O 2(g) CO(g) + ½ O 2(g) CO 2 ΔH 1 = -26, 4 kcal ΔH 2 = -67, 7 kcal Reação de formação do CO 2: C(gr) + O 2(g) CO 2(g) ΔH = ?

Podemos somar as duas equações: C(gr) + ½ O 2(g) CO(g) ΔH 1 = -26, 4 kcal CO(g) + ½ O 2(g) CO 2 ΔH 2 = -67, 7 kcal _+_______________ C(gr) + O 2(g) CO 2(g) ΔH = -26, 4 -67, 7 = -94, 1 kcal

10. A partir dos valores de ∆H determine a variação de entalpia do processo: N 2 (g) + O 2 (g) → I. 2 NO 2 (g) ∆H = ? N 2 (g) + 2 O 2 (g) → 2 NO 2 (g) ∆H = + 66 k. J. mol-1 II. 2 NO (g) + O 2 (g) ∆H = – 113 k. J. mol-1 → 2 NO 2 (g)

12. Calcule o ∆H da reação abaixo: P 4 (s) + 10 Cl 2 (g) → 4 PCl 5 (s) ∆H = ? etapas: P 4 (s) + 6 Cl 2 (g) → 4 PCl 3 (l) ∆H = – 1. 279 k. J. mol-1 4 PCl 3 (l) + 4 Cl 2 (g) → 4 PCl 5 (s) ∆H = – 496 k. J. mol-1

14. Dadas as equações termoquímicas: C (Graf. )→ C (diam. ) ∆H = ? I) C (Graf. ) + O 2 (g) → CO 2 (g) ∆H = - 94, 10 kcal II) C (diam. ) + O 2 (g) → CO 2 (g) ∆H = - 94, 55 kcal A variação de entalpia será: a) - 188, 65 kcal b) + 0, 45 kcal c) + 188, 65 kcal d) – 0, 45 kcal e) – 94, 32 kcal

15. Observe as equações termoquímicas: I) C (s) + H 2 O (g) → CO (g) + H 2 (g) ∆H = + 31, 4 kcal II) CO (g) + ½ O 2 (g) → CO 2 (g) ∆H = - 67, 6 kcal III) H 2 (g) + ½ O 2 (g) → H 2 O(g) ∆H = - 57, 8 kcal De acordo com o ∆H ( variação de entalpia), podemos afirmar que: a) II é endotérmica, I e III exotérmica. b) I e II são endotérmicas, II exotérmica. c) II e III são endotérmicas, I exotérmica. d) I e II são endotérmicas, III exotérmica. e) I é endotérmica, II e III exotérmicas.

• 16. (Mackenzie-SP) S 8 (rômbico) + 12 O 2(g) 8 SO 3(g) + 752, 0 kcal. Na reação acima equacionada, realizada a 25ºC e 1 atm, a entalpia de formação do SO 3(g) é igual a: a) +752, 0 kcal b) -752, 0 kcal c) + 773, 0 kcal d) -94, 0 kcal e) +94, 0 kcal
 20 trocas
20 trocas Quimiorreceptores
Quimiorreceptores Gemulação
Gemulação Calor especifico da agua
Calor especifico da agua Fologori
Fologori Trocas gasosas
Trocas gasosas Estudo das leis gerais do pensamento
Estudo das leis gerais do pensamento Estudo das sete trombetas
Estudo das sete trombetas High- level format of disk lays down:
High- level format of disk lays down: High- level format of disk lays down:
High- level format of disk lays down: Lays a moral and meaningful foundation for life
Lays a moral and meaningful foundation for life Bcg matrix of pepsico
Bcg matrix of pepsico Lays campesinas
Lays campesinas Dikda
Dikda Lays mascot
Lays mascot Advantage and disadvantage of lays chips
Advantage and disadvantage of lays chips Lays mascot
Lays mascot Lays vs lies
Lays vs lies Ich bin das licht der welt
Ich bin das licht der welt Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Canto v est 92 a 100
Canto v est 92 a 100 Eu fico com a pureza gonzaguinha
Eu fico com a pureza gonzaguinha Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Sai da tua terra, da tua parentela mensagem
Sai da tua terra, da tua parentela mensagem Tipos de temperamento
Tipos de temperamento Desenho de pesquisa qualitativa
Desenho de pesquisa qualitativa Hermano alexandre lima rocha
Hermano alexandre lima rocha Uma bola sera retirada de uma sacola contendo 5
Uma bola sera retirada de uma sacola contendo 5 Estudo transversal
Estudo transversal Exemplos de estudo de caso prontos
Exemplos de estudo de caso prontos Coorte
Coorte Diagrama de caso de uso simbologia
Diagrama de caso de uso simbologia Estudo
Estudo Levitico 4 estudo
Levitico 4 estudo O que é um estudo ecológico
O que é um estudo ecológico Igreja batista itacuruça culto ao vivo
Igreja batista itacuruça culto ao vivo Estudo salmo 120
Estudo salmo 120 Estudo sobre o jovem rico
Estudo sobre o jovem rico Estudo duplo cego
Estudo duplo cego Tipos de pesquisa cientifica
Tipos de pesquisa cientifica Tipos de estudo epidemiológico
Tipos de estudo epidemiológico Antes crescei na graça e no conhecimento
Antes crescei na graça e no conhecimento Judeus hebreus
Judeus hebreus Sexta trombeta
Sexta trombeta Salmo 93 3
Salmo 93 3 Objecto de estudo
Objecto de estudo Exodo 39 estudo
Exodo 39 estudo Estudo 17
Estudo 17 Estudo cientifico
Estudo cientifico Estudo de coorte
Estudo de coorte Tipos de estudo epidemiológico
Tipos de estudo epidemiológico Cefak estudo metódico do evangelho
Cefak estudo metódico do evangelho