Termoqumica TERMOQUMICA A QUMICA DOS EFEITOS ENERGTICOS OS















































- Slides: 61

Termoquímica

TERMOQUÍMICA A QUÍMICA DOS EFEITOS ENERGÉTICOS.

OS PRINCÍPIOS FUNDAMENTAIS DO CALOR E DO TRABALHO SE APLICAM, NO ESTUDO DE UMA REAÇÃO QUÍMICA E NAS MUDANÇAS DO ESTADO FÍSICO DE UMA SUBST NCIA.

pilha OBSERVE OS FENÔMENOS

NELES, OCORREM TRANSFORMAÇÕES FÍSICAS E (OU) QUÍMICAS ENVOLVENDO VÁRIOS TIPOS DE ENERGIA, INCLUSIVE ENERGIA TÉRMICA.

CONCEITOS IMPORTANTES SISTEMA - tudo aquilo que se reserva do universo para estudo. ENERGIA - resultado do movimento e da força gravitacional existentes nas partículas formadoras da matéria. ENERGIA QUÍMICA - trabalho realizado por um sistema através de reações químicas. CALOR - energia que flui de um sistema com temperatura mais alta para o outro com temperatura mais baixa. TRABALHO - deslocamento de um corpo contra uma força que se opõe a esse deslocamento.

EM UM SISTEMA ISOLADO A ENERGIA É SEMPRE A MESMA, ELA SE CONSERVA; PODE-SE DIZER ENTÃO QUE A ENERGIA DO UNIVERSO É CONSTANTE.

ENERGIA INTERNA ENERGIA ACUMULADA POR UMA SUBST NCIA SOB VOLUME CONSTANTE. ENTALPIA ENERGIA ACUMULADA POR UMA SUBST NCIA SOB PRESSÃO CONSTANTE, RESUMIDAMENTE, PODEMOS DIZER QUE É O CONTÉUDO DE CALOR DA SUBST NCIA.

O PROCESSO DE MEDIDA DOS CALORES DE REAÇÃO É DENOMINADO CALORIMETRIA. O APARELHO QUE MEDE A ENTALPIA DA REAÇÃO É DENOMINADO CALORÍMETRO.

CALORIA é a quantidade de energia necessária para aumentar de 1ºC a temperatura de 1 g de água. JOULE é a quantidade de energia necessária para deslocar uma massa de 1 kg, inicialmente em repouso, fazendo percurso de 1 metro em 1 segundo. 1 cal = 4, 18 J 1 kcal = 1000 cal 1 k. J = 1000 J

EFEITOS ENERGETICOS NAS REACõES QUÍMICAS Na fotossíntese ocorre absorção de calor 6 CO 2 + 6 H 2 O LUZ CLOROFILA C 6 H 12 O 6 + 6 O 2 GLICOSE Na combustão do etanol ocorre liberação de calor ETANOL

A TERMOQUÍMICA ESTUDA AS MUDANÇAS TÉRMICAS ENVOLVIDAS NAS REAÇÕES QUÍMICAS * quando envolve liberação de calor, denomina-se REAÇÃO EXOTÉRMICA. * quando envolve absorção de calor, denomina-se REAÇÃO ENDOTÉRMICA.

EQUAÇÃO TERMOQUÍMICA É a representação de uma reação química em que está especificado: * o estado físico de todas as substâncias. * o balanceamento da equação. * a variação de calor da reação ( H ). * variedade alotrópica quando existir. * as condições físicas em que ocorre a reação, ou seja, temperatura e pressão. ( 25ºC e 1 atm é o comum) Segue alguns exemplos. . .

REAÇÃO EXOTÉRMICA + 3 H 2(g) C 2 H 6(g) 2 C (s) + 3 H 2(g) C 2 H 6(g) + 20, 2 kcal 2 C (s) H= – 20, 2 kcal REAÇÃO ENDOTÉRMICA Fe 3 O 4(s) 3 Fe (s) + 2 O 2(g) H= + 267, 0 kcal - 267, 0 kcal

REAÇÃO EXOTÉRMICA OBSERVE OS SINAIS + 3 H 2(g) C 2 H 6(g) 2 C (s) + 3 H 2(g) C 2 H 6(g) + 20, 2 kcal 2 C (s) REAÇÃO ENDOTÉRMICA H = – 20, 2 kcal OBSERVE OS SINAIS Fe 3 O 4(s) 3 Fe (s) + 2 O 2(g) H = + 267, 0 kcal Fe 3 O 4(s) 3 Fe (s) + 2 O 2(g) - 267, 0 kcal

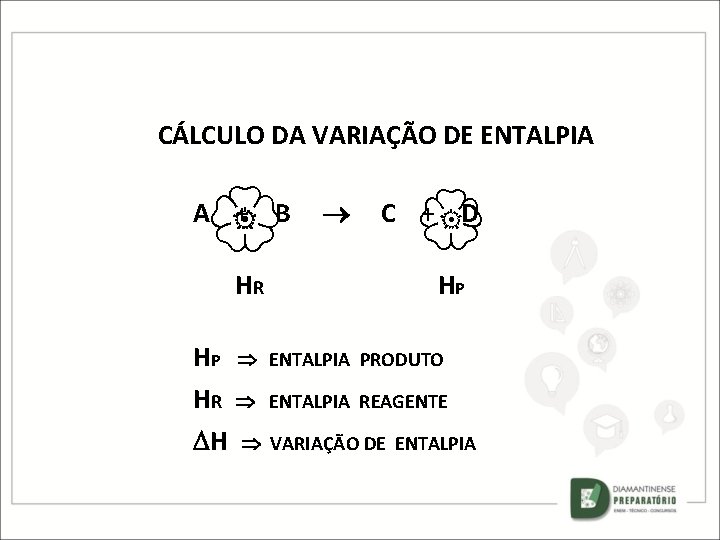
CÁLCULO DA VARIAÇÃO DE ENTALPIA A + B HR C + D HP HP ENTALPIA PRODUTO HR ENTALPIA REAGENTE H VARIAÇÃO DE ENTALPIA

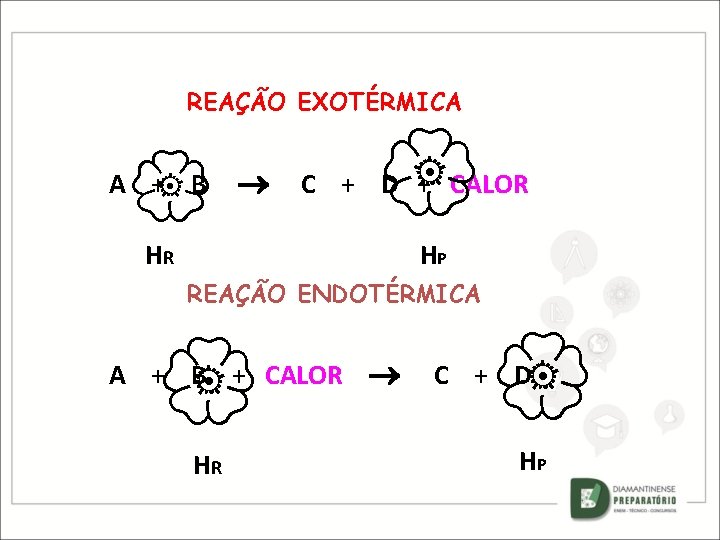
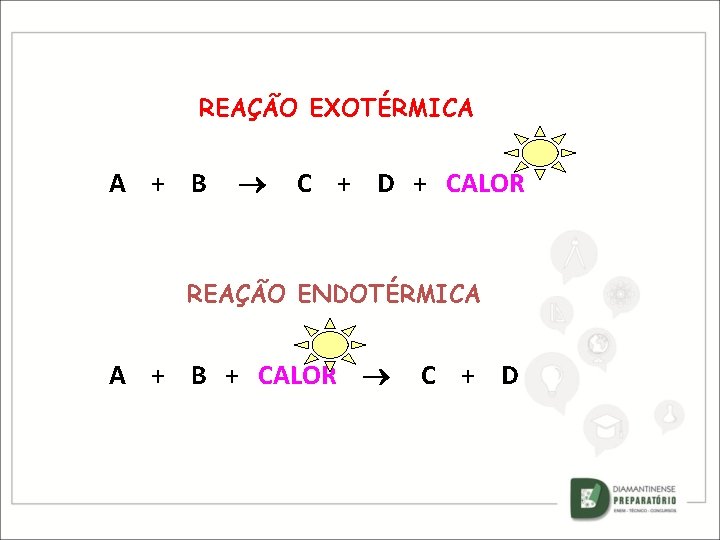
REAÇÃO EXOTÉRMICA A + B C + D + CALOR HR HP REAÇÃO ENDOTÉRMICA A + B + CALOR HR C + D HP

Não esqueça: HP ENTALPIA PRODUTO HR ENTALPIA REAGENTE H VARIAÇÃO DE ENTALPIA

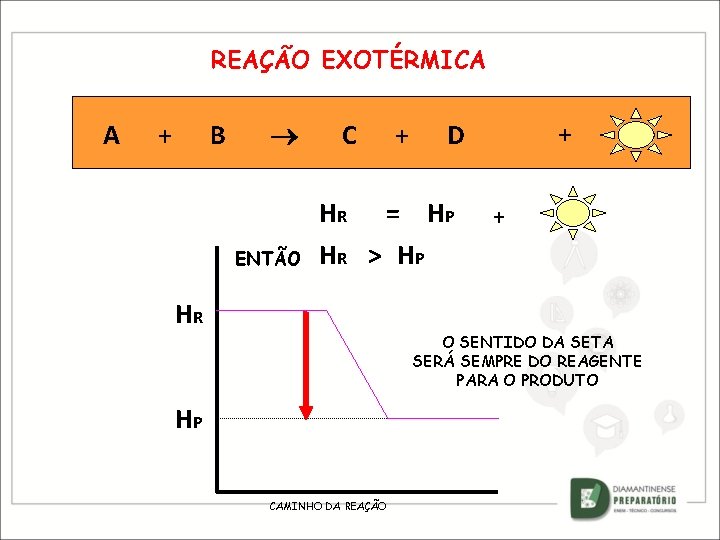
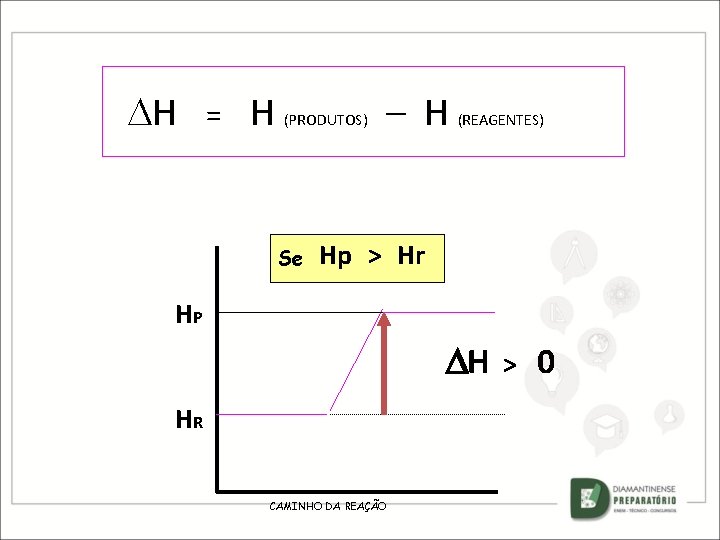
REAÇÃO EXOTÉRMICA A + B ENTÃO C + HR = HP HR > HP HR + D + O SENTIDO DA SETA SERÁ SEMPRE DO REAGENTE PARA O PRODUTO HP CAMINHO DA REAÇÃO

REAÇÃO EXOTÉRMICA A + B C + D + CALOR REAÇÃO ENDOTÉRMICA A + B + CALOR C + D

REAÇÃO ENDOTÉRMICA A + B + ENTÃO C + Hp = Hr Hp > Hr + D HP O SENTIDO DA SETA SERÁ SEMPRE DO REAGENTE PARA O PRODUTO HR CAMINHO DA REAÇÃO

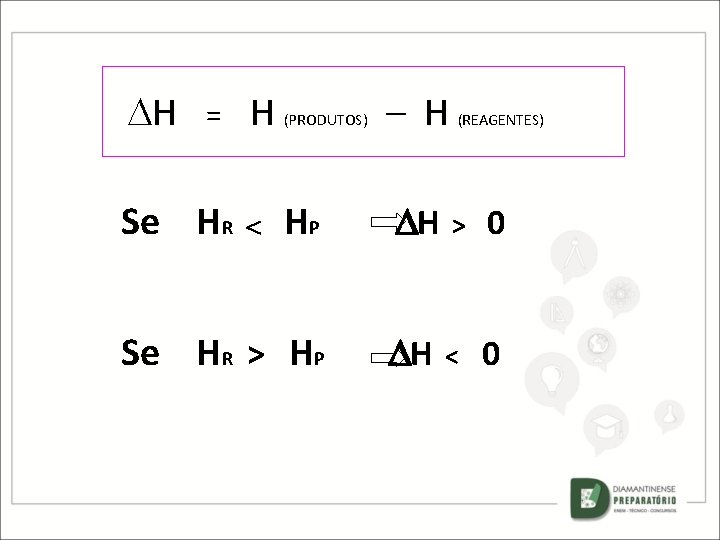
H = Se HR H (PRODUTOS) – H (REAGENTES) HP H > 0 Se HR > HP H < 0

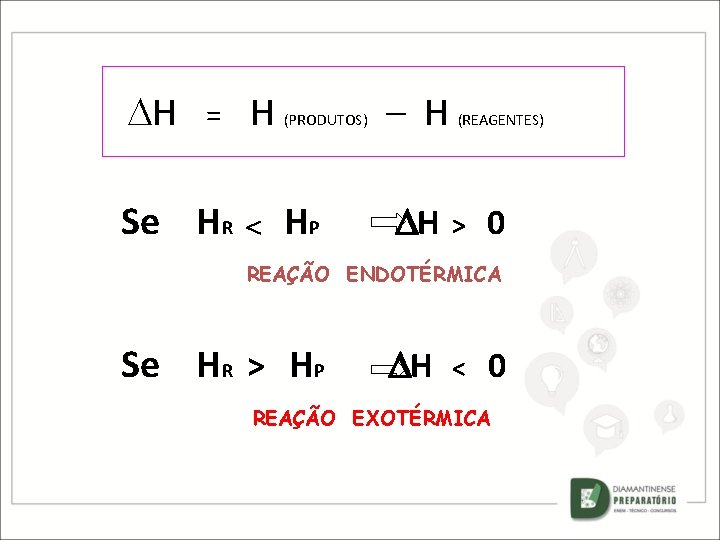
H = Se HR H (PRODUTOS) HP – H H (REAGENTES) > 0 REAÇÃO ENDOTÉRMICA Se HR > HP H < 0 REAÇÃO EXOTÉRMICA

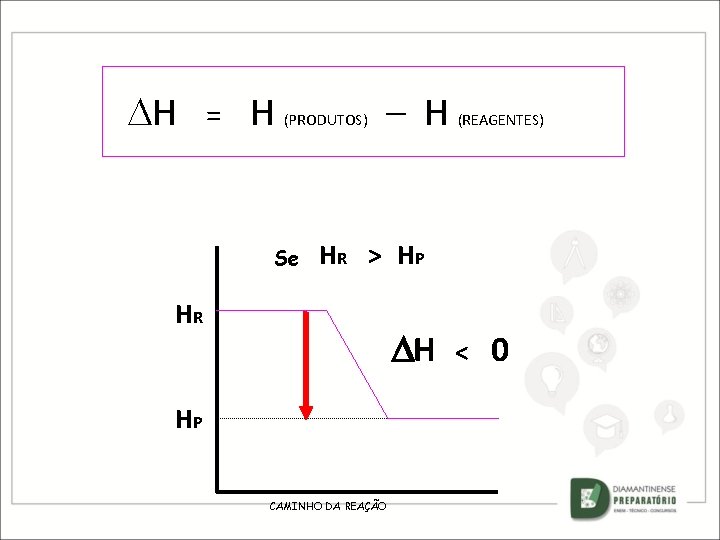
H = H (PRODUTOS) Se – H (REAGENTES) HR > HP HR H HP CAMINHO DA REAÇÃO < 0

H = H (PRODUTOS) Se – H (REAGENTES) HR > HP HR H HP CAMINHO DA REAÇÃO EXOTÉRMICA < 0

H = H (PRODUTOS) Se – H (REAGENTES) Hp > Hr HP H HR CAMINHO DA REAÇÃO > 0

H = H (PRODUTOS) Se – H (REAGENTES) Hp > Hr REAÇÃO ENDOTÉRMICA HP H HR CAMINHO DA REAÇÃO > 0

OBS. : * Convencionou-se entalpia zero para determinadas substâncias simples, em razão de não ser possível medir o valor real da entalpia de uma substância. * Foram escolhidas condições-padrão para estabelecer medidas relativas. * Terá entalpia zero qualquer substância simples que se apresente nos estados físico e alotrópico mais comum, a 25ºC e 1 atm de pressão.


* A forma alotrópica menos estável tem entalpia maior que zero.

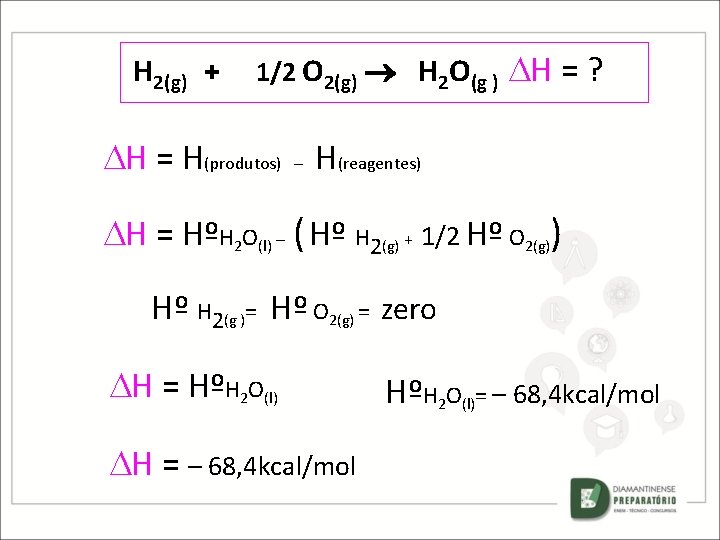
Observe a reação de formação (síntese ) de um mol de água, a 25ºC e 1 atm de pressão. H 2(g) + 1/2 O 2(g) H 2 O(g) Cálculo da entalpia de formação: H = H(produtos) - H(reagentes)

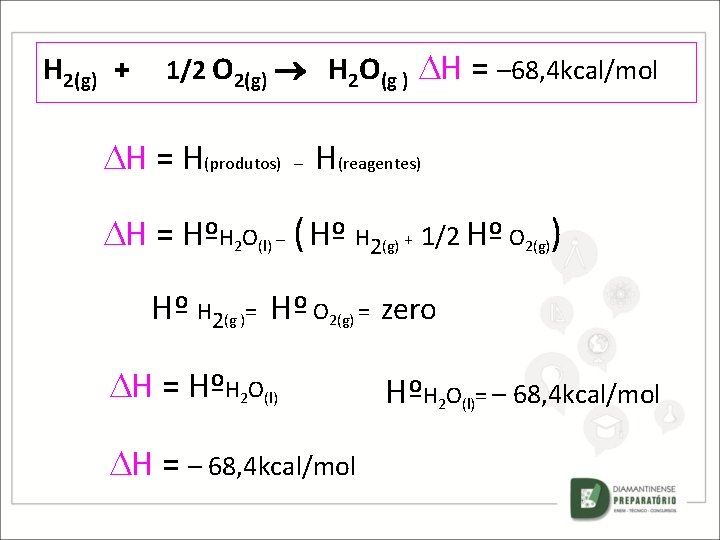
H 2(g) + 1/2 O 2(g) H 2 O(g ) H = ? H = H(produtos) – H(reagentes) H = HºH 2 O(l) – ( Hº H 2(g) + 1/2 Hº O 2(g)) COMO Hº H 2(g )= Hº O 2(g) = zero H = HºH 2 O(l) e ENTÃO H = – 68, 4 kcal/mol HºH 2 O(l)= – 68, 4 kcal/mol

H 2(g) + 1/2 O 2(g) H 2 O(g ) H = ? H = H(produtos) – H(reagentes) H = HºH 2 O(l) – ( Hº H 2(g) + 1/2 Hº O 2(g)) Hº H 2(g )= Hº O 2(g) = zero H = HºH 2 O(l) H = – 68, 4 kcal/mol HºH 2 O(l)= – 68, 4 kcal/mol

H 2(g) + 1/2 O 2(g) H 2 O(g ) H = – 68, 4 kcal/mol H = H(produtos) – H(reagentes) H = HºH 2 O(l) – ( Hº H 2(g) + 1/2 Hº O 2(g)) Hº H 2(g )= Hº O 2(g) = zero H = HºH 2 O(l) H = – 68, 4 kcal/mol HºH 2 O(l)= – 68, 4 kcal/mol

CÁLCULOS DA VARIAÇÃO DE ENTALPIA LEI DE HESS A entalpia de uma reação depende apenas dos estados iniciais e finais da reação, não depende dos estados intermediários, ou seja a reação é a mesma para uma ou mais etapas. Ex. 1 - Cálculo da entalpia da reação de formação do gás carbônico: C(grafite)+ O 2(g) CO 2(g) H = ? kcal/mol

OBSERVE AS EQUAÇÕES: C(grafite)+ 1/2 O 2(g) CO(g) H = – 26, 4 kcal/mol CO(g) + 1/2 O 2(g) CO 2(g) H = – 67, 6 kcal/mol

EFETUAMOS A SOMA ALGÉBRICA DAS MESMAS. Note que os termos semelhantes em membros opostos se anulam. 1ª etapa: C(grafite)+ 1/2 O 2(g) CO(g) H 1 = – 26, 4 kcal/mol 2ª etapa: CO(g) + 1/2 O 2(g) CO 2(g) H 2 = – 67, 6 kcal/mol Etapa final: C(grafite)+ CONCLUINDO O 2(g) CO 2(g) H = H 1 + H 2 H = – 94, 0 kcal/mol

Observe que o processo é puramente algébrico. 1ª etapa : C(grafite)+ 1/2 O 2(g) CO(g) H 1 = -26, 4 kcal/mol 2ª etapa : CO(g) + 1/2 O 2(g) CO 2(g) H 2 = -67, 6 kcal/mol Etapa final: C(grafite)+ O 2(g) CO 2(g) H = -94, 0 kcal/mol

Observe que o processo é puramente algébrico. 1ª etapa : C(grafite)+ 1/2 O 2(g) CO(g) H 1 = -26, 4 kcal/mol 2ª etapa : CO(g) + 1/2 O 2(g) CO 2(g) H 2 = -67, 6 kcal/mol Etapa final: C(grafite)+ O 2(g) CO 2(g) H = -94, 0 kcal/mol H = H 1 + H 2 = -94, 0 kcal/mol

Ex 2 - Dadas as equações: C(grafite )+ O 2(g) CO 2(g) H 1 = – 94, 0 kcal/mol H 2(g) + 1/2 O 2(g) H 2 O(l) H 2 = – 68, 4 kcal/mol C(grafite)+ 2 H 2(g) CH 4(g) H 3 = – 17, 9 kcal/mol Calcular a entalpia da reação: CH 4(g) + O 2(g) CO 2(g)+ H 2 O(l)

Resolução: As equações dadas deverão ser arrumadas de tal modo que a sua soma resulte na equação-problema. Agora vamos identificá-las com algarismos romanos. I) C(grafite )+ O 2(g) CO 2(g) II) H 2(g) + 1/2 O 2(g) H 2 O(l) III) C(grafite)+ 2 H 2(g) CH 4(g) H 1 = – 94, 0 kcal/mol H 2 = – 68, 4 kcal/mol H 3 = – 17, 9 kcal/mol Equação-problema: CH 4(g) + O 2(g) CO 2(g)+ H 2 O(l)

Devemos manter a equação I pois dessa forma obteremos gás carbônico como produto. C(grafite )+ O 2(g) CO 2(g) H 1 = – 94, 0 kcal/mol Multiplicar por 2 a equação II para que os coeficientes fiquem ajustados. ( ) 2 H 2(g) + 1/2 O 2(g) H 2 O(l) H 2 = – 68, 4 kcal/mol 2 H 2(g) + O 2(g) 2 H 2 O(l) H 2 = – 136, 8 kcal/mol O H 2 também é multiplicado Agora, invertemos a equação III de modo a obter o metano ( CH 4 ) como reagente. Observe a inversão de sinal do H 3 CH 4(g) C(grafite)+ 2 H 2(g) H 3 = + 17, 9 kcal/mol

Finalmente aplica-se a soma algébrica das equações, inclusive das variações de entalpia. C(grafite )+ O 2(g) CO 2(g) H 1 = – 94, 0 kcal/mol 2 H 2(g) + O 2(g) 2 H 2 O(l) H 2 = – 136, 8 kcal/mol CH 4(g) C(grafite)+ 2 H 2(g) H 3 = + 17, 9 kcal/mol _______________________________

Observe os cortes: C(grafite )+ O 2(g) CO 2(g) H 1 = – 94, 0 kcal/mol 2 H 2(g) + O 2(g) 2 H 2 O(l) H 2 = – 136, 8 kcal/mol CH 4(g) C(grafite)+ 2 H 2(g) H 3 = + 17, 9 kcal/mol _______________________________ CH 4(g) + 2 O 2(g) CO 2(g)+ 2 H 2 O(l) H = – 212, 9 kcal/mol H = H 1 + H 2 + H 3

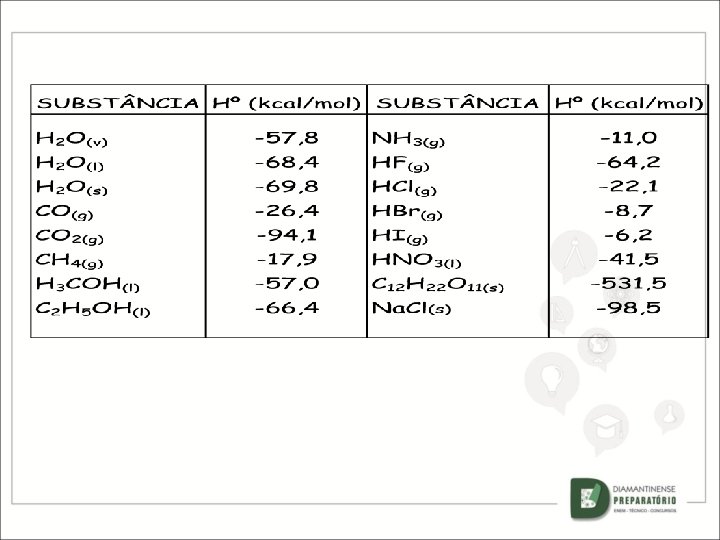
CALORES PADRÃO DE FORMAÇÃO OU ENTALPIA-PADRÃO DE FORMAÇÃO É o calor desenvolvido na formação de um mol de determinado composto, a partir das substâncias simples correspondentes no estado padrão. Representa-se por: O índice sobrescrito padrão. Hfº º significa estado O índice subscrito f significa formação. .

- é aquela em que um mol de um único composto é formado a partir de substâncias simples no estado padrão. Exs. : C(grafite )+ O 2(g) CO 2(g) REAÇÃO DE FORMAÇÃO 1 mol H 2(g) + 1/2 O 2(g) H 2 O(l) 1 mol Os valores de H são pré-estabelecidos e encontrados em tabelas, para aqueles compostos que estejam na sua forma mais estável a 1 atm de pressão, ou seja, no estado padrão.


CALOR PADRÃO DE COMBUSTÃO OU ENTALPIA-PADRÃO DE COMBUSTÃO É o calor liberado na combustão total de um mol de uma substância em que os componentes dessa reação estão no estado-padrão. H 2(g) + 1/2 O 2(g) H 2 O(l) H=– 68, 4 kcal/mol C 2 H 5 OH(l) + 3 O 2(g) 2 CO 2(g) + 3 H 2 O(l) H=– 325 kcal/mol COMBUSTÃO - reação de uma substância com o oxigênio (O 2) em que ocorre liberação de energia. ( REAÇÃO EXOTÉRMICA )

O PODER CALÓRICO DE ALGUMAS SUBST NCIAS A gasolina possui maior poder clalorífico que o álcool. Para cada litro de gasolina queimado são produzidos aproximadamente 8000 quilocalorias, enquanto para cada litro de álcool queimado, temos a produção de aproximadamente 5000 quilocalorias. Veja a tabela de calorias de alguns alimentos, a seguir.


CALOR DE DISSOLUÇÃO OU ENTALPIA DE DISSOLUÇÃO É o calor desenvolvido ( liberado ou absorvido) provocado pela dissolução de um mol de substância, numa quantidade de água suficiente para se obter uma solução diluída, no estado padrão. H 2 SO 4(l) + aq H 2 SO 4(aq) H = – 22, 9 kcal/mol KNO 3(s) + aq KNO 3(aq) H = + 8, 5 kcal/mol

CALOR DE NEUTRALIZAÇÃO OU ENTALPIA DE NEUTRALIZAÇÃO É o calor liberado na neutralização de um equivalente-grama de um ácido por um equivalente-grama de uma base, ambos em soluções aquosas diluídas, no estado padrão. HCl(aq) + Na. OH(aq) Na. Cl(aq) + H 2 O(l) H = – 13, 8 kcal/eq-g HNO 3(aq) + Li. OH(aq) Li. NO 3(aq) + H 2 O(l) H = – 13, 8 kcal/eq-g OBS. : Para ácidos e bases fortes o H será sempre o mesmo.

A variação de entalpia de uma reação pode ser calculada, conhecendo-se apenas as entalpias de formação dos seus reagentes e produtos. H = H(produtos) – H(reagentes)

Observe a equação: C 3 H 8(g) + 5 O 2(g) 3 CO 2(g) + 4 H 2 O(g) H = ? – kcal/mol Consultando a tabela de calores de formação: SUBST NCIAS C 3 H 8(g) CO 2(g) H 2 O (g) O 2(g) H -24, 8 kcal/mol -94, 1 kcal/mol -57, 8 kcal/mol zero

H = H(produtos) – H(reagentes) H = [3 HCO 2(g)+ 4 H H 2 O(g) ] - ( HC 3 H 8(g)+ 5 HO 2(g) ) H = [ 3(-94, 1) + 4(-57, 8)] - (-24, 8 + zero) H = - 488, 7 kcal/mol

ENERGIA DE LIGAÇÃO É A ENERGIA NECESSÁRIA PARA ROMPER UM MOL DE LIGAÇÃO DE UMA SUBST NCIA NO ESTADO GASOSO. EX. Para romper um de ligação H – O são necessárias 110 kcal. Para romper um de ligação H – C são necessárias 100 kcal. Para romper um de ligação O = O são necessárias 118 kcal. . * esses valores são tabelados

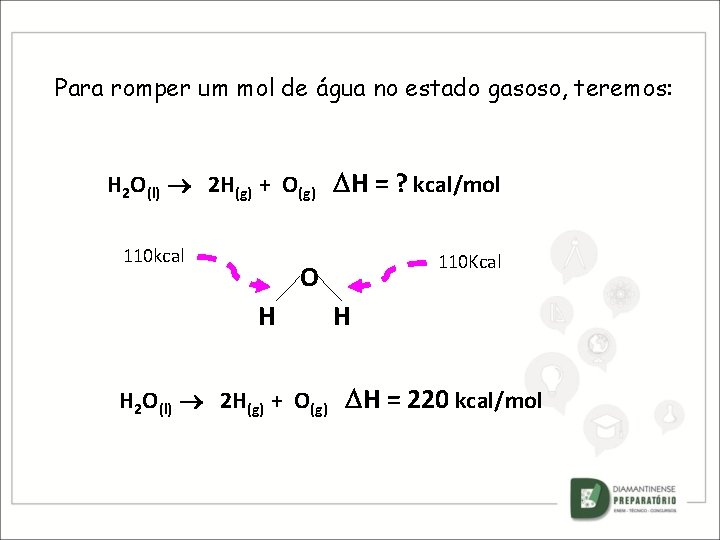
Para romper um mol de água no estado gasoso, teremos: H 2 O(l) 2 H(g) + O(g) H = ? kcal/mol 110 kcal 110 Kcal O H H H 2 O(l) 2 H(g) + O(g) H = 220 kcal/mol

Observe a reação em que todos os participantes estão no estado gasoso: H | H— C— O — H + 3/2 O 2 | H O = C = O + 2 H 2 O Para romper as ligações intramoleculares do metanol e do oxigênio, serão absorvidos, para: 1 mol de O — H +464, 0 kj + 464, 0 kj 1 mol de C — O +330, 0 kj + 330, 0 kj 3 mols de C — H 3 (+413, 0 kj) + 1239, 0 kj 3/2 mols de O = O 3/2 (+493, 0 kj) + 739, 5 kj TOTAL ABSORVIDO + 2772, 5 kj

Cômputo dos produtos: H | H— C— O — H + 3/2 O 2 | H O = C = O + 2 H 2 O Para formar as ligações intramoleculares do CO 2 e da água, serão liberadas: 2 mols de C = O 2 (-7444, 0 kj) 2 mols de H — O 2 ( - 464, 0 kj) TOTAL LIBERADO -1 488, 0 kj - 928, 0 kj -2 416, 0 kj

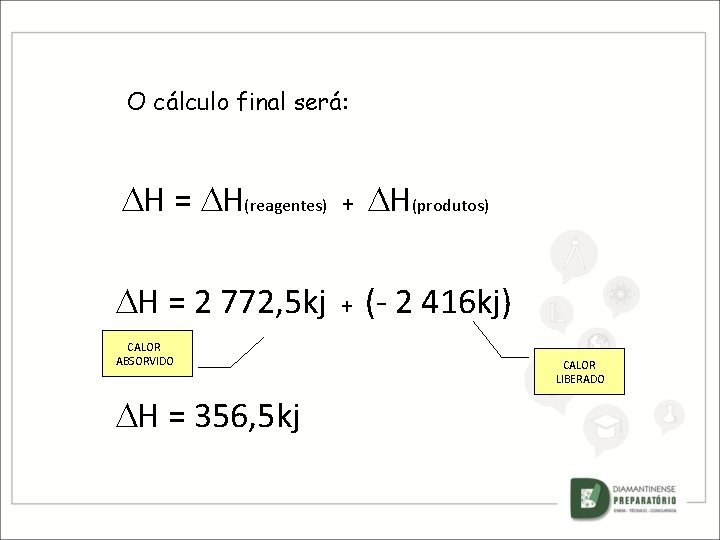
O cálculo final será: H = H(reagentes) + H(produtos) H = 2 772, 5 kj + (- 2 416 kj) CALOR ABSORVIDO H = 356, 5 kj CALOR LIBERADO

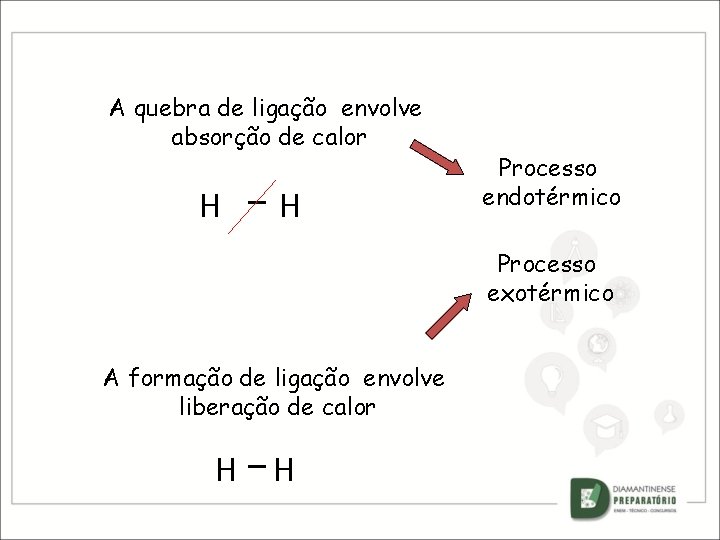
A quebra de ligação envolve absorção de calor H — H Processo endotérmico Processo exotérmico A formação de ligação envolve liberação de calor H —H
 Chá herbalife efeitos colaterais
Chá herbalife efeitos colaterais O que é um efeito de sentido
O que é um efeito de sentido Extenses
Extenses Ebulioscopia slide
Ebulioscopia slide Atividades sobre cores 7 ano
Atividades sobre cores 7 ano Efeitos da noradrenalina
Efeitos da noradrenalina Efeitos biologicos da radiação
Efeitos biologicos da radiação Ebulio
Ebulio Nitroprussiato efeitos colaterais
Nitroprussiato efeitos colaterais Radiacao alfa beta gama
Radiacao alfa beta gama Mediunidade de cura e efeitos físicos
Mediunidade de cura e efeitos físicos Efeitos biologicos da radiação
Efeitos biologicos da radiação Efeitos coligativos
Efeitos coligativos Qumica
Qumica Oxidos neutros
Oxidos neutros Hibridação
Hibridação Qumica
Qumica Qumica
Qumica Formula de los eteres
Formula de los eteres Ionização
Ionização Truta
Truta Qumica
Qumica Qumica
Qumica Qumica
Qumica Como sacar entalpia de reaccion
Como sacar entalpia de reaccion Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Epimeros
Epimeros Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Philippe spitaleri kaufmann
Philippe spitaleri kaufmann Qumica
Qumica Reacciones de orden cero
Reacciones de orden cero Qumica
Qumica Entalpia
Entalpia Qumica
Qumica Qumica
Qumica Stoicheon
Stoicheon Lei de hess
Lei de hess Qumica
Qumica Etapas da gravimetria
Etapas da gravimetria Hidrocarburos
Hidrocarburos Definição de alcinos
Definição de alcinos Qumica
Qumica Reação endergônica
Reação endergônica Tabla qumica
Tabla qumica Hidrocarbonetos
Hidrocarbonetos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Clivagem oxidativa de alcenos
Clivagem oxidativa de alcenos Metiletanamida
Metiletanamida Livresq
Livresq Propiedades extensivas
Propiedades extensivas Qumica
Qumica Qumica
Qumica Cintica
Cintica