STRUCTURES DES ENZYMES ET MECANISME DACTION 20182019 PLAN




















![La courbe [P] = f (t) est : -d’abord linéaire ascendante : l’E est La courbe [P] = f (t) est : -d’abord linéaire ascendante : l’E est](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-25.jpg)
![INFLUENCE DE LA CONCENTRATION DU SUBSTRAT SUR LA VITESSE INITIALE : �A [E] constant, INFLUENCE DE LA CONCENTRATION DU SUBSTRAT SUR LA VITESSE INITIALE : �A [E] constant,](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-26.jpg)




![• KM est la constante de dissociation du complexe [ES], appelée constante de • KM est la constante de dissociation du complexe [ES], appelée constante de](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-32.jpg)
















![Inhibiteur compétitif o Équations d’inhibition compétitive : ‐ [E]t = [E] + [ES] + Inhibiteur compétitif o Équations d’inhibition compétitive : ‐ [E]t = [E] + [ES] +](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-57.jpg)
![Inhibiteur non compétitif o Équations d’inhibition non compétitive : [E]t= [E] + [ES] + Inhibiteur non compétitif o Équations d’inhibition non compétitive : [E]t= [E] + [ES] +](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-62.jpg)

![Inhibiteur incompétitif o Équations d’inhibition incompétitive : [E]t = [E] + [ESI] V’max= Vmax Inhibiteur incompétitif o Équations d’inhibition incompétitive : [E]t = [E] + [ESI] V’max= Vmax](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-66.jpg)









- Slides: 80

STRUCTURES DES ENZYMES ET MECANISME D’ACTION 2018/2019

PLAN DU COURS 1. Introduction 2. Propriétés des enzymes 3. Nature des enzymes 4. Structure des enzymes 5. Site catalytique 6. Les isoenzymes ou isoformes 7. Les complexes multienzymatiques 8. Nomenclature des enzymes 9. Classification des enzymes 10. Mécanisme d’action des enzymes 11. Exemples de dosage d’enzymes en pathologie humaine

1. Introduction S E P

• Le composé transformé /une Enz E est nommé substrat S • Le composé obtenu est appelé produit P • Les Enzs permettent de répondre aux besoins vitaux des Ȼ dans lesquelles R doivent avoir lieu quasiinstantanément • Les Enzs sont des catalyseurs (↑V de la R)biologiques • Il existe = des catalyseurs chimiques (acides, certains métaux, etc. ) • les Enzs en tant que molécules biologiques vont présenter des propriétés qui leurs sont caractéristiques

2. Propriétés des enzymes • Catalyseurs biologiques ou biocatalyseurs : o catalyseur : nécessaires à la réalisation d’une réaction chimique : ↑ la V de R (d’un facteur de 103 à 106), en diminuant l’énergie libre d’activation. ‐ Agissent à faible dose (comparé aux concentrations du substrat). - Se retrouvent intactes en fin de réaction.

2. Propriétés des enzymes • Catalyseurs biologiques ou biocatalyseurs : o biologique : produits / la Ȼ (protéines+++). - détruites par une forte ↑de T° et inactivées à basse T° Max d’activité pour une T° donnée et pour un PH donné (conditions optimales).

2. Propriétés des enzymes • Double spécificité : o Spécificité d’action = accélère un seul type de réaction ( exp : hydrolyse ). o Spécificité de S= transforment un substrat donné. (plus ou moins stricte). • Exemple : glucokinase (spécificité étroite) : substrat glucose hexokinase (spécificité large): substrat hexoses • Réglables : modifient leur activité catalytique en réponse à des signaux métaboliques.

3. Nature des enzymes �+++Protéines: polymères d’Aa formant de longues chaines repliées dans l’espace en: Structure III aire l’état natif. Structure IV aire =monomères ou sous unités (un état natif) en nombre limité “oligo” = peu nb(2 -4) -Exp: 2 Ss U (monomères) pour la pyruvate kinase PK 3 Ss U pour la succinate déshydrogénase SDH �- - -ARN (activité enz) Exp: ribozymes.

4. Structure des enzymes q. Holoenzymes (holoprotéines) = Prq. Hétéroenzymes (hétéroprotéines) = Pr- (apoenzyme)+ cofacteurs

LES COFACTEURS q 1. cofacteurs: ions métalliques (bivalents) : Mg 2+, Zn 2+, ……. etc. ‐Rôle : stabilisation de la structure de l’Enz ou dans la fixation du S q 2. Coenzymes: M organiques non protéiques fabriquées à partir des Vit (alimentation) ‐Rôle: la catalyse Enz ‐Sont de deux types: q. Coenz fixés de façon permanente à l’enz (indissociables) =gp prosthétiques. q. Coenz fixés de façon transitoire sur l’enz(le Tps de la R) =Cosubstrat.

5. Site catalytique site actif • Situé au fond d’une poche de la zone interne hydrophobe de la Pr • Site où se fixe(nt) le substrat(s) et cas échéant le Coenz • Peut être séparé en : – le site de fixation du S grâce à l'établissement de très nbses liaisons faibles avec l’enz. il reconnait la complémentarité responsable de la spécificité de S de l'enz – le site catalytique responsable de la spécificité d'action de l'enz (transforme S →P) c’est le lieu de la R.

6. Les isoenzymes ou isoformes Enz qui catalysent la même réaction (même propriété catalytique) diffèrent par leurs propriétés physico-chimiques (leur séquence d’Aa ne sont pas identiques), chaque isoforme est produit dans un tissu donné (≠) • Exemple d’isoenzymes : la Créatine kinase CPK il existe 3 types d’isoenzymes : – CPK-MB : myocarde. – CPK-BB : cérébrale. – CPK-MM : muscles squelettiques.

7. Les complexes multienzymatiques • Les enz sont svt regpées structurellement en Cplx enzy • liés aux membranes biologiques ou libres dans le cytoplasme • le P de d'une Enz est le S de l'autre (Enz) et ainsi de suite → accélère grandement le passage des métabolites d'une enzyme à une autre le long de chaînes enzymatiques • Exemple : PDH (pyruvate déshydrogénase).


8. Nomenclature des enzymes • Conceptions anciennes : q Noms communs, consacrés par l’usage par exemple : pepsine, trypsine, chymotrypsine, papaïne, etc. q Nom du substrat suivi du suffixe « ase » par exemple : peptidase, phosphatase, etc. q Nom du substrat puis celui de la réaction catalysée avec le suffixe « ase » par exemple : malate déshydrogénase.

8. Nomenclature des enzymes • Conceptions actuelles : q recommandation de l’union internationale de biochimie (UIB) l’enzyme est dénommée par 4 chiffres séparés par des points. Ø 1 erchiffre: Classe des enzymes Ø 2èmechiffre: sous classe de l’enzyme : type de fonction du substrat participant à la réaction Ø 3èmechiffre: sous classe de l’enzyme : nature de l’accepteur Ø 4ème chiffre: numéro d’ordre ou groupe : place de l’enzyme particulière dans la sous classe.

8. Nomenclature des enzymes Exemple : ATP Glucose Phosphotransférase (2. 7. 1. 1) 2 : classe. 7 : sous classe. 1 : sous-sous classe. 1 : numéro d’ordre.

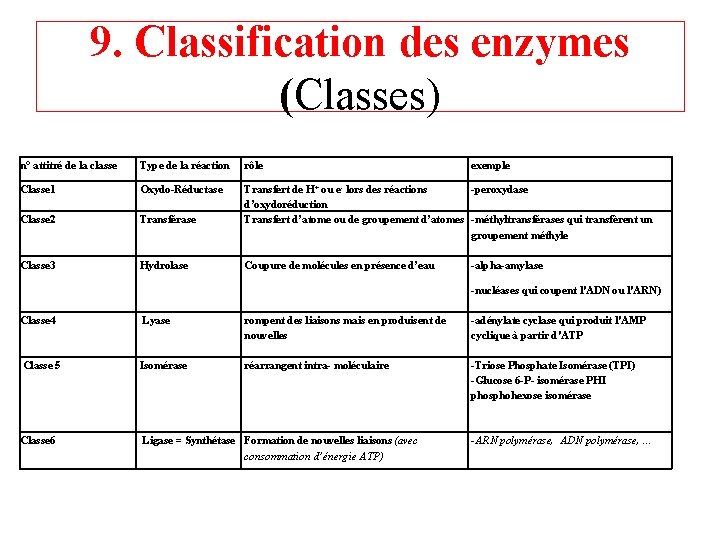
9. Classification des enzymes (Classes) n° attitré de la classe Type de la réaction rôle Classe 1 Oxydo-Réductase Classe 2 Transférase Transfert de H+ ou e- lors des réactions -peroxydase d’oxydoréduction Transfert d’atome ou de groupement d’atomes -méthyltransférases qui transfèrent un groupement méthyle Classe 3 Hydrolase Coupure de molécules en présence d’eau exemple -alpha-amylase -nucléases qui coupent l'ADN ou l'ARN) Classe 4 Lyase rompent des liaisons mais en produisent de nouvelles -adénylate cyclase qui produit l'AMP cyclique à partir d'ATP Classe 5 Isomérase réarrangent intra- moléculaire -Triose Phosphate Isomérase (TPI) -Glucose 6 -P- isomérase PHI phosphohexose isomérase Classe 6 Ligase = Synthétase Formation de nouvelles liaisons (avec consommation d’énergie ATP) -ARN polymérase, ADN polymérase, …

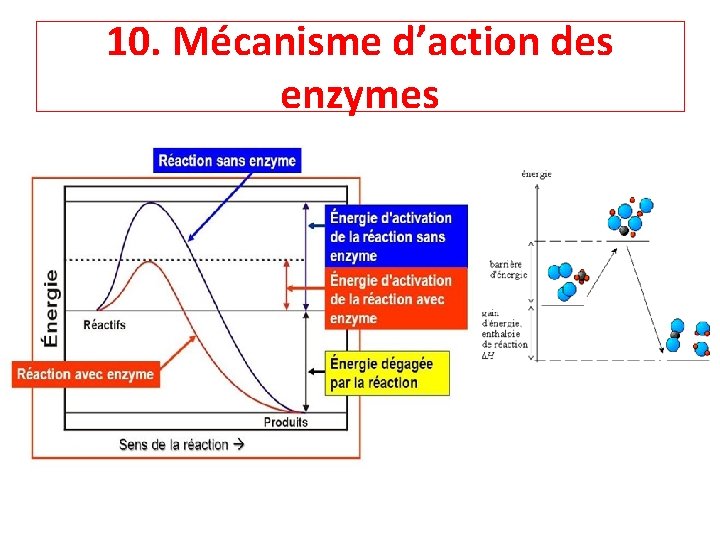
10. Mécanisme d’action des enzymes

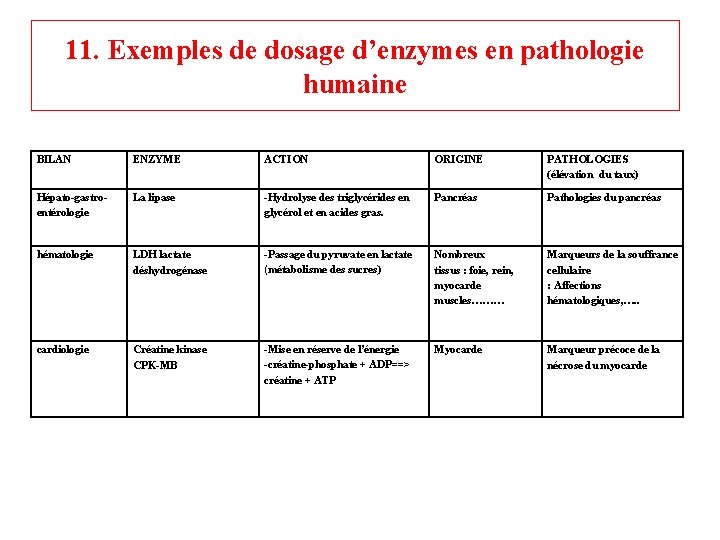
11. Exemples de dosage d’enzymes en pathologie humaine BILAN ENZYME ACTION ORIGINE PATHOLOGIES (élévation du taux) Hépato-gastroentérologie La lipase -Hydrolyse des triglycérides en glycérol et en acides gras. Pancréas Pathologies du pancréas hématologie LDH lactate déshydrogénase -Passage du pyruvate en lactate (métabolisme des sucres) Nombreux tissus : foie, rein, myocarde muscles……… Marqueurs de la souffrance cellulaire : Affections hématologiques, …. . cardiologie Créatine kinase CPK-MB -Mise en réserve de l’énergie -créatine-phosphate + ADP==> créatine + ATP Myocarde Marqueur précoce de la nécrose du myocarde

LA CINETIQUE ENZYMATIQUE PLAN DU COURS I. INTRODUCTION. II. LA VITESSE D’UNE REACTION ENZYMATIQUE. III. LA CONSTANTE DE MICHAELIS MENTEN. IV. L’EQUATION DE MICHAELIS MENTEN. V. REPRESENTATION GRAPHIQUE DE LINE WEAVER ET BURKE. VI. EXPRESSION DE L’ACTIVITE ENZYMATIQUE.

I. INTRODUCTION L'étude cinétique d'une réaction enzymatique consiste en l'étude de la vitesse de réaction et de l'influence de différents paramètres susceptibles de la modifier.

La R Enz peut se diviser en 3 principales étapes : 1. L’association de l’ (E) et (S) : ‐ Elle se produit en une région bien précise de l’enzyme appelée (site actif). ‐ Le site actif est une entité tridimesionnelle correspondant à une petite région de la protéine. ‐ Cette reconnaissance dynamique est appelée adaptation induite. • L’association enzyme-substrat (ES) est stabilisée par des liaisons de faibles énergie : liaisons hydrogène, interactions hydrophobes, liaisons ioniques……. 2. Le complexe ES subit un réarrangement interne qui va permettre la transformation du (S)en (P). 3. L’E libère le P de la R et retrouve son état initial.

II. LA VITESSE D’UNE REACTION ENZYMATIQUE �Soit la réaction catalysée par l’enzyme E qui transforme le substrat en produit S E P �La vitesse instantanée de réaction est la quantité de S disparue par unité de temps ou la quantité de P apparue par unité de temps ; elle est proportionnelle à la concentration du substrat : V= - ds/dt = dp/dt = K [S] �Pour des concentrations de [E] et de [S] données, on mesure la quantité de P formé en fonction du temps :
![La courbe P f t est dabord linéaire ascendante lE est La courbe [P] = f (t) est : -d’abord linéaire ascendante : l’E est](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-25.jpg)
La courbe [P] = f (t) est : -d’abord linéaire ascendante : l’E est saturée par son S, la vitesse est constante -puis s’infléchit : l’E n’est plus saturée par son S, la vitesse décroit -et enfin devient horizontale : l’équilibre de la réaction est atteint et la vitesse est nulle. A l’instant t, v=tgα. A l’instant t 0, v est maximale, c’est la vitesse vi initiale de la réaction : vi=tgα 0
![INFLUENCE DE LA CONCENTRATION DU SUBSTRAT SUR LA VITESSE INITIALE A E constant INFLUENCE DE LA CONCENTRATION DU SUBSTRAT SUR LA VITESSE INITIALE : �A [E] constant,](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-26.jpg)
INFLUENCE DE LA CONCENTRATION DU SUBSTRAT SUR LA VITESSE INITIALE : �A [E] constant, on répète la mesure de Vi à des concentrations croissantes de S. �La courbe Vi=f([S]) est une courbe hyperbole qui tend vers une valeur limite, la vitesse maximale ou Vmax.

III. LA CONSTANTE DE MICHAELISMENTEN • En 1913, MICHAELIS et MENTEN ont établi l’équation d’une réaction enzymatique

III-LA CONSTANTE DE MICHAELIS-MENTEN l’équation d’une réaction enzymatique K 1 K 3 E + S ES E + P (1) K 2 se décompose en 02 temps : 1 -formation du complexe enzyme-substrat : • - La transformation du substrat en produit, se fait obligatoirement par le passage un état intermédiaire : le complexe enzyme substrat. • Etape rapide et réversible. V 1 , k 1 E + S ES V 2, k 2 • V 1 et K 1 sont les vitesse et constante de formation du complexe ES • V 2 et K 2 les vitesse et constante de dissociation du complexe ES.

• 2 -formation du produit P à partir du complexe enzyme-substrat : La deuxième étape correspond à la formation du produit à partir du complexe activé. • Étape plus lente V 3, k 3 ES E + P • V 3 et k 3 sont la vitesse et constante de formation du produit P.

• la vitesse de disparition du substrat S (‐ ds/dt) est égale à la vitesse de formation des produits de la réaction (d. P/dt). ‐ d. S/dt = d. P/dt (2) • D’après la loi d’action des masses on a : V 1 = K 1 [E] [S] K 1 V 1 K 3 V 3 E + S E + P K 2 V 2= K 2 [ES] • La vitesse d’apparition des produits des réactions : d. P/dt = V 3 = K 3 [ES] (3)

![KM est la constante de dissociation du complexe ES appelée constante de • KM est la constante de dissociation du complexe [ES], appelée constante de](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-32.jpg)
• KM est la constante de dissociation du complexe [ES], appelée constante de Michaelis-Menten (exprimée en mole/litre), elle définit l’affinité de l’enzyme pour son substrat : • Si KM est faible, l’affinité de l’enzyme pour le substrat est grande et réciproquement

III-l’Equation de Michaelis-Menten : L’enzyme est soit sous forme libre E, soit complexé au substrat ES: [ ET ]= [ E] + [ ES] → [ E]= [ ET]- [ ES] …………. . (1) � [ ET ] étant la concentration totale de l’E. Km=[ E] [ S]/ [ ES] Km=([ET ]-[ ES] )[ S]/ [ ES] =[ ET ] [ S]/ [ ES] -[ S] d’où [ ES]= [ ET ][ S]/ km + [ S] …………………. (2) � La vitesse de la réaction Vi est égale à V 3, vitesse de la réaction la plus lente: Vi = V 3=K 3[ ES]. D’où Vi=K 3 [ ET ][ S]/ km + [ S]. Rapport Vmax Vi en remplacant [ ES]/ (2) � Or V max = K 3 [ ET ] � Donc Vi=Vmax [ S]/ km + [ S] → l’équation de Michaelis Menten

Equation de Michaelis Menten



• DEFINITION: • Vmax est la vitesse maximale que peut atteindre la réaction lorsque l'enzyme est saturée de substrat • Km est la concentration de substrat qui sature l'enzyme à moitié.

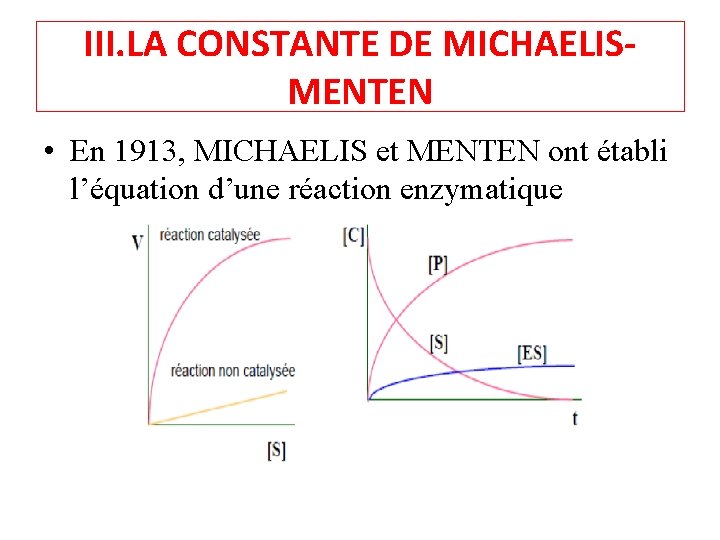
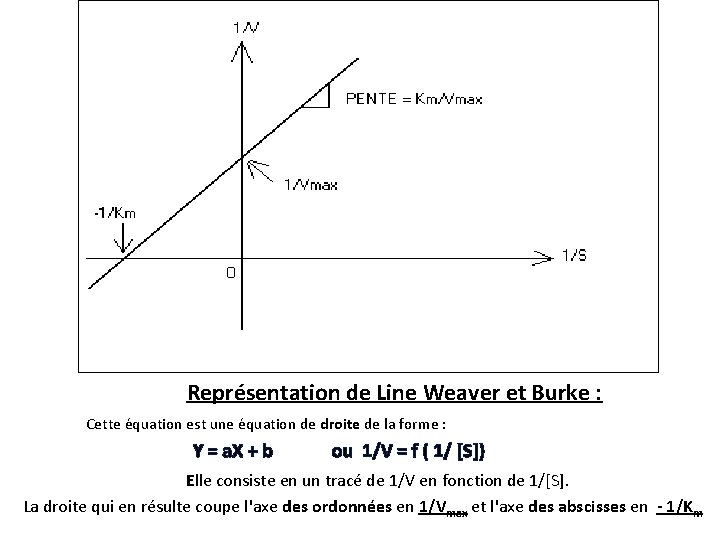
IV- Représentation de Line Weaver et Burke : • ‐Une hyperbole est difficile à tracer manuellement. Des erreurs sur l'estimation de la Vmax sont possibles. • ‐Pour simplifier la représentation graphique de l'équation de MICHALEIS‐ MENTEN , on transforme l'hyperbole en droite. • L’équation de MICHALEIS‐ MENTEN peut s’écrire sous la forme :


Représentation de Line Weaver et Burke : Cette équation est une équation de droite de la forme : Y = a. X + b ou 1/V = f ( 1/ [S]) Elle consiste en un tracé de 1/V en fonction de 1/[S]. La droite qui en résulte coupe l'axe des ordonnées en 1/Vmax et l'axe des abscisses en - 1/Km

• Cette représentation présente l'avantage d'être plus facile à lire. • En effet, on définit: • ‐‐ Vmax : par le point d'intersection de la droite avec l'axe des ordonnés • ‐‐ Km : par le point d'intersection de la droite avec l'axe des abscisses.

III-LES FACTEURS INFLUENÇANT LA REACTION ENZYMATIQUE PLAN DU COURS 1/ Les facteurs physico-chimiques a-Influence du p. H B-Influence de la température 2/ les activateurs enzymatiques § Ions métalliques § Protéolyse limitée (irréversible) § Modification covalente (réversible) 3/Les inhibiteurs enzymatiques a-Les inhibiteurs réversibles a 1 -inhibiteurs compétitifs 2 a-inhibiteurs non compétitifs a 3 -inhibiteurs incompétitifs b-a-Les inhibiteurs irréversibles

III-LES FACTEURS INFLUENÇANT LA REACTION ENZYMATIQUE PLAN DU COURS 1/ Les facteurs physico-chimiques a-Influence du p. H B-Influence de la température 2/ les activateurs enzymatiques § Ions métalliques § Protéolyse limitée § Modification covalente 3/Les inhibiteurs enzymatiques a- Les inhibiteurs réversibles a 1 -inhibiteurs compétitifs 2 a-inhibiteurs non compétitifs a 3 -inhibiteurs incompétitifs b-a-Les inhibiteurs irréversibles

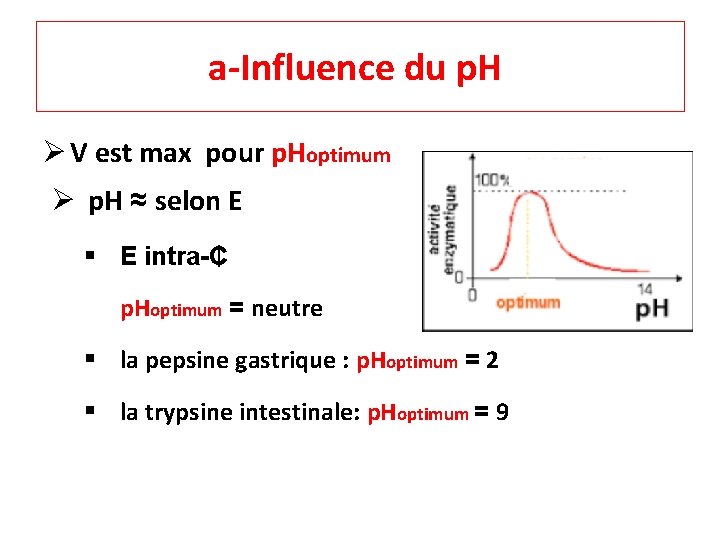
a-Influence du p. H Ø V est max pour p. Hoptimum Ø p. H ≈ selon E § E intra-₵ p. Hoptimum = neutre § la pepsine gastrique : p. Hoptimum = 2 § la trypsine intestinale: p. Hoptimum = 9

III-LES FACTEURS INFLUENÇANT LA REACTION ENZYMATIQUE PLAN DU COURS 1/ Les facteurs physico-chimiques a-Influence du p. H B-Influence de la température 2/ les activateurs enzymatiques § Ions métalliques § Protéolyse limitée (irréversible) § Modification covalente (réversible) 3/Les inhibiteurs enzymatiques a-Les inhibiteurs réversibles a 1 -inhibiteurs compétitifs 2 a-inhibiteurs non compétitifs a 3 -inhibiteurs incompétitifs b-a-Les inhibiteurs irréversibles

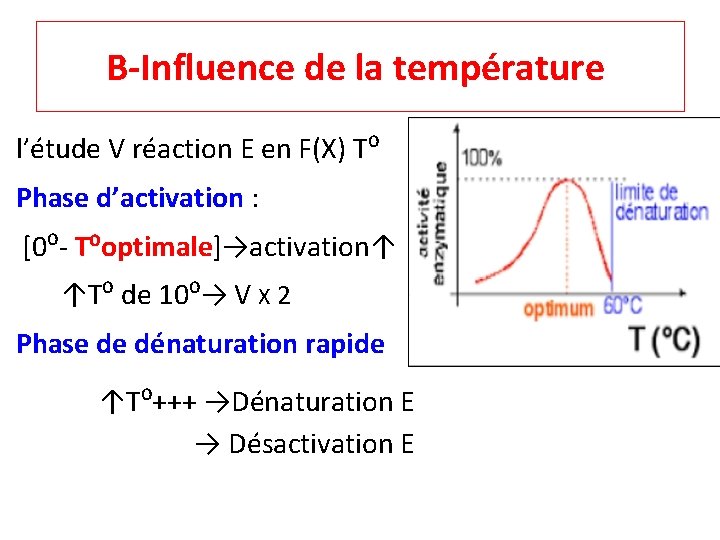
B-Influence de la température l’étude V réaction E en F(X) T⁰ Phase d’activation : [0⁰‐ T⁰optimale]→activation↑ ↑T⁰ de 10⁰→ V X 2 Phase de dénaturation rapide ↑T⁰+++ →Dénaturation E → Désactivation E

III-LES FACTEURS INFLUENÇANT LA REACTION ENZYMATIQUE PLAN DU COURS 1/ Les facteurs physico-chimiques a-Influence du p. H B-Influence de la température 2/ les activateurs enzymatiques § Ions métalliques § Protéolyse limitée § Modification covalente 3/Les inhibiteurs enzymatiques a-Les inhibiteurs réversibles a 1 -inhibiteurs compétitifs 2 a-inhibiteurs non compétitifs a 3 -inhibiteurs incompétitifs b-a-Les inhibiteurs irréversibles

Ions métalliques Bonne conformation E Fixation S Participent à la catalyse enzymatique Ø Exp: Mg++ → kinases Cl‐ → amylase

III-LES FACTEURS INFLUENÇANT LA REACTION ENZYMATIQUE PLAN DU COURS 1/ Les facteurs physico-chimiques a-Influence du p. H B-Influence de la température 2/ les activateurs enzymatiques § Ions métalliques § Protéolyse limitée § Modification covalente 3/Les inhibiteurs enzymatiques a-Les inhibiteurs réversibles a 1 -inhibiteurs compétitifs 2 a-inhibiteurs non compétitifs a 3 -inhibiteurs incompétitifs b-a-Les inhibiteurs irréversibles

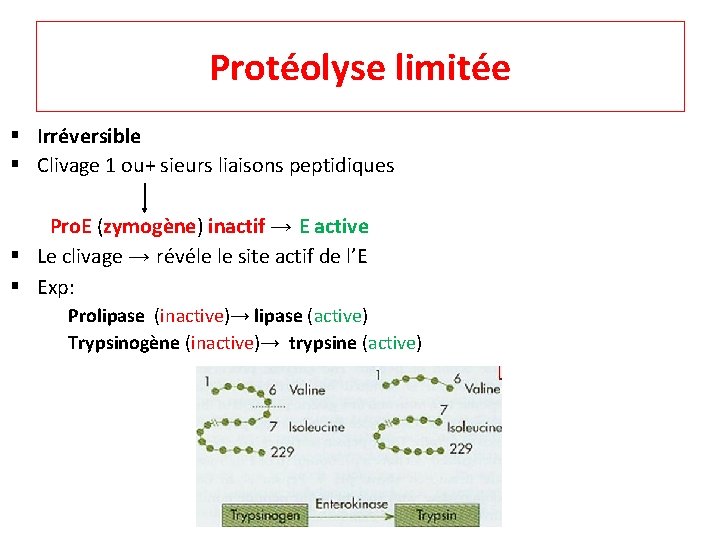
Protéolyse limitée § Irréversible § Clivage 1 ou+ sieurs liaisons peptidiques Pro. E (zymogène) inactif → E active § Le clivage → révéle le site actif de l’E § Exp: Prolipase (inactive)→ lipase (active) Trypsinogène (inactive)→ trypsine (active)

III-LES FACTEURS INFLUENÇANT LA REACTION ENZYMATIQUE PLAN DU COURS 1/ Les facteurs physico-chimiques a-Influence du p. H B-Influence de la température 2/ les activateurs enzymatiques § Ions métalliques § Protéolyse limitée § Modification covalente 3/Les inhibiteurs enzymatiques a-Les inhibiteurs réversibles a 1 -inhibiteurs compétitifs 2 a-inhibiteurs non compétitifs a 3 -inhibiteurs incompétitifs b-a-Les inhibiteurs irréversibles

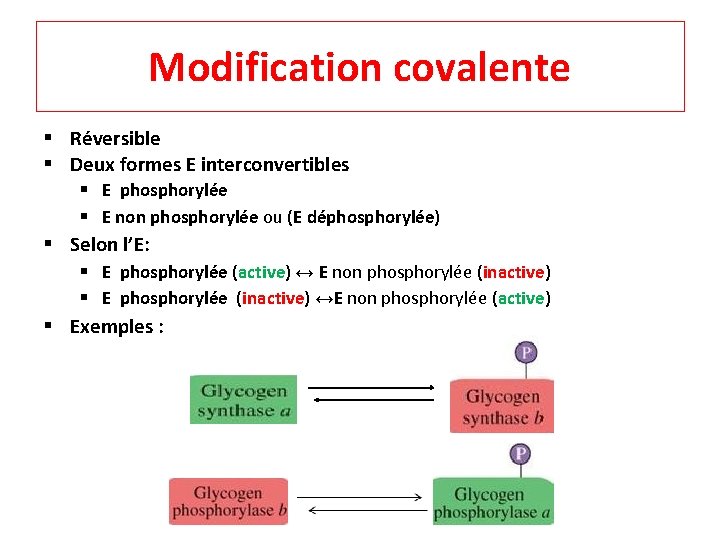
Modification covalente § Réversible § Deux formes E interconvertibles § E phosphorylée § E non phosphorylée ou (E déphosphorylée) § Selon l’E: § E phosphorylée (active) ↔ E non phosphorylée (inactive) § E phosphorylée (inactive) ↔E non phosphorylée (active) § Exemples :

Les inhibiteurs enzymatiques Les inhibiteurs réversibles inhibiteur compétitif Inhibiteur non compétitif inhibiteur incompétitif Les inhibiteurs irréversibles

Définition d’un inhibiteur enzymatique • I est un ligand • I qui se lie à E • ne subit pas de transformation • I → ↓activité ou inactivation E (↓Réaction enzymatique)

Les inhibiteurs enzymatiques Les inhibiteurs réversibles dissociation rapide du complexe EI inhibiteur compétitif

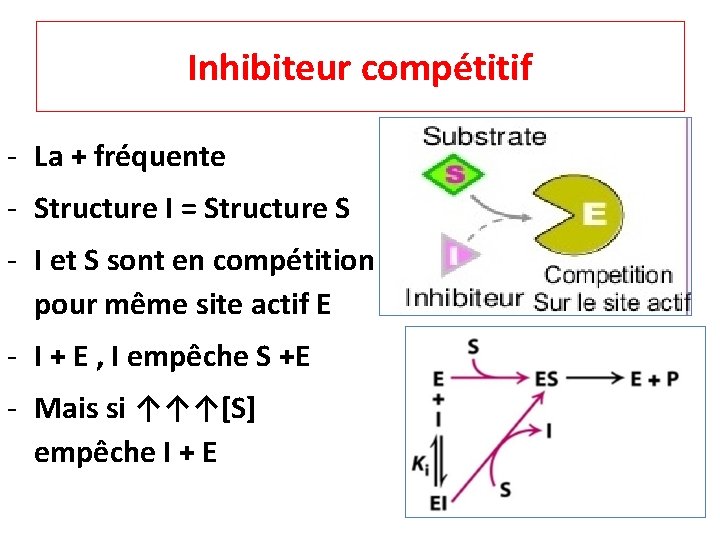
Inhibiteur compétitif ‐ La + fréquente ‐ Structure I = Structure S ‐ I et S sont en compétition pour même site actif E ‐ I + E , I empêche S +E ‐ Mais si ↑↑↑[S] empêche I + E
![Inhibiteur compétitif o Équations dinhibition compétitive Et E ES Inhibiteur compétitif o Équations d’inhibition compétitive : ‐ [E]t = [E] + [ES] +](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-57.jpg)
Inhibiteur compétitif o Équations d’inhibition compétitive : ‐ [E]t = [E] + [ES] + [EI] ‐ Ki = [E][I]/[EI] ‐ Ki mesure de l’affinité de I pour E: + Ki est petit, +I est puissant

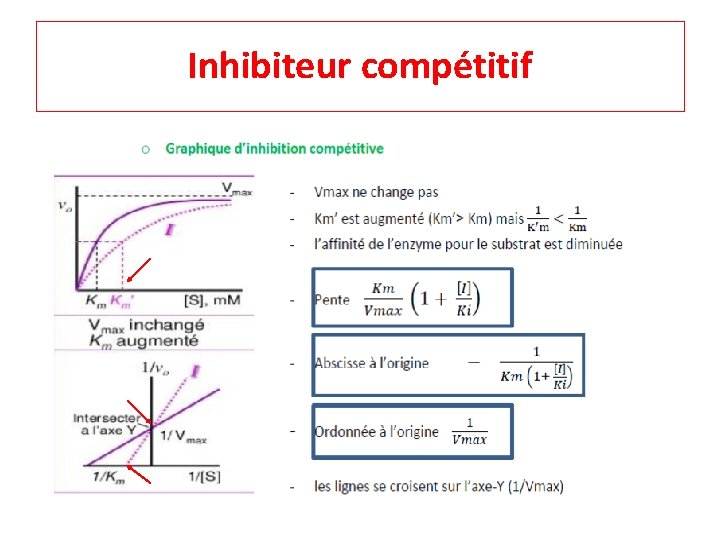
Inhibiteur compétitif

Les inhibiteurs enzymatiques Les inhibiteurs réversibles inhibiteur non compétitif

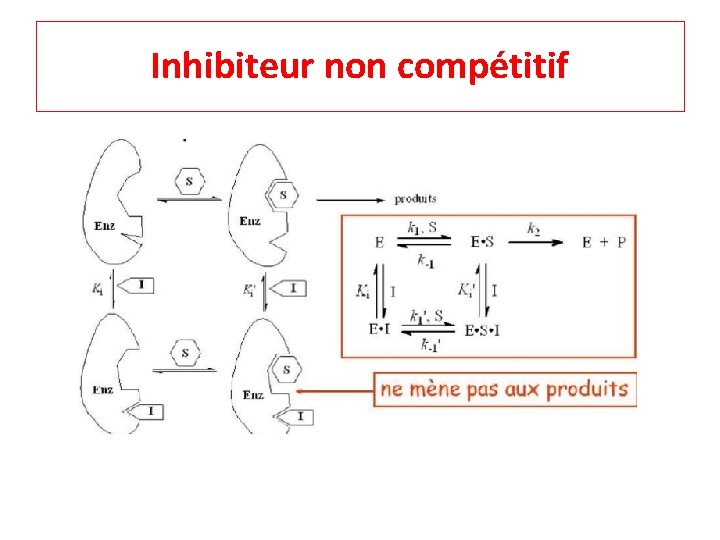
Inhibiteur non compétitif

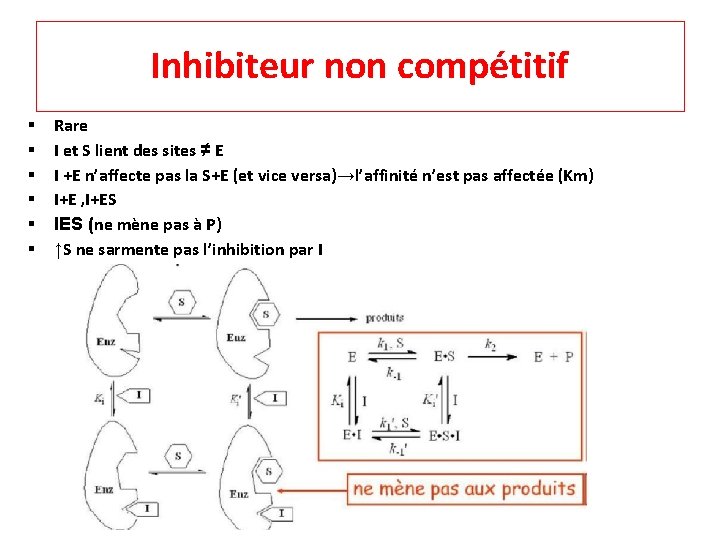
Inhibiteur non compétitif § § § Rare I et S lient des sites ≠ E I +E n’affecte pas la S+E (et vice versa)→l’affinité n’est pas affectée (Km) I+E , I+ES IES (ne mène pas à P) ↑S ne sarmente pas l’inhibition par I
![Inhibiteur non compétitif o Équations dinhibition non compétitive Et E ES Inhibiteur non compétitif o Équations d’inhibition non compétitive : [E]t= [E] + [ES] +](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-62.jpg)
Inhibiteur non compétitif o Équations d’inhibition non compétitive : [E]t= [E] + [ES] + [EI]+[ESI] (Ki et Ki') Cst d’inhibition

Inhibiteur non compétitif

Les inhibiteurs enzymatiques Les inhibiteurs réversibles inhibiteur incompétitif

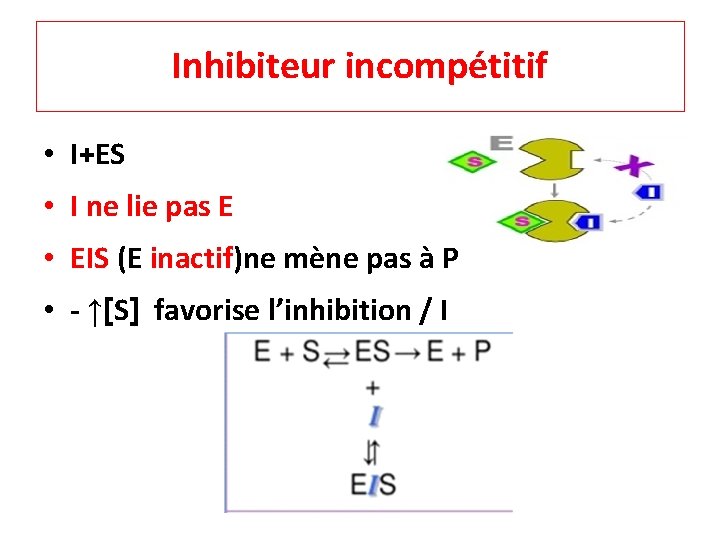
Inhibiteur incompétitif • I+ES • I ne lie pas E • EIS (E inactif)ne mène pas à P • - ↑[S] favorise l’inhibition / I
![Inhibiteur incompétitif o Équations dinhibition incompétitive Et E ESI Vmax Vmax Inhibiteur incompétitif o Équations d’inhibition incompétitive : [E]t = [E] + [ESI] V’max= Vmax](https://slidetodoc.com/presentation_image_h/0d11575ee2e2ee676c9fa27a62923856/image-66.jpg)
Inhibiteur incompétitif o Équations d’inhibition incompétitive : [E]t = [E] + [ESI] V’max= Vmax / (1 + [I]/Ki) Km’= Km / (1 + [I]/Ki)

Inhibiteur incompétitif

Les inhibiteurs enzymatiques Les inhibiteurs irréversibles

b-Inhibiteurs irréversibles § Irréversibles § Liaison covalente IE (site imp de l’E) § Inactivation permanente : inhibiteur suicide § Connaissance Aa catalyse § Exp : la 5 fluorouracile

IV/Les enzymes allostériques mot grec «allos» autre et «stereos» formes

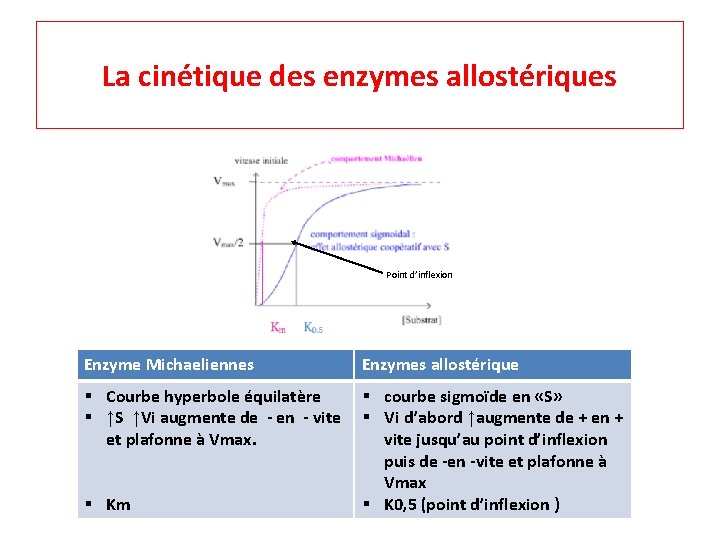
La cinétique des enzymes allostériques Point d’inflexion Enzyme Michaeliennes Enzymes allostérique § Courbe hyperbole équilatère § courbe sigmoïde en «S» § ↑S ↑Vi augmente de - en - vite § Vi d’abord ↑augmente de + en + et plafonne à Vmax. vite jusqu’au point d’inflexion puis de -en -vite et plafonne à Vmax § Km § K 0, 5 (point d’inflexion )

La cinétique des enzymes allostériques le caractère sigmoïde de la courbe s’explique par le fait la fixation du S par E ↑affinité de El’enzyme pour Sc’est l’effet coopératif

Structure des enzymes allostériques Structure quaternaire Plusieurs sous unités : Ss. U Chaque sous-unité peut fixer 1 S Disposition des Ss. U→axe de symétrie de la molécule. E

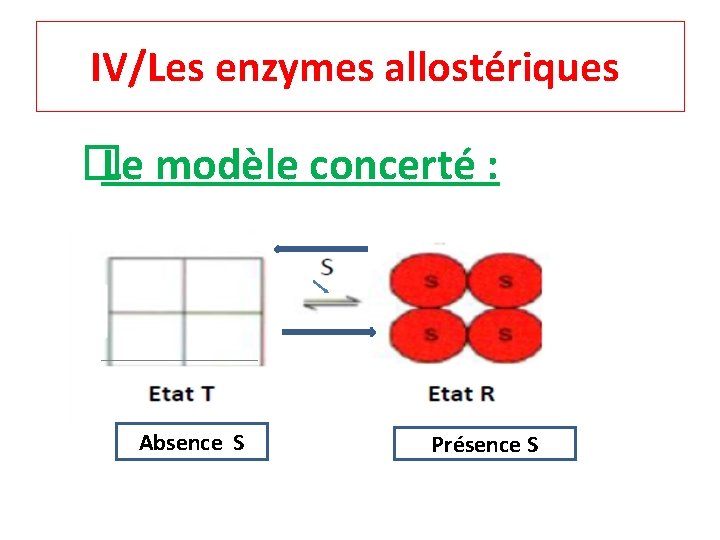
IV/Les enzymes allostériques l’effet coopératif ‘’coopérativité homotrope’’ Deux modèles ont été proposés: qle modèle concerté de J. Monod qle modèle séquentiel de D. koshland. Dans les 2 modèles , il existe 2 conformations : La conformation T (tendue): faible affinité pour S La conformation R (relâchée): forte affinité pour S

IV/Les enzymes allostériques � Le modèle concerté : Absence S Présence S

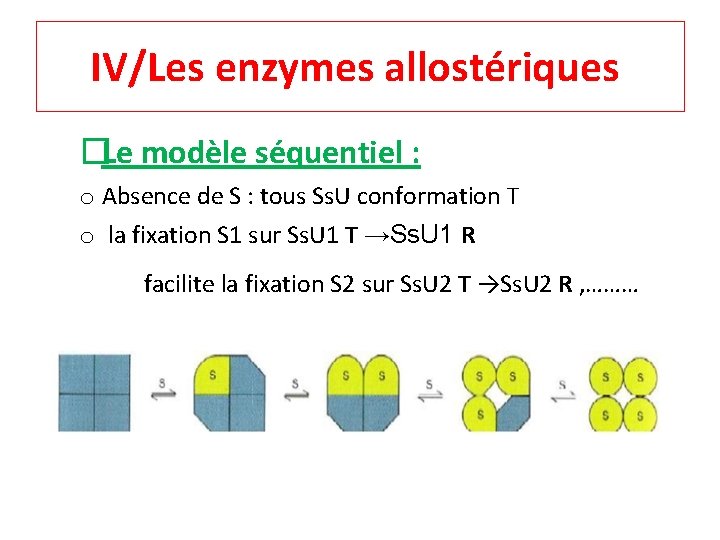
IV/Les enzymes allostériques �Le modèle séquentiel : o Absence de S : tous Ss. U conformation T o la fixation S 1 sur Ss. U 1 T →Ss. U 1 R facilite la fixation S 2 sur Ss. U 2 T →Ss. U 2 R , ………

IV/Les enzymes allostériques Sites allostériques ou sites régulateurs Sites(+ieurs) de fixation des effecteurs allostériques Site de fixation effecteur ≠ site de fixation S Deux types d’effecteurs allostériques Effecteurs positifs (activateurs) Effecteurs négatifs (inhibiteurs) Phénomène hétérotope

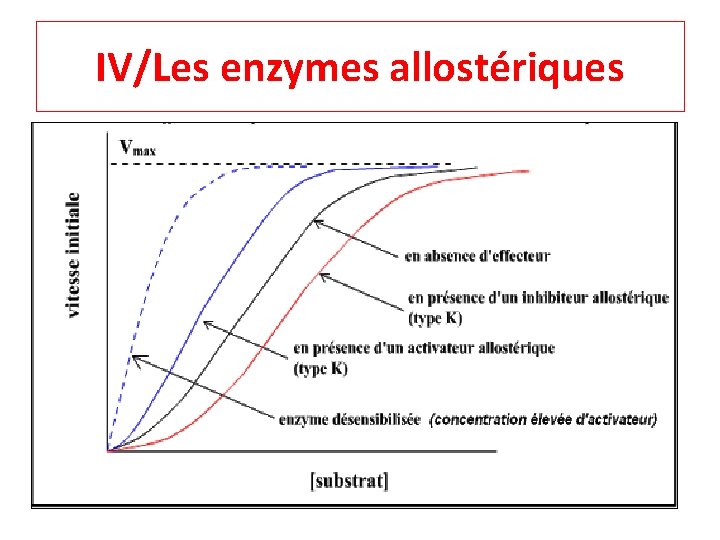
IV/Les enzymes allostériques o Un effecteur inhibiteur : • ↓ l'affinité de E pour S • R↔T • ↑ K 0. 5 • Courbe → la droite • Phénomène hétérotope négatif o Un effecteur activateur : • ↑ l'affinité de E pour S • T↔R • ↓K 0. 5 • Courbe →gauche • Phénomène hétérotope positif.

IV/Les enzymes allostériques

IV/Les enzymes allostériques L’importance de l’allostérie : o Sensibilité de l’activité E aux ≈ [S]et [Eff ] o Mécanisme régulateur