Individualisation du traitement Jean Luc Meynard Laurence Morand





































































- Slides: 82

Individualisation du traitement Jean Luc Meynard, Laurence Morand Joubert, Hôpital Saint Antoine, Paris

Mr B 47 ANS • MOTIF DE L'HOSPITALISATION – Cachexie, asthénie et diarrhée chez un patient de 46 ans, séropositif pour le VIH. • ANTECEDENTS – Infection VIH diagnostiquée en 1995 avec mauvaise observance thérapeutique et rupture de traitement de 2012 à 2014. Plusieurs lignées de traitement • • 2000 : ZIAGEN, COMBIVIR, 2003 à 2005 : SUSTIVA, TRIZIVIR 2006 : REYATAZ, NORVIR, KIVEXA, 2006 à 2012 : KIVEXA, NORVIR, PREZISTA. – infections opportunistes : • Condylomes anaux. • Pneumocystose en 2011 (CD 4 à 63/mm) • Giardiase en 2014 prise en charge à Tel Aviv. • Co infections : Hépatite A en 1988.

Histoire de la maladie • Début septembre, le patient rapporte une altération de l'état général (perte de 10 kg environ) associée à des sueurs nocturnes et à une fièvre fluctuante. • Hospitalisation dans un hôpital de Tel Aviv du 15/09 au 13/10 – Scanner thoraco abdominopelvien – adénopathies mésentériques et rétropéritonéales. Pas d'adénopathie en sus diaphragmatique. Hépatomégalie homogène sans signe d'hypertension portale – 14 CD 4 – LDH 1, 5 N – PCR CMV négative – Biopsie d une adénopathie rétropéritoneale • • • Baar + Zhiel + Pas de nécrose caséeuse Que faites vous ?

• diagnostic de mycobactériose atypique ganglionnaire est posé devant la présence d'adénopathies rétropéritonéales et mésentériques sur le scanner ainsi qu'une biospie ganglionnaire sous laparoscopie, positive pour le Ziehl avec une PCR BK négative (résultat des cultures en attente). • Il est traité par ZECLAR, ETHAMBUTOL, RIFABUTINE et AMIKLIN en fin d'hospitalisation à Tel Aviv et mis sous BACTRIM en préventif. • En raison d'un problème de prise en charge en Israël, il rentre en France et est vu par le Dr X qui l'adresse dans le service pour suite de la prise en charge.

• Examen Clinique: • TA 102/67 mm. Hg, FC 90/min, sat 99 % temp 37° 4. • Hépatomegalie • Ras par ailleurs a part la cachexie.

Examens Complémentaires • • • NFS : leucocytes 2. 810/mm 3 (PNN 1. 880, lymphocytes 250), hémoglobine 9, 7 g/dl, plaquettes 250. 000/mm 3. TP 69 % Ionogramme sanguin : sodium 135, potassium 3, 7, protides 70, créatinine 71. ASAT 50, ALAT 65, LDH 436, GGT 226, PAL 265, lipase 21, CRP 58, 9 mg/l, bilirubine totale 9 µmol/l, calcium 2, 28 mmol/l, phosphore 1, 35 mmol/l, fer 2, 4 µmol/l. CD 4 14/mm 3 (6 %), CD 8 116/mm 3 (55 %), rapport T 4/T 8 0, 11. Charge virale VIH : 5 log soit 94. 312 copies/ml. Antigène cryptocoque négatif. ECBU stérile. Hémocultures 2 fois négatif • PCR CMV négative • • Dépistage de BMR négatif. Sérologie VHB négative. Sérologie VHC négative. TPHA VDRL négatif. • • Scanner thoraco abdominopelvien du 27/10 injecté : adénopathies mésentériques et rétropéritonéales. Pas d'adénopathie en sus diaphragmatique. Hépatomégalie homogène sans signe d'hypertension portale. • Examen ophtalmologique : FO nl. • • .

Evolution • • Mycobactérisoe atyique ganglionnaire documentée en Israël (cultures non disponibles, ). Trithérapie anti MAC associant ANSATIPINE, ZECLAR et ETHAMBUTOL débutée le le 05/10. Fièvre bien tolérée persistante durant l'hospitalisation jusqu'au 27/10 environ. Bonne tolérance biologique et clinique du traitement. Scanner thoraco abdominopelvine de référence refait dans le service retrouvant des adénopathies rétropéritonéales et mésentériques. • 2° Absence d'argument pour une autre infection opportuniste. • 3° Sur le plan du VIH : le taux de CD 4 est de 14/mm 3 (rapport 0, 11) et la charge virale est de 94. 312 copies/ml. On introduit un traitement antirétroviral le 27/10 associant TRUVADA, PREZISTA et NORVIR. Le traitement antirétroviral est bien toléré. Le patient semble avoir compris l'intérêt des traitements. • Il sort à domicile le 31/10 et sera revu régulièrement en consultation d'éducation thérapeutique. Il effectuera un bilan de contrôle (tolérance et efficacité du traitement) dans 1 mois et reverra le Dr X en consultation pour la suite de la prise en charge. • • CONCLUSION Mycobactérie atypique ganglionnaire chez un patient VIH, en rupture de traitement. Trithérapie anti MAC débutée le 05/10 environ. • Introduction des antirétroviraux le 27/10/14 .

Mr B 47 ANS • Re hospitaliser le 29/11/2014 pour cachexie, asthénie, diarrhée , douleur abdominale, température à 38, 5 apparue après une amélioration initiale • Examen clinique : – 51 kg vs 58 en octobre – 38, 5 – Hépatosplénomégalie – Ras par ailleurs – QUE FAITES VOUS ?

Mr B 47 ans • Examens Complémentaires – – – – • NFS : globules blancs 8. 390/mm 3 (PNN 6. 880, éosinophiles 80, basophile 0, lymphocytes 340, monocytes 1. 010, hémoglobine 8, 1, VGM 74, plaquettes 356. 000/mm 3, réticulocytes 50. 478). Ionogramme sanguin : sodium 130, potassium 3, 6, chlore 88, CO 2 total 33, protides 69, urée 3, 9, créatinine 64. ASAT 72, ALAT 46, CPK 10, LDH 735, GGT 185, PAL 328, bilirubine totale 13, lipase 24. albumine 27 g/l, haptoglobine 4, 73 g/l. CRP 165 mg/l à l'entrée. Gaz du sang du 28/11 : p. H 7; 53, p. CO 2 29, p. O 2 96, bicarbonates 25, lactates 1, 4. Calcium 2, 22, phosphore 1, 12. C Electrophorèse des protéines sériques : albumine 232, 1 g/l, gammaglobuline 19, 5 g/l, profil compatible avec un syndrome inflammatoire important. Bilan lipidique : triglycérides 0, 90 g/l, cholestérol 0, 86 g/l, HDL 0, 17 g/l, LDL 0, 52 g/l. Lymphocytes T CD 4 à 23/mm 3 soit 7 %, lymphocytes T CD 8 à 156/mm 3 soit 48 %. Charge virale VIH du 14/11. 14 : 297 copies soit 2, 5 log. Ferritine 7. 220. Cortisol à 8 heures : 481. Protéinurie sur échantillon à 0, 29 g/l. Bactériologie : – – – Antigénémie cryptocoque négative à 2 reprises. Ensemble des hémocultures prélevées en hospitalisation négatives. ECBU Sérile

Mr B 47 ans • Les hémocultures à mycobactéries ne poussent pas en hospitalisation. • PCR CMV 1. 300 le 02/12, contrôlée négative le 11/12. • Sérologie TPHA VDRL négative. • Recherche de leishmanie en Parasitologie et en Biologie moléculaire sur sang négative. • Scanner thoraco abomino pelvien du 17/11 : – augmentation modérée de taille des adénopathies inframédiastinales postérieures rétropéritonéales coeliaques et mésentériques avez un caractère nécrotique plus marqué. Apparition d'une lame d'épanchement péritonéal en pelvien. Rate homogène de taille et de morphologie stable. Foie homogène de taille stable de 20 cm de hauteur

Mr B 47 ans • Infection à Mycobactéries atypiques non identifiées • Aggravation après introduction du traitement antirétroviral • Que faites vous ?

Mr B 47 ans • Hypothèse initiale d'un syndrome de restauration immunitaire chez ce patient VIH avec une mycobactériose atypique devant une charge virale diminuée de moitié et une augmentation de volume des adénopathies scanographiques nécrotiques et une observance correcte d'après le patient. • Cependant, devant la persistance d'une fièvre jusqu'à 39° en particulier vespérale, une documentation infectieuse négative et les cultures en Israël qui ne poussent pas à mycobactéries avec un typage impossible, il est décidé de réaliser des biopsies ganglionnaires scano guidées qui retrouvent à l'examen direct plus de 100 BAAR/champ après une fenêtre thérapeutique de 72 h • Que faites vous devant ce résultat ?

Une mycobactérie atypique ! • • Culture initiale négative Aspect macroscopique en petit grains Patients Immunodéprimés Localisation abdominale – Très évocateur d’une infection à Mycobacterium genavense – Sera confirmée par PCR

Mr B 47 ans • • Modification du traitement Arrêt ethambutol Introduction Izilox Introduction Amiklin pendant 1 mois • Evolution favorable sous traitement

Infections à mycobactéries atypiques Dr Jean Luc Meynard MD, Ph. D Service des maladies infectieuses Hôpital Saint Antoine 75012 Paris France



Introduction • Bactéries de l’environnement, pathogène opportuniste • Pathogène en cas – Immunodépression générale: VIH, transplanté – Immunodépression locale : tuberculose – Inoculation dans un milieu stérile

Epidémiologie des infections à mycobactéries non tuberculeuses

Principales mycobactéries atypiques responsables d’infections • Très nombreuses espèces décrites • Plus de 20 espèces communément isolées au laboratoire • Dont une dizaine responsables d’infections – Pulmonaires: xenopi, kansasii, avium complex, Abcessus – Ganglionnaires: avium complex, scrofulaceum, genavense – Cutanées: marinum, à croissance rapide ( chelonae, abcessus, fortuitum) , ulcérans – Généralisées: avium complex, kansasii, genavense

Diagnostic au laboratoire • Examen microscopique (BAAR) • Cultures: – sur milieu de L. Jensen à 37 C, et aussi à 30 et 42 °C , sur milieu spécialement enrichis • Identification des cultures par sonde génétique ou séquençage • Amplification réservée aux échantillons riches en BAAR (M+)

Diagnostic des infections à mycobactéries atypiques • Facile si isolement de la mycobactérie d’une cavité fermée – Mycobactérie isolée = responsable de l’infection • Difficile si la mycobactérie est isolée de cavité ouverte ( ex sécrétions respiratoires) – Responsable d’infection ou contaminant


Mesure de la sensibilité aux antibiotiques des mycobactéries atypiques • Homogénéité de la sensibilité au sein des espèces • Résistance acquise sous traitement


Tests de sensibilité • Non recommandés pour toutes les mycobacteries • Exception – CMI Clarithromycine/ complexe aviumintracellulare • Échec thérapeutique ou prophylaxie • R >32 mg/l – M. kansasii • R naturelle PZA • tester Rifampicine, Isoniazide, Ethambutol, Streptomycine


Traitement de MAC in vitro modèle murin immunodéprimé immunocompétent





Conclusion MAC • Réunir critères cliniques+radiologiques+bactériologiques • Poser un diagnostic n'implique pas un traitement • Pour les formes bronchectasiques, une surveillance peut être proposée initialement • La clarithromycine est la clef du traitement • Traitement au moins 1 an après négativation des cultures • Le traitement reste inférieur à celui de la tuberculose • Fréquence des rechutes dans les formes bronchectasiques

Mycobacterium genavense infections: a retrospective multicenter study in France, 1996 -2007 • • We conducted the current study to describe the features of this infection in patients infected with human immunodeficiency virus (HIV) in the HAART era and in non HIV infected patients. We conducted a retrospective cohort survey in France. All patients with M. genavense infection diagnosed from 1996 to 2007 at the National Reference Center, Institut Pasteur, Paris, were identified and their clinical, laboratory, and microbiologic data were centralized in a single database. Twenty five cases of M. genavense infection originating from 19 centers were identified. – – – • • Twenty patients had AIDS, 3 had solid organ transplantation, and 2 had sarcoidosis. Sixty four percent (n = 16) were male, mean age was 42 years, and median CD 4 count was 13/mm (range, 0 148/mm) in patients with AIDS. Twenty four patients had disseminated infection with fever (75%, n = 18), weight loss (79%, n = 19), abdominal pain (71%, n = 17), diarrhea (62. 5%, n = 15), splenomegaly (71%, n = 17), hepatomegaly (62. 5%, n = 15), or abdominal adenopathy (62. 5%, n = 15). M. genavense was isolated from the lymph node (n = 13), intestinal biopsy (n = 9), blood (n = 6), sputum (n = 3), stool (n = 3), and bone marrow (n = 5). Eleven patients (44%) died, 8 (32%) were considered cured with no residual symptoms, and 6 (24%) had chronic symptoms. The 1 year survival rate was 72%. The prognosis of M. genavense infection in HIV infected patients has dramatically improved with HAART. Clinical presentations in HIV and non HIV immunocompromised patients were similar. Charles P Medicine 2011

M. genavense • • M. genavense should be considered in patients with AIDS who have suspected disseminated MAC, but whose routine AFB cultures are negative. Treatment. In vitro susceptibility data are limited because of the extreme fastidiousness of the organism. Available data suggest that most isolates are susceptible to amikacin, rifamycins, fluoroquinolones, streptomycin, and macrolides (162, 366). Ethambutol has limited activity against M. genavense (366). Optimal therapy is not determined, but multidrug therapies including clarithromycin appear to be more effective than those without clarithromycin (368– 370).

Conclusion • Mycobacteries atypiques peuvent être encore observées chez les patients VIH tres immunodéprimes • M avium est la plus fréquent mais facile a isoler et diagnostiquer • Devant un tableau avec adenopathies abdominales , BAAR+ , PCR BK négatives , penser a M genavensae • Traitement mal codifié mais FQ et amikacine en adjonction à la clarithromycine et rifabutine

Cas d’un patient multitraité, en succès, sans génotype antérieur

Optimisation, Allègement, Simplification…. Chez des patients en succès virologique (<20 50 copies/ml) • Objectifs différents des stratégies proposées: Ø Modification pour des effets indésirables, pour éviter une interaction médicamenteuse Ø Prévention d’une toxicité à long terme Ø Réduction du nombre de prise et/ou du nombre de comprimés • Stratégies proposées très différentes: → Trithérapie en une seule prise, Bithérapie Sans INTI, Monothérapie…. Arrêt.

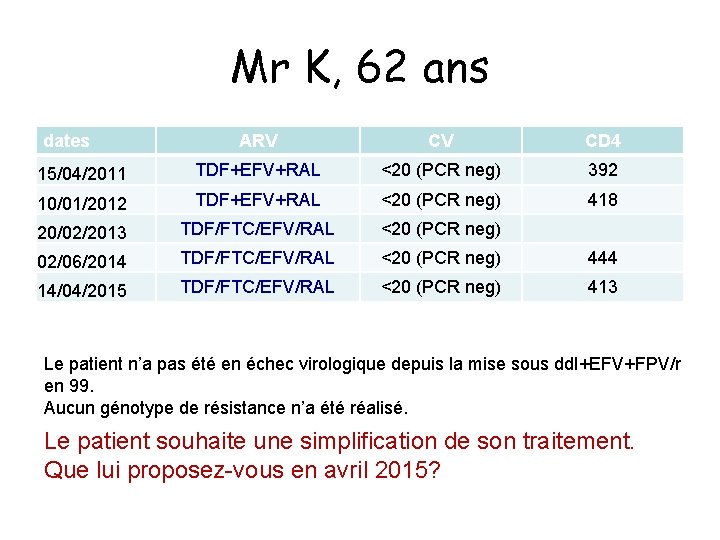
Mr K, 62 ans • • • Dépistage VIH 1985 80 kg pour 1 m 82, IMC= 22, 6; travail à temps complet et voyage pour des raisons professionnelles Antécédents: – Infarctus du myocarde en 2004 sous Kardégic • Affections liées au VIH: – Nadir CD 4: 130 • Traitements ARV – – – – 1994: AZT 1995: AZT+dd. C puis AZT+dd. I 1996: d 4 T+3 TC 1997: d 4 T+3 TC+IDV 1999: dd. I+EFV+FPV/r CV= 6074, CD 4=393 2004: dd. I+EFV+ATV/r CV < 50, CD 4=539 2010: TDF+EFV+RAL CV<20, CD 4=436 2012: TDF/FTC/EFV/RAL; CV<20, CD 4=413

Mr K, 62 ans dates ARV CV CD 4 15/04/2011 TDF+EFV+RAL <20 (PCR neg) 392 10/01/2012 TDF+EFV+RAL <20 (PCR neg) 418 20/02/2013 TDF/FTC/EFV/RAL <20 (PCR neg) 02/06/2014 TDF/FTC/EFV/RAL <20 (PCR neg) 444 14/04/2015 TDF/FTC/EFV/RAL <20 (PCR neg) 413 Le patient n’a pas été en échec virologique depuis la mise sous dd. I+EFV+FPV/r en 99. Aucun génotype de résistance n’a été réalisé. Le patient souhaite une simplification de son traitement. Que lui proposez vous en avril 2015?

Mr K, 62 ans • Un Génotype de résistance est réalisé sur PBMC: Sous type B Résistance à l'AZT, d 4 T, dd. I. Résistance possible à l'ABC. Absence de mutation conférant une résistance à la classe des inhibiteurs non nucléosidiques de la RT. Pas de résistance aux IP (présence de plusieurs mutations mineures). Absence de mutation conférant une résistance aux inhibiteurs de l'intégrase Quelle prise en charge préconisez vous après ce génotype ?

Nouvel Algorithme septembre 2015

Mr K, 62 ans • Un Génotype de résistance est réalisé sur PBMC: Sous type B Résistance à l'AZT, d 4 T, dd. I, ABC. Résistance possible au TDF. Absence de mutation conférant une résistance à la classe des inhibiteurs non nucléosidiques de la RT. Pas de résistance aux IP (présence de plusieurs mutations mineures). Absence de mutation conférant une résistance aux inhibiteurs de l'intégrase Quelle prise en charge préconisez vous après ce génotype ?

Génotype sous traitement (Succès) • Test génotypique sur prélèvement antérieur congelé (ARN plasmatique), au moment de la pression de sélection • Test génotypique sur ADN proviral – Mais l’importance de ces mutations dans l’ADN proviral est elle la même que dans l’ARN, en présence d’une réplication virale? – Dépendant du type de mutations et de la barrière génétique de l’ARV

Optimisation du traitement antirétroviral en cas de succès virologique Il est indispensable de vérifier que les INTI qui seront associés à l’INNTI restent pleinement actifs (analyse du passé thérapeutique, recherche de réplication virale sous INNTI et analyse ou réanalyse des génotypes de résistance disponibles). En cas d’échec d’amplification de l’ARN VIH plasmatique, on peut envisager, après concertation avec le virologue, la réalisation d'un test génotypique de r stance sur l’ADN VIH dans les cellules du sang périphérique. Un seul profil de mutations de résistance effectué à partir de l’ADN VIH est toutefois moins informatif que celui obtenu en cumulant l’ensemble des génotypes de résistances effectués à partir du virus plasmatique lors des échecs précédents; on doit donc tenir compte des mutations identifiées mais on ne peut exclure l'existence de mutations non détectées. C'est pourquoi, il est indispensable de tenir compte des résultats de tous les tests génotypiques de résistance réalisés antérieurement (génotype cumulé). Les résultats des tests génotypiques de résistance antérieurs doivent être réinterprétés à l'aide de l'algorithme le plus récent de l'AC 11 de l'ANRS. Rapport Morlat 2014

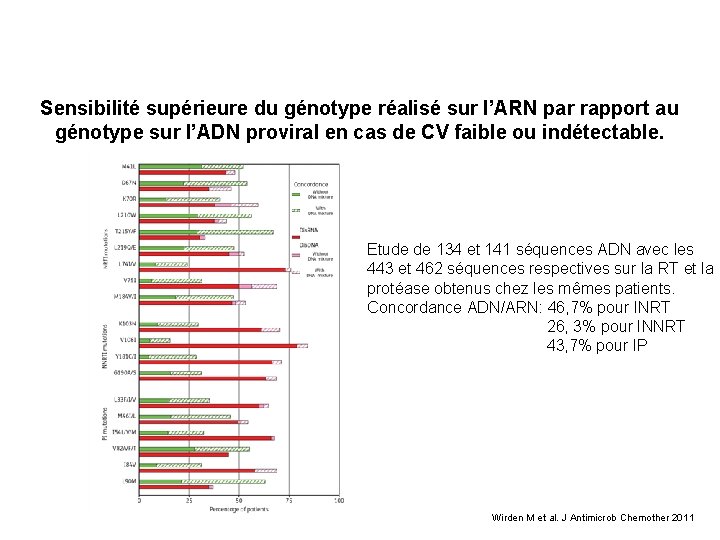
Sensibilité supérieure du génotype réalisé sur l’ARN par rapport au génotype sur l’ADN proviral en cas de CV faible ou indétectable. Etude de 134 et 141 séquences ADN avec les 443 et 462 séquences respectives sur la RT et la protéase obtenus chez les mêmes patients. Concordance ADN/ARN: 46, 7% pour INRT 26, 3% pour INNRT 43, 7% pour IP Wirden M et al. J Antimicrob Chemother 2011

Valeur prédictive du génotype de résistance réalisé sur PBMC chez les patients prétraités avant le switch. Inclusion de 77 patients ; médiane d’infection de 17 ans et de traitement ARV: 14. 6 ans au moment du switch. CD 4 médian: 540/mm 3 (nadir à 161) ; CV indétectable pour 39 patients (50. 7%), CV détectable avec une médiane à 66 copies/ml (IQR: 37 -138) Génotype ARN réalisé en 5, 8 ans (2. 0 -7. 5) avant le génotype ADN Diagnostic measures Se Sp PPV NPV 77. 3 81. 3 85. 0 71. 2 NRTI-resistance 66. 7 85. 4 80. 0 74. 5 NNRTIresistance 45. 5 88. 9 62. 5 80. 0 PI-resistance 54. 2 98. 1 92. 9 82. 5 Any resistance ARV class resistance Boukli N, IHDRW 2015, Abs. 4

Intérêt d’un génotype ADN avant de changer les ARV chez les patients en succès virologique • Objectif : Evaluer l’apport d’un génotype ADN proviral chez les patients en succès virologique depuis plusieurs années en cas de changement d’ARV Résultats de différentes études Boukli N, IHDRW 2015, Abs. 4 Lambert-Niclot S, IHDRW 2015, Abs. 22 Ferré V, IHDRW 2015, Abs. 16 • • n Délai médian entre génotypes ARN et ADN (années) 76 5, 8 (IQR = 2, 1 7, 4) • Concordance ARN/ADN pour 78, 9 % des mutations • Discordance ADN+/ ARN pour 6 mutations (7, 9 %) 244 Patients sans EV : 2, 5 (IQR = 0, 8 4, 4) Patients avec EV : 3, 6 (IQR = 1, 8 5, 7) • % virus avec des mutations à une des molécules TDF/FTC/RPV : chez les patients sans EV historique : 8 % et 9 % dans les génotypes ARN et ADN chez les patients avec 1 EV historique : 60 % et 45 % dans les génotypes ARN et ADN 69 3, 9 (IQR = 2, 4 5, 3) • Concordance ARN/ADN pour les virus non défectifs : 80 % pour la TI et 87 % pour la protéase • Concordance ARN/ADN pour les virus défectifs : 45 % pour la TI et 31 % pour la protéase Bonne concordance globale entre génotypes ADN et ARN Concordance ADN/ARN chez les patients ayant eu un échec virologique antérieur et ceux porteurs de virus défectifs Boukli N, IHDRW 2015, Abs. 4 ; Lambert-Niclot S, IHDRW 2015, Abs. 22 ; Ferré V, IHDRW 2015, Abs. 16

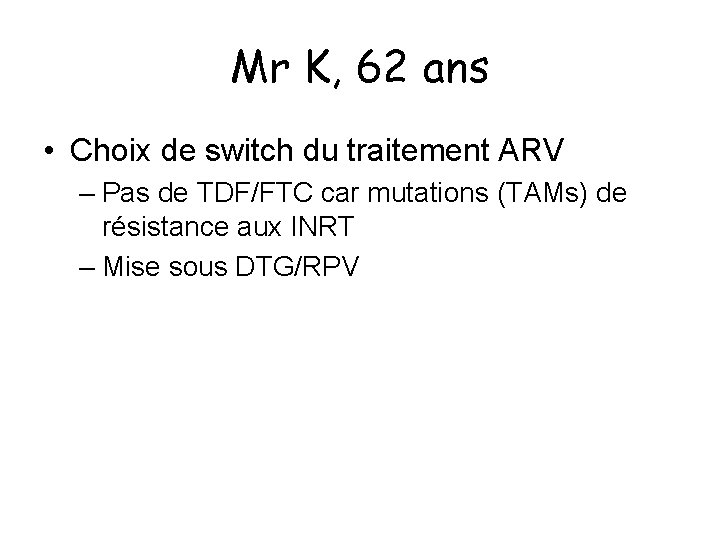
Mr K, 62 ans • Choix de switch du traitement ARV – Pas de TDF/FTC car mutations (TAMs) de résistance aux INRT – Mise sous DTG/RPV

Facteurs prédictifs de l’échec virologique sous monothérapie d’IP en maintenance Etude chez 529 patients avec 9% d’échec virologique GUIGUET M et al. AIDS 2012

Switch. Mrk: trithérapie avec RAL vs LPV/r Eron JJ et al. Lancet 2010

Différence entre SPIRAL vs. SWITCHMRK SPIRAL SWITCHMRK 1&2 N 273 702 Essai Ouvert En aveugle et double insu PI/r 44% LPV/r Durée avec CV <50 c/m. L >6 mois > 3 mois Antériorité d’échec virologique 38% 33, 5% Taux médian de CD 4, BL 516 445 Durée d’indétectabilité 73 (39– 106) mois inconnue % de CV < 50 c/m. L à S 48 RAL 89, 2%, PI/r 86, 6 % RAL 80, 8%, LPV/r 87, 4% Augmentation des échecs au RAL en fonction des EV antérieurs NON OUI Eron JJ et al. Lancet 2010; Martinez E et al. AIDS 2010

Paramètres à prendre en compte lors de l’optimisation, allègement…. . • • • Charge virale initiale et nadir des CD 4 Antécédents d’échecs virologiques Sélection antérieure de virus résistants Barrière génétique du nouveau traitement Durée antérieure de la suppression virologique Niveau attendu de l’adhérence → Prérequis nécessaires à un changement plus « fragile » sur le plan virologique

Cas d’un patient multitraité, en échec virologique de faible niveau, avec génotypes antérieurs

Mr R, 64 ans • • • Dépistage VIH en 1986 65 kg pour 1 m 69 Antécédents: – Cholangite liée au VIH – Sarcome de Kaposi • Affections liées au VIH: – Nadir CD 4: 88 • Traitements ARV – – – – 1992: AZT 1993: AZT+dd. I 1995: AZT+dd. C 1996: AZT+dd. C+IDV 1997: d 4 T+3 TC+SQV/r CV= 110000, 1999: d 4 T/3 TC/NVP CV = 50000 2001: 3 TC/SQV/r puis FPV/LPV/r CV = 230180, CD 4=115

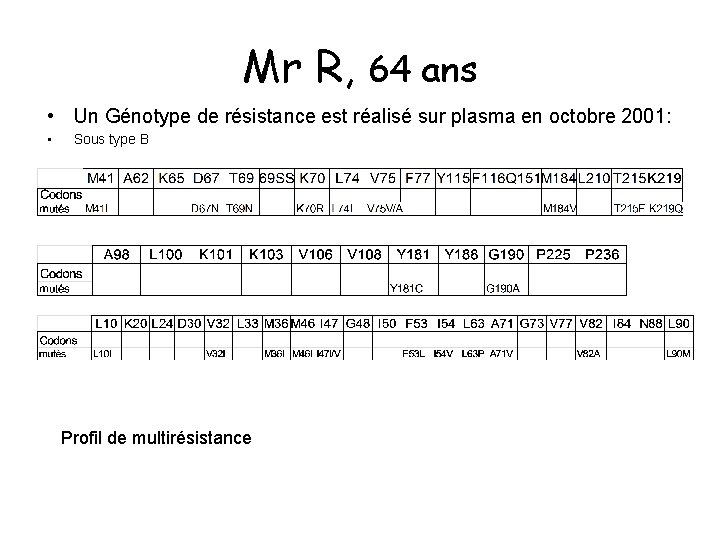
Mr R, 64 ans • Un Génotype de résistance est réalisé sur plasma en octobre 2001: • Sous type B Profil de multirésistance

Mr R, 64 ans • Traitements ARV – 2002: TDF/ABC/3 TC/ATV/r CV = 178000, CD 4=96 – 2003: TDF/T 20/TPV/r CV = 178000, CD 4=96 • • • CV <50 en 2005 CD 4 à 537 Echec virologique en 2007 avec CV à 11066 et CD 4 à 735 Un génotype de résistance est réalisé

Mr R, 64 ans • Un Génotype de résistance est réalisé sur plasma en Juillet 2007: • Sous type B Résistance à l’AZT et au d 4 T Résistance au T 20

Mr R, 64 ans • Traitements ARV – 2002: TDF/ABC/3 TC/ATV/r CV = 178000, CD 4=96 – 2003: TDF/T 20/TPV/r CV = 178000, CD 4=96 • • • CV <50 en 2005 CD 4 à 537 Echec virologique en 2007 avec CV à 11066 et CD 4 à 735 Un génotype de résistance est réalisé – 2007: TDF/FTC/DRV/r • • CV <20 jusqu’à fin 2010 CD 4 à 537 Echec virologique de niveau faible à partir de décembre 2012 – 2011: TDF/FTC/ETR/DRV/r CD 4 CV 02/07/2010 584 <20 14/12/2010 529 65 03/06/2011 455 184 11/07/2011 332 180 26/10/2011 461 272 29/12/2011 541 242 05/01/2012 190

Mr R, 64 ans • Un Génotype de résistance est réalisé sur plasma en Janvier 2012: • Sous type B Tropisme R 5 Résistance à l'AZT, d 4 T, dd. I, ABC, 3 TC/FTC. Résistance possible au TDF. Résistance à la NVP, l'EFV et à la RPV. (Résistance probable à l'ETR en raison de la présence de 2 mutations majeures: Y 181 C et G 190 A) Résistance à l'IDV, NFV, SQV/r, ATV/r, Fos. APV/r, LPV/r (Résistance probable au DRV/r en raison de la présence de 2 mutations majeures: V 32 I et I 47 V)

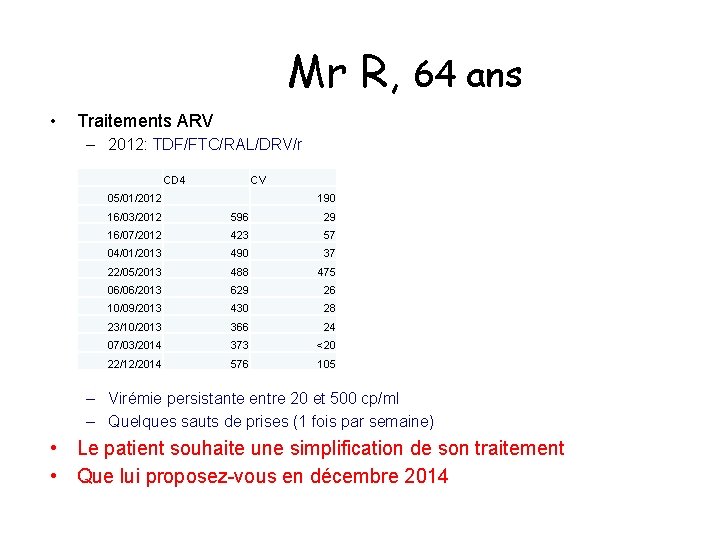
Mr R, 64 ans • Traitements ARV – 2012: TDF/FTC/RAL/DRV/r CD 4 CV 05/01/2012 190 16/03/2012 596 29 16/07/2012 423 57 04/01/2013 490 37 22/05/2013 488 475 06/06/2013 629 26 10/09/2013 430 28 23/10/2013 366 24 07/03/2014 373 <20 22/12/2014 576 105 – Virémie persistante entre 20 et 500 cp/ml – Quelques sauts de prises (1 fois par semaine) • Le patient souhaite une simplification de son traitement • Que lui proposez vous en décembre 2014

Mr R, 64 ans • Un Génotype de résistance avec l’intégrase est réalisé sur PBMC en Septembre 2013: Résistance à l'AZT, d 4 T, dd. I, ABC, 3 TC/FTC. Résistance possible au TDF. Résistance à la NVP, l'EFV et à la RPV. Pas de résistance aux IP (présence de quatre mutations mineures). Absence de mutation de résistance aux inhibiteurs d'intégrase

Mr R, 64 ans • Choix de switch du traitement ARV – Mise sous TDF/FTC/EVG/c +DRV/r • Renforcement de l’observance • Surveillance biologique rapproché CD 4 06/03/2015 CV <20 16/03/2015 400 24/03/2015 453 02/04/2015 43 40 18/06/2015 581 130 29/06/2015 445 50

Détection des mutations de résistance aux ARV chez des patients à bas niveaux d’ARN VIH 1 plasmatique • Etude du nombre de mutations de résistance en fonction du niveau de charge virale (UK HIV Drug Resistance Database et CHIC Study) • Génotypes avec au moins 1 mutation (n = 5 088) 7 6 p = 0, 015 5 Nombre de mutations de R (médiane IQR) 4 4 3 3 3 3 2 1 CV (c/ml) ≥ 10 0 00 0 99 9 00 0 - 99 99 9 30 00 0 - 29 99 9 10 00 3 02 00 1 09 99 9 9 99 30 0 - < 30 0 0 La détection de mutations de résistance à des niveaux de CV < 1 000 c/ml est donc fréquente, ce qui justifie les recommandations actuelles de réaliser des génotypes à partir de 50 c/ml Geretti AM, XVIII IHDRW 2009, Abs. 56

Impact d’une virémie faible sur la sélection de résistance • Analyse rétrospective chez des patients avec une CV entre 40 et 500 cp/ml à au moins 3 occasions sur une période d’au moins 6 mois sous le même traitement • 11 patients/37 (30%), tous prétraités ont acquis au moins une nouvelle mutation (median 2, de 1 à 9) • En fonction de leur traitement, – 3/33 (9%) patients sous 3 TC ou FTC : + M 184 V – 1/8 (12. 5%) patient sous INNRT : + K 103 N – 4/32 (12. 5%) patients sous IP : + mutations majeures – 2/7 (29%) patients sous raltegravir: + mutations au RAL. Delaugerre C et al. Plos one 2012

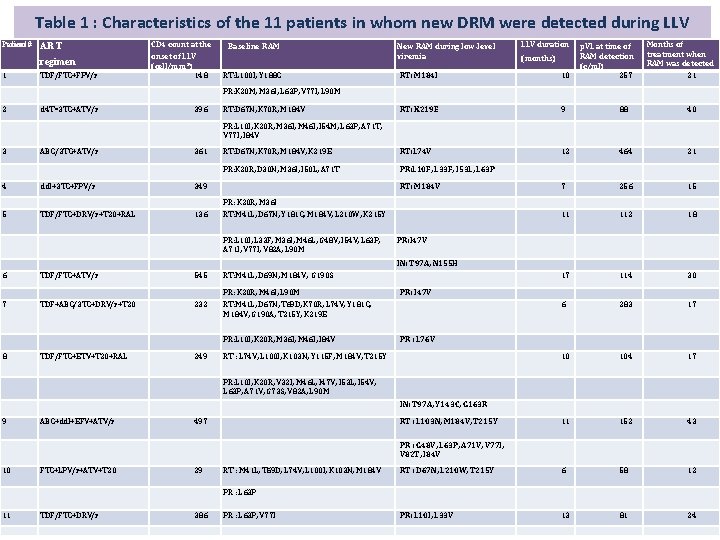
Table 1 : Characteristics of the 11 patients in whom new DRM were detected during LLV Patient # ART regimen 1 TDF/FTC+FPV/r CD 4 count at the onset of LLV (cell/mm³) 148 Baseline RAM RT: L 100 I, Y 188 C New RAM during low-level viremia LLV duration (months) p. VL at time of RAM detection (c/ml) 257 Months of treatment when RAM was detected RT: M 184 I 10 21 RT: K 219 E 9 88 40 RT: D 67 N, K 70 R, M 184 V, K 219 E RT: L 74 V 12 464 21 PR: K 20 R, D 30 N, M 36 I, I 50 L, A 71 T PR: L 10 F, L 33 F, I 53 L, L 63 P 7 256 15 11 112 18 17 114 30 6 283 17 10 104 17 11 152 43 RT : D 67 N, L 210 W, T 215 Y 6 58 12 PR: L 10 I, L 33 V 13 81 24 PR: K 20 M, M 36 I, L 63 P, V 77 I, L 90 M 2 d 4 T=3 TC+ATV/r 396 RT: D 67 N, K 70 R, M 184 V PR: L 10 I, K 20 R, M 36 I, M 46 I, I 54 M, L 63 P, A 71 T, V 77 I, I 84 V 3 ABC/3 TC+ATV/r 361 4 dd. I+3 TC+FPV/r 349 5 TDF/FTC+DRV/r+T 20+RAL 136 RT: M 184 V PR: K 20 R, M 36 I RT: M 41 L, D 67 N, Y 181 C, M 184 V, L 210 W, K 215 Y PR: L 10 I, L 33 F, M 36 I, M 46 L, G 48 V, I 54 V, L 63 P, A 71 I, V 77 I, V 82 A, L 90 M PR: I 47 V IN: T 97 A, N 155 H 6 TDF/FTC+ATV/r 545 RT: M 41 L, D 69 N, M 184 V, G 190 S TDF+ABC/3 TC+DRV/r+T 20 232 PR: K 20 R, M 46 I, L 90 M RT: M 41 L, D 67 N, T 69 D, K 70 R, L 74 V, Y 181 C, M 184 V, G 190 A, T 215 Y, K 219 E PR: I 47 V 7 PR: L 10 I, K 20 R, M 36 I, M 46 I, I 84 V PR : L 76 V 8 TDF/FTC+ETV+T 20+RAL 249 RT : L 74 V, L 100 I, K 103 N, Y 115 F, M 184 V, T 215 Y PR: L 10 I, K 20 R, V 32 I, M 46 L, I 47 V, I 53 L, I 54 V, L 63 P, A 71 V, G 73 S, V 82 A, L 90 M IN: T 97 A, Y 143 C, G 163 R 9 ABC+dd. I+EFV+ATV/r 497 RT : L 103 N, M 184 V, T 215 Y PR : G 48 V, L 63 P, A 71 V, V 77 I, V 82 T, I 84 V 10 FTC+LPV/r+ATV+T 20 29 RT : M 41 L, T 69 D, L 74 V, L 100 I, K 103 N, M 184 V PR : L 63 P 11 TDF/FTC+DRV/r 386 PR : L 63 P, V 77 I

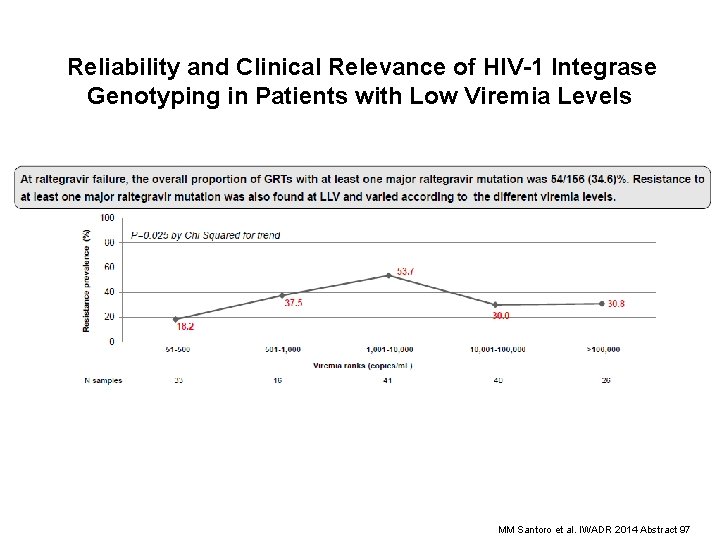
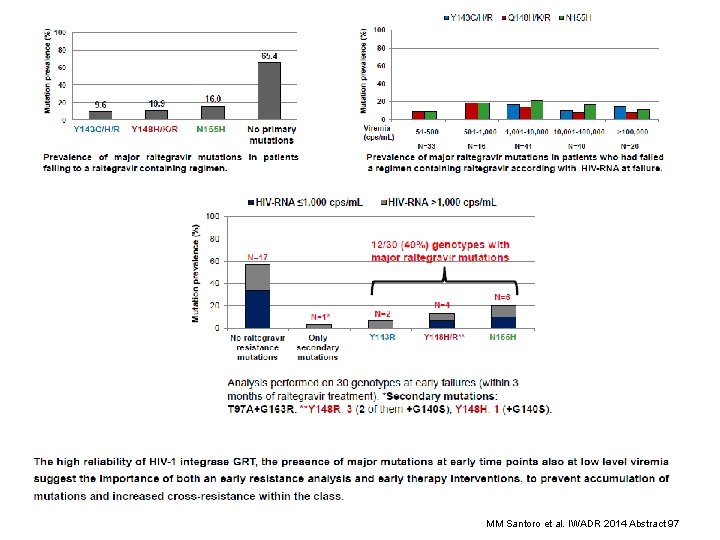
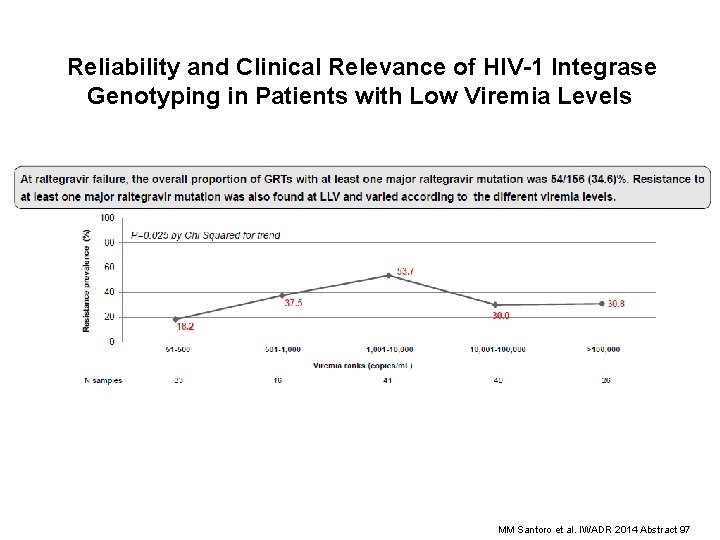
Reliability and Clinical Relevance of HIV-1 Integrase Genotyping in Patients with Low Viremia Levels MM Santoro et al. IWADR 2014 Abstract 97

MM Santoro et al. IWADR 2014 Abstract 97

Génotype sous traitement (Echec) • Mise en évidence des mutations sous la pression de sélection du traitement • Echec virologique – Niveau faible (<1000 cp/ml) – Intérêt du génotype ARN>ADN • Si plusieurs échecs virologiques sous différentes lignes de traitement, possibilité d’absence de détection de la résistance en l’absence du traitement spécifique – Importance de l’histoire thérapeutique – Intérêt du génotype cumulé

Conduite à tenir en cas d’une réplication virale faible (charge virale < 200 copies/ml) Les conséquences d’une réplication virale résiduelle confirmée entre 50 et 200 copies/ml ne sont pas aussi clairement établies qu’en cas de réplication > 200 copies/ml. Il en est de même pour les réplications faibles au dessus des seuils de détection les plus bas des techniques actuellement utilisées en routine (actuellement 20 copies/ml, Roche V 2. 0). Une surveillance particulière est requise et une intervention éventuelle adaptée à la nature du traitement ARV en cours. Si le patient reçoit un traitement comportant des ARV à faible barrière génétique (lamivudine ou emtricitabine, INNTI, INI), le risque de sélection de mutations de résistance supplémentaires augmente avec le niveau de réplication virale et sa durée [104; 105]. Le risque de sélection de mutation de résistance supplémentaire est plus faible si le patient reçoit un traitement par IP/r. Ce risque peut néanmoins exister vis à vis des autres ARV associés à l’IP/r s'ils ne sont pas pleinement actifs [106].

En priorité, les causes identifiées lors du bilan d’évaluation de l’échec virologique (cf. supra) doivent être corrigées : notamment renforcement de l’observance ; adaptation de dose, guidée par les résultats des dosages pharmacologiques ; correction d’une interaction pharmacologique. En cas de difficultés d’observance non liées à des effets indésirables, un changement de traitement n’est généralement pas la réponse la plus appropriée. Si l’inobservance est liée à des effets indésirables ou une inadéquation du schéma posologique avec le rythme de vie du patient, ce changement peut être considéré. La simplification du traitement (nombre de prises, nombre de comprimés) peut permettre d’améliorer l’observance. En dehors de ces situations d’inobservance, la persistance de la réplication virale, d’autant plus que celle ci augmente et se rapproche du seuil de 200 copies/ml et que le patient reçoit un traitement par INNTI ou INI, justifie une modification rapide de traitement pour prévenir la sélection de nouvelles mutations (BIII). Dans cette situation, un génotypage de résistance n’est le plus souvent pas réalisable à ce niveau de réplication virale résiduelle <200 copies/ml du fait d’échecs d’amplification (55% d'échec d'amplification quand la CV est comprise entre 51 et 500 copies/ml)[107]. Le choix se portera de préférence vers un traitement comportant un IP/r. Après un changement de traitement ARV pour échec virologique, un contrôle précoce (au bout d’un mois) de la CV et de la tolérance du nouveau traitement est nécessaire.

• • • Mme S, 40 ans Dépistage VIH 1999 75 kg pour 1 m 75, Sans Emploi 4 Enfants Antécédents: – Tuberculose disséminée 199 • Affections liées au VIH: – Nadir CD 4: 180 • Traitements ARV – 1999: AZT + 3 TC + VIRACEPT CD 4 400 , CV < 500 copies/ml – 2001: TRIZIVIR CD 4 stable CV indetectable jusqu en 2004 , puis fluctuente entre 0 et 500 copies ( observance) jusqu en 2005 ou cv 4100 copies) – 2005: TDF + ATZ/r indetectable jusqu en 2013 , ou cv positive dernier trimestre de la grossesse, intensification par isentress. Diabète gestationnel , HTA , dyslipidémie – 2013 : TDF + RAL : alternance charge virale indétéctable et virémie < 200 copies. Oublis de prise – 2014 : STRIBILD

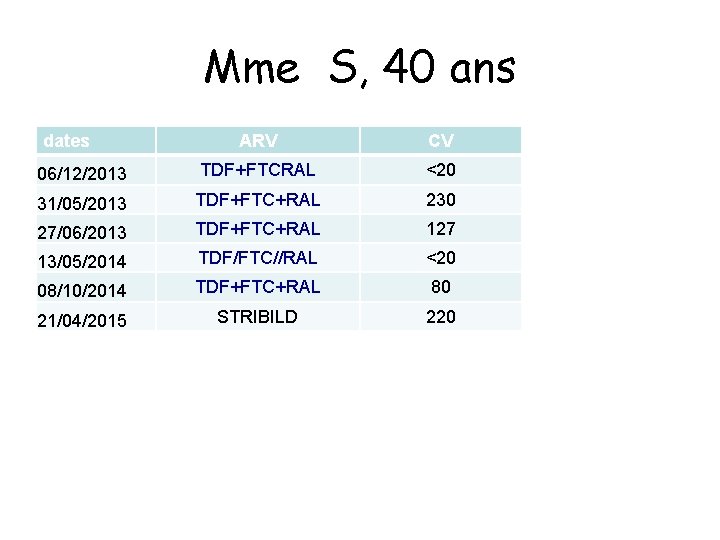
Mme S, 40 ans dates ARV CV 06/12/2013 TDF+FTCRAL <20 31/05/2013 TDF+FTC+RAL 230 27/06/2013 TDF+FTC+RAL 127 13/05/2014 TDF/FTC//RAL <20 08/10/2014 TDF+FTC+RAL 80 21/04/2015 STRIBILD 220

Mme S, 1 ER génotype 10/03/2004 : traitement reçu Trizivir Sous type B Interprétation : Résistance au 3 TC/FTC Absence de mutation conférant une résistance à la classe des inhibiteurs non nucléosidiques de la RT. Pas de résistance aux IP (présence de plusieurs mutations mineures). Modification du traitement par TDF+ATZ/r

Mme S, 40 ans 31/05/2013 sous TDF+FTC+ATZ/r + RAL Redevenue indétectable ensuite , passage TDF+FTC+RAL M 41 E 44 A 62 K 65 D 67 T 69 69 SS K 70 L 74 V 75 F 77 Y 115 F 116 Q 151 M 184 L 210 T 215 K 219 Autres Codons mutés N R Résistance à AZT, d 4 T, 3 TC/FTC Absence de résistance aux inhibiteurs non nucléosidiques de la RT. Absence de mutation conférant une résistance aux inhibiteurs de protéase. Absence de mutation de résistance aux inhibiteurs d'intégrase V Q

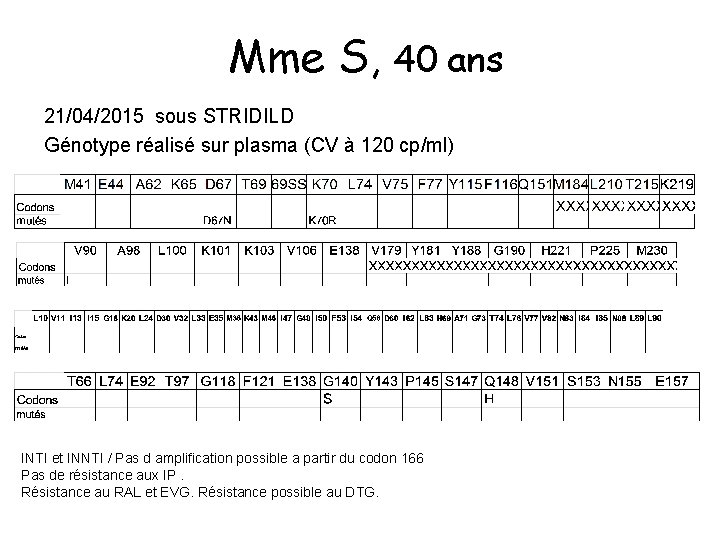
Mme S, 40 ans 21/04/2015 sous STRIDILD Génotype réalisé sur plasma (CV à 120 cp/ml) INTI et INNTI / Pas d amplification possible a partir du codon 166 Pas de résistance aux IP. Résistance au RAL et EVG. Résistance possible au DTG.

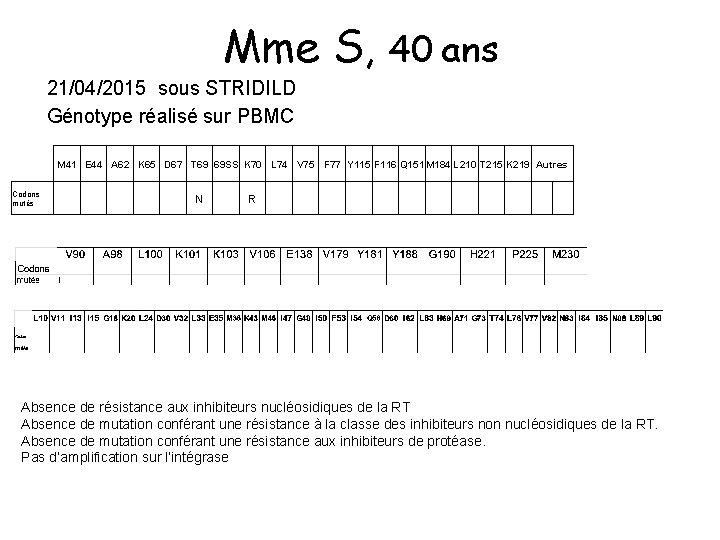
Mme S, 40 ans 21/04/2015 sous STRIDILD Génotype réalisé sur PBMC M 41 E 44 A 62 K 65 D 67 T 69 69 SS K 70 L 74 V 75 F 77 Y 115 F 116 Q 151 M 184 L 210 T 215 K 219 Autres Codons mutés N R Absence de résistance aux inhibiteurs nucléosidiques de la RT Absence de mutation conférant une résistance à la classe des inhibiteurs non nucléosidiques de la RT. Absence de mutation conférant une résistance aux inhibiteurs de protéase. Pas d’amplification sur l’intégrase

Mme S, 40 ans Que proposez vous ?

• Ce qui a été fait : – Reprise TDF + DRV/r – Indétectable à 1 mois et 3 mois

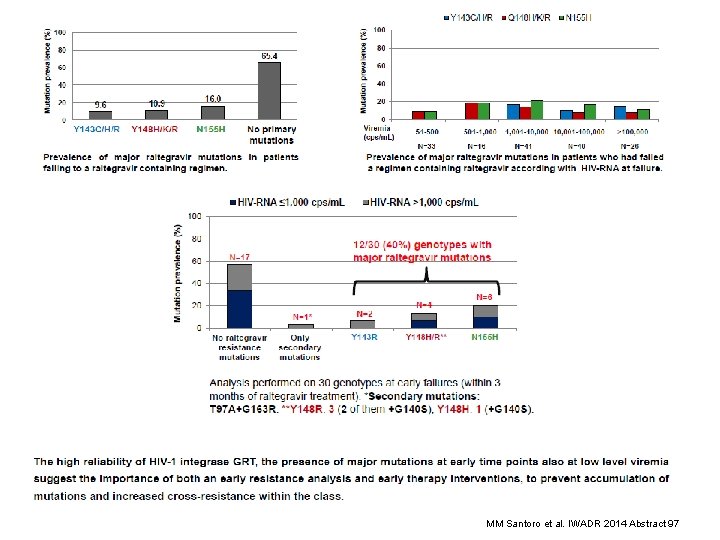
Reliability and Clinical Relevance of HIV-1 Integrase Genotyping in Patients with Low Viremia Levels MM Santoro et al. IWADR 2014 Abstract 97

MM Santoro et al. IWADR 2014 Abstract 97

Messages • Barrière génétique du raltégravir et Elvitégravir < IP • Réplication à bas bruit sous anti intégrase peut entrainer des mutations • Données génotypes plasma et PBMC complémentaires
 Reactive arthritis urethritis
Reactive arthritis urethritis Individualisation strengthsfinder
Individualisation strengthsfinder Lionel morand
Lionel morand Jean-luc lehners
Jean-luc lehners Jean-luc harousseau
Jean-luc harousseau Jean-luc mélenchon jeanine bayona
Jean-luc mélenchon jeanine bayona Dr jean-luc hoepffner
Dr jean-luc hoepffner Jean monnet jean-gabriel monnet
Jean monnet jean-gabriel monnet Jean omer marie gabriel monnet
Jean omer marie gabriel monnet Hyperprolactinémie
Hyperprolactinémie Traitement de lerreur en classe
Traitement de lerreur en classe Glo-7027
Glo-7027 Stargardt traitement
Stargardt traitement Celine duperron urologue
Celine duperron urologue Depakine surveillance biologique
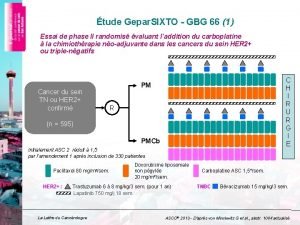
Depakine surveillance biologique Gepar
Gepar Cours traitement de texte open office
Cours traitement de texte open office Adhérence préputiale traitement
Adhérence préputiale traitement Traitement antibiotique longue durée
Traitement antibiotique longue durée Amaxophobie definition
Amaxophobie definition Broncopneumopatia
Broncopneumopatia Clostridioses
Clostridioses Traitement de lerreur en classe
Traitement de lerreur en classe Polype pulpaire traitement
Polype pulpaire traitement Holer houdoux
Holer houdoux Traitement acidose lactique metformine
Traitement acidose lactique metformine Traitement hypertension
Traitement hypertension Os naviculaire accessoire type 2 traitement
Os naviculaire accessoire type 2 traitement Muriel lenoir
Muriel lenoir Syndrome de chilaiditi traitement
Syndrome de chilaiditi traitement Traitement des objections vente
Traitement des objections vente Cystadénolymphome irm
Cystadénolymphome irm Hla b 27
Hla b 27 Leucome traitement
Leucome traitement Gastrite du moignon
Gastrite du moignon Vascularite
Vascularite Traitement dimage
Traitement dimage Synéchie utérine traitement naturel
Synéchie utérine traitement naturel Asthme traitement
Asthme traitement Asthme traitement
Asthme traitement Tympan
Tympan Kyste hydatique pulmonaire traitement
Kyste hydatique pulmonaire traitement Cholestatome
Cholestatome Ligaments jaunes hypertrophiés
Ligaments jaunes hypertrophiés Station de traitement d'eau potable
Station de traitement d'eau potable Plèvre
Plèvre Traitement du signal
Traitement du signal Cerclage haubanage rotule
Cerclage haubanage rotule Traitement didactique course d'orientation
Traitement didactique course d'orientation Condrolyse
Condrolyse Mycobacterium avium traitement naturel
Mycobacterium avium traitement naturel Lymphome traitement
Lymphome traitement Chilomastix mesnili traitement
Chilomastix mesnili traitement Dyshidrose traitement dakin
Dyshidrose traitement dakin Welcome chorus pro
Welcome chorus pro Traitement du signal
Traitement du signal Examen coude
Examen coude Traitement thyroxinique
Traitement thyroxinique Traitement eaux blanches
Traitement eaux blanches Signe du halo graisseux
Signe du halo graisseux Oap traitement d'urgence
Oap traitement d'urgence Clinique traitement ibogaïne
Clinique traitement ibogaïne Fibrome ossifiant traitement
Fibrome ossifiant traitement Transformation bilinéaire
Transformation bilinéaire Aerococcus urinae traitement
Aerococcus urinae traitement Filtre de canny python
Filtre de canny python Tp traitement de signal
Tp traitement de signal Traitement automatique des langues cours
Traitement automatique des langues cours Modèle conceptuel de traitement analytique
Modèle conceptuel de traitement analytique Cellulite sus mylo hyoïdienne
Cellulite sus mylo hyoïdienne Traitement heuristique et systématique
Traitement heuristique et systématique Céphalhématome calcifié
Céphalhématome calcifié Seuillage otsu
Seuillage otsu Laurence hubbard
Laurence hubbard Robert laurence binyon
Robert laurence binyon Friar laurence character traits
Friar laurence character traits Laurence boxer
Laurence boxer Laurence gex
Laurence gex Laurence gladieff
Laurence gladieff Laurence portal
Laurence portal Balthasar character traits romeo and juliet
Balthasar character traits romeo and juliet Laurence lwoff
Laurence lwoff Laurence boxer
Laurence boxer