Facolt di Medicina e Chirurgia Universit degli Studi
























































































- Slides: 112

Facoltà di Medicina e Chirurgia, Università degli Studi di Verona Anno Accademico 2012 -13 Corso di Farmacologia “Modulo di Farmacologia Generale” Lo sviluppo di un farmaco Prof. Roberto Leone

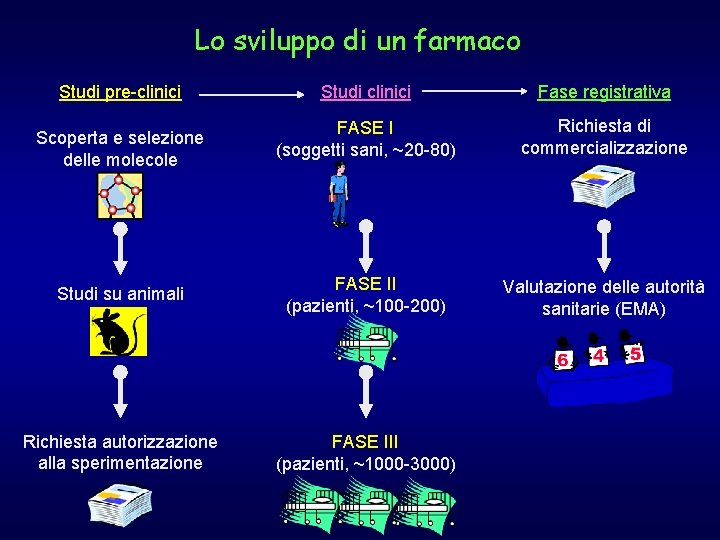
Lo sviluppo di un farmaco Studi pre-clinici Studi clinici Fase registrativa FASE I (soggetti sani, ~20 -80) Richiesta di commercializzazione Studi su animali FASE II (pazienti, ~100 -200) Valutazione delle autorità sanitarie (EMA) Richiesta autorizzazione alla sperimentazione FASE III (pazienti, ~1000 -3000) Scoperta e selezione delle molecole

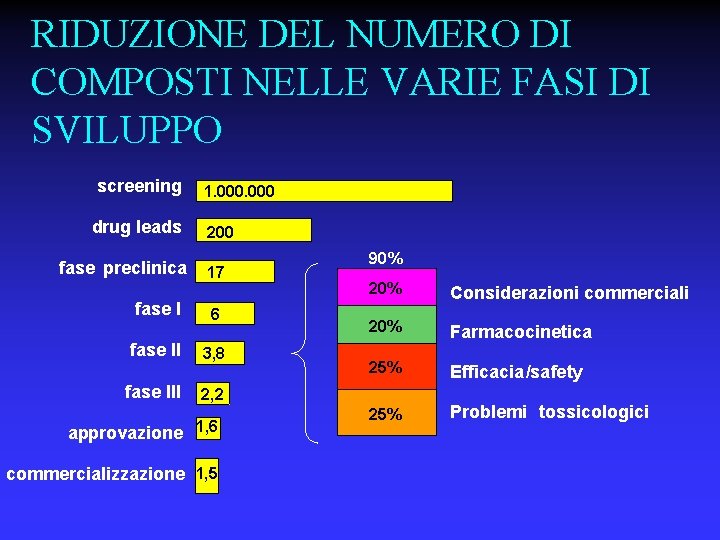
RIDUZIONE DEL NUMERO DI COMPOSTI NELLE VARIE FASI DI SVILUPPO screening drug leads fase preclinica fase III 1. 000 200 17 6 3, 8 90% 20% Considerazioni commerciali 20% Farmacocinetica 25% Efficacia/safety 25% Problemi tossicologici 2, 2 approvazione 1, 6 commercializzazione 1, 5

Obiettivi degli studi pre-clinici DURATA: 2 -3 anni 1 a FASE 2 a FASE • Caratteristiche farmacodinamiche – Effetto principale – Effetti collaterali – Durata dell’effetto Parametri farmacocinetici Assorbimento Distribuzione Metabolismo Eliminazione • Tossicità acuta – Variazioni dei parametri vitali – Determinazione DL 50 • Stabilità chimica Tossicità subacuta e cronica Alterazioni funzionali Alterazioni anatomopatologiche Effetti teratogeni Effetti sulla fertilità Effetti sul periodo peri- e post-natale Prove di mutagenesi Prove di cancerogenesi Tecnica farmacuetica Formulazione Dosaggio

Definizione di “Clinical Trial” “Qualsiasi forma di esperimento pianificato che coinvolge persone, disegnato per chiarire il trattamento più appropriato per futuri pazienti con una determinata condizione patologica”

Sperimentazioni cliniche di fase I OBIETTIVI • Tollerabilità nell’uomo • Dati di farmacocinetica e farmacodinamica • Schema di dosaggio da impiegare nella fase II SOGGETTI • Da 20 a 80 volontari sani (o pazienti in caso di farmaci ad alta tossicità) DURATA • 1 -2 anni

Sperimentazioni cliniche di fase II OBIETTIVI • Definizione della efficacia e tollerabilità nei pazienti • Individuazione del rapporto dose/effetto SOGGETTI • 100 -200 pazienti, ma anche fino od oltre 500 DURATA • 1 -2 anni METODOLOGIA • sia studi comparativi che non comparativi

Sperimentazioni cliniche di fase II La fase II è cruciale nello stabilire se continuare o meno la sperimentazione. Si tratta di capire se il risultato è così modesto (π < π0) da non meritare ulteriori studi o sufficientemente buono (π > π1) da giustificare il passaggio alla fase III. La fase II spesso viene articolata in due stadi (denominati IIa e IIb).

Sperimentazioni cliniche di fase III OBIETTIVI • Acquisizione di dati di efficacia e tollerabilità su un ampio campione • Verifica del significato clinico delle interazioni farmacologiche prevedibili • Definizione finale del rapporto dose/effetto SOGGETTI • 1000 -3000 pazienti, ma anche fino od oltre 5000 DURATA • 3 -4 anni

Sperimentazioni cliniche di fase III Ø Sperimentazioni non controllate Ø Sperimentazioni controllate non randomizzate • controlli paralleli • controlli storici Ø Sperimentazioni controllate e randomizzate (RCT)

BIAS Con questo termine si indica una forma di distorsione introdotta nei risultati I bias possono essere prevenuti attraverso un adeguato disegno sperimentale e una corretta esecuzione dello studio I bias non si possono evitare attraverso l’ampliamento della casistica

Sperimentazioni non controllate Il farmaco sperimentale viene dato ad una coorte di pazienti, in genere consecutivamente osservati, e si valutano le modificazioni da pre- a post-trattamento Bias Ø Miglioramenti post-trattamento: possono essere spontanei e non dovuti alla terapia Ø La variabilità di decorso delle malattie non consente la distinzione tra beneficio terapeutico e miglioramento spontaneo Ø Le speranze dei pazienti e le aspettative dei medici determinano un bias verso un risultato falso positivo

Sperimentazioni non controllate prospettabili solo se: • Malattia con decorso esattamente prevedibile • Efficacia del nuovo trattamento drammaticamente evidente in osservazioni iniziali • Effetti sfavorevoli accettabili in confronto al beneficio terapeutico • Assenza di trattamenti alternativi di confronto • Plausibilità biologica e farmacologica di efficacia Byar DP. NEJM 1990; 323: 1343

Alcuni esempi storici di terapie con effetti “drammatici” ü ü ü ü ü Insulina per il diabete Trasfusioni di sangue per shock emorragici Streptomicina per la meningite tubercolare Neostigmina per la miastenia gravis Tracheostomia per ostruzione trachea Suture per ferite Drenaggio ascessi Anestesia con etere Fototerapia per tubercolosi cutanea Chemioterapia con cisplatino, vinblastina e bleomicina per tumore testicolare Glasziou P et al. BMJ 2007; 334: 349 -51

In altre parole…… Il paracadute riduce il rischio di danni quando ci si lancia da un aereo, tuttavia la sua efficacia non è mai stata provata con un trial clinico controllato randomizzato…… (Smith GCS, Pell JP. BMJ 2003; 327: 1459 -62 e Potts M et al. BMJ 2006; 333: 701 -3)

Il dilemma della Farmacologia: la verifica dell’efficacia dei farmaci I PRIMI “STUDI CLINICI CONTROLLATI” In un testo di medicina del XVI sec si legge una delle più antiche esperienze farmacologiche fatte sull’uomo. Nell’antico Egitto a due condannati a morte fu donato da una donna un cedro, lo mangiarono e le morsicature degli aspidi non furono mortali. Saputa la cosa il re il giorno dopo diede del cedro ad uno dei due e non all’altro e li fece accompagnare nello stesso luogo. “quello che non aveva gustato cedro restò morto e quello che si haveva mangiato uscì vivo”. Nel 1545 Ambrose Parè, chirurgo francese, testa la capacità delle cipolle di guarire le ferite e le scottature avvolgendo alcune ferite, lasciandone scoperte altre ancora trattandole con rimedi più tradizionali. Nel 1753 James Lind, un chirurgo navale scozzese, sceglie 12 marinai con lo scorbuto, il più simili possibile fra di loro, e confronta 6 trattamenti diversi per la malattia. I due marinai che ricevettero aranci e limoni guarirono più velocemente degli altri.

1948: spartiacque per gli studi clinici (da un editoriale del BMJ, 1998) Costituzione dello “Streptomycin in Tuberculosis Trial Committee” in Inghilterra Studio sulla streptomicina sulla tubercolosi polmonare su 107 pazienti di cui 55 trattati con streptomicina e riposo a letto (Gruppo S) e 52 solo con il riposo a letto (Gruppo C). Caratteristiche dello studio: Tubercolosi polmonare acuta progressiva bilaterale Età compresa fra 15 e 25 anni (in seguito 30) Randomizzazione nell’assegnazione ai gruppi Analisi dei risultati dopo 6 mesi Risultati: Morirono 4 su 55 pazienti del gruppo S e 14 su 52 pazienti del gruppo C. Il risultato è statisticamente significativo e la probabilità che sia dovuto al caso è inferiore a 1 su 100.

L’evoluzione nel tempo delle sperimentazioni cliniche Fino agli anni 30 Trials non controllati Anni 30 -50 Trials controllati non randomizzati Anni 50 -80 Trials controllati randomizzati Anni 80 - Mega trials, Meta-analisi, Review sistematiche, Outcome research Evidence Based Medicine

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci (Fase III) Ø Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) L’utilizzo del placebo potrebbe essere preferibile in alcune situazioni ad esempio quando si vogliono chiarire aspetti di safety, ovviamente si deve valutare attentamente l’aspetto etico di privare pazienti del trattamento farmacologico.

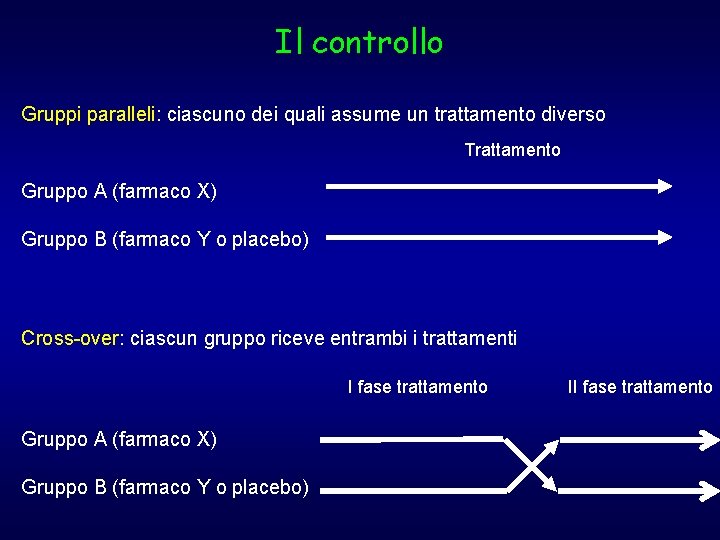
Il controllo Gruppi paralleli: ciascuno dei quali assume un trattamento diverso Trattamento Gruppo A (farmaco X) Gruppo B (farmaco Y o placebo) Cross-over: ciascun gruppo riceve entrambi i trattamenti I fase trattamento Gruppo A (farmaco X) Gruppo B (farmaco Y o placebo) II fase trattamento

Ø Il vantaggio di un disegno cross-over è essenzialmente quello di consentire un campione più limitato, in quanto si sfruttano maggiormente i pazienti arruolati e si diminuisce la variabilità (si confrontano nello stesso gruppo gli effetti del secondo trattamento rispetto al primo) Ø Gli svantaggi sono l’applicabilità solo a trattamenti cronici, la possibilità che il primo trattamento influenzi il secondo (effetto carry-over), la complessità nella gestione e nell’analisi. Ø Per evitare l’effetto carry-over sarebbe necessario un periodo di wash-out (no trattamento)

Sperimentazioni controlli storici (HCTs) ü Tutti i pazienti elegibili ricevono il trattamento sperimentale ü Si utilizzano come controlli pazienti osservati in precedenza e trattati con terapia tradizionale ü I dati dei controlli sono retrospettivi, di solito ricavati dalle cartelle cliniche

Sperimentazioni controlli storici (HCTs): LIMITI ü Limiti di completezza e attendibilità delle cartelle cliniche ü Bias di risultati falsi positivi: i pazienti che ricevono il trattamento sperimentale si avvantaggiano di progressi diagnostici e terapeutici successivi al periodo di osservazione dei controlli

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) ØRandomizzazione dei pazienti (assegnazione casuale)

Randomizzazione (random = a caso) Ø Rappresenta, assieme al controllo, la caratteristica fondamentale dei trial clinici Ø I pazienti, reclutati sulla base dei criteri di inclusione ed esclusione stabiliti a priori, vengono assegnati al trattamento sperimentale o a quello di controllo mediante una forma più o meno sofisticata di sorteggio (ad esempio generazione da parte di un computer di sequenze numeriche casuali) Ø La procedura di randomizzazione deve essere tale da rendere imprevedibile a quale trattamento verrà assegnato il paziente successivo, non sono accettabili procedure basate sulla data di nascita, sul giorno del ricovero, sul reparto di degenza, ecc. Ø Con la randomizzazione si riescono ad ottenere (almeno teoricamente) gruppi omogenei tra di loro per tutte le caratteristiche note ed ignote (es. età, sesso, gravità patologia, abitudini di vita, ecc. ) Ø L’omogeneità tra i gruppi sarà maggiore anche in relazione alla numerosità del campione


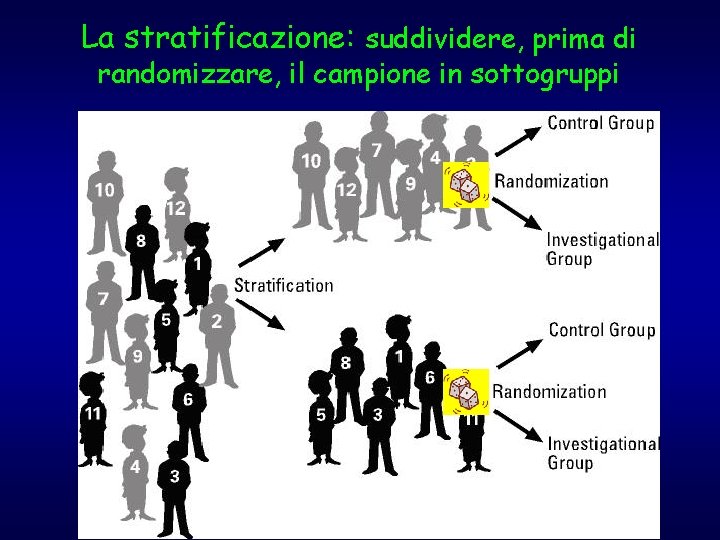
La stratificazione: suddividere, prima di randomizzare, il campione in sottogruppi


E. Van Cutsem et al.

Il paradosso della umpredictability: La randomizzazione nell’assegnazione del trattamento introduce l’imprevedibilità con lo scopo di evitare l’imprevedibilità nel numero e tipo di errori nei trial clinici Kunz and Oxman, BMJ, 1998

Sperimentazioni controllate, non randomizzate: bias ü L’assegnazione non random dei trattamenti è prevedibile e può essere modificata dalla preferenza del ricercatore a favore di uno dei due trattamenti: i gruppi a confronto non sono più comparabili Juni P et al. BMJ 2001; 323: 42 -6

Cosa vuol dire avere 2 gruppi sbilanciati: ovvero quando la randomizzazione non riesce L’ESPERIMENTO DEL LATTE NEL LANARKSHIRE (RIFERITO DA “STUDENT”, 1931) • Nel 1930 si realizzò un esperimento consistente nella somministrazione nelle scuole di 3/4 di pinta di latte al giorno a 10. 000 ragazzi; altri 10. 000 ragazzi nelle stesse scuole non ricevevano questa somministrazione. • L’obiettivo dell’esperimento era di verificare se il supplemento di latte portava a un maggior accrescimento ponderale e nella statura. • Inizialmente fu deciso di effettuare l’assegnazione dei bambini all’uno o all’altro gruppo in modo casuale in alcune scuole, e in ordine alfabetico in altre. • Si decise poi, per evitare una sproporzione numerica tra i due gruppi, di affidare agli insegnanti il compito di integrare l’uno o l’altro gruppo con altri bambini. • Verosimilmente a causa del senso di umanità degli insegnanti, che li portava ad assegnare al gruppo cui era destinato il latte i bambini più malnutriti, il risultato finale fu che il gruppo di controllo risultò superiore in una misura corrispondente a circa 3 mesi di crescita ponderale e 4 mesi di crescita in statura.

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Ø Randomizzazione dei pazienti (assegnazione casuale) Ø Cecità

La cecità: per vedere bene Singolo cieco: solo il soggetto sotto sperimentazione non sa quale trattamento sta ricevendo Doppio cieco: sia il soggetto sotto sperimentazione che gli sperimentatori non sanno quale trattamento si assume/somministra Triplo cieco: dove anche altre figure coinvolte nello studio (es. radiologi, valutatori, statistici, ecc. ) non conoscono quale trattamento hanno ricevuto i pazienti Doppio simulato (double dummy): metodica utilizzata per mantenere la cecità quando si confrontano farmaci somministrati per vie o con formulazioni diverse tra di loro In aperto: sperimentazione senza cecità. Accettabile quando si confrontano terapie diverse e/o complesse

La cecità: per vedere bene Ø Non conoscere il trattamento che si riceve (paziente) o che si somministra (sperimentatore) impedisce di essere influenzati dalle aspettative che si hanno rispetto al trattamento Ø Altrettanto importante è essere ciechi nella valutazione dei risultati della sperimentazione, soprattutto se gli end-points sono sfumati o di difficle interpretazione

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Ø Randomizzazione dei pazienti (assegnazione casuale) Ø Cecità Ø Definizione dei criteri di inclusione ed esclusione dei pazienti

Criteri di inclusione ed esclusione I criteri di inclusione, es. donne di età tra 18 e 45 anni con tumore al seno di grado II senza metastasi con coinvolgimento linfonodale (3 -6 linfonodi positivi), e i criteri di esclusione, es. precedenti patologie tumorali, diabete, ipertensione arteriosa, gravidanza o allattamento vanno definiti con chiarezza prima di iniziare la sperimentazione. Generalmente i criteri di esclusione tendono a salvaguardare determinati soggetti a rischio dai possibili danni del trattamento sperimentale

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Ø Randomizzazione dei pazienti (assegnazione casuale) Ø Cecità Ø Definizione dei criteri di inclusione ed esclusione dei pazienti Ø Rappresentatività del campione rispetto alla popolazione che assumerà il farmaco e sua adeguata dimensione

Popolazione studiata Sottogruppo della popolazione generale determinato dai criteri di inclusione/esclusione Popolazione Generale Criteri di elegibilità (incl. /escl. ) Popolazione studiata Arruolamento Campione studiato

Dimensione del campione ü Ricordarsi che lo studio è un esperimento che coinvolge persone ü La numerosità del campione deve essere tale da rispondere agli obiettivi dello studio (viene calcolata in base all’obiettivo primario) ü Non dovrebbero mai essere arruolate più persone di quelle necessarie ü La dimensione del campione è una stima basata su criteri statistici

INFERENZA STATISTICA CAMPIONE POPOLAZIONE STUDIATA La popolazione è la collettività di soggetti oggetto di studio Il campione è il gruppo di soggetti estratti dalla popolazione La casualità del campione consente di utilizzare le procedure dell’inferenza statistica trasferendo i risultati alla popolazione Il problema dei trial clinici è la definizione della popolazione (criteri di inclusione ed esclusione) e l’estrapolazione dei risultati ad una popolazione più generale rispetto a quella oggetto dello studio

Rappresentatività del campione Ø I risultati di uno studio sono estrapolabili solo ai soggetti con le stesse caratteristiche dei reclutati Ø Criteri di inclusione troppo rigidi non permettono di sapere se l’intervento in sperimentazione avrebbe gli stessi risultati nella popolazione Ø Problema donne in gravidanza, ultra anziani, bambini, spesso esclusi dalle sperimentazioni ma poi trattati quando i farmaci entrano in commercio

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Definizione chiara degli obiettivi (end-points) dello studio q Obiettivo primario q Obiettivi secondari


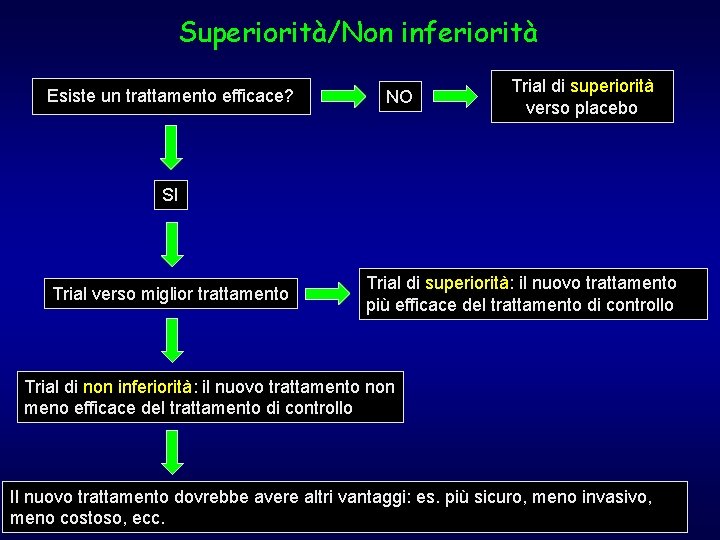
Superiorità/Non inferiorità Esiste un trattamento efficace? NO Trial di superiorità verso placebo SI Trial verso miglior trattamento Trial di superiorità: il nuovo trattamento più efficace del trattamento di controllo Trial di non inferiorità: il nuovo trattamento non meno efficace del trattamento di controllo Il nuovo trattamento dovrebbe avere altri vantaggi: es. più sicuro, meno invasivo, meno costoso, ecc.

Esempi di trial di non inferiorità accettabili Trial Angioplastica+ stent carotide vs chirurgia (Lancet 2006; 368: 1239) Vantaggi del nuovo trattamento Minore invasività Amoxicillina 3 gg vs 8 gg nella polmonite comunitaria (BMJ 2006; 332: 1355) Minore resistenza, minori costi, Ibandronato mensile vs giornaliero (Clin Migliore compliance Ther 2007; 29: 1116) Glargine 1/die vs Lispro 3/die (Lancet 2008; 371: 1073) Migliore tolleranza, minor fastidio

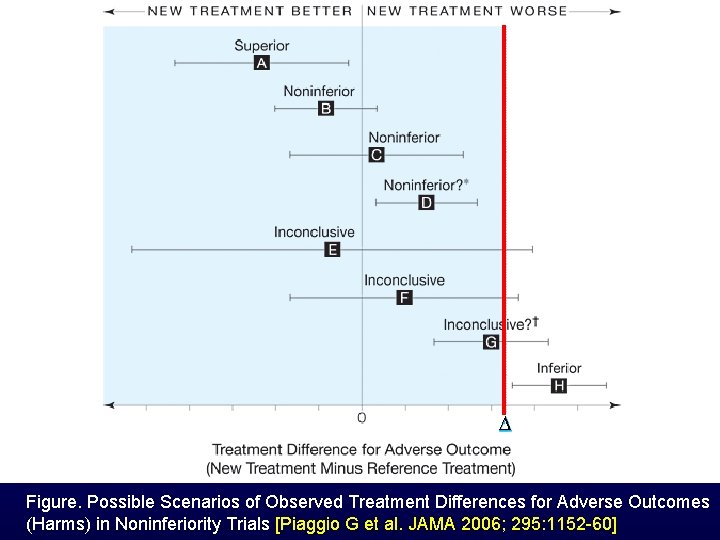
Figure. Possible Scenarios of Observed Treatment Differences for Adverse Outcomes (Harms) in Noninferiority Trials [Piaggio G et al. JAMA 2006; 295: 1152 -60]

Un dibattito acceso

End points ü Diretti efficacy (mortalità totale, mortalità causa-specifica, eventi non fatali) ü Indiretti o surrogati variazioni parametri di laboratorio ü Hard di sicura determinazione, per la verifica dei quali l’errore è minimo (mortalità) ü Soft possono essere influenzati da imprecisioni o soggettività (es. miglioramento di un quadro sintomatologico)

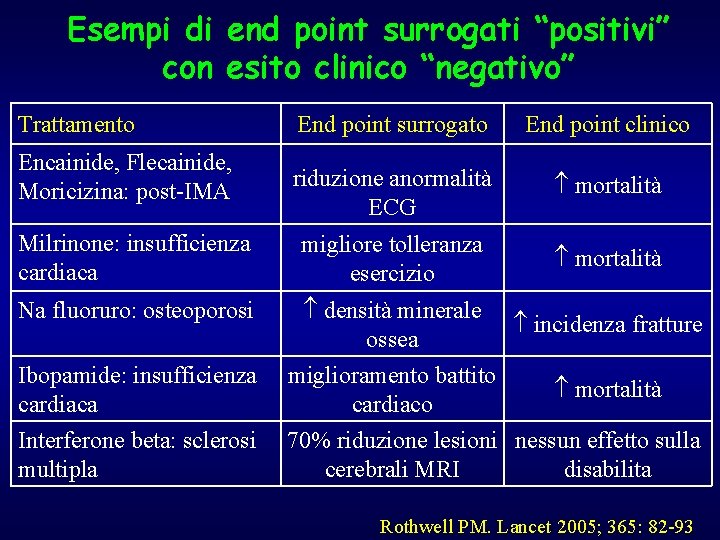
Esempi di end point surrogati “positivi” con esito clinico “negativo” Trattamento End point surrogato End point clinico riduzione anormalità ECG mortalità Milrinone: insufficienza cardiaca migliore tolleranza esercizio mortalità Na fluoruro: osteoporosi densità minerale ossea incidenza fratture Ibopamide: insufficienza cardiaca miglioramento battito cardiaco mortalità Interferone beta: sclerosi multipla 70% riduzione lesioni nessun effetto sulla cerebrali MRI disabilita Encainide, Flecainide, Moricizina: post-IMA Rothwell PM. Lancet 2005; 365: 82 -93

End-point surrogati Gli end-point surrogati possono essere utilizzati nei trial di fase II per verificare se un nuovo trattamento è biologicamente attivo. Nei trial di fase III gli end-point surrogati non dovrebbero mai sostituire i veri esiti clinici, tranne in quei rari casi in cui la loro validità è stata già rigorosamente stabilita.

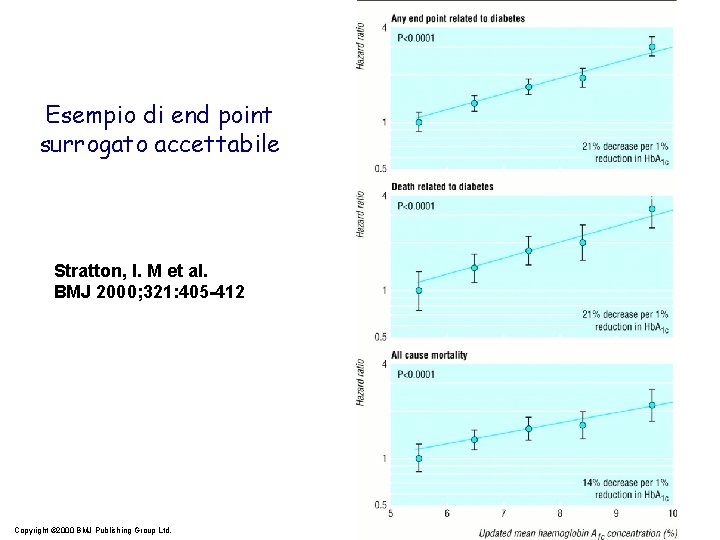
Esempio di end point surrogato accettabile Stratton, I. M et al. BMJ 2000; 321: 405 -412 Copyright © 2000 BMJ Publishing Group Ltd.

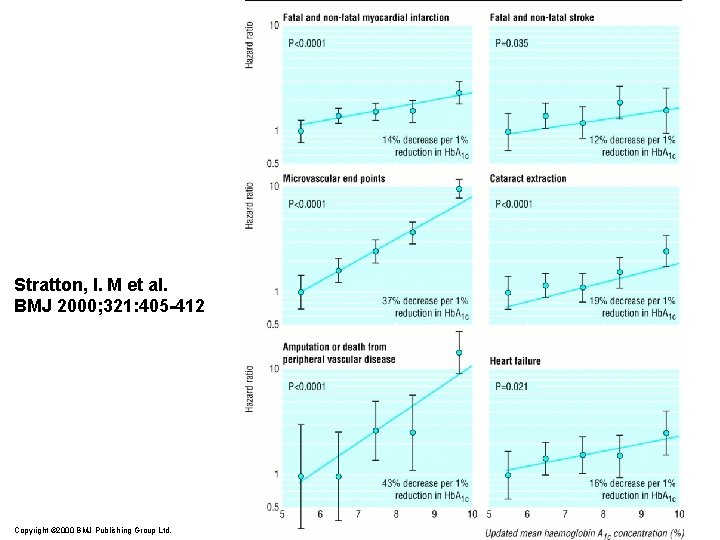
Stratton, I. M et al. BMJ 2000; 321: 405 -412 Copyright © 2000 BMJ Publishing Group Ltd.

End-point compositi Gli end-point compositi includono più eventi morbosi aumentando la potenza statistica del trial. Il loro uso è più frequente nei trial cardiovascolari. Esempio di end-point composito: morte + infarto del miocardio + rivascolarizzazione del vaso o territorio bersaglio. Attenzione se eventi maggiori vengono mescolati ad eventi minori. Possono sorgere problemi di interpretazione se gli effetti del trattamento sulla mortalità e sull’end-point composito vanno in senso diverso.

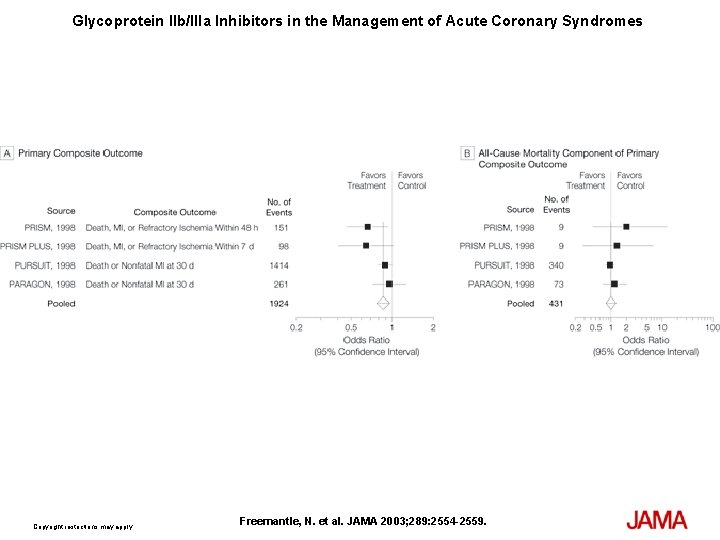
Glycoprotein IIb/IIIa Inhibitors in the Management of Acute Coronary Syndromes Copyright restrictions may apply. Freemantle, N. et al. JAMA 2003; 289: 2554 -2559.

Valutazione degli end-points: Metodi obiettivi e rigorosi Cecità




Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Definizione chiara degli obiettivi (end-points) dello studio Ø Analisi dei risultati in base a “intention to treat” o “by treatment”

Analisi dei risultati Intention to treat: i risultati vengono analizzati tenendo conto anche dei soggetti che si intendevano trattare e che per qualche motivo non sono stati trattati In questo modo la randomizzazione è l’unico elemento che determina la formazione dei gruppi Fornisce una stima pragmatica del beneficio di un intervento piuttosto che dei potenziali benefici nei pazienti che lo ricevono effettivamente Si può applicare solo quando sono disponibili i dati di esito per tutti i soggetti randomizzati Molti trials mancano dei dati sugli esiti e l’analisi dei risultati spesso non è descritta né applicata adeguatamente (vedi esempio diapositiva successiva)


Non inferiorità Superiorità L’analisi deve essere PP L’analisi deve essere ITT (tende ad accentuare le differenze quindi a maggior ragione se non c’è una differenza sarà più probabile che non ci sia) (tende a sottostimare/ridurre quindi a maggior ragione se c’è una differenza sarà più probabile che sia vera) L’analisi ITT può/deve essere aggiuntiva L’analisi PP può essere aggiuntiva

Attenzione nell’interpretazione dei risultati di una sperimentazione clinica!!

Analizzare i numeri! – 1 Interpretare i dati numerici degli studi clinici richiede un’attenta valutazione del loro significato in relazione a diversi fattori, quali il numero dei soggetti coinvolti, l’importanza e la gravità delle patologie considerate e degli eventi misurati. Alcune definizioni e formule: Experimental Event Rate (EER)= frequenza di eventi nel gruppo sperimentale Control Event Rate (CER)= frequenza di eventi nel gruppo di controllo Number Needed to Treat (NNT)= N. di pazienti da trattare EER= CER= N. eventi nel gruppo sperimentale N. di soggetti nel gruppo sperimentale N. eventi nel gruppo di controllo N. di soggetti nel gruppo di controllo Riduzione relativa del rischio (RRR)= CER-EER CER Riduzione assoluta del rischio (ARR)= CER-EER NNT per prevenire un evento= 1 AAR

ANALIZZARE I NUMERI! – 2 – Spesso i risultati degli studi clinici sono presentati come riduzione relativa del rischio (RRR) espressa come percentuale. RRR è un indicatore che, se non completato da ulteriori elementi, può enfatizzare l’efficacia di un trattamento, in particolare può far credere che il risultato sia più rilevante del reale nella pratica medica. Si noti come si possa avere stessa RRR per studi con diversa incidenza di eventi: Studio A: 10. 000 pazienti/gruppo; EER=0. 1 (10%); CER=0. 2 (20%); RRR= 0, 5 (50%) Studio B: 10. 000 pazienti/gruppo; EER=0. 01 (1%); CER= 0. 02 (2%); RRR= 0. 5 (50%) Studio C: 10. 000 pazienti/gruppo; EER=0, 001 (0, 1%); CER= 0, 002 (0, 2%); RRR= 0. 5 (50%) Se invece consideriamo la riduzione assoluta del rischio (ARR): Studio A = 0. 1 (10%); Studio B = 0. 01 (1%); Studio C = 0, 001 (0, 1%) Se consideriamo il NNT per prevenire un evento: Studio A = 10 soggetti; Studio B = 100 soggetti; Studio C = 1000 soggetti

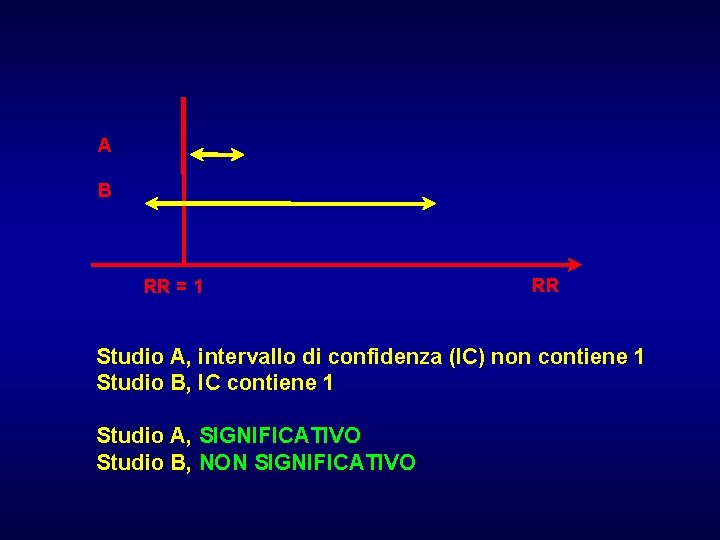
A B RR = 1 RR Studio A, intervallo di confidenza (IC) non contiene 1 Studio B, IC contiene 1 Studio A, SIGNIFICATIVO Studio B, NON SIGNIFICATIVO

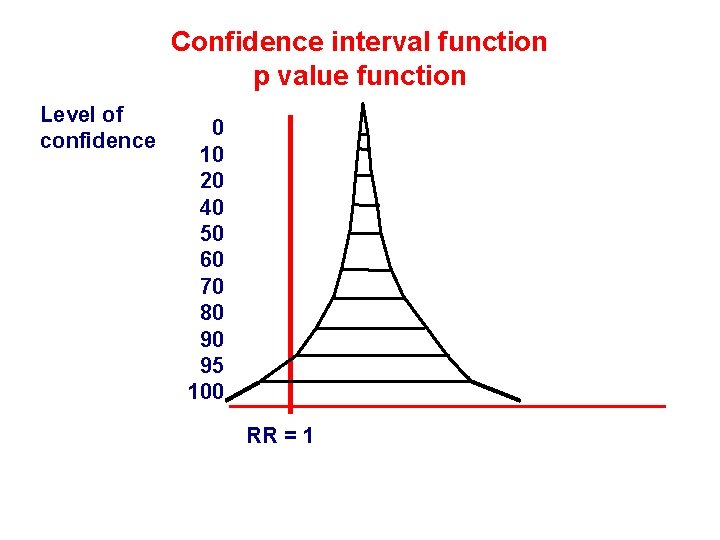
Confidence interval function p value function Level of confidence 0 10 20 40 50 60 70 80 90 95 100 RR = 1

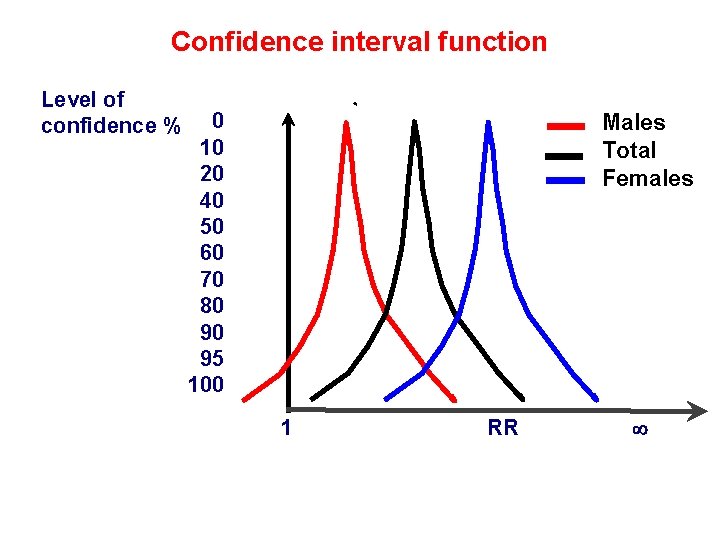
Confidence interval function Level of confidence % 0 10 20 40 50 60 70 80 90 95 100 Males Total Females 1 RR

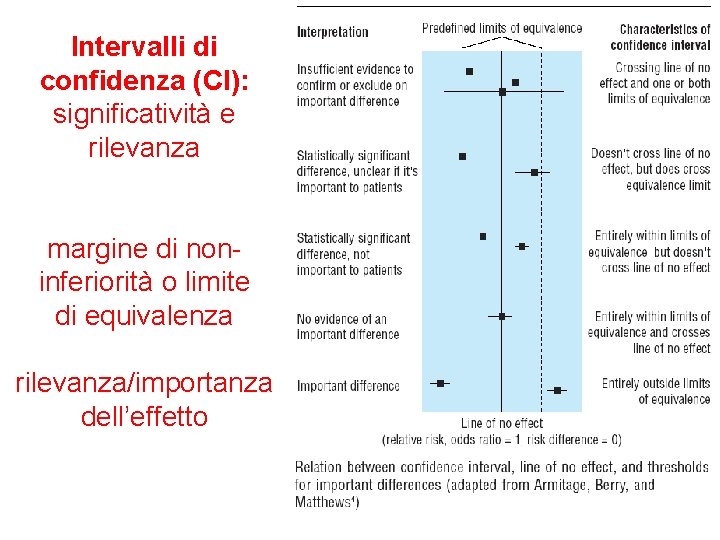
Intervalli di confidenza (CI): significatività e rilevanza margine di noninferiorità o limite di equivalenza rilevanza/importanza dell’effetto

Attenzione ai sottogruppi Risultati spesso casuali su sottogruppi non specificati a priori

Analisi per sottogruppi: … per segno zodiacale … *analisi complessiva appropriata per valutare l’effetto vero in tutti i sottogruppi ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17, 187 cases of suspected acute myocardial infarction. Lancet. 1988 Aug 13; 2(8607): 349 -60

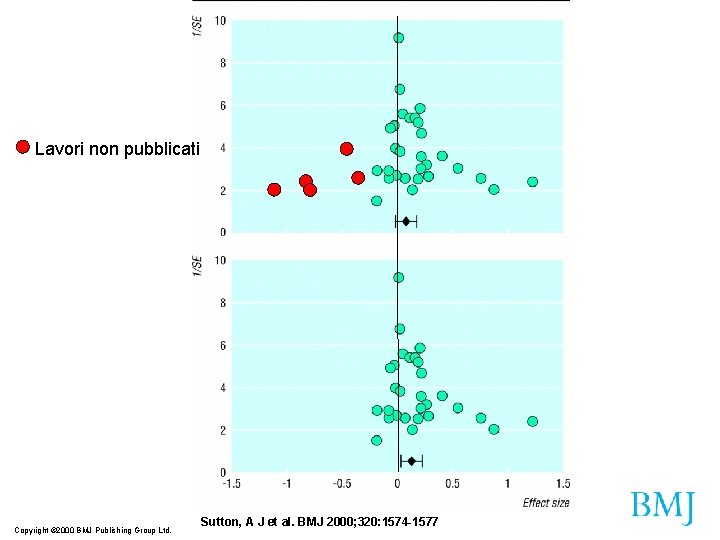
Il problema dei dati non pubblicati Publication bias Problema dei risultati (negativi) non pubblicati Uno studio randomizzato sulla lorcainide (antiaritmico di classe I), dove si osservava un aumento di morti fra i pazienti trattati, non venne pubblicato per 13 anni. Negli anni 80 questi farmaci causarono fra 20 e 70. 000 morti premature negli USA Tonks, BMJ dicembre 1999 Il publication bias si riverbera in modo particolare sulle meta-analisi

Lavori non pubblicati Copyright © 2000 BMJ Publishing Group Ltd. Sutton, A J et al. BMJ 2000; 320: 1574 -1577

SELECTIVE PUBLICATIONS OF 5 SSRI EVIDENCE B(I)ASED MEDICINE IN TOTAL 42 STUDIES • 21 STUDIES SHOW DRUG BETTER THAN PLACEBO • 19 PRIMARY PUBLICATIONS • 21 STUDIES SHOW NEGATIVE RESULTS • 6 PRIMARY PUBLICATIONS Sweedish Drug Regulatory Authority Melander et al. , BMJ 2003

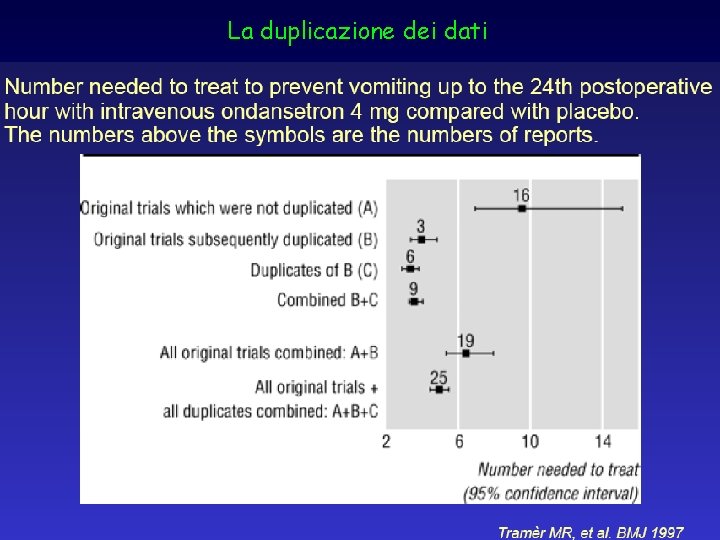
La duplicazione dei dati

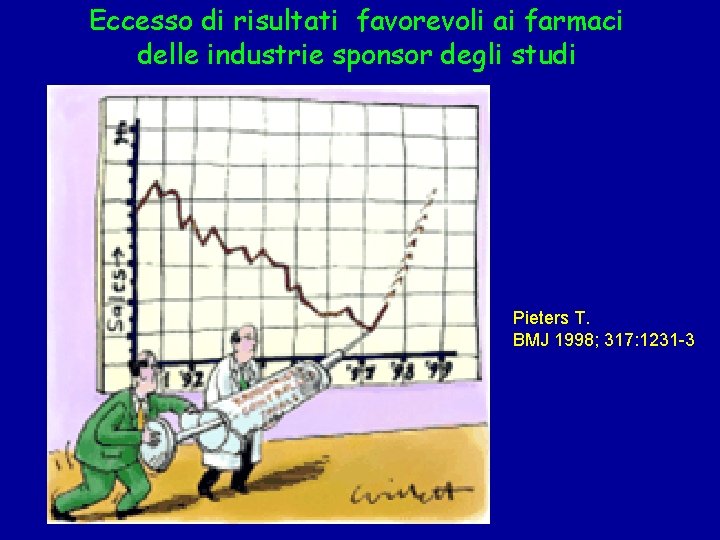
Eccesso di risultati favorevoli ai farmaci delle industrie sponsor degli studi Pieters T. BMJ 1998; 317: 1231 -3

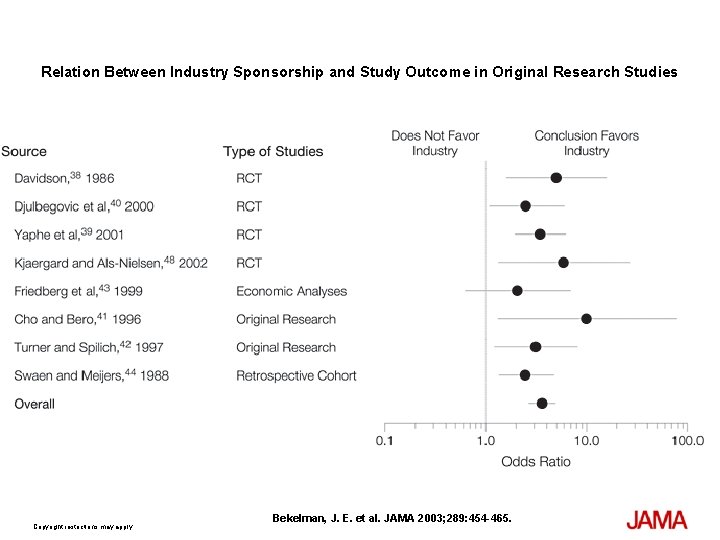
Relation Between Industry Sponsorship and Study Outcome in Original Research Studies Copyright restrictions may apply. Bekelman, J. E. et al. JAMA 2003; 289: 454 -465.

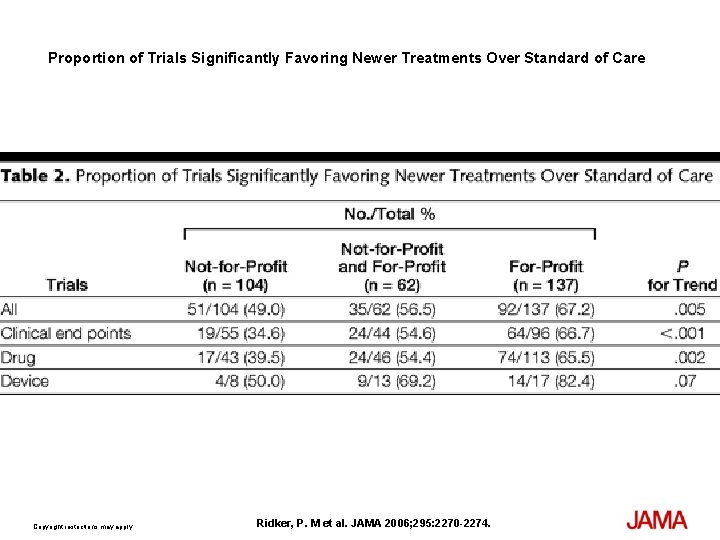
Proportion of Trials Significantly Favoring Newer Treatments Over Standard of Care Copyright restrictions may apply. Ridker, P. M et al. JAMA 2006; 295: 2270 -2274.

Possibili fattori alla base dell’eccesso di risultati favorevoli ai farmaci delle industrie sponsor degli studi Ø Scelta di farmaci di controllo “deboli” o del placebo Ø Scelta di end-point surrogati favorevoli Ø Publication bias Lexchin J et al. BMJ 2003; 326: 1167 -70

Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Ø Definizione chiara degli obiettivi (end-points) dello studio Ø Analisi dei risultati in base a “intention to treat” o “by treatment” Ø Eticità della sperimentazione Ø Consenso informato dei partecipanti

Sperimentazione clinica ed etica: un dibattito che nasce nel ‘ 800 Gli sperimenti di Neisser su prostitute non consenzienti 29 dicembre del 1900: circolare del Ministero degli affari sociali, educazione e medicina della Prussia che vieta la sperimentazione senza consenso Albert Neisser (1855 -1916) Ai primi del ‘ 900 il medico russo Smidovich pubblica The confessions of a physician dove ricostruisce le pratiche cliniche in tutto il mondo e in vari settori della ricerca, mettendo in luce i notevoli problemi etici esistenti In Italia nel 1871 il Monitore dei Tribunali si interroga, in un editoriale, sugli aspetti etici e giuridici delle sperimentazioni farmacologiche

Le tragedie della sperimentazione non etica La sperimentazione umana nei lager nazisti e giapponesi Dr. Joseph Mengele (1911 -? ) Nel 1972 il New York Times dà notizia di uno studio, iniziato nel 1932, condotto a Tuskegee (Alabama) su ignari uomini neri ammalati di sifilide che non vengono trattati per seguire l’evoluzione naturale della malattia Nel 1953 sempre negli USA viene autorizzata la sperimentazione degli effetti di armi chimiche, biologiche e atomiche su “volontari” (progionieri comuni o militari Secondo una recente inchiesta negli USA dal 25 al 50% dei soggetti coinvolti negli studi clinici non sanno a cosa hanno dato il consenso, ne sanno citare un possibile rischio o complicazione del trattamento cui hanno aderito

Requisiti etici per una corretta sperimentazione clinica Validità scientifica e valore scientifico Bad science = bad ethics La validità scientifica non comporta inevitabilmente l’eticità di una sperimentazione, è necessaria anche una eticità del metodo Good science non sempre = good ethics

ETICITÀ Non è etico effettuare una sperimentazione mal pianificata o mal eseguita Non è etico condurre una sperimentazione che non si preveda possa portare dei benefici reali alla collettività (etica collettiva) Non è etico non assicurare il miglior trattamento a ciascun paziente (etica individuale) Uno degli aspetti più problematici è quello di assicurare un giusto bilanciamento tra l’etica collettiva e quella individuale

Informare sempre sui rischi Possibili rischi: • Nuovi farmaci o terapie non sempre sono superiori (o uguali) alle cure già disponibili • Anche se il nuovo trattamento ha dei benefici non è detto che lavori bene in ogni paziente • Ovviamente conosciamo molto meno sulla sicurezza di un nuovo farmaco

Come salvaguardare i diritti dei pazienti? • Consenso informato • Ruolo dei Comitati Etici • Data safety and monitoring boards (DSMBs)

CONSENSO INFORMATO NECESSITA’ DI ANDARE OLTRE UN TACITO ASSENSO QUALITA’ DEL CONSENSO QUALITA’ DELLA COMUNICAZIONE § COMPRENSIONE DELLA INFORMAZIONE § LIBERTA’ DECISIONALE § CAPACITA’ DECISIONALE

CONSENSO INFORMATO LIMITI • ATTO BUROCRATICO • PRETESTO PER ESCLUDERE UNA COMUNICAZIONE IDEALE • PREVARICAZIONE DELLA VOLONTA’ DEL PAZIENTE

Il ruolo dei Comitati Etici

Totale CE in Italia: 254

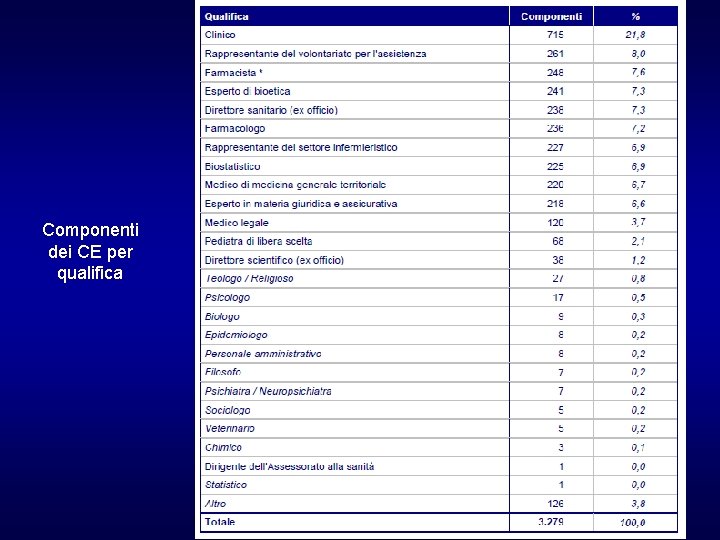
Componenti dei CE per qualifica

Esempio di griglia di valutazione: Comitato Etico Azienda Ospedaliera Verona Ø Adeguatezza del razionale scientifico del protocollo e degli obiettivi della ricerca Ø Adeguatezza del disegno dello studio Ø Rilevanza dello studio proposto Ø Adeguatezza del gruppo di controllo Ø Adeguatezza dei criteri di inclusione/esclusione del protocollo Ø Adeguatezza del coinvolgimento di volontari sani Ø Giustificazione della via di somministrazione, del dosaggio, del regime di dosaggio e della durata del trattamento sia della terapia sperimentale che della terapia di confronto 1

Esempio di griglia di valutazione: Comitato Etico Azienda Ospedaliera Verona Ø Adeguatezza delle procedure (esami e visite) previste dal protocollo per la gestione della patologia in esame Ø Adeguatezza della misura di esito primaria Ø Adeguatezza dei metodi e dei tempi per l’accertamento, la registrazione e l’analisi dei parametri di efficacia Ø Adeguatezza del follow-up previsto, rispetto alla storia naturale della malattia ed all’end-point primario scelto per lo studio Ø Adeguatezza dei parametri per la valutazione della sicurezza Ø Benefici attesi per i soggetti coinvolti Ø Benefici attesi per la società 2

Esempio di griglia di valutazione: Comitato Etico Azienda Ospedaliera Verona Ø Rischi ed inconvenienti prevedibili Ø Valutazione del rapporto benefici/rischi Ø Adeguatezza delle modalità di informazione e di richiesta del consenso informato ai soggetti da arruolare Ø Adeguatezza delle modalità di informazione del MMG Ø Adeguatezza della dimensione del campione che si vuole arruolare Ø Adeguatezza del piano statistico di analisi dei dati Ø Adeguatezza del numero dei centri partecipanti Ø Conformità rispetto alle linee guida EMEA e/o FDA in materia, se disponibili 3

Esempio di griglia di valutazione: Comitato Etico Azienda Ospedaliera Verona Ø Adeguatezza della copertura assicurativa Ø Adeguatezza del compenso previsto per lo sperimentatore Ø Correttezza dei criteri di pubblicazione dei risultati dello studio Ø Investigator’s Brochure Ø CRF (scheda raccolta dati) Ø Adeguatezza delle attività di monitoraggio previste dal protocollo 4

La sperimentazione clinica in Italia: dati del ottavo rapporto nazionale, 2009 Disponibile nel sito: http: //oss-sper-clin. agenziafarmaco. it

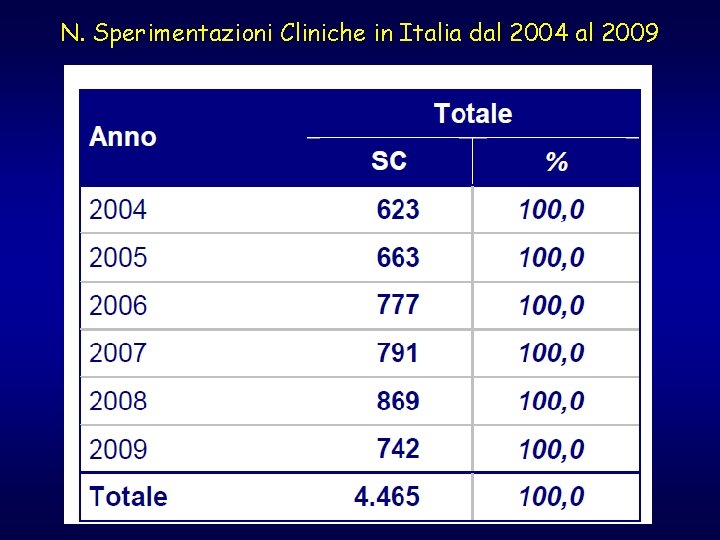
N. Sperimentazioni Cliniche in Italia dal 2004 al 2009







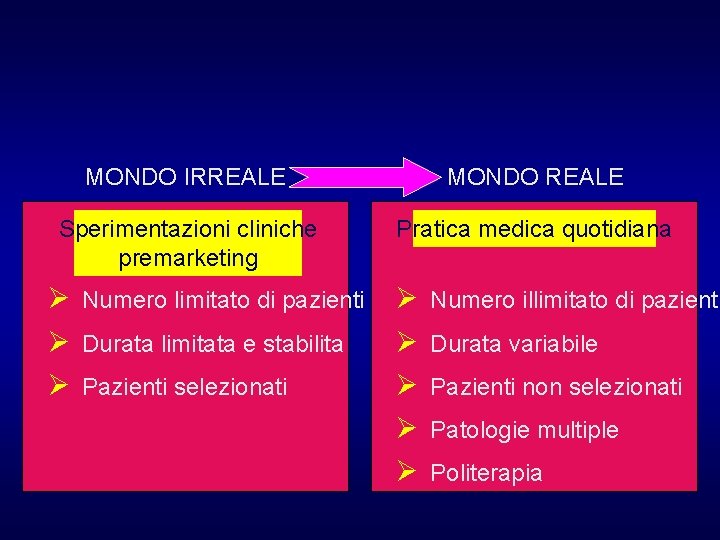
Va anche considerato che, come spero sia risultato chiaro da quanto finora esposto, esistono diversi limiti nelle sperimentazioni cliniche. Uno dei principali è la distanza tra il mondo “artificiale” della sperimentazione e quello “reale” della pratica clinica

MONDO IRREALE MONDO REALE Sperimentazioni cliniche premarketing Pratica medica quotidiana Ø Numero limitato di pazienti Ø Durata limitata e stabilita Ø Pazienti selezionati Ø Ø Ø Numero illimitato di pazienti Durata variabile Pazienti non selezionati Patologie multiple Politerapia

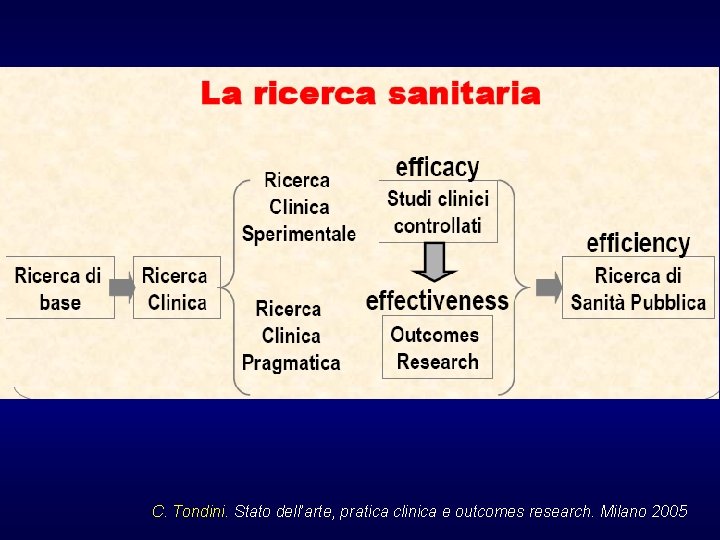
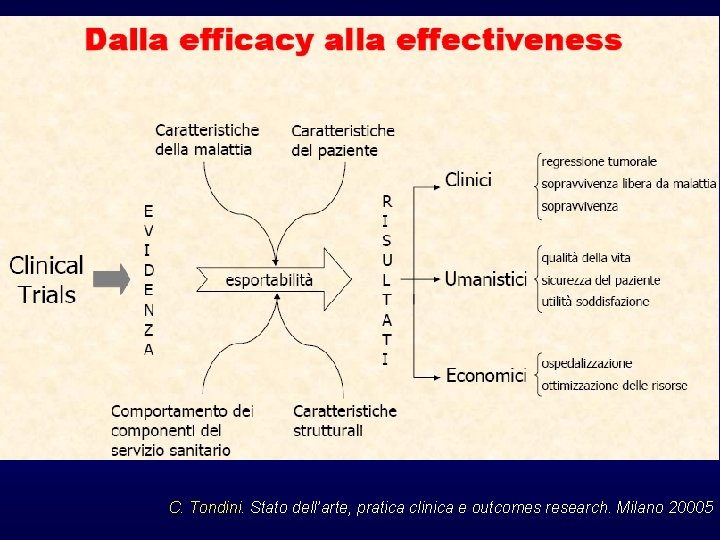
Proprio per affrontare questo problema è stato sviluppato, negli anni ’ 90, il filone delle OUTCOMES RESEARCH La finalità dell’Outcomes Research è di valutare l’esportabilità di un certo intervento, che si è dimostrato efficace nel contesto “artificiale” (efficacy), anche nel “mondo reale” (effectiveness) mantenendo lo stesso impatto finale

C. Tondini. Stato dell’arte, pratica clinica e outcomes research. Milano 2005

C. Tondini. Stato dell’arte, pratica clinica e outcomes research. Milano 2005

C. Tondini. Stato dell’arte, pratica clinica e outcomes research. Milano 20005

In ogni caso, al di là dei limiti, i trial clinici controllati randomizzati condotti secondo i criteri esposti rappresentano lo strumento indispensabile per ottenere delle evidenze scientifiche Altre metodiche possono contribuire a questo risultato, ma sono meno “forti” o si basono sui trial clinici controllati randomizzati

Evidence Based Medicine La “forza” dell’evidenza in relazione al tipo di studi effettuati Livello Tipo di studi 1 Megatrial 2 Meta-analisi 3 Trial Clinici Randomizzati 4 Studi di coorte controllati 5 Studi caso-controllo 6 Serie di casi 7 Opinioni di esperti senza riferimenti ad un tipo di studio sopracitato
 Medicina e chirurgia pisa
Medicina e chirurgia pisa Erasmus universit
Erasmus universit Universit of london
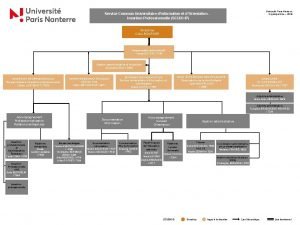
Universit of london Organigramme nanterre
Organigramme nanterre Universit
Universit Universit sherbrooke
Universit sherbrooke Kit dello studente erasmus unige
Kit dello studente erasmus unige Università degli studi di napoli
Università degli studi di napoli Kiro unipv farmacia
Kiro unipv farmacia Università degli studi di firenze psicologia
Università degli studi di firenze psicologia Università degli studi roma tre mascotte
Università degli studi roma tre mascotte Lembi random
Lembi random Edmonton obesity staging system (eoss)
Edmonton obesity staging system (eoss) Chirurgia toracica monza
Chirurgia toracica monza Chirurgia bariatrica varese
Chirurgia bariatrica varese Ittero ostruttivo
Ittero ostruttivo Plastron wyrostka robaczkowego
Plastron wyrostka robaczkowego Brand scienze
Brand scienze Facolt
Facolt Facolt
Facolt Facolt
Facolt Facolt
Facolt Idoneit
Idoneit Facolt
Facolt Match the verbs 1-6 with the nouns a-f
Match the verbs 1-6 with the nouns a-f Facolt
Facolt Abitudini alimentari degli studenti
Abitudini alimentari degli studenti Ordine degli architetti di siracusa
Ordine degli architetti di siracusa Le neoavanguardie degli anni 60 e 70
Le neoavanguardie degli anni 60 e 70 Iterazione enumerativa
Iterazione enumerativa Analisi degli scostamenti dei costi
Analisi degli scostamenti dei costi Malus comparativo e superlativo
Malus comparativo e superlativo Sistema sessagesimale angoli
Sistema sessagesimale angoli Riconoscimento degli oggetti
Riconoscimento degli oggetti Paleolitico inferiore medio e superiore
Paleolitico inferiore medio e superiore I moti degli anni 20
I moti degli anni 20 La regolazione degli affetti e la riparazione del sé
La regolazione degli affetti e la riparazione del sé Ordine degli umiliati
Ordine degli umiliati Applicazione degli integrali alla fisica
Applicazione degli integrali alla fisica Nidi di isotteri
Nidi di isotteri Rito dell'unzione degli infermi
Rito dell'unzione degli infermi Decameron federigo degli alberighi
Decameron federigo degli alberighi Gilda bologna
Gilda bologna Scienze
Scienze La palestina antica ebrei e fenici
La palestina antica ebrei e fenici Sanitaria roseto degli abruzzi
Sanitaria roseto degli abruzzi Compressibilità isoterma
Compressibilità isoterma Dichiarazione degli innocenti
Dichiarazione degli innocenti La classificazione degli alimenti
La classificazione degli alimenti Mito degli indiani yakima
Mito degli indiani yakima Cosa si intende per spezzata
Cosa si intende per spezzata Patrimonio blasi
Patrimonio blasi Teorema di unicità degli zeri
Teorema di unicità degli zeri Cablaggio strutturato edificio
Cablaggio strutturato edificio Dove si trova il medio oriente
Dove si trova il medio oriente Valori tangente
Valori tangente è risaputo che
è risaputo che 2 ottobre festa degli angeli custodi
2 ottobre festa degli angeli custodi Parafrasi inno di mameli
Parafrasi inno di mameli Formule degli urti elastici e anelastici
Formule degli urti elastici e anelastici Configurazioni elettroniche
Configurazioni elettroniche Piramide degli eventi avversi
Piramide degli eventi avversi Grandezze fisiche
Grandezze fisiche Teoria degli errori
Teoria degli errori Matrice degli stakeholder
Matrice degli stakeholder Organizzazione politica degli etruschi
Organizzazione politica degli etruschi Itn duca degli abruzzi napoli
Itn duca degli abruzzi napoli Filastrocca le forme degli gnomi
Filastrocca le forme degli gnomi Disegno d'assieme
Disegno d'assieme Ciclo cardiaco mappa concettuale
Ciclo cardiaco mappa concettuale Uno degli aspetti
Uno degli aspetti Parafrasi canto 33 inferno
Parafrasi canto 33 inferno Teoria degli stakeholder
Teoria degli stakeholder Ordinamento finanziario e contabile degli enti locali slide
Ordinamento finanziario e contabile degli enti locali slide Riempimento degli orbitali
Riempimento degli orbitali Ordinamento finanziario e contabile degli enti locali slide
Ordinamento finanziario e contabile degli enti locali slide Pessimismo montale
Pessimismo montale Spazio degli eventi
Spazio degli eventi Negano i postulati del matematico degli elementi
Negano i postulati del matematico degli elementi La nascita degli imperi coloniali
La nascita degli imperi coloniali Scostamento di efficienza
Scostamento di efficienza Reazione combustione propano
Reazione combustione propano Dichiarazione degli innocenti
Dichiarazione degli innocenti N acetil glutammato
N acetil glutammato Legge degli eventi rari
Legge degli eventi rari Costante dielettrica nel vuoto
Costante dielettrica nel vuoto I dori erano più civilizzati degli achei
I dori erano più civilizzati degli achei Ischemia acuta degli arti
Ischemia acuta degli arti Bisettrice del 1 e 3 quadrante
Bisettrice del 1 e 3 quadrante Abitudini alimentari degli studenti
Abitudini alimentari degli studenti 1s2 2s1 elemento
1s2 2s1 elemento Codice degli appalti pubblici slide
Codice degli appalti pubblici slide Le folle degli ebrei
Le folle degli ebrei Analisi degli algoritmi
Analisi degli algoritmi Il canto degli italiani
Il canto degli italiani Nastagio degli onesti boccaccio
Nastagio degli onesti boccaccio Filastrocca degli elefanti
Filastrocca degli elefanti Ben pastor la sinagoga degli zingari
Ben pastor la sinagoga degli zingari Lettera di san paolo ai corinzi amore
Lettera di san paolo ai corinzi amore Termodinamica degli stati
Termodinamica degli stati Personalizzazione degli apprendimenti
Personalizzazione degli apprendimenti Algebra degli schemi a blocchi
Algebra degli schemi a blocchi 4-sec-butil-2 3-dimetilpentano
4-sec-butil-2 3-dimetilpentano Schema atti degli apostoli
Schema atti degli apostoli Budget acquisti
Budget acquisti Tempo digestione pasta
Tempo digestione pasta Ordine psicologi della sardegna
Ordine psicologi della sardegna Parco degli aironi
Parco degli aironi Pessimismo montale
Pessimismo montale Asintoto orizzontale
Asintoto orizzontale Rotazione degli oppioidi
Rotazione degli oppioidi Poesia degli affetti
Poesia degli affetti Diritti e doveri del docente scuola primaria
Diritti e doveri del docente scuola primaria