Capitolo 11 Le soluzioni Copyright 2008 Zanichelli editore




















































- Slides: 66

Capitolo 11 Le soluzioni Copyright © 2008 Zanichelli editore 11. 1 Le soluzioni richiedono l’uso di una terminologia specifica 11. 2 Le sostanze si miscelano spontaneamente in assenza di barriere energetiche 11. 3 Le soluzioni acquose dei composti ionici conducono la corrente elettrica 11. 4 La solubilità dei gas è maggiore a basse temperature e a pressioni elevate 11. 5 La composizione di una soluzione è espressa dalla sua concentrazione 11. 6 Alcune proprietà delle soluzioni dipendono dal numero di particelle disciolte 11. 7 Le soluzioni hanno un punto di congelamento più basso e un punto di ebollizione più alto dei solventi puri 11. 8 L’osmosi è il flusso di solvente attraverso una membrana semipermeabile 11. 9 I soluti ionici hanno un effetto particolare sulle proprietà colligative 11. 10 I colloidi sono costituiti da particelle sospese in un solvente

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA Prima di affrontare lo studio delle soluzioni, è importante conoscere i termini utilizzati per descriverle. Una soluzione è una miscela omogenea i cui componenti, molecole o ioni, si mescolano muovendosi liberamente l’uno rispetto all’altro Copyright © 2008 Zanichelli editore

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA Per formare una soluzione sono necessarie almeno due sostanze: una è detta solvente, mentre le altre prendono il nome di soluti. Con il termine solvente si indica generalmente il componente presente in maggior quantità; è il mezzo in cui i soluti sono miscelati o disciolti. Il solvente più utilizzato è l’acqua liquida, anche se, in realtà, un solvente si può trovare in qualsiasi stato fisico: solido, liquido o gassoso. Assumiamo, da ora in poi, che tutte le soluzioni di cui ci occuperemo siano soluzioni acquose. Si definisce soluto una qualsiasi sostanza disciolta nel solvente. Copyright © 2008 Zanichelli editore Un soluto può essere solido, liquido o gassoso.

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA Per descrivere la composizione di generalmente a una grandezza detta: una soluzione ci riferiamo concentrazione, definita come rapporto tra quantità di soluto e quantità di solvente o di soluzione. Tali quantità possono essere espresse utilizzando diversi tipi di unità di misura secondo le necessità. . Il rapporto espresso come grammi di soluto presenti in 100 g di soluzione viene definito concentrazione percentuale. Copyright © 2008 Zanichelli editore Le quantità relative di soluto e di solvente possono essere a volte indicate in modo approssimativo. In una soluzione diluita, per esempio, il rapporto tra soluto e solvente può essere molto piccolo. In una soluzione concentrata, al contrario, il rapporto tra soluto e solvente è elevato.

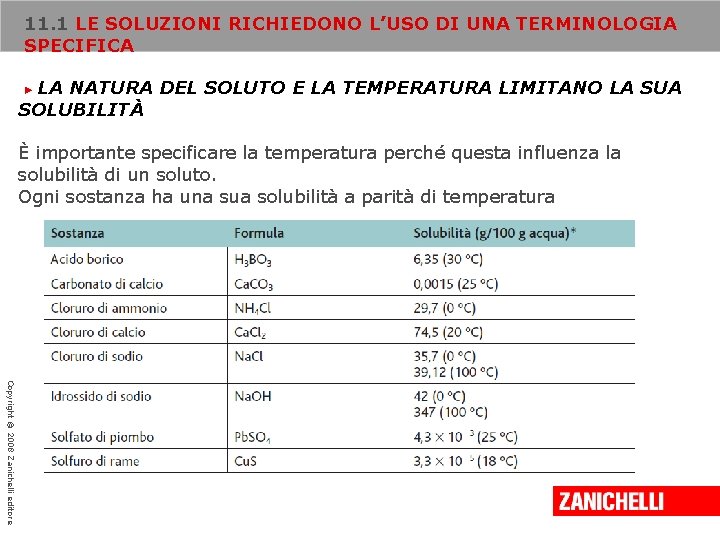
11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA LA NATURA DEL SOLUTO E LA TEMPERATURA LIMITANO LA SUA SOLUBILITÀ ► A ogni valore di temperatura esiste in genere un limite alla quantità di soluto che può essere disciolta in una certa quantità di solvente. A 20 °C, per esempio, in 100 g di acqua possono essere disciolti non più di 36, 0 g di cloruro di sodio; l’ulteriore aggiunta di soluto ne comporta semplicemente la deposizione sul fondo della soluzione (corpo di fondo). Si tratta di una soluzione satura poiché a questa temperatura non è possibile disciogliere altro soluto. Copyright © 2008 Zanichelli editore La solubilità di un soluto è generalmente definita dai grammi di soluto che, disciolti in 100 g di solvente, a una certa temperatura, rendono satura una soluzione.

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA LA NATURA DEL SOLUTO E LA TEMPERATURA LIMITANO LA SUA SOLUBILITÀ ► È importante specificare la temperatura perché questa influenza la solubilità di un soluto. Ogni sostanza ha una sua solubilità a parità di temperatura Copyright © 2008 Zanichelli editore

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA LA NATURA DEL SOLUTO E LA TEMPERATURA LIMITANO LA SUA SOLUBILITÀ ► In genere, la solubilità di un soluto aumenta all’aumentare della temperatura della soluzione; in tal caso, riscaldando la miscela si può disciogliere una maggiore quantità di soluto. A livello molecolare le particelle di soluto passano continuamente dalla soluzione alla fase separata e viceversa, perché esiste un equilibrio tra le due fasi Possiamo rappresentare questo equilibrio come segue: Copyright © 2008 Zanichelli editore

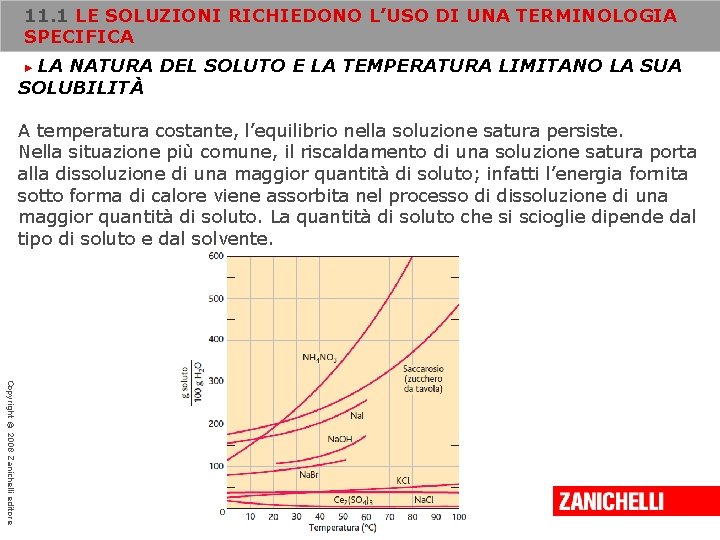
11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA LA NATURA DEL SOLUTO E LA TEMPERATURA LIMITANO LA SUA SOLUBILITÀ ► A temperatura costante, l’equilibrio nella soluzione satura persiste. Nella situazione più comune, il riscaldamento di una soluzione satura porta alla dissoluzione di una maggior quantità di soluto; infatti l’energia fornita sotto forma di calore viene assorbita nel processo di dissoluzione di una maggior quantità di soluto. La quantità di soluto che si scioglie dipende dal tipo di soluto e dal solvente. Copyright © 2008 Zanichelli editore

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA LA NATURA DEL SOLUTO E LA TEMPERATURA LIMITANO LA SUA SOLUBILITÀ ► Se una soluzione satura viene successivamente raffreddata, il soluto in eccesso si separa spontaneamente dalla soluzione. Talvolta, il soluto in eccesso non si separa: in questi casi si produce una soluzione sovrasatura, nella quale è effettivamente contenuta una quantità maggiore di soluto rispetto alla sua solubilità a una certa temperatura. Le soluzioni sovrasature sono instabili; la semplice presenza o l’aggiunta di un minuscolo cristallo di soluto determina infatti la cristallizzazione del soluto in eccesso. Copyright © 2008 Zanichelli editore

11. 1 LE SOLUZIONI RICHIEDONO L’USO DI UNA TERMINOLOGIA SPECIFICA LA NATURA DEL SOLUTO E LA TEMPERATURA LIMITANO LA SUA SOLUBILITÀ ► Quando una reazione si svolge in soluzione, può accadere che uno dei prodotti formati sia scarsamente solubile nel solvente. Non appena questa sostanza si forma, la soluzione diviene fortemente sovrasatura e la stessa sostanza si separa dalla soluzione formando un solido che prende il nome di precipitato. Una reazione in cui si forma un precipitato è detta reazione di precipitazione. Copyright © 2008 Zanichelli editore

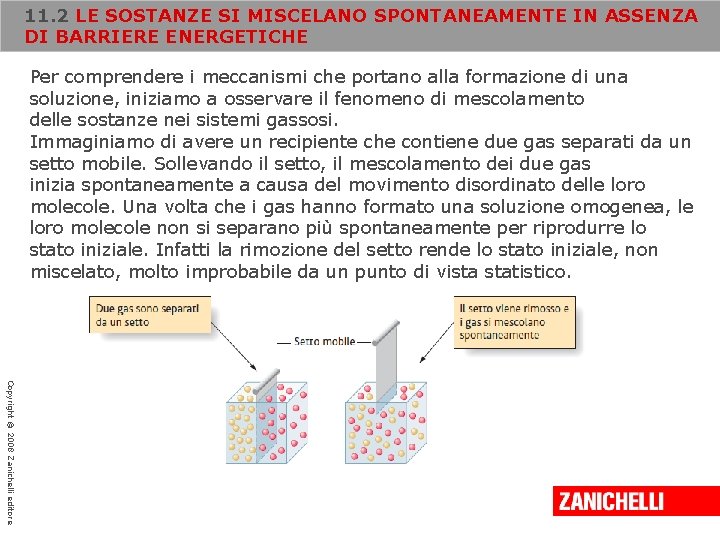
11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE Per comprendere i meccanismi che portano alla formazione di una soluzione, iniziamo a osservare il fenomeno di mescolamento delle sostanze nei sistemi gassosi. Immaginiamo di avere un recipiente che contiene due gas separati da un setto mobile. Sollevando il setto, il mescolamento dei due gas inizia spontaneamente a causa del movimento disordinato delle loro molecole. Una volta che i gas hanno formato una soluzione omogenea, le loro molecole non si separano più spontaneamente per riprodurre lo stato iniziale. Infatti la rimozione del setto rende lo stato iniziale, non miscelato, molto improbabile da un punto di vista statistico. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE Il mescolamento spontaneo dei gas illustra una delle «forze trainanti» più importanti in natura: un sistema tende spontaneamente verso lo stato più probabile. La tendenza naturale a raggiungere lo stato più probabile spiega la formazione di una miscela di gas, ma anche di soluzioni liquide in cui le forze di attrazione fra tutte le molecole sono della stessa natura. Se le forze di attrazione fra molecole uguali nelle sostanze allo stato puro sono più intense di quelle fra le molecole diverse presenti in soluzione, ciò impedisce al sistema di evolvere spontaneamente verso lo stato miscelato più probabile. Il successo nella preparazione di soluzioni non gassose non dipende solo dal fatto che lo stato miscelato è il più probabile, ma anche dall’intensità delle forze di attrazione intermolecolari presenti nel solvente e nel soluto. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE LA SOLUBILITÀ DEI LIQUIDI DIPENDE DALLA NATURA DELLE FORZE TRA LE PARTICELLE DEL SOLVENTE E QUELLE DEL SOLUTO ► Se mescoliamo, in qualsiasi proporzione, etanolo (il comune alcol etilico) e acqua, questi formano una soluzione; possiamo quindi affermare che le due sostanze sono completamente miscibili. Il benzene, C 6 H 6, al contrario, è un liquido pressoché insolubile in acqua; le due sostanze sono immiscibili. Per comprendere il diverso comportamento, osserviamo più attentamente che cosa accade in entrambi i casi quando i liquidi si mescolano. In primo luogo, sappiamo che quando si forma una soluzione le molecole del soluto e quelle del solvente si devono separare le une dalle altre per potersi mescolare. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE LA SOLUBILITÀ DEI LIQUIDI DIPENDE DALLA NATURA DELLE FORZE TRA LE PARTICELLE DEL SOLVENTE E QUELLE DEL SOLUTO ► Le molecole di etanolo possiedono un gruppo polare OH e sono quindi in grado di formare legami a idrogeno fra loro e con le molecole d’acqua. Queste ultime possono attrarre le molecole di alcol quasi con la stessa intensità con cui si attraggono reciprocamente. Le forze che devono essere vinte quando le molecole d’acqua si separano per lasciar posto a quelle di etanolo sono compensate da attrazioni simili con le nuove molecole. La tendenza naturale della soluzione a evolvere verso lo stato miscelato più probabile può agire indisturbata: acqua e alcol sono miscibili. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE LA SOLUBILITÀ DEI LIQUIDI DIPENDE DALLA NATURA DELLE FORZE TRA LE PARTICELLE DEL SOLVENTE E QUELLE DEL SOLUTO ► Copyright © 2008 Zanichelli editore Quando proviamo a sciogliere il benzene nell’acqua la situazione è diversa: le molecole di benzene sono apolari e si attraggono reciprocamente soltanto per mezzo di deboli forze di London; non formano invece legami a idrogeno e non sono quindi apprezzabilmente attratte dalle molecole d’acqua. Per lasciare spazio alle molecole di benzene, le molecole d’acqua dovrebbero separarsi fra loro e ciò richiederebbe una certa spesa energetica per rompere i legami a idrogeno che le tengono unite. L’energia spesa non sarebbe compensata da nuove forze di attrazione verso le molecole di benzene. In queste condizioni, le intense forze intermolecolari dell’acqua si oppongono alla tendenza naturale a raggiungere lo stato miscelato più probabile.

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE LA SOLUBILITÀ DEI LIQUIDI DIPENDE DALLA NATURA DELLE FORZE TRA LE PARTICELLE DEL SOLVENTE E QUELLE DEL SOLUTO ► Sebbene il benzene non si sciolga in acqua, esso si può miscelare facilmente con liquidi apolari come il tetracloruro di carbonio, CCl 4. Le forze di attrazione fra le molecole CCl 4 sono della stessa natura e intensità di quelle esistenti fra le molecole di benzene. L’energia necessaria per aprire spazi nel benzene, che possano essere occupati dalle molecole CCl 4, è compensata dall’energia liberata quando si formano nuove attrazioni fra molecole di benzene e CCl 4. Su questo principio generale si basa la tecnica di laboratorio nota come «estrazione con solvente» Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE LA SOLUBILITÀ DEI LIQUIDI DIPENDE DALLA NATURA DELLE FORZE TRA LE PARTICELLE DEL SOLVENTE E QUELLE DEL SOLUTO ► Nel complesso osserviamo che, quando l’intensità delle attrazioni intermolecolari è simile nel soluto e nel solvente, le soluzioni possono formarsi facilmente, come nei casi delle miscele alcol-acqua e benzenetetracloruro di carbonio. Questa è l’essenza della regola che i chimici sintetizzano con l’espressione simile scioglie simile: se soluto e solvente sono costituiti da molecole «simili» fra loro in termini di polarità, essi tendono a formare una soluzione. Al contrario, se soluto e solvente hanno polarità diversa, non si forma alcuna soluzione. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE ANCHE LA SOLUBILITÀ DEI SOLIDI DIPENDE DALL’INTENSITÀ RELATIVA DELLE ATTRAZIONI INTERMOLECOLARI ► Se consideriamo le soluzioni dei solidi nei liquidi, i principi di base sono sempre gli stessi. Vediamo che cosa accade quando il cloruro di sodio, un solido cristallino, si scioglie in acqua. La figura illustra la sezione di un cristallo di Na. Cl a contatto con l’acqua. I dipoli delle molecole d’acqua si orientano: la parte negativa di alcune molecole è disposta verso gli ioni Na+ e quella positiva di altre verso gli ioni Cl-. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE ANCHE LA SOLUBILITÀ DEI SOLIDI DIPENDE DALL’INTENSITÀ RELATIVA DELLE ATTRAZIONI INTERMOLECOLARI ► Una volta liberi, gli ioni vengono completamente circondati da molecole d’acqua, secondo un processo che prende il nome di idratazione degli ioni. Il termine generale usato per indicare che la particella di soluto è stata circondata dalle molecole del solvente è solvatazione; l’idratazione è solo un caso particolare di solvatazione. I composti ionici si sciolgono in acqua quando le attrazioni che si stabiliscono fra le molecole d’acqua e gli ioni sono più intense di quelle esistenti fra gli stessi ioni nel cristallo. Copyright © 2008 Zanichelli editore

11. 2 LE SOSTANZE SI MISCELANO SPONTANEAMENTE IN ASSENZA DI BARRIERE ENERGETICHE ANCHE LA SOLUBILITÀ DEI SOLIDI DIPENDE DALL’INTENSITÀ RELATIVA DELLE ATTRAZIONI INTERMOLECOLARI ► Copyright © 2008 Zanichelli editore Per analogia, anche i solidi costituiti da molecole polari, come lo zucchero, si sciolgono in acqua. Le attrazioni fra i dipoli del solvente e del soluto contribuiscono a separare le molecole dal cristallo e a portarle in soluzione. Ancora una volta osserviamo che «simile scioglie simile» : il soluto polare si scioglie in un solvente polare. Lo stesso tipo di ragionamento spiega per quale motivo i solidi apolari come la cera siano solubili nei solventi apolari come il benzene. La cera è una miscela solida di idrocarburi a catena lunga, stabilizzata da forze di London. Le attrazioni che si esercitano fra le molecole del solvente (benzene) e fra quelle del soluto (cera) sono, in entrambi i casi, forze di London di intensità simile. La tendenza naturale a evolvere verso lo stato miscelato più probabile non è ostacolata.

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA Mentre l’acqua pura ha una conducibilità elettrica molto scarsa perché è costituita da molecole neutre, incapaci di trasportare cariche elettriche, la soluzione di un composto ionico come Cu. SO 4 o Na. Cl in acqua presenta un’elevata conducibilità elettrica. La solubilità di un soluto è generalmente definita dai grammi di soluto che, disciolti in 100 g di solvente, a una certa temperatura, rendono satura una soluzione. Copyright © 2008 Zanichelli editore

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA La conducibilità elettrica è dovuta alla presenza di particelle cariche in grado di muoversi liberamente all’interno delle soluzioni. Questa proprietà può essere spiegata assumendo che, quando un composto ionico si discioglie in acqua, gli ioni che lo costituiscono si separano l’uno dall’altro ed entrano in soluzione sotto forma di particelle indipendenti, ognuna circondata da molecole del solvente. Tale fenomeno è noto come dissociazione del composto ionico. In generale, possiamo affermare che la dissociazione di un composto ionico è completa e che una sua soluzione non contiene particelle indissociate del sale. Una soluzione acquosa di Na. Cl contiene quindi ioni Na + e Cl- ma non particelle indissociate di Na. Cl. Copyright © 2008 Zanichelli editore

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA Copyright © 2008 Zanichelli editore Grazie alla presenza di un gran numero di ioni, queste soluzioni presentano un’elevata conducibilità elettrica e i sali che le costituiscono sono detti elettroliti forti. Molti composti ionici sono scarsamente solubili in acqua; un esempio è rappresentato dal bromuro di argento, Ag. Br, la sostanza sensibile alla luce delle pellicole fotografiche. Per quanto ridotta sia la quantità di Ag. Br che si scioglie in acqua, questa è comunque completamente dissociata. A causa della scarsissima solubilità, tuttavia, il numero di ioni che si libera è molto piccolo e la soluzione non mostra una buona conducibilità elettrica. Ciò nonostante, anche in questo caso è giusto considerare Ag. Br come un elettrolita forte, perché così ricordiamo che i sali in soluzione acquosa vanno incontro a dissociazione completa.

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA La maggior parte delle soluzioni acquose di composti molecolari non presenta conducibilità elettrica; i relativi soluti vengono perciò detti non elettroliti. Ne sono esempi lo zucchero e il glicole etilenico (il soluto delle soluzioni antigelo), le cui molecole rimangono intatte quando sono disciolte, mescolandosi semplicemente con le molecole d’acqua per formare le rispettive soluzioni. Queste ultime non contengono particelle elettricamente cariche e quindi non conducono l’elettricità. Copyright © 2008 Zanichelli editore

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA LE EQUAZIONI RELATIVE ALLE REAZIONI DI DISSOCIAZIONE METTONO IN EVIDENZA GLI IONI ► Con le equazioni chimiche è possibile rappresentare un modo conveniente per descrivere la dissociazione di un composto ionico: Copyright © 2008 Zanichelli editore Ogni particella carica è seguita dal simbolo (aq) per indicare che è disciolta in soluzione ed è circondata da molecole di acqua. Le formule degli ioni vengono scritte separatamente perché in soluzione questi sono, in pratica, indipendenti l’uno dall’altro.

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA LE EQUAZIONI RELATIVE ALLE REAZIONI DI DISSOCIAZIONE METTONO IN EVIDENZA GLI IONI ► Possiamo scrivere un’equazione simile per rappresentare la dissociazione del cloruro di calcio, Ca. Cl 2: Copyright © 2008 Zanichelli editore L’equazione mostra che ogni unità formula di Ca. Cl 2(s) rilascia tre ioni, uno ione Ca 2+(aq) e due Cl-(aq). Ancora una volta, i simboli (s) e (aq) indicano che il fenomeno consiste nella dissociazione del composto ionico. Più frequentemente, tuttavia, questi simboli non sono riportati ma vengono «sottintesi» quando dal contesto si comprende che il sistema è una soluzione acquosa.

11. 3 LE SOLUZIONI ACQUOSE DEI COMPOSTI IONICI CONDUCONO LA CORRENTE ELETTRICA LE EQUAZIONI RELATIVE ALLE REAZIONI DI DISSOCIAZIONE METTONO IN EVIDENZA GLI IONI ► Gli ioni poliatomici, di norma, non si modificano nel corso della dissociazione. Per esempio, quando il solfato di sodio, Na 2 SO 4, si scioglie in acqua, la sua soluzione contiene ioni sodio e ioni solfato, liberati secondo la seguente equazione: Per scrivere correttamente un’equazione come questa, dobbiamo conoscere la formula e la carica dello ione poliatomico. Copyright © 2008 Zanichelli editore

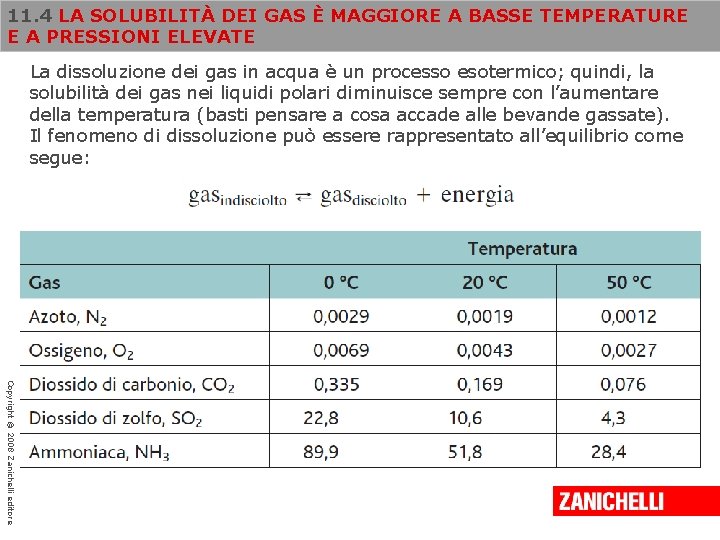
11. 4 LA SOLUBILITÀ DEI GAS È MAGGIORE A BASSE TEMPERATURE E A PRESSIONI ELEVATE La dissoluzione dei gas in acqua è un processo esotermico; quindi, la solubilità dei gas nei liquidi polari diminuisce sempre con l’aumentare della temperatura (basti pensare a cosa accade alle bevande gassate). Il fenomeno di dissoluzione può essere rappresentato all’equilibrio come segue: Copyright © 2008 Zanichelli editore

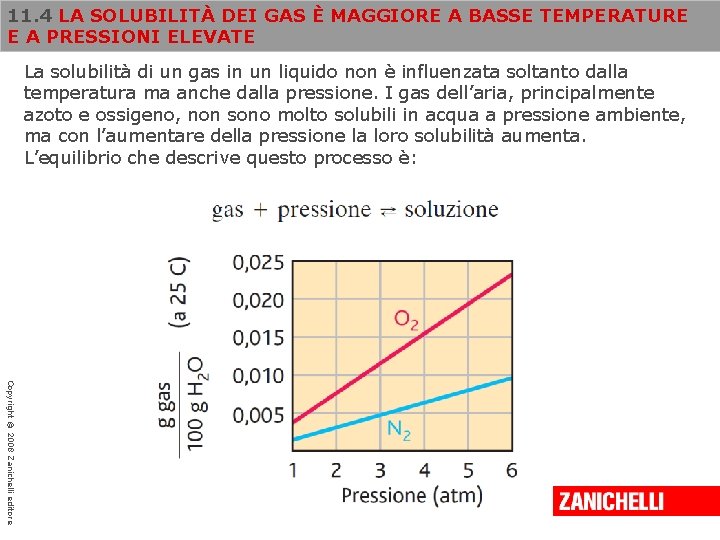
11. 4 LA SOLUBILITÀ DEI GAS È MAGGIORE A BASSE TEMPERATURE E A PRESSIONI ELEVATE La solubilità di un gas in un liquido non è influenzata soltanto dalla temperatura ma anche dalla pressione. I gas dell’aria, principalmente azoto e ossigeno, non sono molto solubili in acqua a pressione ambiente, ma con l’aumentare della pressione la loro solubilità aumenta. L’equilibrio che descrive questo processo è: Copyright © 2008 Zanichelli editore

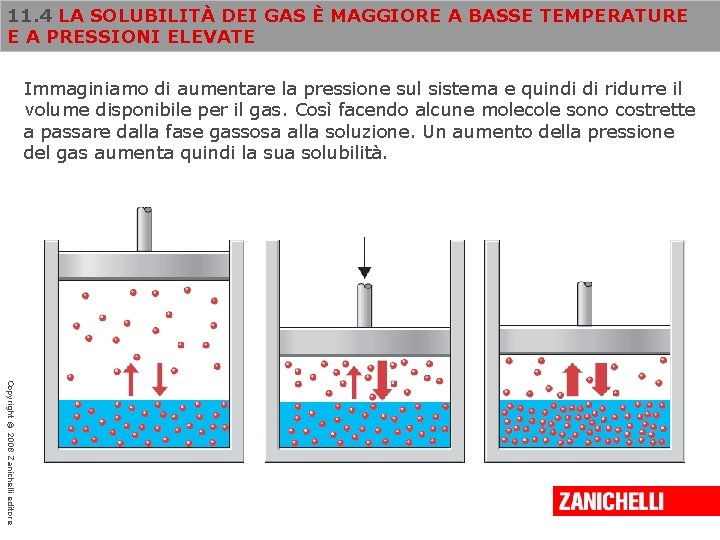
11. 4 LA SOLUBILITÀ DEI GAS È MAGGIORE A BASSE TEMPERATURE E A PRESSIONI ELEVATE Immaginiamo di aumentare la pressione sul sistema e quindi di ridurre il volume disponibile per il gas. Così facendo alcune molecole sono costrette a passare dalla fase gassosa alla soluzione. Un aumento della pressione del gas aumenta quindi la sua solubilità. Copyright © 2008 Zanichelli editore

11. 4 LA SOLUBILITÀ DEI GAS È MAGGIORE A BASSE TEMPERATURE E A PRESSIONI ELEVATE Se, al contrario, riduciamo la pressione sulla soluzione, parte delle molecole disciolte ritorna allo stato di gas. Questo è ciò che osserviamo quando stappiamo la bottiglia di una bibita gassata: il diossido di carbonio disciolto si libera in conseguenza dell’abbassamento di pressione. Lo stesso fenomeno si verifica durante la risalita di un magma in un camino vulcanico: i gas disciolti al suo interno, diminuendo la pressione a mano che esso giunge in superficie, tendono a liberarsi e trascinano con sé il magma stesso, dando luogo a un’eruzione. Copyright © 2008 Zanichelli editore

11. 4 LA SOLUBILITÀ DEI GAS È MAGGIORE A BASSE TEMPERATURE E A PRESSIONI ELEVATE Nel caso di gas che non reagiscono con il solvente, esiste una semplice relazione fra pressione e solubilità, la legge pressione-solubilità o legge di Henry. Legge di Henry (legge pressione-solubilità) A una data temperatura, la concentrazione di un gas in un liquido è direttamente proporzionale alla pressione parziale del gas sulla soluzione. Copyright © 2008 Zanichelli editore Nell’equazione, Cgas e Pgas sono, rispettivamente, la concentrazione e la pressione del gas. La costante di proporzionalità, k H, chiamata costante della legge di Henry, è specifica per ciascun gas. L’equazione è valida solo per bassi valori di concentrazione e pressione e per i gas che non reagiscono con il solvente.

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE LA MOLARITÀ ESPRIME IL RAPPORTO TRA LE MOLI DI SOLUTO E IL VOLUME DI UNA SOLUZIONE ► La concentrazione molare o molarità (abbreviata con M) di una soluzione è definita come numero di moli di soluto per litro di soluzione. Si tratta del rapporto tra moli di soluto e volume della soluzione espresso in litri: Copyright © 2008 Zanichelli editore in cui n (mol) indica le moli di soluto e V (l) è il volume in litri della soluzione.

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE LA MOLARITÀ ESPRIME IL RAPPORTO TRA LE MOLI DI SOLUTO E IL VOLUME DI UNA SOLUZIONE ► Tutte le volte in cui affrontiamo un problema che richiede calcoli sulla quantità di una certa sostanza e su un volume di soluzione della stessa, il collegamento risolutivo è dato dalla molarità. La molarità consente infatti di impostare i fattori di conversione necessari per trasformare le moli in volume (litri o millilitri) e viceversa. Copyright © 2008 Zanichelli editore

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE LA MOLARITÀ ESPRIME IL RAPPORTO TRA LE MOLI DI SOLUTO E IL VOLUME DI UNA SOLUZIONE ► Quando desideriamo preparare una soluzione di molarità nota, dopo avere fissato il volume di soluzione di cui abbiamo bisogno, calcoliamo la quantità di soluto necessaria. Tutte le volte che conosciamo sia il volume sia la molarità di una soluzione, possiamo calcolare il numero di moli di soluto grazie alla formula: Copyright © 2008 Zanichelli editore

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE LE FRAZIONI MOLARI E LA PERCENTUALE MOLARE SI RIFERISCONO AI RAPPORTI TRA MOLI DEI SOLUTI E MOLI TOTALI ► La frazione molare di ciascun componente di una miscela è il rapporto fra il numero di moli di quel componente e il numero di moli totali di tutti i componenti presenti. In forma matematica, la frazione molare di una sostanza A in una miscela di A, B, C, …, Z è: Copyright © 2008 Zanichelli editore dove XA è la frazione molare del componente A e n. A, n. B, n. C, …, n. Z sono, il numero di moli di ciascun componente. La somma di tutte le frazioni molari in una miscela deve sempre essere uguale a 1. Nell’equazione tutte le unità si eliminano, quindi le frazioni molari sono numeri adimensionali, cioè non hanno unità. Moltiplicando per 100 la frazione molare si ottiene la cosiddetta percentuale molare (mol%).

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE LE FRAZIONI MOLARI E LA PERCENTUALE MOLARE SI RIFERISCONO AI RAPPORTI TRA MOLI DEI SOLUTI E MOLI TOTALI ► In base alla legge di Dalton delle pressioni parziali, la somma delle pressioni parziali al denominatore di questa equazione è uguale alla pressione totale della miscela. Quindi, l’equazione si riduce a un’espressione molto semplice che corrisponde alla frazione molare di un gas in una miscela gassosa: Copyright © 2008 Zanichelli editore

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE ► CONCENTRAZIONE PERCENTUALE percentuale in massa (detta a volte percentuale in peso), che indica i grammi di solutopresenti in 100 grammi di soluzione. La percentuale in massa è indicata dal simbolo % (p/p), dove «p» sta per «peso» . Per calcolare la percentuale in massa dalle masse del soluto e della soluzione, possiamo utilizzare la seguente formula: Copyright © 2008 Zanichelli editore

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE ► CONCENTRAZIONE PERCENTUALE I laboratori clinici spesso riportano le concentrazioni in percentuale massa/volume, indicata dal simbolo «% (p/v)» : Copyright © 2008 Zanichelli editore Le percentuali non sono altro che parti per cento. Esistono altre espressioni della concentrazione, come le parti per milione (ppm) e le parti per miliardo (ppb): 1 ppm e 1 ppb corrispondono, rispettivamente, a 1 g di componente ogni 106 g e 109 g della miscela.

11. 5 LA COMPOSIZIONE DI UNA SOLUZIONE È ESPRESSA DALLA SUA CONCENTRAZIONE LA CONCENTRAZIONE MOLALE SI RIFERISCE ALLE MOLI CONTENUTE IN OGNI KILOGRAMMO DI SOLVENTE ► La concentrazione molale o molalità di una soluzione è definita come numero di moli di soluto per kilogrammo di solvente. La molalità è rappresentata dal simbolo m. Alcune importanti proprietà fisiche delle soluzioni sono correlate in modo semplice alla loro molalità. La molarità di una soluzione varia di poco con la temperatura, mentre la molalità non cambia. È quindi opportuno utilizzare la molalità per esprimere la concentrazione delle soluzioni nel corso di esperimenti che prevedono variazioni di temperatura. Copyright © 2008 Zanichelli editore

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE Le proprietà delle soluzioni che dipendono dal numero e non dal tipo di particelle vendono definite proprietà colligative. LA PRESSIONE DI VAPORE DELLE SOLUZIONI È MINORE RISPETTO AL SOLVENTE PURO ► Copyright © 2008 Zanichelli editore Tutte le soluzioni liquide di soluti non volatili (soluti che non possono evaporare dalla soluzione) hanno una pressione di vapore più bassa rispetto al solvente puro. Nel caso di soluzioni diluite, una semplice legge, nota come legge di Raoult, afferma che la pressione di vapore della soluzione, P soluzione, è pari al prodotto tra la frazione molare del solvente, X solvente, e la sua pressione di vapore allo stato puro, P°solvente. La legge di Raoult può essere espressa in forma di equazione:

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE LA PRESSIONE DI VAPORE DELLE SOLUZIONI È MINORE RISPETTO AL SOLVENTE PURO ► La frazione molare che compare nella legge di Raoult si riferisce al solvente e non al soluto. In realtà, il nostro interesse è soprattutto volto a conoscere l’effetto della frazione molare del soluto, X soluto, sulla pressione di vapore. È possibile dimostrare che la variazione della pressione di vapore, ΔP, è direttamente proporzionale alla frazione molare del soluto, Xsoluto: Copyright © 2008 Zanichelli editore

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE LA PRESSIONE DI VAPORE DELLE SOLUZIONI È MINORE RISPETTO AL SOLVENTE PURO ► La legge di Raoult si spiega facilmente. Consideriamo un liquido all’equilibrio: Quando la velocità di evaporazione è abbastanza grande, la pressione di vapore è alta. Se aggiungiamo un soluto non volatile, però, le particelle del soluto si distribuiscono in tutta la soluzione e anche vicino alla superficie libera. Copyright © 2008 Zanichelli editore

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE LA PRESSIONE DI VAPORE DELLE SOLUZIONI È MINORE RISPETTO AL SOLVENTE PURO ► Le molecole del soluto, che non possono evaporare, rendono perciò più difficoltosa la «fuga» delle molecole del solvente nella fase di vapore, mentre non interferiscono con il processo inverso. Di conseguenza, la pressione di vapore di una soluzione risulta più bassa rispetto a quella del solvente puro. Copyright © 2008 Zanichelli editore

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE COME POSSIAMO PREVEDERE LA PRESSIONE DI VAPORE DI UNA SOLUZIONE CHE CONTIENE PIÙ DI UN COMPONENTE VOLATILE? ► Quando una soluzione liquida è costituita da due o più sostanze volatili, il vapore che si forma al di sopra di essa contiene molecole di ogni componente. Ciascuno contribuisce alla pressione totale con la propria pressione parziale che, per la legge di Raoult, è direttamente proporzionale alla sua frazione molare nella soluzione. La legge di Dalton delle pressioni parziali afferma che la pressione di vapore totale è data dalla somma delle pressioni parziali. Queste ultime possono essere calcolate applicando l’equazione della legge di Raoult per ciascun componente. Copyright © 2008 Zanichelli editore

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE COME POSSIAMO PREVEDERE LA PRESSIONE DI VAPORE DI UNA SOLUZIONE CHE CONTIENE PIÙ DI UN COMPONENTE VOLATILE? ► In una soluzione costituita dalle sostanze A e B, esprimendo la concentrazione del componente A sotto forma di frazione molare, X A, la pressione parziale di A, PA, è pari al prodotto tra la sua frazione molare e la sua pressione di vapore allo stato puro, P°A, e lo stesso dicasi di B: Copyright © 2008 Zanichelli editore

11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE COME POSSIAMO PREVEDERE LA PRESSIONE DI VAPORE DI UNA SOLUZIONE CHE CONTIENE PIÙ DI UN COMPONENTE VOLATILE? ► La pressione di vapore totale della soluzione è quindi uguale alla somma delle pressioni parziali di ciascuno dei componenti presenti nel vapore: Copyright © 2008 Zanichelli editore

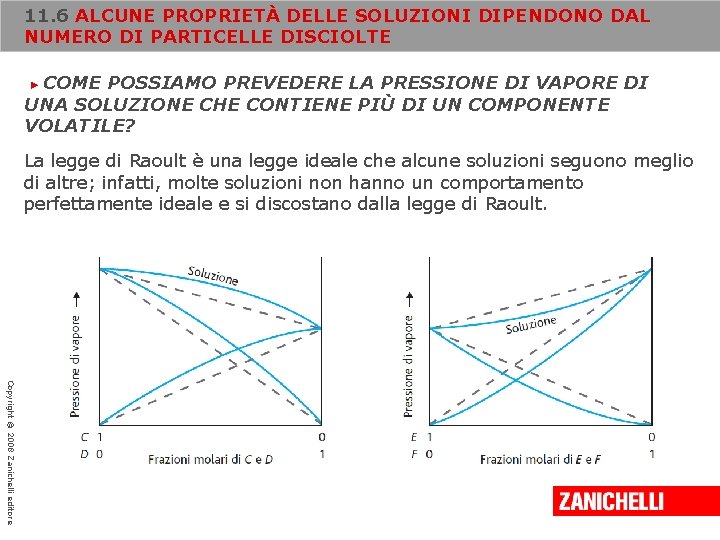
11. 6 ALCUNE PROPRIETÀ DELLE SOLUZIONI DIPENDONO DAL NUMERO DI PARTICELLE DISCIOLTE COME POSSIAMO PREVEDERE LA PRESSIONE DI VAPORE DI UNA SOLUZIONE CHE CONTIENE PIÙ DI UN COMPONENTE VOLATILE? ► La legge di Raoult è una legge ideale che alcune soluzioni seguono meglio di altre; infatti, molte soluzioni non hanno un comportamento perfettamente ideale e si discostano dalla legge di Raoult. Copyright © 2008 Zanichelli editore

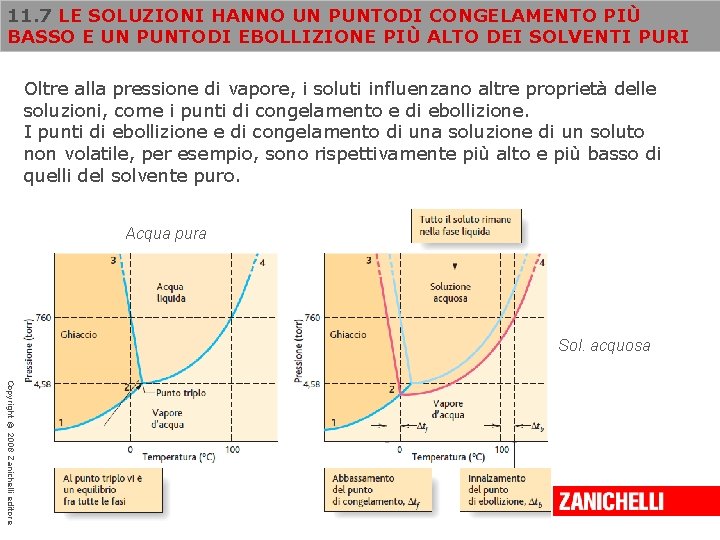
11. 7 LE SOLUZIONI HANNO UN PUNTODI CONGELAMENTO PIÙ BASSO E UN PUNTODI EBOLLIZIONE PIÙ ALTO DEI SOLVENTI PURI Oltre alla pressione di vapore, i soluti influenzano altre proprietà delle soluzioni, come i punti di congelamento e di ebollizione. I punti di ebollizione e di congelamento di una soluzione di un soluto non volatile, per esempio, sono rispettivamente più alto e più basso di quelli del solvente puro. Acqua pura Sol. acquosa Copyright © 2008 Zanichelli editore

11. 7 LE SOLUZIONI HANNO UN PUNTODI CONGELAMENTO PIÙ BASSO E UN PUNTODI EBOLLIZIONE PIÙ ALTO DEI SOLVENTI PURI Il soluto rende minore la pressione di vapore della soluzione rispetto all’acqua pura. La curva liquido-vapore della soluzione sarà quindi posizionata più in basso rispetto a quella dell’acqua, a qualsiasi valore di temperatura. I punti di ebollizione dell’acqua pura e della soluzione possono essere estrapolati, rispettivamente, dalla linea blu e da quella rossa. A qualsiasi valore di pressione, la soluzione bolle a una temperatura più alta rispetto all’acqua pura. La differenza fra il punto di ebollizione della soluzione e quello dell’acqua pura è detta innalzamento del punto di ebollizione (o innalzamento ebullioscopico), indicato dal simbolo Δtb. Copyright © 2008 Zanichelli editore

11. 7 LE SOLUZIONI HANNO UN PUNTODI CONGELAMENTO PIÙ BASSO E UN PUNTODI EBOLLIZIONE PIÙ ALTO DEI SOLVENTI PURI L’abbassamento della curva liquido-vapore della soluzione porta a un valore più basso del punto triplo. La curva dell’equilibrio solido-liquido, che si origina dal punto triplo portandosi verso l’alto, risulta così spostata a sinistra (tratto 2 -3). A una qualsiasi pressione, il punto di congelamento della soluzione risulta più basso di quello del solvente puro. A livello molecolare sappiamo che i cristalli che si formano in una soluzione sono costituiti dal solvente e non contengono molecole di soluto. Tuttavia le particelle di soluto rendono più difficile la formazione del cristallo. La differenza fra il punto di ebollizione dell’acqua pura e quello della soluzione è detta abbassamento del punto di congelamento (o abbassamento crioscopico), indicato dal simbolo Δtf. Copyright © 2008 Zanichelli editore

11. 7 LE SOLUZIONI HANNO UN PUNTODI CONGELAMENTO PIÙ BASSO E UN PUNTODI EBOLLIZIONE PIÙ ALTO DEI SOLVENTI PURI L’abbassamento del punto di congelamento e l’innalzamento del punto di ebollizione sono due proprietà colligative delle soluzioni. I valori di Δtb e Δtf sono proporzionali alle popolazioni relative delle particelle di soluto e di solvente. Alla luce delle relazioni fra Δt e concentrazione della soluzione, quest’ultima viene preferibilmente espressa come molalità (m). Le seguenti relazioni possono essere correttamente utilizzate solo nel caso di soluzioni diluite: Copyright © 2008 Zanichelli editore

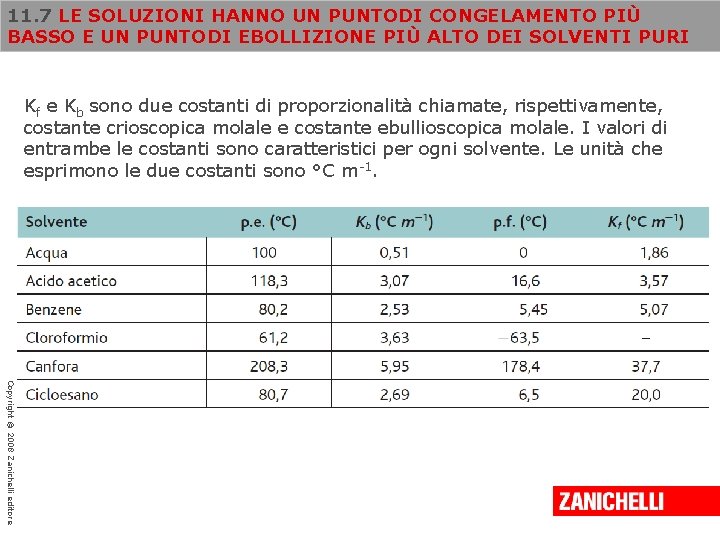
11. 7 LE SOLUZIONI HANNO UN PUNTODI CONGELAMENTO PIÙ BASSO E UN PUNTODI EBOLLIZIONE PIÙ ALTO DEI SOLVENTI PURI Kf e Kb sono due costanti di proporzionalità chiamate, rispettivamente, costante crioscopica molale e costante ebullioscopica molale. I valori di entrambe le costanti sono caratteristici per ogni solvente. Le unità che esprimono le due costanti sono °C m-1. Copyright © 2008 Zanichelli editore

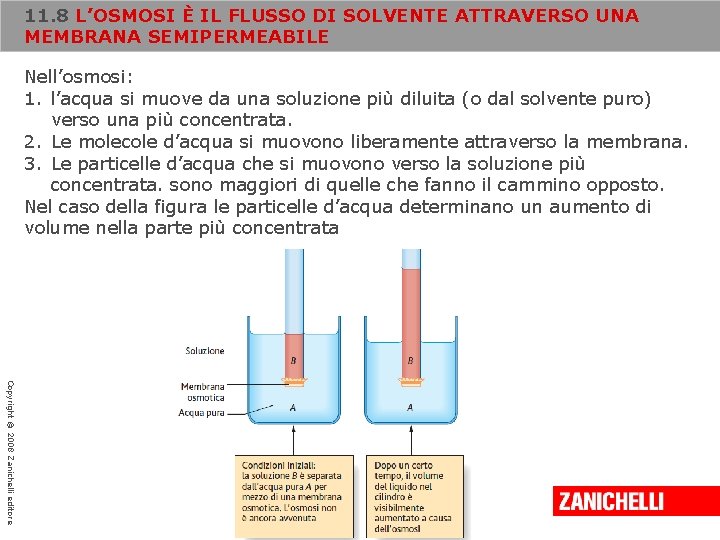
11. 8 L’OSMOSI È IL FLUSSO DI SOLVENTE ATTRAVERSO UNA MEMBRANA SEMIPERMEABILE Le membrane presenti nei sistemi viventi sono semipermeabili, cioè possono essere attraversate solo da alcune specie chimiche e non da altre; in altri termini, presentano una permeabilità selettiva. In alcuni casi, possono passare solo le molecole d’acqua e altre specie di piccole dimensioni, per esempio ioni e piccoli metaboliti; le molecole più grandi, come le proteine, non riescono invece ad attraversare le membrane. Il passaggio selettivo di piccole molecole o ioni attraverso le membrane è chiamato dialisi. Una membrana che si comporta in questo modo è detta membrana da dialisi. L’osmosi è un caso limite della dialisi: soltanto le molecole del solvente riescono ad attraversare una membrana osmotica. Copyright © 2008 Zanichelli editore

11. 8 L’OSMOSI È IL FLUSSO DI SOLVENTE ATTRAVERSO UNA MEMBRANA SEMIPERMEABILE Nell’osmosi: 1. l’acqua si muove da una soluzione più diluita (o dal solvente puro) verso una più concentrata. 2. Le molecole d’acqua si muovono liberamente attraverso la membrana. 3. Le particelle d’acqua che si muovono verso la soluzione più concentrata. sono maggiori di quelle che fanno il cammino opposto. Nel caso della figura le particelle d’acqua determinano un aumento di volume nella parte più concentrata Copyright © 2008 Zanichelli editore

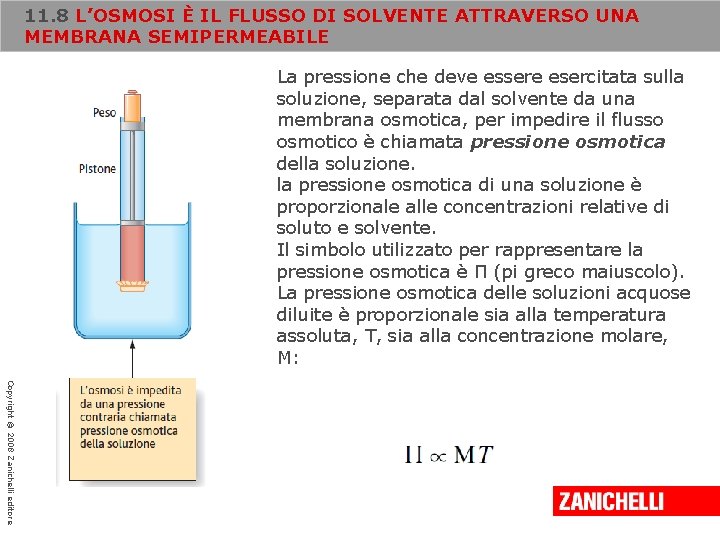
11. 8 L’OSMOSI È IL FLUSSO DI SOLVENTE ATTRAVERSO UNA MEMBRANA SEMIPERMEABILE La pressione che deve essere esercitata sulla soluzione, separata dal solvente da una membrana osmotica, per impedire il flusso osmotico è chiamata pressione osmotica della soluzione. la pressione osmotica di una soluzione è proporzionale alle concentrazioni relative di soluto e solvente. Il simbolo utilizzato per rappresentare la pressione osmotica è Π (pi greco maiuscolo). La pressione osmotica delle soluzioni acquose diluite è proporzionale sia alla temperatura assoluta, T, sia alla concentrazione molare, M: Copyright © 2008 Zanichelli editore

11. 8 L’OSMOSI È IL FLUSSO DI SOLVENTE ATTRAVERSO UNA MEMBRANA SEMIPERMEABILE Per le soluzioni acquose diluite, la costante di proporzionalità è la costante dei gas, R; quindi possiamo scrivere: Dalla quale si ricava che: Copyright © 2008 Zanichelli editore L’equazione riportata sopra è l’equazione di van’t Hoff per la pressione osmotica.

11. 9 I SOLUTI IONICI HANNO UN EFFETTO PARTICOLARE SULLE PROPRIETÀ COLLIGATIVE La costante crioscopica molale dell’acqua è 1, 86 °C m -1. Possiamo quindi pensare che una soluzione 1, 00 m di Na. Cl congeli a -1, 86 °C; al contrario, essa congela a -3, 37 °C. La presenza del sale abbassa il punto di congelamento di circa il doppio rispetto a quanto previsto e ciò non è difficile da spiegare se pensiamo che le proprietà colligative dipendono dalla concentrazione delle particelle in soluzione. Sappiamo infatti che Na. Cl(s) in acqua si dissocia in ioni: Copyright © 2008 Zanichelli editore

11. 9 I SOLUTI IONICI HANNO UN EFFETTO PARTICOLARE SULLE PROPRIETÀ COLLIGATIVE Se gli ioni si separano completamente, Na. Cl 1, 00 m ha, in realtà, una concentrazione di particelle di soluto pari a 2, 00 m, cioè il doppio della concentrazione data. In teoria, una soluzione di Na. Cl 1, 00 m dovrebbe quindi congelare a 2 x(-1, 86 °C) = -3, 72 °C. Ma la soluzione non congela a una temperatura così bassa perché il sale non è dissociato in ioni al 100%. Diluendo la soluzione, però, il punto di congelamento osservato e quello calcolato si avvicinano sempre di più. In soluzioni di elettroliti forti a una concentrazione 0, 1 M o minore, gli ioni presenti interagiscono fra loro così poco che i soluti si comportano come se fossero completamente dissociati. Copyright © 2008 Zanichelli editore

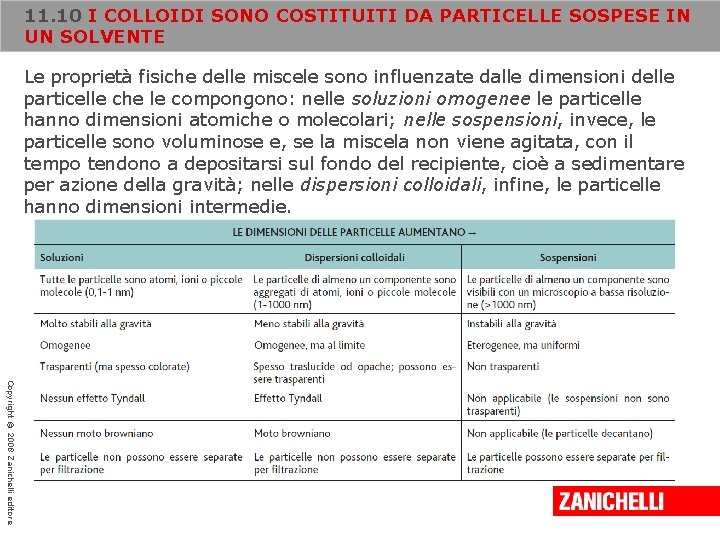
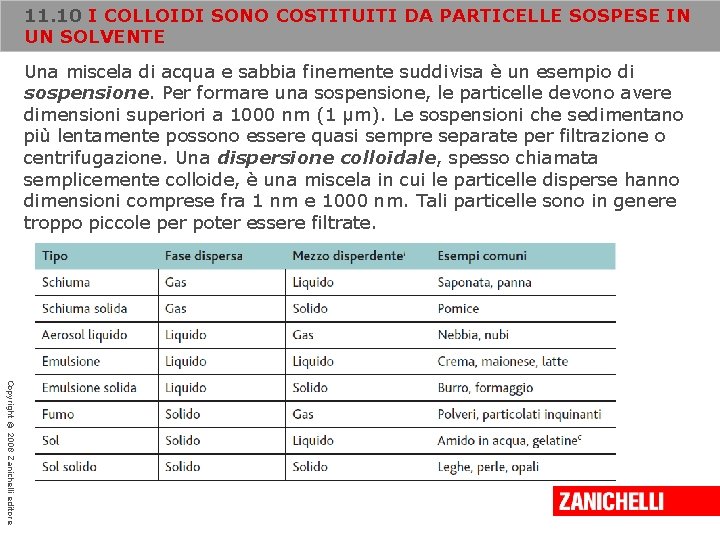
11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE Le proprietà fisiche delle miscele sono influenzate dalle dimensioni delle particelle che le compongono: nelle soluzioni omogenee le particelle hanno dimensioni atomiche o molecolari; nelle sospensioni, invece, le particelle sono voluminose e, se la miscela non viene agitata, con il tempo tendono a depositarsi sul fondo del recipiente, cioè a sedimentare per azione della gravità; nelle dispersioni colloidali, infine, le particelle hanno dimensioni intermedie. Copyright © 2008 Zanichelli editore

11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE Una miscela di acqua e sabbia finemente suddivisa è un esempio di sospensione. Per formare una sospensione, le particelle devono avere dimensioni superiori a 1000 nm (1 μm). Le sospensioni che sedimentano più lentamente possono essere quasi sempre separate per filtrazione o centrifugazione. Una dispersione colloidale, spesso chiamata semplicemente colloide, è una miscela in cui le particelle disperse hanno dimensioni comprese fra 1 nm e 1000 nm. Tali particelle sono in genere troppo piccole per poter essere filtrate. Copyright © 2008 Zanichelli editore

11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE La stabilità di una dispersione colloidale è favorita dagli urti fra le particelle disperse e le molecole del solvente. Il movimento irregolare delle particelle disperse viene chiamato moto browniano in onore del botanico scozzese Robert Brown (1773 -1858) che, studiando al microscopio i pollini sospesi in acqua, osservò per primo questo fenomeno. Le dispersioni colloidali che si separano sono quelle in cui le particelle disperse tendono a crescere di dimensioni nel tempo. Per preparare una soluzione colloidale stabile bisogna fare in modo che all’inizio le particelle siano abbastanza piccole e che non si aggreghino col passare del tempo. Copyright © 2008 Zanichelli editore

11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE Le dispersioni più stabili si formano quando le particelle hanno la stessa carica elettrica, positiva o negativa: ciò si verifica, per esempio, quando le particelle colloidali attraggono (adsorbono) sulla loro superficie ioni originati da un soluto. In questi casi, gli ioni di carica opposta presenti nel solvente garantiscono la neutralità complessiva del sistema. Le particelle disperse nella maggior parte delle dispersioni colloidali di un solido in un liquido, dette sol, ne sono i principali esempi. In altri casi, invece, le particelle che formano la dispersione colloidale sono di dimensioni molto grandi, per esempio le proteine, e presentano esse stesse gruppi dotati di carica elettrica. Copyright © 2008 Zanichelli editore

11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE Le emulsioni, dispersioni colloidali di un liquido in un altro liquido, risultano stabili se è presente una terza sostanza, chiamata emulsionante. La maionese, per esempio, è un’emulsione di tipo olio-in-acqua stabilizzata dalla lecitina presente nel tuorlo dell’uovo, una sostanza lipidica le cui molecole conferiscono alle microgocce d’olio una superficie carica elettricamente. Copyright © 2008 Zanichelli editore

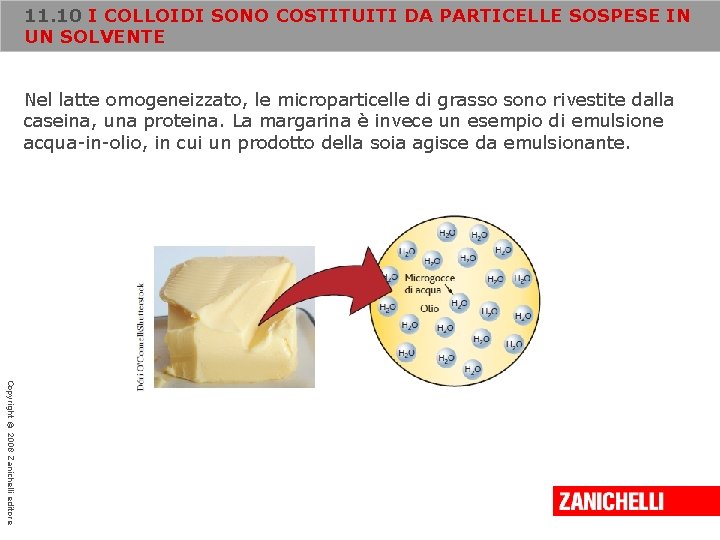
11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE Nel latte omogeneizzato, le microparticelle di grasso sono rivestite dalla caseina, una proteina. La margarina è invece un esempio di emulsione acqua-in-olio, in cui un prodotto della soia agisce da emulsionante. Copyright © 2008 Zanichelli editore

11. 10 I COLLOIDI SONO COSTITUITI DA PARTICELLE SOSPESE IN UN SOLVENTE L’amido è costituito da molecole di grandi dimensioni e in acqua forma dispersioni colloidali. Le miscele colloidali di amido hanno in genere un aspetto lattescente perché le particelle disperse sono abbastanza grandi da riflettere o disperdere la luce visibile. La dispersione luminosa rivela il raggio di luce anche quando il colloide di amido è molto diluito e limpido. La dispersione della luce da parte dei colloidi è chiamata effetto Tyndall, in onore dello scienziato inglese John Tyndall (1820 -1893). Le soluzioni propriamente dette, invece, non presentano l’effetto Tyndall perché i soluti sono troppo piccoli per poter disperdere la luce. Copyright © 2008 Zanichelli editore