CAPITOLO 14 Le soluzioni Indice 1 Le soluzioni














- Slides: 24

CAPITOLO 14 Le soluzioni Indice 1. Le soluzioni 2. Solubilità e temperatura 3. Dipendenza della solubilità dalla natura del soluto e del solvente 4. Fattori che influenzano la solubilità dei gas: pressione e temperatura 5. Concentrazione molare (M) 6. Diluizione di soluzioni a molarità nota 7. Frazione molare 8. Molalità di una soluzione (m) 9. Le proprietà colligative delle soluzioni 10. Osmosi e pressione osmotica 11. Colloidi © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

1 Le soluzioni CAPITOLO 14. LE SOLUZIONI Una soluzione è una miscela omogenea di due o più sostanze che presenta proprietà uniformi in ogni sua parte. La sostanza disciolta rappresenta il soluto, mentre il solvente è il liquido che porta in soluzione il soluto. Il ruolo di solvente può essere svolto non solo dall’acqua, ma anche da sostanze, come la trielina e l’alcool etilico, che presentano proprietà completamente differenti dall’acqua. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

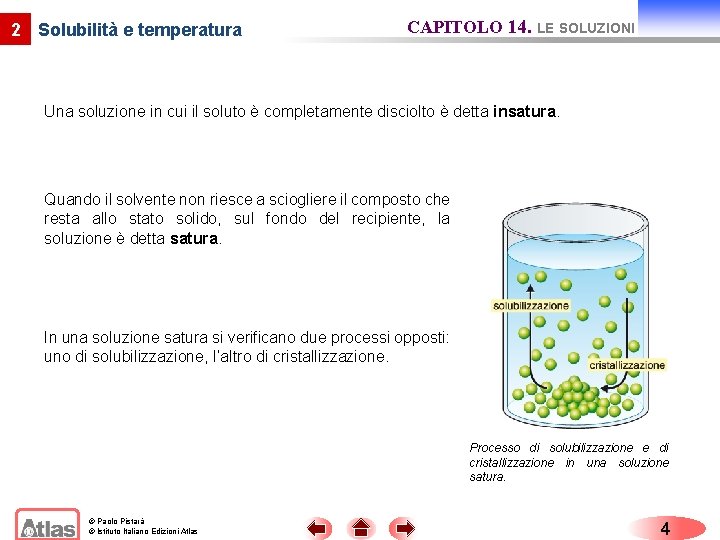
2 Solubilità e temperatura CAPITOLO 14. LE SOLUZIONI La solubilità varia da sostanza ed è influenzata dalla temperatura. “Per solubilità s’intende la quantità massima di soluto che può sciogliersi, ad una definita temperatura, in una data quantità di solvente”. Soluzione insatura di Na. Cl. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Soluzione satura di Na. Cl. 3

2 Solubilità e temperatura CAPITOLO 14. LE SOLUZIONI Una soluzione in cui il soluto è completamente disciolto è detta insatura. Quando il solvente non riesce a sciogliere il composto che resta allo stato solido, sul fondo del recipiente, la soluzione è detta satura. In una soluzione satura si verificano due processi opposti: uno di solubilizzazione, l’altro di cristallizzazione. Processo di solubilizzazione e di cristallizzazione in una soluzione satura. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

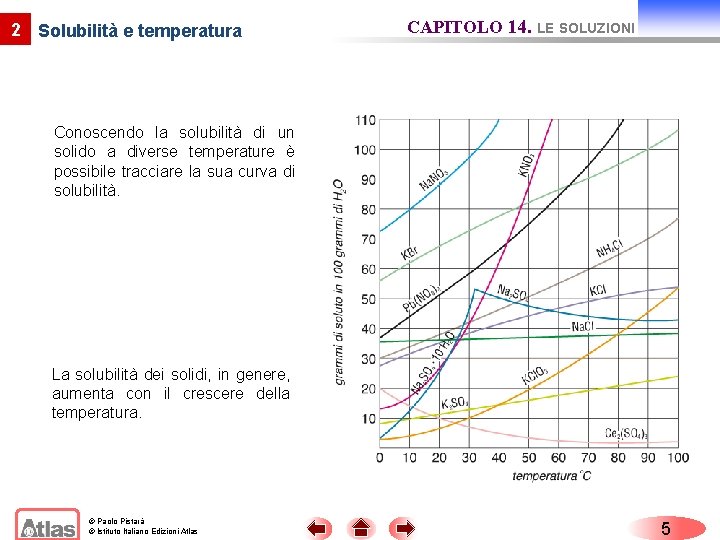
2 Solubilità e temperatura CAPITOLO 14. LE SOLUZIONI Conoscendo la solubilità di un solido a diverse temperature è possibile tracciare la sua curva di solubilità. La solubilità dei solidi, in genere, aumenta con il crescere della temperatura. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

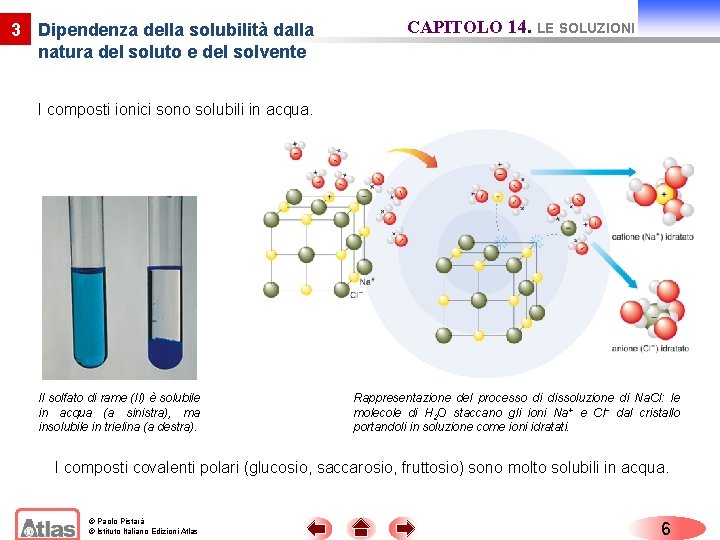
3 Dipendenza della solubilità dalla natura del soluto e del solvente CAPITOLO 14. LE SOLUZIONI I composti ionici sono solubili in acqua. Il solfato di rame (II) è solubile in acqua (a sinistra), ma insolubile in trielina (a destra). Rappresentazione del processo di dissoluzione di Na. Cl: le molecole di H 2 O staccano gli ioni Na+ e Cl− dal cristallo portandoli in soluzione come ioni idratati. I composti covalenti polari (glucosio, saccarosio, fruttosio) sono molto solubili in acqua. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

3 Dipendenza della solubilità dalla natura del soluto e del solvente CAPITOLO 14. LE SOLUZIONI I composti covalenti non polari (naftalene) non sono solubili in acqua, un solvente polare, mentre sono solubili in solventi organici. Il naftalene solido è solubile in trielina (a sinistra) ma insolubile in acqua (a destra). © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

3 Dipendenza della solubilità dalla natura del soluto e del solvente CAPITOLO 14. LE SOLUZIONI Una regola che si può ricavare da questi comportamenti è la seguente: “una sostanza tende a disciogliersi in un solvente chimicamente simile ad essa, cioè “il simile scioglie il simile”. Due liquidi polari (alcool etilico e acqua) sono completamente miscibili tra loro. Invece un liquido non polare (olio) non è solubile in acqua. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 8

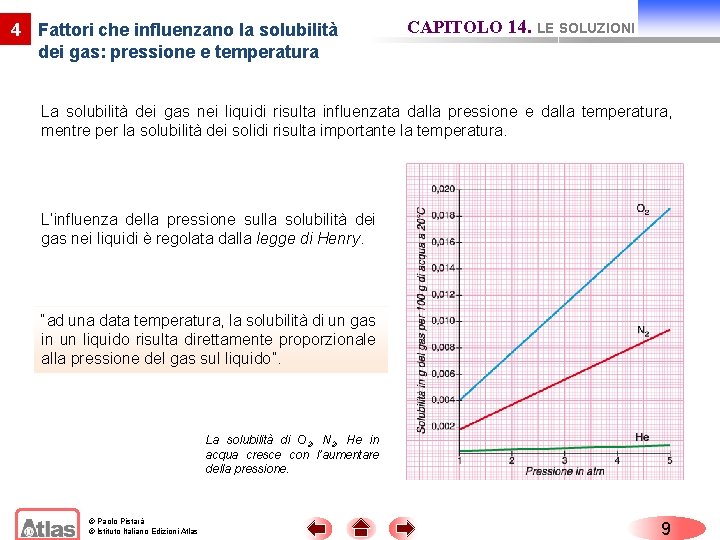
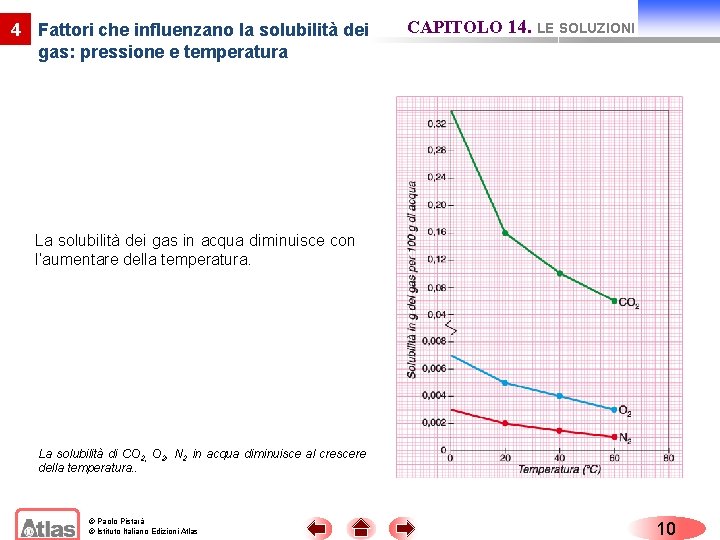
4 Fattori che influenzano la solubilità dei gas: pressione e temperatura CAPITOLO 14. LE SOLUZIONI La solubilità dei gas nei liquidi risulta influenzata dalla pressione e dalla temperatura, mentre per la solubilità dei solidi risulta importante la temperatura. L’influenza della pressione sulla solubilità dei gas nei liquidi è regolata dalla legge di Henry. “ad una data temperatura, la solubilità di un gas in un liquido risulta direttamente proporzionale alla pressione del gas sul liquido”. La solubilità di O 2, N 2, He in acqua cresce con l’aumentare della pressione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

4 Fattori che influenzano la solubilità dei gas: pressione e temperatura CAPITOLO 14. LE SOLUZIONI La solubilità dei gas in acqua diminuisce con l’aumentare della temperatura. La solubilità di CO 2, N 2 in acqua diminuisce al crescere della temperatura. . © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10

5 Concentrazione molare (M) CAPITOLO 14. LE SOLUZIONI La molarità è uno dei modi più comunemente adoperati per esprimere la concentrazione di una soluzione. La molarità (indicata con M) è definita dalle moli di soluto disciolto in un litro di soluzione (soluto + solvente). moli (soluto) Molarità (M) = Vlitri (soluzione) Preparazione di 250 m. L di una soluzione 0, 01 M di Cu. SO 4 5 H 2 O Una quantità pesata di Cu. SO 4 5 H 2 O (0, 6243 g) viene dapprima posta in un matraccio pulito del volume di 250 ml. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Il Cu. SO 4 • 5 H 2 O solido viene disciolto in meno di 250 m. L di acqua. Si tappa il matraccio e si agita. Il matraccio viene riempito fino alla tacca di 250 m. L con l’aggiunta goccia dell’acqua distillata necessaria. Si tappa il matraccio e si agita. 11

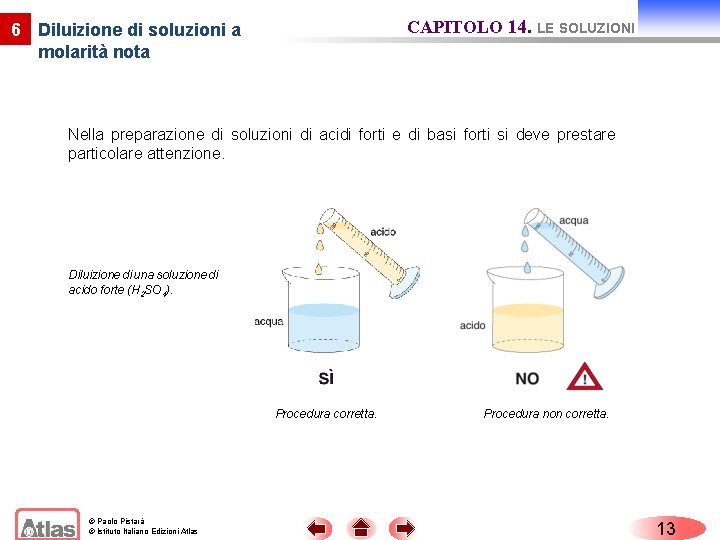
6 Diluizione di soluzioni a molarità nota CAPITOLO 14. LE SOLUZIONI Diluendo con acqua una soluzione concentrata di molarità nota si ottiene una soluzione più diluita. Con la diluizione il numero di moli di soluto non varia: moli di soluto = moli di soluto (prima della diluizione) (dopo la diluizione) M 1 V 1 = M 2 V 2 © Paolo Pistarà © Istituto Italiano Edizioni Atlas 12

CAPITOLO 14. LE SOLUZIONI 6 Diluizione di soluzioni a molarità nota Nella preparazione di soluzioni di acidi forti e di basi forti si deve prestare particolare attenzione. Diluizione di una soluzione di acido forte (H 2 SO 4). Procedura corretta. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Procedura non corretta. 13

7 Frazione molare CAPITOLO 14. LE SOLUZIONI La frazione molare di ciascun componente di una soluzione è data dal rapporto tra le moli di quel componente e la somma delle moli di tutti i componenti della soluzione (soluto + solvente). La frazione molare del soluto (xs) e quella del solvente (xsolv) è data dalle relazioni: ns n solv xs = e xsolv. = ns + nsolv © Paolo Pistarà © Istituto Italiano Edizioni Atlas 14

8 Molalità di una soluzione (m) CAPITOLO 14. LE SOLUZIONI La molalità di una soluzione è definita dalle moli di soluto disciolto in 1 kg di solvente e si indica con m moli di soluto Molalità (m) = massa del solvente (kg) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 15

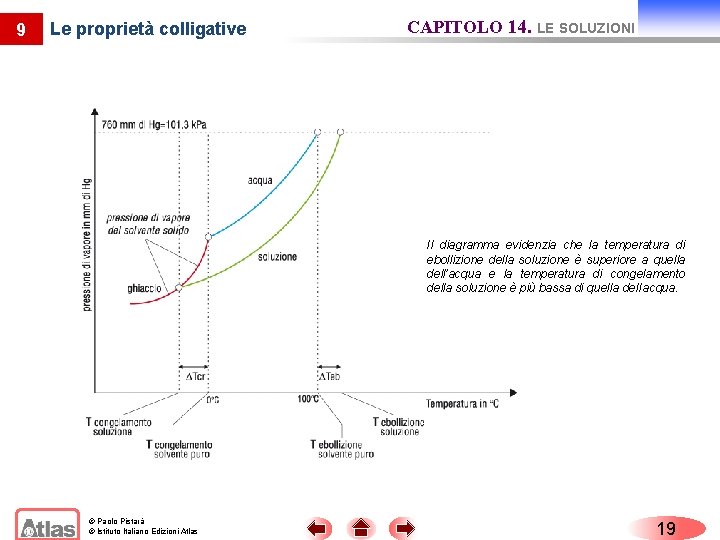
9 Le proprietà colligative CAPITOLO 14. LE SOLUZIONI La presenza di un soluto non volatile disciolto in un solvente modifica le proprietà fisiche del solvente. Queste modificazioni vanno sotto il nome di proprietà colligative. Queste proprietà dipendono solo dal numero di particelle di soluto disciolte nel solvente, cioè dalla concentrazione e non dall’identità chimica del soluto. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 16

9 CAPITOLO 14. LE SOLUZIONI Le proprietà colligative u Innalzamento della temperatura di ebollizione L’innalzamento della temperatura di ebollizione (innalzamento ebullioscopico), teb, di una soluzione è dato dalla relazione: teb Keb m dove teb variazione del punto di ebollizione Keb costante molale ebullioscopica m concentrazione molale della soluzione © Paolo Pistarà © Istituto Italiano Edizioni Atlas 17

9 CAPITOLO 14. LE SOLUZIONI Le proprietà colligative u Abbassamento della temperatura di congelamento L’abbassamento della temperatura di congelamento (abbassamento crioscopico), tcr, è proporzionale alla concentrazione molale secondo la relazione: tcr Kcr m dove tcr variazione del punto di congelamento Kcr costante molale crioscopica m concentrazione molale della soluzione © Paolo Pistarà © Istituto Italiano Edizioni Atlas 18

9 Le proprietà colligative CAPITOLO 14. LE SOLUZIONI Il diagramma evidenzia che la temperatura di ebollizione della soluzione è superiore a quella dell’acqua e la temperatura di congelamento della soluzione è più bassa di quella dell’acqua. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 19

9 Proprietà colligative di soluzioni contenenti ioni CAPITOLO 14. LE SOLUZIONI Nel caso di sostanze ioniche, che in soluzione si dissociano, occorre calcolare l’effettiva concentrazione degli ioni presenti. Pertanto per i composti di struttura ionica si applicano le relazioni: tcr Kcr m i teb Keb m i dove i indica quante moli di ioni derivano da ogni mole di soluto. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 20

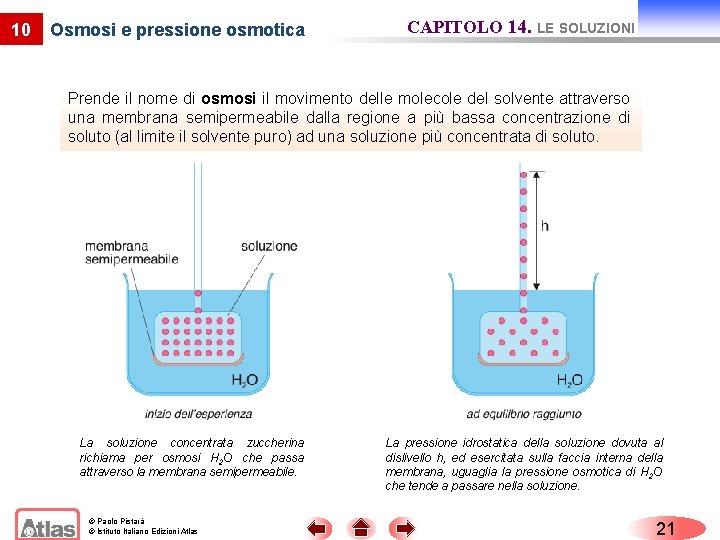
10 Osmosi e pressione osmotica CAPITOLO 14. LE SOLUZIONI Prende il nome di osmosi il movimento delle molecole del solvente attraverso una membrana semipermeabile dalla regione a più bassa concentrazione di soluto (al limite il solvente puro) ad una soluzione più concentrata di soluto. La soluzione concentrata zuccherina richiama per osmosi H 2 O che passa attraverso la membrana semipermeabile. © Paolo Pistarà © Istituto Italiano Edizioni Atlas La pressione idrostatica della soluzione dovuta al dislivello h, ed esercitata sulla faccia interna della membrana, uguaglia la pressione osmotica di H 2 O che tende a passare nella soluzione. 21

10 Osmosi e pressione osmotica CAPITOLO 14. LE SOLUZIONI Per pressione osmotica ( ) s’intende la pressione idrostatica esercitata dalle molecole di solvente che passano attraverso una membrana semipermeabile in un sistema in soluzione all’equilibrio. Per soluzioni diluite la pressione osmotica e la concentrazione (mol/L) sono in relazione tra loro mediante l’equazione di van’t Hoff: M R T dove pressione osmotica M molarità della soluzione R costante di proporzionalità T temperatura assoluta in kelvin Il processo di osmosi è molto importante in campo biologico. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 22

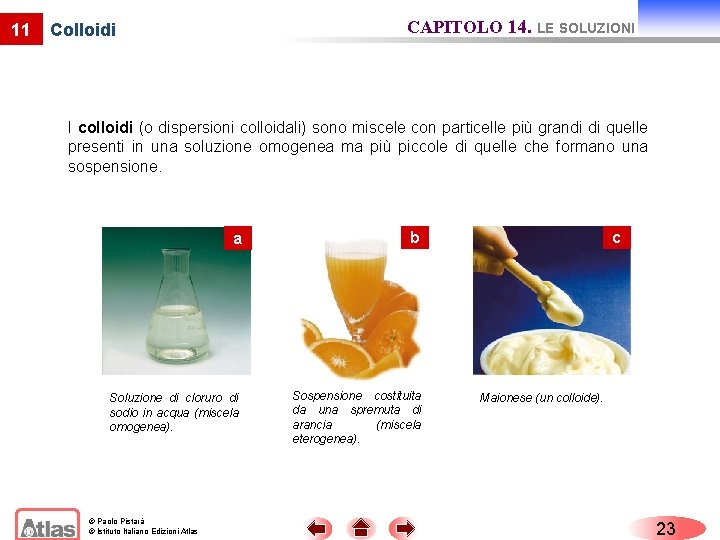
11 CAPITOLO 14. LE SOLUZIONI Colloidi I colloidi (o dispersioni colloidali) sono miscele con particelle più grandi di quelle presenti in una soluzione omogenea ma più piccole di quelle che formano una sospensione. a Soluzione di cloruro di sodio in acqua (miscela omogenea). © Paolo Pistarà © Istituto Italiano Edizioni Atlas b Sospensione costituita da una spremuta di arancia (miscela eterogenea). c Maionese (un colloide). 23

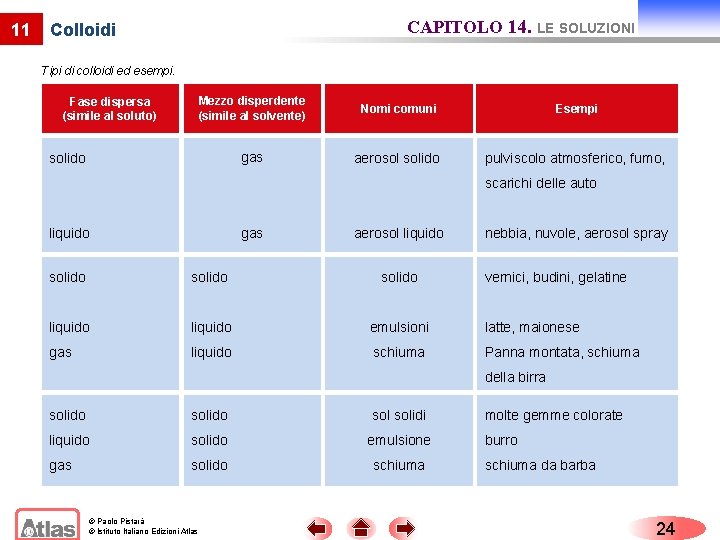
11 CAPITOLO 14. LE SOLUZIONI Colloidi Tipi di colloidi ed esempi. Fase dispersa (simile al soluto) Mezzo disperdente (simile al solvente) Nomi comuni Esempi gas aerosol solido pulviscolo atmosferico, fumo, solido scarichi delle auto gas liquido aerosol liquido nebbia, nuvole, aerosol spray solido vernici, budini, gelatine liquido emulsioni latte, maionese gas liquido schiuma Panna montata, schiuma della birra solido solidi liquido solido emulsione gas solido schiuma © Paolo Pistarà © Istituto Italiano Edizioni Atlas molte gemme colorate burro schiuma da barba 24