Vito Posca Tiziana Fiorani Chimica pi verde Capitolo




























- Slides: 34


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 5 Dalle sostanze alla teoria atomica

Sommario 1. Le sostanze pure sono distinte in elementi e composti 2. Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica 3. Le trasformazioni della materia possono essere fisiche e chimiche 4. Nelle reazioni chimiche la materia si conserva 5. Gli elementi che formano un composto si combinano sempre nello stesso rapporto Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 6. Gli stessi elementi possono combinarsi in rapporti diversi per formare composti diversi 7. La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

Le sostanze pure sono distinte in elementi e composti La materia è formata da miscele di componenti, che possono essere separati per ottenere sostanze pure. La maggior parte delle sostanze pure è decomponibile: sottoposta al passaggio di corrente elettrica nel voltametro di Hoffman, l’acqua si decompone in idrogeno e ossigeno. Questo processo si chiama elettrolisi. Alcune sostanze pure, invece, non si decompongono: il cloro e il sodio, così come i gas idrogeno e ossigeno. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

Le sostanze pure sono distinte in elementi e composti È quindi possibile suddividere le sostanze pure in sostanze semplici (o elementi) e in sostanze composte (o composti). Un elemento è una sostanza pura che non può essere decomposta in sostanze più semplici. Un composto è una sostanza pura che si può decomporre in due o più sostanze più semplici. Un composto è formato da due o più elementi e proprio per questo può essere decomposto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

Le sostanze pure sono distinte in elementi e composti La materia può presentarsi in forma di sostanze pure, che possono essere semplici o composte, e di miscele, omogenee ed eterogenee. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica Gli elementi noti sono oggi 118. Dei primi 92, ne sono presenti in natura 89 (elementi naturali). A eccezione del plutonio che si può trovare in tracce, tutti gli elementi dopo il numero 92 sono stati ottenuti in laboratorio (elementi artificiali). In natura si trovano prevalentemente composti. I nomi degli elementi chimici hanno svariate origini. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica A. Il nome cloro deriva da chlorós, «verde» in greco. B. Oro deriva dal nome latino aurum. C. Il californio prende il nome dallo stato della California. D. Il nome mendelevio è un omaggio al chimico D. Mendeleev. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica Gli elementi sono rappresentati da simboli, costituiti dalla lettera iniziale maiuscola del nome dell’elemento. Se due elementi hanno la stessa iniziale, si usa anche la seconda o una lettera diversa. I simboli vanno pronunciati staccando le lettere. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

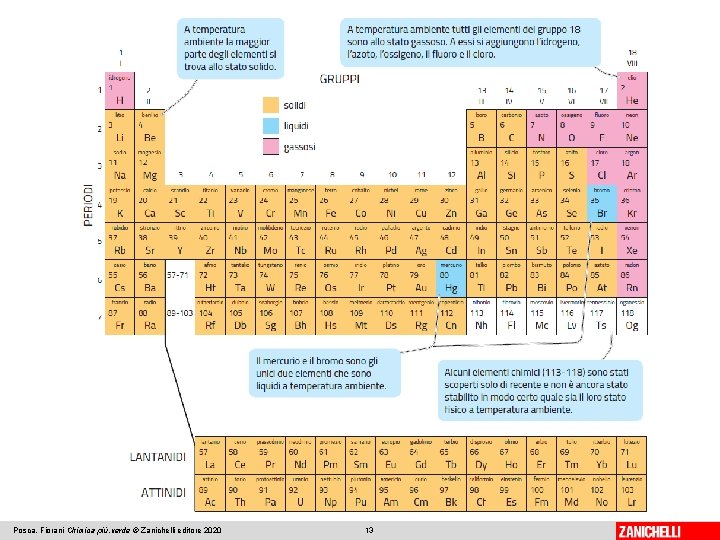
Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica I simboli di tutti gli elementi sono raccolti nella tavola periodica. In ogni casella è contenuto il simbolo di un elemento sormontato da un numero, il numero atomico. Molti elementi a temperatura ambiente sono solidi. Due sono allo stato liquido e undici sotto forma di gas. Gli elementi si susseguono in ordine di numero atomico crescente, raggruppati in base alle loro proprietà secondo uno schema simile a quello proposto da Mendeleev (1869). Le colonne sono chiamate gruppi, le righe periodi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

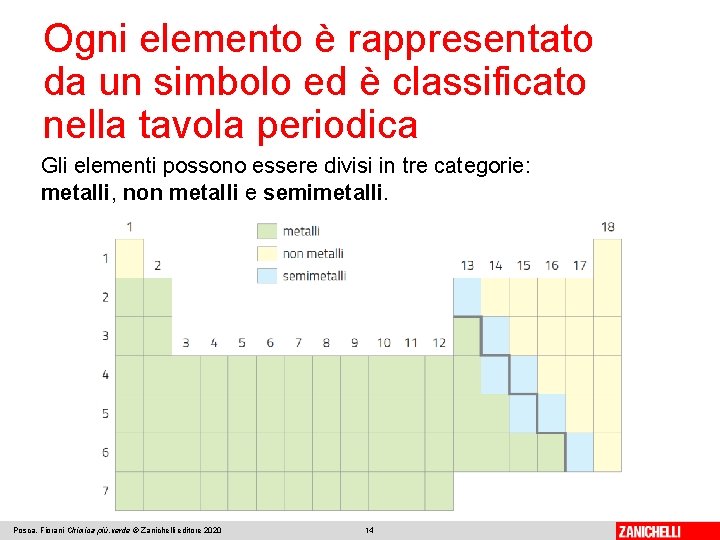
Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica Gli elementi possono essere divisi in tre categorie: metalli, non metalli e semimetalli. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica I metalli, eccetto il mercurio, sono solidi a temperatura ambiente, spesso lucenti allo stato puro, buoni conduttori di calore ed elettricità, malleabili e duttili. I non metalli si presentano in diversi stati di aggregazione, hanno bassi punti di fusione e densità e sono cattivi conduttori di calore e di elettricità. I semimetalli, solidi a temperatura ambiente, hanno proprietà intermedie tra metalli e non metalli. Non sono normalmente conduttori di elettricità, ma lo diventano al variare della temperatura e per aggiunta di piccolissime quantità di altri elementi; per questo sono chiamati semiconduttori. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica Il carbonio (grafite) (A) e lo zolfo (B) sono non metalli. Il magnesio (C), il rame (D) e il ferro (E) sono metalli. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

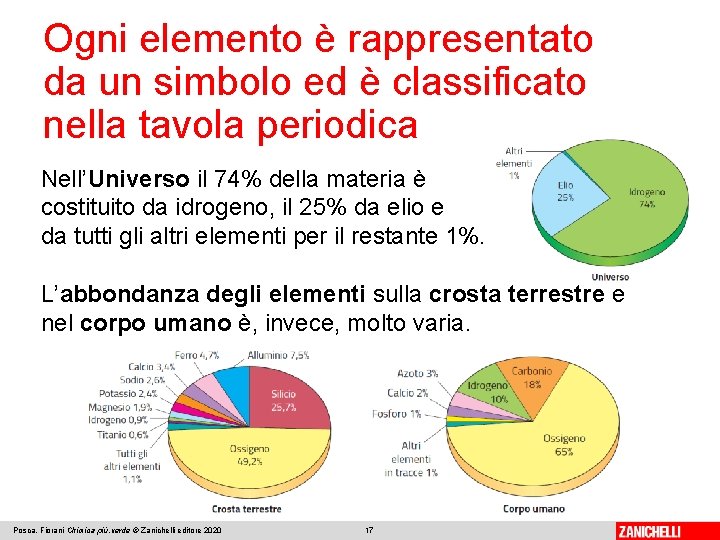
Ogni elemento è rappresentato da un simbolo ed è classificato nella tavola periodica Nell’Universo il 74% della materia è costituito da idrogeno, il 25% da elio e da tutti gli altri elementi per il restante 1%. L’abbondanza degli elementi sulla crosta terrestre e nel corpo umano è, invece, molto varia. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

✓ Mettiamoci alla prova Individua il simbolo e la posizione nella tavola periodica degli elementi azoto, cloro, ferro, idrogeno e ossigeno. Quale elemento è presente in maggiore quantità nell’Universo? Nella crosta terrestre? E nel corpo umano? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

Le trasformazioni della materia possono essere fisiche e chimiche Le trasformazioni fisiche provocano un cambiamento fisico delle sostanze, ma lasciano inalterata la loro natura. Le trasformazioni (o reazioni) chimiche sono processi che formano sostanze diverse da quelle di partenza, modificandone la composizione. Come simbologia viene usata una freccia, che indica il verso in cui procede la trasformazione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

Le trasformazioni della materia possono essere fisiche e chimiche Una reazione in cui una sostanza viene decomposta in sostanze più semplici è una reazione di analisi o di decomposizione. Una reazione in cui più sostanze vanno a formarne una sola è detta di sintesi. Alle sostanze prima della freccia si dà il nome di reagenti, a quelle dopo la freccia di prodotti. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

Le trasformazioni della materia possono essere fisiche e chimiche Ci sono molte altri tipi di trasformazioni chimiche. Di alcune reazioni possiamo avere percezione perché: • sono accompagnate da un cambiamento di colore, di sapore, di odore; • sviluppano un gas; • portano alla distruzione di un materiale. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Nelle reazioni chimiche la materia si conserva Nel 1789 Lavoisier enunciò la legge di conservazione della massa: in ogni reazione chimica la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti. In altri termini, in una reazione la materia non si crea né si distrugge. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

Gli elementi che formano un composto si combinano sempre nello stesso rapporto Nel 1799 Proust enunciò la legge delle proporzioni definite: quando due elementi si combinano per formare un solo composto, reagiscono secondo un rapporto di massa ben definito e costante. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Gli stessi elementi possono combinarsi in rapporti diversi per formare composti diversi Dalton (1766 -1844) enunciò la legge delle proporzioni multiple: quando due elementi si combinano per formare due o più composti, tenendo fissa la quantità di uno, le quantità dell’altro stanno tra loro in rapporti esprimibili con numeri piccoli e interi (1 : 1, 2 : 1, 3 : 1). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Durante una reazione come ad esempio la combustione, il carbone, costituito essenzialmente da carbonio, brucia grazie all’ossigeno dell’aria. Carbone e ossigeno si consumano e sono sostituiti da diossido di carbonio. Poiché le proprietà osservabili degli elementi non si mantengono quando essi si combinano per formare un composto, ciò che si conserva sfugge all’osservazione e riguarda la struttura microscopica della materia. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

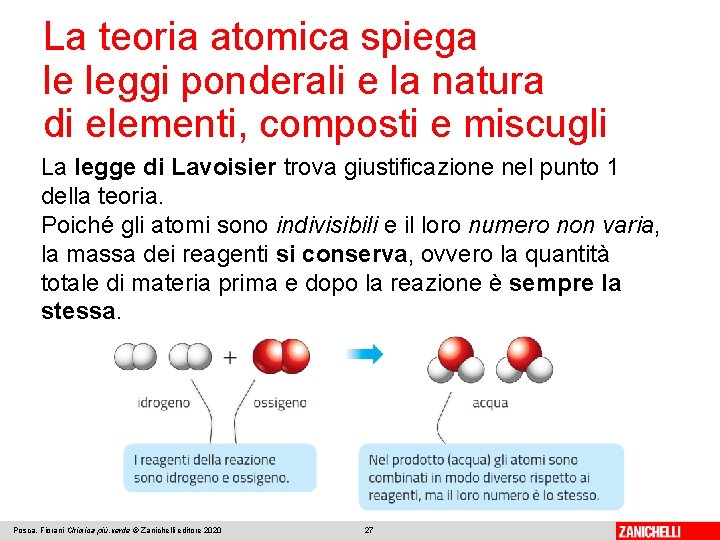
La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Secondo la teoria atomica della materia, formulata da Dalton: 1. la materia è costituita da piccolissime particelle indivisibili dette atomi, che non possono essere creati né distrutti; 2. gli atomi di uno stesso elemento hanno massa uguale, gli atomi di elementi diversi hanno massa diversa; 3. gli atomi si combinano secondo rapporti semplici; 4. le reazioni chimiche consistono nel separare e/o combinare atomi interi. Un atomo è la più piccola parte di un elemento che durante le reazioni chimiche mantiene la sua identità Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli La legge di Lavoisier trova giustificazione nel punto 1 della teoria. Poiché gli atomi sono indivisibili e il loro numero non varia, la massa dei reagenti si conserva, ovvero la quantità totale di materia prima e dopo la reazione è sempre la stessa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

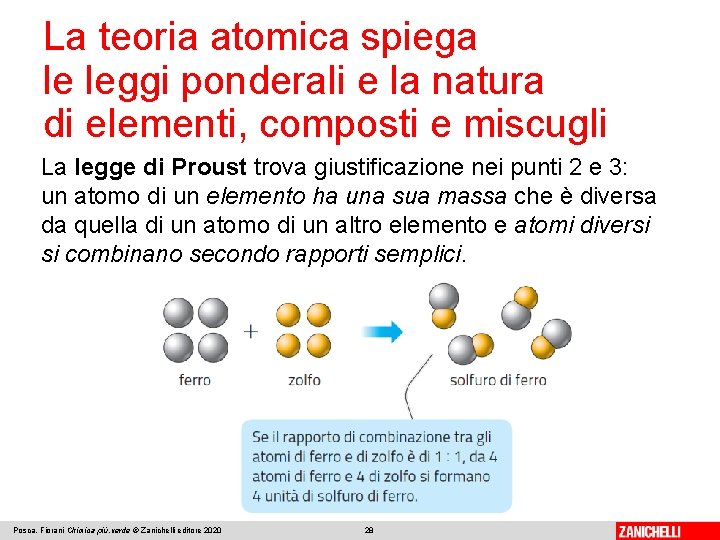
La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli La legge di Proust trova giustificazione nei punti 2 e 3: un atomo di un elemento ha una sua massa che è diversa da quella di un atomo di un altro elemento e atomi diversi si combinano secondo rapporti semplici. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Poiché l’atomo di ferro ha una massa diversa da quella dell’atomo di zolfo, il rapporto tra le masse di ferro e zolfo che reagiscono deve essere uguale al rapporto, costante, tra le masse dei singoli atomi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli La legge di Dalton trova giustificazione nel punto 4 della teoria atomica e si spiega ammettendo che i composti chimici si formino per combinazioni tra atomi interi. Il carbonio può legarsi all’ossigeno in rapporti diversi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Con la teoria atomica è possibile giustificare le differenze tra elementi, composti e miscugli. Consideriamo la reazione tra ferro e zolfo che produce solfuro di ferro. Se uniamo i due reagenti solidi polverizzati e li mescoliamo, otteniamo un miscuglio eterogeneo. I componenti possono essere separati, per esempio, attirando il ferro con una calamita. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Il prodotto della reazione di sintesi che si ottiene riscaldando la miscela di ferro e zolfo è invece un composto (solfuro di ferro) con proprietà diverse sia dal ferro sia dallo zolfo: esso, per esempio, non viene attratto da una calamita. Per separare ferro e zolfo è necessario decomporre il composto, cioè effettuare una reazione chimica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

La teoria atomica spiega le leggi ponderali e la natura di elementi, composti e miscugli Ferro e zolfo sono elementi, in quanto non si decompongono in sostanze più semplici, e sono diversi tra loro perché sono costituiti da atomi con massa diversa. Il solfuro di ferro è invece un composto, è formato da unità tutte uguali, ma ciascuna di esse è costituita da un atomo di zolfo e uno di ferro saldamente legati tra loro. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

✓ Mettiamoci alla prova Mg e O si combinano nel rapporto 1, 5 : 1. Qual è la massa del composto che si forma a partire da 1, 5 g di Mg? E da 2 g di O? Perché n atomi di ferro + n atomi di zolfo non danno 2 n unità di solfuro di ferro? Nella dimostrazione aiutati, se vuoi, con dei mattoncini da costruzione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34
 Chimica più soluzioni capitolo 8
Chimica più soluzioni capitolo 8 Soluzione chimica più verde
Soluzione chimica più verde Chimica più soluzioni
Chimica più soluzioni Posca soluzioni
Posca soluzioni Chimica piu capitolo 17 soluzioni
Chimica piu capitolo 17 soluzioni Chimica più verde soluzioni
Chimica più verde soluzioni Verde nace verde se cría y verde sube los troncos arriba
Verde nace verde se cría y verde sube los troncos arriba Legame metallico zanichelli
Legame metallico zanichelli Molecole in movimento soluzioni capitolo 11
Molecole in movimento soluzioni capitolo 11 Capitolo 21 chimica zanichelli
Capitolo 21 chimica zanichelli Soluzioni chimica zanichelli capitolo 12
Soluzioni chimica zanichelli capitolo 12 Chimica piu capitolo 17 soluzioni
Chimica piu capitolo 17 soluzioni Soluzioni chimica capitolo 18
Soluzioni chimica capitolo 18 Soluzioni capitolo 14 zanichelli chimica
Soluzioni capitolo 14 zanichelli chimica Capitolo 10 chimica zanichelli
Capitolo 10 chimica zanichelli Che elemento è
Che elemento è Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Barriere postzigotiche
Barriere postzigotiche Chimica zanichelli soluzioni capitolo 6
Chimica zanichelli soluzioni capitolo 6 Chimica piu capitolo 11 soluzioni
Chimica piu capitolo 11 soluzioni Zanichelli chimica soluzioni capitolo 14
Zanichelli chimica soluzioni capitolo 14 Chimica piu capitolo 17 soluzioni
Chimica piu capitolo 17 soluzioni Klein soluzioni
Klein soluzioni Carbonio metabolismo biotech soluzioni
Carbonio metabolismo biotech soluzioni Chimica più soluzioni capitolo 10
Chimica più soluzioni capitolo 10 Legame covalente dativo
Legame covalente dativo Soluzioni capitolo 8
Soluzioni capitolo 8 Soluzioni chimica zanichelli capitolo 11
Soluzioni chimica zanichelli capitolo 11 Soluzioni chimica più capitolo 10
Soluzioni chimica più capitolo 10 Chimica più soluzioni capitolo 14
Chimica più soluzioni capitolo 14 Classificazione idrocarburi
Classificazione idrocarburi Capitolo 16 zanichelli chimica
Capitolo 16 zanichelli chimica Zanichelli soluzioni chimica capitolo 16
Zanichelli soluzioni chimica capitolo 16 Reazioni reversibili e irreversibili zanichelli
Reazioni reversibili e irreversibili zanichelli Chimica più soluzioni capitolo 18
Chimica più soluzioni capitolo 18