Capitolo 19 Lelettrochimica Copyright 2008 Zanichelli editore 19

























































- Slides: 67

Capitolo 19 L’elettrochimica Copyright © 2008 Zanichelli editore 19. 1 Le celle galvaniche sfruttano le reazioni redox per produrre elettricità 19. 2 I potenziali di cella dipendono dai potenziali di riduzione 19. 3 I potenziali standard di riduzione consentono di prevedere la spontaneità delle reazioni 19. 4 Le batterie sono applicazioni pratiche delle celle galvaniche 19. 5 L’elettrolisi utilizza energia elettrica per fare avvenire reazioni chimiche 19. 6 Le trasformazioni quantitative durante l’elettrolisi

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Le reazioni di ossidoriduzione , come ricordiamo, comportano trasferimenti di elettroni da una sostanza chimica all’altra. Il trasferimento di elettroni è associato a sua volta al passaggio di energia, pertanto questi fenomeni sono stati sfruttati industrialmente in due modi fondamentali e contrapposti. È stato possibile infatti ottenere energia da particolari redox e per contro certe reazioni, di per sé non spontanee, sono state rese possibili utilizzando energia elettrica. Copyright © 2008 Zanichelli editore Affrontiamo per prima cosa i fenomeni collegati alla generazione di elettricità da parte di reazioni di ossidoriduzione in ambiente controllato.

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ L’energia delle batterie impiegate per azionare giocattoli, calcolatrici elettroniche, computer portatili, pacemaker, videocamere e telefoni cellulari proviene da reazioni redox spontanee in cui i processi di ossidazione (perdita di elettroni) e riduzione (acquisto di elettroni) avvengono in compartimenti separati e il trasferimento di elettroni si realizza attraverso un circuito esterno. I sistemi che forniscono elettricità in questo modo sono chiamati celle galvaniche, in onore di Luigi Galvani (1737 -1798), l’anatomista italiano a cui si deve la scoperta che l’elettricità può causare la contrazione muscolare. Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Se un pezzetto di rame metallico viene immerso in una soluzione di nitrato d’argento, si verifica una reazione redox spontanea. Sul rame si forma gradualmente un deposito grigio chiaro e la soluzione diventa blu a causa della dissoluzione degli ioni Cu 2+ idratati. Sebbene sia esotermica, questa reazione non produce energia utile perché la variazione energetica che la accompagna è completamente dispersa sotto forma di calore. L’equazione della reazione è: Copyright © 2008 Zanichelli editore

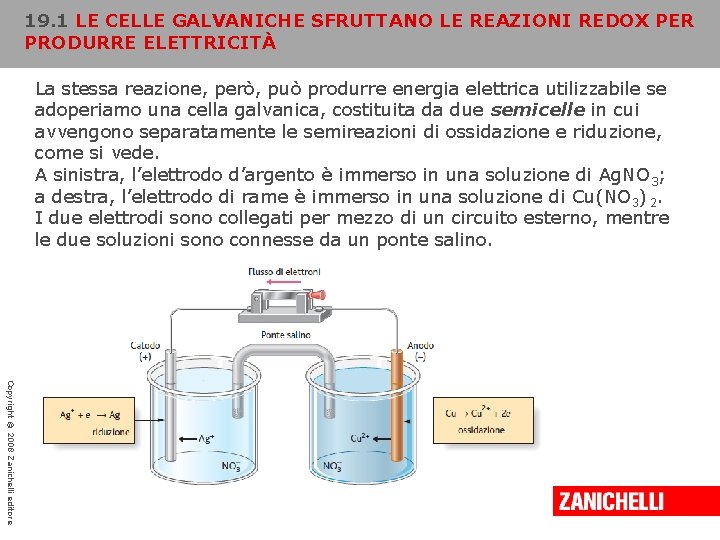
19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ La stessa reazione, però, può produrre energia elettrica utilizzabile se adoperiamo una cella galvanica, costituita da due semicelle in cui avvengono separatamente le semireazioni di ossidazione e riduzione, come si vede. A sinistra, l’elettrodo d’argento è immerso in una soluzione di Ag. NO 3; a destra, l’elettrodo di rame è immerso in una soluzione di Cu(NO 3) 2. I due elettrodi sono collegati per mezzo di un circuito esterno, mentre le due soluzioni sono connesse da un ponte salino. Copyright © 2008 Zanichelli editore

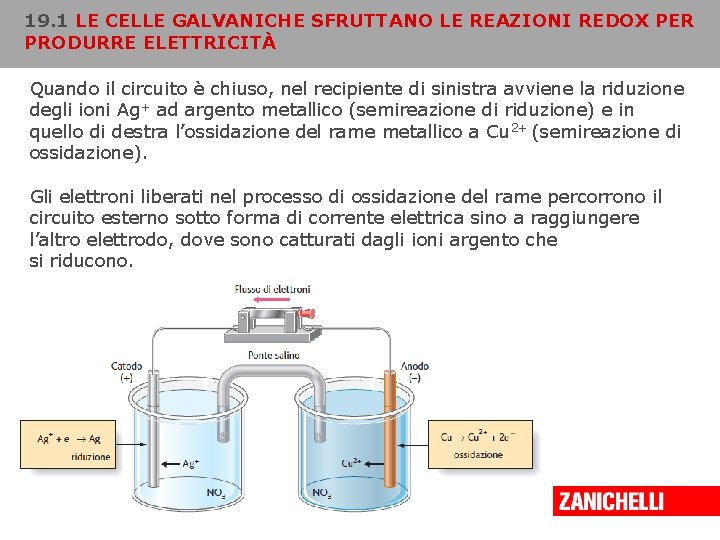
19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Quando il circuito è chiuso, nel recipiente di sinistra avviene la riduzione degli ioni Ag+ ad argento metallico (semireazione di riduzione) e in quello di destra l’ossidazione del rame metallico a Cu 2+ (semireazione di ossidazione). Gli elettroni liberati nel processo di ossidazione del rame percorrono il circuito esterno sotto forma di corrente elettrica sino a raggiungere l’altro elettrodo, dove sono catturati dagli ioni argento che si riducono. Copyright © 2008 Zanichelli editore

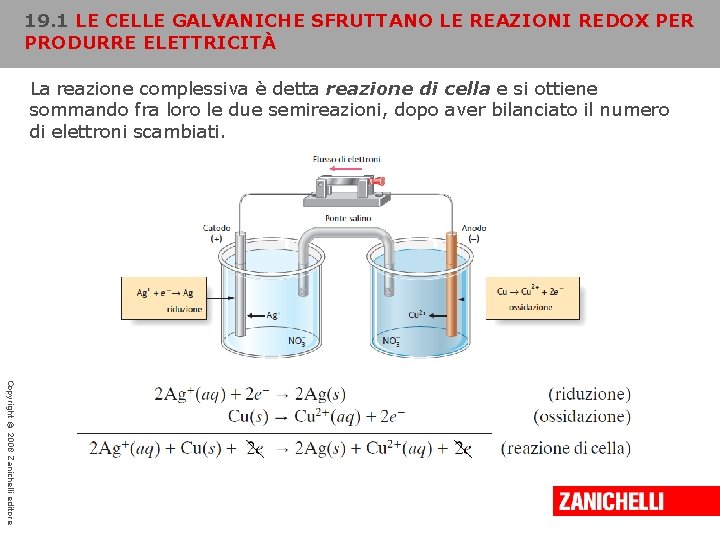
19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ La reazione complessiva è detta reazione di cella e si ottiene sommando fra loro le due semireazioni, dopo aver bilanciato il numero di elettroni scambiati. Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Nei sistemi elettrochimici, gli elettrodi sono chiamati catodo e anodo. I nomi vengono sempre assegnati in base alla natura delle trasformazioni chimiche si svolgono agli elettrodi. In un qualsiasi sistema elettrochimico: il catodo è l’elettrodo su cui avviene la riduzione (acquisto di elettroni); l’anodo è l’elettrodo su cui avviene l’ossidazione (perdita di elettroni). Copyright © 2008 Zanichelli editore Nella cella galvanica appena descritta, quindi, l’elettrodo d’argento è il catodo e quello di rame è l’anodo. Nel circuito esterno della cella, la carica elettrica è trasportata da un elettrodo all’altro grazie al movimento degli elettroni che si spostano dall’anodo, dove vengono liberati dal processo di ossidazione, verso il catodo, dove sono catturati dalla sostanza che si riduce. Questo tipo di conduzione, caratteristica dei metalli, si chiama conduzione metallica.

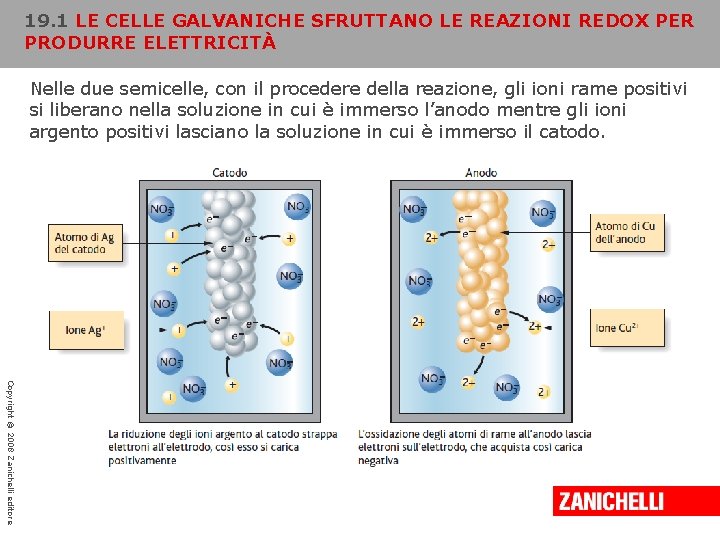
19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Nelle due semicelle, con il procedere della reazione, gli ioni rame positivi si liberano nella soluzione in cui è immerso l’anodo mentre gli ioni argento positivi lasciano la soluzione in cui è immerso il catodo. Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Se questi processi si prolungassero nel tempo, la soluzione anodica diverrebbe rapidamente positiva mentre quella catodica acquisterebbe carica negativa. Una cella galvanica, però, può funzionare solo se le soluzioni delle due semicelle rimangono elettricamente neutre. Il ponte salino della figura consente lo spostamento ionico necessario per mantenere la neutralità delle soluzioni. Un ponte salino è un tubo riempito con una soluzione di un sale costituito da ioni diversi da quelli coinvolti nella reazione di cella, in genere KNO 3 o KCl. Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Il tubo è chiuso alle estremità da due setti porosi che impediscono alla soluzione di diffondere, ma, allo stesso tempo, consentono uno scambio di ioni fra la soluzione del ponte salino e quelle delle semicelle. Durante il funzionamento della cella, gli ioni negativi diffondono dal ponte salino verso la semicella del rame, oppure gli ioni Cu 2+ passano dalla soluzione al ponte salino, rendendo la semicella neutra. Allo stesso tempo, la semicella dell’argento viene mantenuta elettricamente neutra dal passaggio di ioni positivi dal ponte salino alla soluzione o di ioni NO 3 - in senso opposto. Copyright © 2008 Zanichelli editore In una soluzione che contiene soluti ionici (o, come vedremo più avanti, in un composto ionico allo stato fuso), la carica elettrica è trasportata dal movimento degli ioni. Questo tipo di trasporto della carica elettrica è detto conduzione elettrolitica.

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ Se analizziamo con più attenzione il movimento complessivo degli ioni durante il funzionamento della cella galvanica, vediamo che gli ioni negativi (anioni) si allontanano dal catodo, dove sono presenti in eccesso, e si portano all’anodo, dove sono necessari per bilanciare la carica positiva degli ioni che si formano. Analogamente, gli ioni positivi (cationi) si allontanano dall’anodo e si portano al catodo per bilanciare la carica degli anioni rimasti in eccesso. Il motivo per cui gli ioni positivi e negativi sono detti, rispettivamente, cationi e anioni deriva proprio dal tipo di elettrodo verso cui essi si muovono. Riassumendo: Copyright © 2008 Zanichelli editore i cationi si muovono in direzione del catodo; gli anioni si muovono in direzione dell’anodo.

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ All’anodo della cella galvanica descritta nella figura, gli atomi di rame lasciano spontaneamente l’elettrodo ed entrano in soluzione come ioni Cu 2+. Gli elettroni rimasti sull’anodo conferiscono all’elettrodo una leggera carica negativa (l’anodo acquista polarità negativa). Al catodo, gli ioni Ag+ strappano elettroni all’elettrodo che si carica così positivamente (il catodo ha polarità positiva). La differenza di carica fra il catodo e l’anodo provoca il flusso della corrente elettrica, quando il circuito è chiuso. Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ I DIAGRAMMI DI CELLA CONSENTONO DI DESCRIVERE SINTETICAMENTE LE CELLE GALVANICHE ► Per convenienza, i chimici hanno ideato un sistema che consente di descrivere in modo sintetico una cella galvanica. Per esempio, la cella rame-argento trattata in precedenza può essere rappresentata come segue: Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ I DIAGRAMMI DI CELLA CONSENTONO DI DESCRIVERE SINTETICAMENTE LE CELLE GALVANICHE ► In un diagramma di cella standard, la semicella anodica viene descritta per convenzione a sinistra, iniziando dal materiale di cui è costituito l’anodo. Nel nostro caso, l’anodo è di rame metallico. La barra verticale singola rappresenta il confine di fase, in questo caso fra l’elettrodo di rame e la soluzione in cui è immerso. La doppia barra verticale indica, invece, il ponte salino che collega le soluzioni delle due semicelle. La semicella catodica è descritta a destra, collocando in ultima posizione il materiale di cui è costituito il catodo. Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ I DIAGRAMMI DI CELLA CONSENTONO DI DESCRIVERE SINTETICAMENTE LE CELLE GALVANICHE ► Talvolta, le forme ossidate e ridotte dei reagenti di una semicella si trovano entrambe in soluzione. Per esempio, una cella galvanica può essere costituita da un anodo in cui un elettrodo di zinco è immerso in una soluzione che contiene ioni Zn 2+ e da un catodo in cui un elettrodo inerte (non reattivo) di platino è immerso in una soluzione che contiene ioni Fe 2+ e Fe 3+. La reazione di cella è: Copyright © 2008 Zanichelli editore

19. 1 LE CELLE GALVANICHE SFRUTTANO LE REAZIONI REDOX PER PRODURRE ELETTRICITÀ I DIAGRAMMI DI CELLA CONSENTONO DI DESCRIVERE SINTETICAMENTE LE CELLE GALVANICHE ► Il diagramma di cella è il seguente: Copyright © 2008 Zanichelli editore I simboli relativi ai due ioni ferro sono separati da una virgola. In questa cella, la riduzione di Fe 3+ a Fe 2+ avviene sulla superficie dell’elettrodo inerte di platino.

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Una cella galvanica ha la proprietà di far fluire elettroni attraverso un circuito esterno. La grandezza legata a questa proprietà è il potenziale o forza elettromotrice (f. e. m. ), che si misura in volt (V). Il potenziale misura la quantità di energia (in joule) che può essere liberata per unità SI di carica (il coulomb) quando la corrente attraversa il circuito. Una corrente che attraversa un circuito con un potenziale di un volt può dunque liberare un joule di energia per coulomb: Copyright © 2008 Zanichelli editore

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Il potenziale (o voltaggio) di una cella galvanica varia a seconda della quantità di corrente che attraversa il circuito. Il potenziale massimo di una data cella è chiamato potenziale di cella, Ecella, e dipende dalla composizione degli elettrodi, dalla concentrazione degli ioni nelle semicelle e dalla temperatura. Per poter confrontare i potenziali di celle diverse, dobbiamo fare riferimento al Copyright © 2008 Zanichelli editore potenziale standard di cella, simboleggiato con E°cella: questo è il potenziale della cella quando tutte le concentrazioniche sono 1, 00 M, la temperatura è 25 °C e la pressione di eventuali gas coinvolti nella reazione di cella è pari a 1 atm.

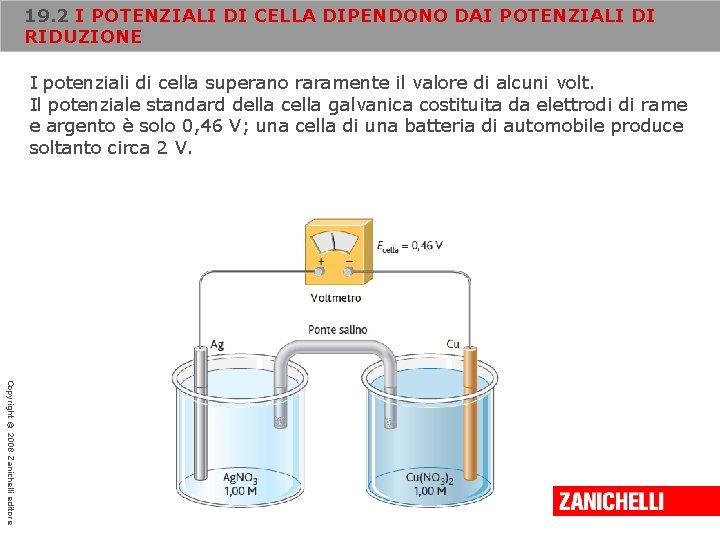
19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE I potenziali di cella superano raramente il valore di alcuni volt. Il potenziale standard della cella galvanica costituita da elettrodi di rame e argento è solo 0, 46 V; una cella di una batteria di automobile produce soltanto circa 2 V. Copyright © 2008 Zanichelli editore

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Le batterie che generano alti voltaggi contengono più celle collegate in serie, in modo da sommare i loro potenziali; nelle automobili, per esempio, esse sono formate da sei celle, per un potenziale complessivo di circa 12 V. È utile immaginare che il potenziale complessivo della cella derivi dalla competizione fra le due semicelle per la cattura degli elettroni. Possiamo così pensare che ciascuna semicella abbia una certa tendenza naturale ad acquistare elettroni, procedendo quindi nel senso di una riduzione. Copyright © 2008 Zanichelli editore

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE L’entità di questa tendenza è espressa dal potenziale di riduzione della semireazione. Se misurato in condizioni standard (temperatura 25 °C, concentrazioni dei soluti 1, 00 M e pressione 1 atm), il potenziale di riduzione prende il nome di potenziale standard di riduzione ed è simboleggiato con E°x, dove x indica la sostanza che si riduce. Quindi, il potenziale standard di riduzione della semireazione: Copyright © 2008 Zanichelli editore è indicato con E°Cu 2+

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Quando due semicelle sono collegate, quella con potenziale di riduzione maggiore (ovvero con una maggiore tendenza a ridursi) acquista elettroni dalla semicella con potenziale di riduzione minore, in cui avviene l’ossidazione. Il potenziale di cella misurato è sempre un numero positivo e rappresenta l’entità della differenza fra i potenziali di riduzione delle due semicelle. In generale: Copyright © 2008 Zanichelli editore

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Consideriamo come esempio la cella rame-argento. Dalla reazione di cella vediamo che gli ioni argento si riducono e il rame si ossida. Se confrontiamo le due possibili semireazioni di riduzione: Copyright © 2008 Zanichelli editore

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE La semicella con Ag+ deve avere una maggiore tendenza a procedere rispetto a quella con Cu 2+, perché è lo ione argento che, di fatto, si riduce. Ciò significa che il potenziale standard di riduzione di Ag + deve essere maggiore di quello di Cu 2+. In altri termini, se conoscessimo i valori di E° Ag e di E°Cu , potremmo calcolare E°cella sottraendo il potenziale di riduzione minore da quello maggiore: + 2+ Copyright © 2008 Zanichelli editore

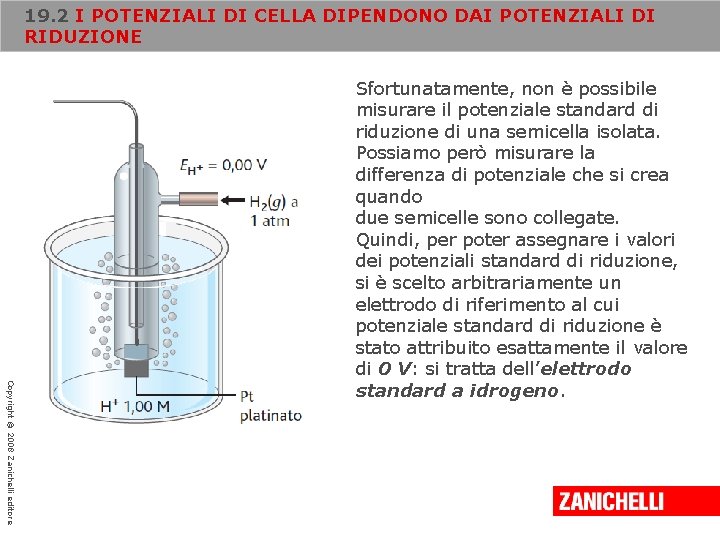
19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Copyright © 2008 Zanichelli editore Sfortunatamente, non è possibile misurare il potenziale standard di riduzione di una semicella isolata. Possiamo però misurare la differenza di potenziale che si crea quando due semicelle sono collegate. Quindi, per poter assegnare i valori dei potenziali standard di riduzione, si è scelto arbitrariamente un elettrodo di riferimento al cui potenziale standard di riduzione è stato attribuito esattamente il valore di 0 V: si tratta dell’elettrodo standard a idrogeno.

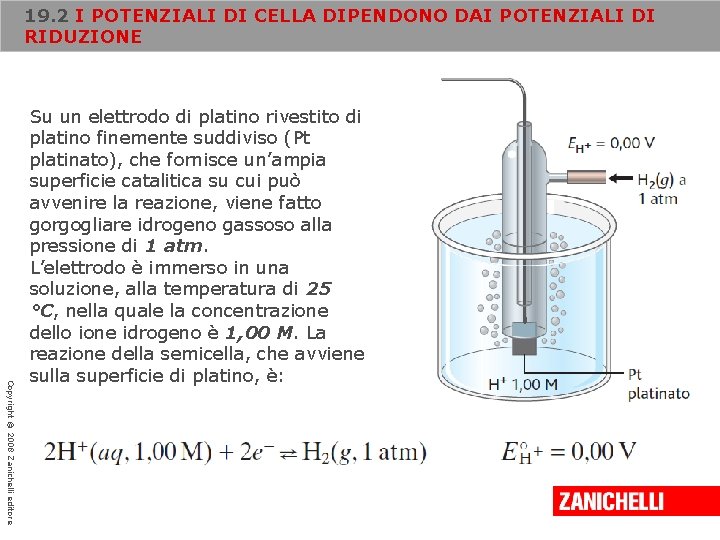
19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Copyright © 2008 Zanichelli editore Su un elettrodo di platino rivestito di platino finemente suddiviso (Pt platinato), che fornisce un’ampia superficie catalitica su cui può avvenire la reazione, viene fatto gorgogliare idrogeno gassoso alla pressione di 1 atm. L’elettrodo è immerso in una soluzione, alla temperatura di 25 °C, nella quale la concentrazione dello ione idrogeno è 1, 00 M. La reazione della semicella, che avviene sulla superficie di platino, è:

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Copyright © 2008 Zanichelli editore La doppia freccia indica che la reazione è reversibile, ma non esiste un vero equilibrio. La direzione in cui la reazione si svolge dipende dal potenziale di riduzione della semicella con cui l’elettrodo è accoppiato. La figura mostra come l’elettrodo a idrogeno viene collegato a una semicella di rame per formare una cella galvanica. Per ottenere la reazione di cella, dobbiamo sapere quali sono il catodo e l’anodo. La misura delle cariche sugli elettrodi consente questa determinazione, perché sappiamo che in una cella galvanica il catodo è l’elettrodo positivo e l’anodo quello negativo.

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Usando un voltmetro per misurare il potenziale della cella, osserviamo che l’elettrodo di rame porta carica positiva e quello di idrogeno carica negativa. Quindi, il rame deve essere il catodo e, durante il funzionamento della cella, Cu 2+ si riduce a Cu. Analogamente, l’idrogeno deve essere l’anodo e H 2 si ossida a H+. Le due semireazioni e la reazione di cella sono, quindi: Copyright © 2008 Zanichelli editore

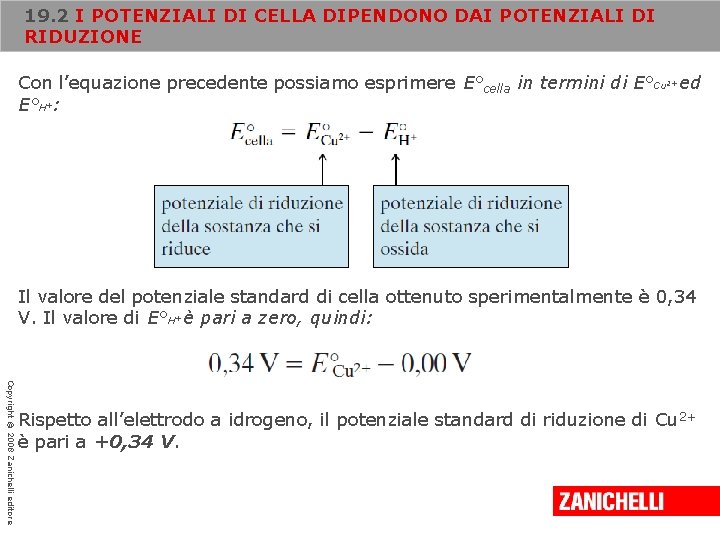
19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Con l’equazione precedente possiamo esprimere E°cella in termini di E°Cu ed E°H : 2+ + Il valore del potenziale standard di cella ottenuto sperimentalmente è 0, 34 V. Il valore di E°H è pari a zero, quindi: + Copyright © 2008 Zanichelli editore Rispetto all’elettrodo a idrogeno, il potenziale standard di riduzione di Cu 2+ è pari a +0, 34 V.

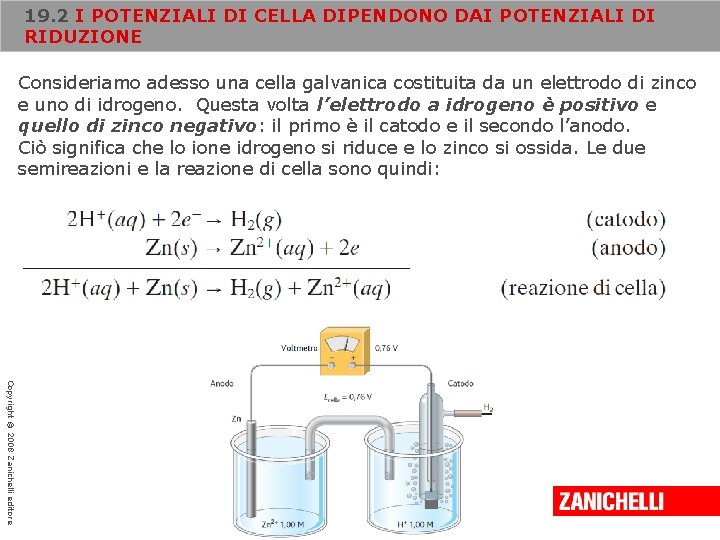
19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Consideriamo adesso una cella galvanica costituita da un elettrodo di zinco e uno di idrogeno. Questa volta l’elettrodo a idrogeno è positivo e quello di zinco negativo: il primo è il catodo e il secondo l’anodo. Ciò significa che lo ione idrogeno si riduce e lo zinco si ossida. Le due semireazioni e la reazione di cella sono quindi: Copyright © 2008 Zanichelli editore

19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Il potenziale standard di cella risulta: Sostituendo nell’equazione il potenziale standard misurato per la cella, che corrisponde a 0, 76 V, e ponendo E°H+ uguale a 0, 00 V, abbiamo: Copyright © 2008 Zanichelli editore Il potenziale di riduzione dello zinco ha segno negativo; questo significa semplicemente che la tendenza della sostanza a ridursi è minore di quella di H+. In altri termini, lo zinco si ossida quando è accoppiato all’elettrodo a idrogeno.

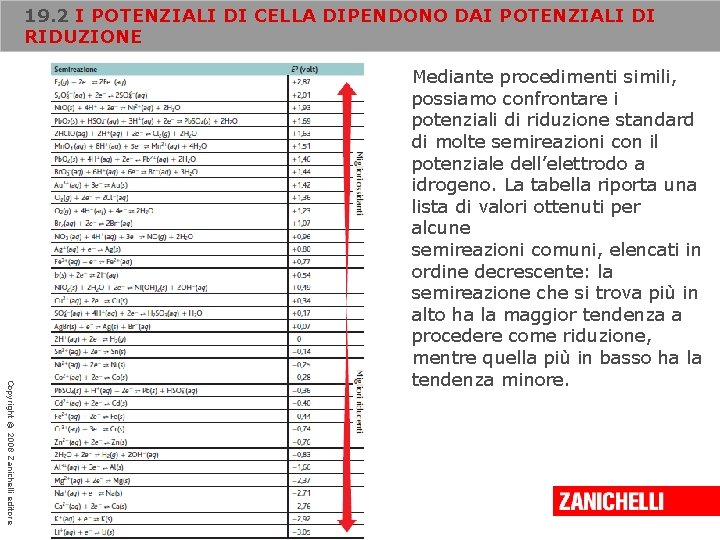
19. 2 I POTENZIALI DI CELLA DIPENDONO DAI POTENZIALI DI RIDUZIONE Copyright © 2008 Zanichelli editore Mediante procedimenti simili, possiamo confrontare i potenziali di riduzione standard di molte semireazioni con il potenziale dell’elettrodo a idrogeno. La tabella riporta una lista di valori ottenuti per alcune semireazioni comuni, elencati in ordine decrescente: la semireazione che si trova più in alto ha la maggior tendenza a procedere come riduzione, mentre quella più in basso ha la tendenza minore.

19. 3 I POTENZIALI STANDARD DI RIDUZIONE CONSENTONO DI PREVEDERE LA SPONTANEITÀ DELLE REAZIONI Le semireazioni e i potenziali standard di riduzione, possono essere utilizzati per ricavare informazioni sulle celle galvaniche, ma anche per prevedere se si può realizzare una reazione spontanea fra due sostanze che non costituiscono una cella galvanica, confrontando i valori di E°. Sappiamo infatti che la semireazione con il potenziale di riduzione più positivo avviene sempre nel senso in cui è scritta (ovvero come riduzione), mentre l’altra semireazione si svolge in senso contrario (come ossidazione). Copyright © 2008 Zanichelli editore

19. 3 I POTENZIALI STANDARD DI RIDUZIONE CONSENTONO DI PREVEDERE LA SPONTANEITÀ DELLE REAZIONI È possibile individuare i reagenti e i prodotti delle reazioni redox spontanee in base alla posizione relativa delle semireazioni nella tabella dei potenziali standard poiché i potenziali di riduzione sono elencati in ordine decrescente. Per una qualsiasi coppia di semireazioni, quella situata più in alto nella tabella possiede un potenziale di riduzione maggiore e procede come riduzione; l’altra semireazione è invertita e procede come ossidazione. Copyright © 2008 Zanichelli editore Quindi, in una reazione spontanea, i reagenti si trovano a sinistra della semireazione posizionata più in alto e a destra della semireazione più in basso.

19. 3 I POTENZIALI STANDARD DI RIDUZIONE CONSENTONO DI PREVEDERE LA SPONTANEITÀ DELLE REAZIONI I potenziali di riduzione possono servire per prevedere la spontaneità di una reazione redox. Se le reazioni redox spontanee sono utilizzate in una cella galvanica, siamo in grado di prevedere il potenziale standard di cella. Date le premesse, siamo in grado di prevedere se una reazione, così come è scritta, si realizza spontaneamente o meno. In questo caso, dobbiamo calcolare il potenziale di cella che corrisponde alla reazione in questione e vedere se è positivo. Queste generalizzazioni sono valide in condizioni standard: concentrazione 1 M di tutte le specie ioniche, 1 atm di pressione per i gas e temperatura di 25 °C. Copyright © 2008 Zanichelli editore In una cella galvanica, il potenziale di cella della reazione spontanea è sempre positivo. Se dovesse risultare negativo, è spontanea la reazione inversa.

19. 3 I POTENZIALI STANDARD DI RIDUZIONE CONSENTONO DI PREVEDERE LA SPONTANEITÀ DELLE REAZIONI IL POTENZIALE DI UNA CELLA GALVANICA È INFLUENZATO DALLE CONCENTRAZIONI DELLE SOSTANZE ► Alle condizioni appena definite, il potenziale di cella (Ecella) è uguale al potenziale standard (E°cella). Se però variano le concentrazioni o le pressioni, varia anche il potenziale. L’effetto della concentrazione sul potenziale di cella può essere calcolato mediante l’equazione di Nernst: Copyright © 2008 Zanichelli editore

19. 3 I POTENZIALI STANDARD DI RIDUZIONE CONSENTONO DI PREVEDERE LA SPONTANEITÀ DELLE REAZIONI IL POTENZIALE DI UNA CELLA GALVANICA È INFLUENZATO DALLE CONCENTRAZIONI DELLE SOSTANZE ► Nell’equazione di Nernst Ecella è il potenziale reale della cella, E°cella è il potenziale standard, R è la costante dei gas (in J K-1 mol-1), T è la temperatura assoluta, F è la costante di Faraday (96 500 coulomb/mol e-), n è il numero di moli di elettroni trasferiti e Q è il quoziente di reazione. Tutti i termini costanti che appaiono nell’equazione prima del logaritmo si possono raggruppare; a 25 °C, la combinazione delle costanti porta a un’equazione facile da memorizzare: Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE Uno degli utilizzi più diffusi delle celle galvaniche sfrutta la loro capacità di generare energia elettrica. In queste diapositive esamineremo brevemente alcuni degli impieghi odierni delle celle galvaniche, comunemente note come batterie e alcune promettenti applicazioni future. Questi dispositivi possono essere classificati come celle primarie o pile, celle non ricabili che devono essere smaltite dopo l’uso, e celle secondarie o accumulatori, celle ricabili progettate per usi prolungati. Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► BATTERIA AL PIOMBO La comune batteria al piombo, usata per avviare i motori delle automobili, è costituita da un certo numero di celle secondarie, ciascuna con un potenziale di 2 V, collegate in serie in modo che il loro voltaggio si sommi. La maggior parte delle moderne batterie per automobili contiene sei celle di questo tipo per un totale di circa 12 V. La figura mostra una tipica batteria al piombo. L’anodo di ogni cella è costituito da numerose piastre di piombo e il catodo da altre piastre rivestite con diossido di piombo; l’acido solforico è l’elettrolita. Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► BATTERIA AL PIOMBO Quando la batteria è in funzione, le reazioni agli elettrodi sono: La reazione netta in ciascuna cella è: Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► BATTERIA AL PIOMBO Mano a mano che la cella si scarica, la concentrazione dell’acido solforico diminuisce perché esso viene consumato nella reazione. Il vantaggio principale offerto dalle batterie al piombo è che le reazioni di cella, spontanee durante la scarica, possono essere invertite mediante il collegamento con una sorgente di energia elettrica esterna. In altri termini, la batteria può essere ricata per elettrolisi. Copyright © 2008 Zanichelli editore I maggiori svantaggi di queste batterie sono il peso elevato e la presenza di aperture da cui l’acido solforico può fuoriuscire. Le batterie al piombo più recenti presentano un anodo costituito da una lega al piombo-calcio che consente di sigillare la batteria, prevenendo le eventuali perdite dell’elettrolita.

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► PILA ALLO ZINCO-DIOSSIDO DI MANGANESE La comune, poco costosa, pila a secco da 1, 5 V è una pila allo zincodiossido di manganese o pila Leclanché (in onore del suo inventore, George Leclanché). Si tratta di una cella primaria usata per flash, registratori e altri apparecchi. Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► PILA ALLO ZINCO-DIOSSIDO DI MANGANESE La parte esterna è costituita da zinco, che funziona da anodo; la superficie esterna sul fondo della pila è il polo negativo della batteria. Il catodo (polo positivo) è costituito da una barretta di carbonio (grafite) circondata da un impasto di diossido di manganese, cloruro d’ammonio e grafite finemente suddivisa. La reazione all’anodo consiste nell’ossidazione dello zinco: Il processo che si svolge al catodo è molto complesso e porta alla formazione di una miscela di prodotti. Una delle reazioni principali è la seguente: Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► PILA ALLO ZINCO-DIOSSIDO DI MANGANESE L’ammoniaca prodotta al catodo reagisce con parte degli ioni Zn 2+ per formare uno ione complesso, Zn(NH 3) 42+. I principali vantaggi della pila a secco sono il costo relativamente basso e il fatto che, normalmente, funziona senza fuoriuscita di materiale. Uno svantaggio è la sua rapida scarica in condizioni di forte assorbimento di corrente; ciò avviene perché gli ioni che si formano nella reazione di cella tendono a permanere in prossimità degli elettrodi. Se non vengono utilizzate per qualche tempo, queste pile possono però recuperare la loro efficienza grazie alla diffusione dei prodotti di reazione. Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► PILA ALLO ZINCO-DIOSSIDO DI MANGANESE Una versione più comune della pila Leclanché impiega un elettrolita alcalino ed è per questo chiamata pila alcalina o pila alcalina a secco. I reagenti sono sempre Zn e Mn. O 2, ma l’ambiente è basico. Il voltaggio è pari a circa 1, 54 V. La pila ha una durata maggiore rispetto alla normale pila zinco-carbonio. Le reazioni di semicella sono: Copyright © 2008 Zanichelli editore

19. 4 LE BATTERIE SONO APPLICAZIONI PRATICHE DELLE CELLE GALVANICHE ► PILA ALL’OSSIDO DI ARGENTO Spesso negli orologi da polso, nei calcolatori e nelle macchine fotografiche vengono utilizzate pile all’ossido di argento, di piccole dimensioni, che generano un voltaggio di 1, 5 V. Sostituiscono le pile al mercurio, molto pericolose dal punto di vista ambientale, ma il loro costo è elevato perché contengono argento. L’anodo è di zinco, la sostanza che reagisce al catodo è l’ossido di argento, Ag 2 O, e l’elettrolita è basico. Le semireazioni agli elettrodi sono: Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE Abbiamo sinora esaminato il modo in cui le reazioni redox spontanee possono essere sfruttate per generare energia elettrica. Spostiamo adesso l’attenzione sul processo opposto, l’uso dell’energia elettrica per realizzare reazioni redox non spontanee. In effetti, si tratta proprio delle reazioni che avvengono durante la rica delle batterie. Per prima cosa affronteremo lo studio dei fenomeni che si verificano quando un sale fuso è attraversato da corrente continua. Poi analizzeremo il fenomeno in soluzione acquosa, in cui si possono realizzare processi ossidoriduttivi molto diversi tra loro. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE L’ELETTROLISI DI UN SALE FUSO LIBERA GLI ELEMENTI AGLI ELETTRODI ► Quando si fa passare l’elettricità attraverso un composto ionico fuso o una soluzione di un elettrolita, avviene una reazione chimica detta elettrolisi. La figura illustra un tipico apparecchio per elettrolisi, chiamato cella elettrolitica o cella per elettrolisi. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE L’ELETTROLISI DI UN SALE FUSO LIBERA GLI ELEMENTI AGLI ELETTRODI ► Questa particolare cella contiene cloruro di sodio fuso. Per poter subire un processo elettrolitico, una sostanza deve essere allo stato fuso o in soluzione, in modo che i suo in ioni possano muoversi liberamente e quindi condurre l’elettricità. Nella cella sono immersi elettrodi inerti (che non reagiscono con Na. Cl fuso), collegati a una sorgente di corrente elettrica continua. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE L’ELETTROLISI DI UN SALE FUSO LIBERA GLI ELEMENTI AGLI ELETTRODI ► Le trasformazioni chimiche hanno inizio non appena l’elettricità comincia a scorrere. All’elettrodo positivo avviene l’ossidazione: gli elettroni vengono strappati agli ioni cloruro carichi negativamente. A causa di questa trasformazione, l’elettrodo positivo diventa l’anodo. La sorgente di corrente continua spinge questi elettroni lungo il circuito esterno verso l’elettrodo negativo, dove avviene la riduzione: gli elettroni sono acquisiti dagli ioni sodio, carichi positivamente. L’elettrodo negativo è quindi il catodo. Le trasformazioni chimiche agli elettrodi sono le seguenti: Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE L’ELETTROLISI DI UN SALE FUSO LIBERA GLI ELEMENTI AGLI ELETTRODI ► La conducibilità elettrica di un sale fuso o di una soluzione di un elettrolita è dovuta allo spostamento degli ioni nel mezzo liquido. Nel caso di Na. Cl fuso, per esempio, gli ioni Cl- si muovono gradualmente verso l’anodo, formando un rivestimento sull’elettrodo. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE L’ELETTROLISI DI UN SALE FUSO LIBERA GLI ELEMENTI AGLI ELETTRODI ► La reazione anodica trasforma gli ioni in molecole che, liberandosi in forma di gas, lasciano spazio per nuovi ioni Cl-. Analogamente, gli ioni positivi si avvicinano al catodo e vengono ridotti, cedendo così il posto ad altri ioni. Sono quindi le reazioni che si svolgono agli elettrodi a determinare il movimento degli ioni nel liquido. Come in una cella galvanica, la reazione complessiva prende il nome di reazione di cella e si ottiene sommando le due semireazioni degli elettrodi, dopo aver bilanciato gli elettroni scambiati: Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE L’ELETTROLISI DI UN SALE FUSO LIBERA GLI ELEMENTI AGLI ELETTRODI ► Com’è noto, il sale da cucina è molto stabile e non si decompone, dal momento che la reazione inversa fra sodio e cloro per formare cloruro di sodio è fortemente favorita. Dobbiamo perciò scrivere la parola elettrolisi sopra la freccia dell’equazione per indicare che l’elettricità è la forza trainante di questa reazione, altrimenti non spontanea: Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE LA CELLA GALVANICA E LA CELLA ELETTROLITICA PRESENTANO ELETTRODI CON POLARITÀ OPPOSTE ► In una cella galvanica, la reazione di cella spontanea deposita elettroni sull’anodo e li allontana dal catodo. Il risultato è che l’anodo e il catodo hanno, rispettivamente, una lieve carica negativa e positiva. In una cella elettrolitica, la situazione è capovolta. La reazione di ossidazione all’anodo deve essere assistita e ciò richiede che l’anodo sia carico positivamente in modo da strappare gli elettroni al reagente. Al contrario, il catodo deve essere negativo in modo da indurre l’altro reagente ad accettare elettroni. Copyright © 2008 Zanichelli editore Cella elettrolitica: il catodo è negativo (riduzione) e l’anodo è positivo (ossidazione). Cella galvanica: il catodo è positivo (riduzione) e l’anodo è negativo (ossidazione).

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE LA CELLA GALVANICA E LA CELLA ELETTROLITICA PRESENTANO ELETTRODI CON POLARITÀ OPPOSTE ► Sebbene le cariche del catodo e dell’anodo siano diverse nelle due celle, gli ioni in soluzione si muovono sempre nella stessa direzione. I cationi sono ioni positivi che, in entrambi i tipi di cella, si muovono verso il catodo. In una cella elettrolitica, essi sono attratti dalla carica negativa del catodo; in una cella galvanica, diffondono invece verso il catodo per bilanciare l’eccesso di ioni negativi che consegue alla riduzione degli ioni positivi. Copyright © 2008 Zanichelli editore Analogamente, gli anioni sono ioni negativi che si muovono sempre verso l’anodo. In una cella elettrolitica, essi sono attratti dalla carica positiva dell’anodo; in una cella galvanica, diffondono verso l’anodo per bilanciare la carica degli ioni positivi che entrano in soluzione.

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE LE REAZIONI DI ELETTROLISI IN SOLUZIONE ACQUOSA POSSONO COINVOLGERE L’ACQUA ► Quando l’elettrolisi si svolge in soluzione acquosa, le reazioni agli elettrodi sono più difficili da prevedere perché vi può essere una competizione fra più reagenti. In questo caso, non dobbiamo considerare soltanto il coinvolgimento del soluto ma anche la possibile ossidazione o riduzione dell’acqua. Esaminiamo, per esempio, quello che avviene durante l’elettrolisi di una soluzione di solfato di potassio Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE LE REAZIONI DI ELETTROLISI IN SOLUZIONE ACQUOSA POSSONO COINVOLGERE L’ACQUA ► I prodotti sono idrogeno e ossigeno. Al catodo, viene ridotta l’acqua e non lo ione K+. All’anodo, viene ossidata l’acqua e non lo ione solfato. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE LE REAZIONI DI ELETTROLISI IN SOLUZIONE ACQUOSA POSSONO COINVOLGERE L’ACQUA ► Il viraggio di un eventuale indicatore acido-base presente in soluzione conferma che questa è basica vicino al catodo, dove si forma OH -, ed è acida vicino all’anodo, dove si forma H+. Inoltre, H 2 e O 2 gassosi possono essere raccolti separatamente. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE LE REAZIONI DI ELETTROLISI IN SOLUZIONE ACQUOSA POSSONO COINVOLGERE L’ACQUA ► La reazione di cella complessiva per l’elettrolisi del solfato di potassio si può ottenere con il metodo illustrato in precedenza, e risulta essere: Copyright © 2008 Zanichelli editore A questo punto potreste chiedervi se il solfato di potassio ha qualche funzione, visto che né gli ioni K+ né gli ioni SO 42 - si trasformano nel corso della reazione. La funzione di K 2 SO 4 (o di qualsiasi altro elettrolita) è quella di mantenere la neutralità elettrica in prossimità degli elettrodi. Se K 2 SO 4 non fosse presente mentre avviene l’elettrolisi, la soluzione intorno all’anodo si arricchirebbe di ioni H+. Analogamente, la soluzione intorno al catodo si arricchirebbe di ioni OH -.

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE I POTENZIALI DI RIDUZIONE CONSENTONO DI PREVEDERE I PRODOTTI DI UN’ELETTROLISI ► Vediamo come si possono utilizzare i potenziali di riduzione per prevedere i prodotti di un’elettrolisi. Immaginiamo di voler condurre l’elettrolisi di una soluzione acquosa di bromuro di rame(II), Cu. Br 2. Quali prodotti ci attendiamo? Per rispondere a questa domanda, dobbiamo esaminare le possibili semireazioni agli elettrodi e i loro rispettivi potenziali di riduzione. Copyright © 2008 Zanichelli editore

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE I POTENZIALI DI RIDUZIONE CONSENTONO DI PREVEDERE I PRODOTTI DI UN’ELETTROLISI ► Al catodo, le due reazioni possibili sono la riduzione degli ioni rame e la riduzione dell’acqua: Copyright © 2008 Zanichelli editore Il valore molto più elevato del potenziale di Cu 2+ ci consente di prevedere la riduzione di questo ione al catodo.

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE I POTENZIALI DI RIDUZIONE CONSENTONO DI PREVEDERE I PRODOTTI DI UN’ELETTROLISI ► All’anodo, le reazioni possibili sono l’ossidazione di Br - e l’ossidazione dell’acqua: Copyright © 2008 Zanichelli editore dati indicano che O 2 si riduce più facilmente di Br 2, quindi Br- si ossida più facilmente di H 2 O.

19. 5 L’ELETTROLISI UTILIZZA ENERGIA ELETTRICA PER FARE AVVENIRE REAZIONI CHIMICHE I POTENZIALI DI RIDUZIONE CONSENTONO DI PREVEDERE I PRODOTTI DI UN’ELETTROLISI ► All’anodo ci attendiamo così l’ossidazione di Br-. Le reazioni sono: Riassumendo, in una cella elettrolitica: Copyright © 2008 Zanichelli editore al catodo avverrà la semireazione con il potenziale di riduzione maggiore mentre all’anodo avverrà, in senso inverso, la semireazione con il potenziale di riduzione minore.

19. 6 UN SALE INDISCIOLTO È IN EQUILIBRIO CON LA SOLUZIONE CHE LO CIRCONDA Lo scienziato inglese Michael Faraday fu il primo a condurre ricerche in elettrochimica; a lui dobbiamo i termini anodo, catodo, elettrolita ed elettrolisi. Intorno al 1833, Faraday scoprì che la quantità di sostanza trasformata durante l’elettrolisi è direttamente proporzionale alla quantità di elettricità che attraversa la cella elettrolitica. Per esempio, la riduzione dello ione rame al catodo è data dalla seguente equazione: Copyright © 2008 Zanichelli editore L’equazione ci dice che il deposito di 1 mol di rame metallico richiede 2 mol di elettroni. Quindi, se desideriamo depositare 2 mol di rame abbiamo bisogno di 4 mol di elettroni, che rappresentano una quantità doppia di elettricità. Ma come misurare la quantità di elettricità che passa in una cella elettrolitica?

19. 6 UN SALE INDISCIOLTO È IN EQUILIBRIO CON LA SOLUZIONE CHE LO CIRCONDA L’unità SI della corrente elettrica è l’ampere (A) mentre quella della carica elettrica è il coulomb (C). Un coulomb corrisponde alla quantità di carica che passa in un dato punto di un filo quando una corrente elettrica di un ampere lo attraversa per un secondo. Ciò significa che: Per esempio, se una corrente di 4 A attraversa un filo per 10 s, in ogni punto del filo passano 40 C: Copyright © 2008 Zanichelli editore

19. 6 UN SALE INDISCIOLTO È IN EQUILIBRIO CON LA SOLUZIONE CHE LO CIRCONDA Si è determinato sperimentalmente che 1 mol di elettroni porta una carica di 9, 65 x 104 C; questa quantità è stata chiamata costante di Faraday, F. Possiamo adesso mettere in relazione fra loro le misure ottenute in laboratorio con la quantità di sostanza trasformata durante un’elettrolisi. Misurando la corrente in ampere e il tempo in secondi possiamo calcolare la carica, in coulomb, che ha attraversato il sistema; da questa possiamo ottenere la quantità di elettroni (in moli) che ci consente, infine, di calcolare la quantità di sostanza prodotta. Copyright © 2008 Zanichelli editore