CAPITOLO La velocit delle reazioni chimiche 16 Indice










- Slides: 18

CAPITOLO La velocità delle reazioni chimiche 16 Indice 1. La velocità delle reazioni chimiche 2. Espressione della velocità di reazione 3. Teoria delle collisioni 4. Teoria dello stato di transizione (o del complesso attivato) 5. Fattori che influenzano la velocità di reazione 6. Legge della velocità di reazione 7. Cinetica e meccanismo di reazione Mappa concettuale: La velocità delle reazioni chimiche © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

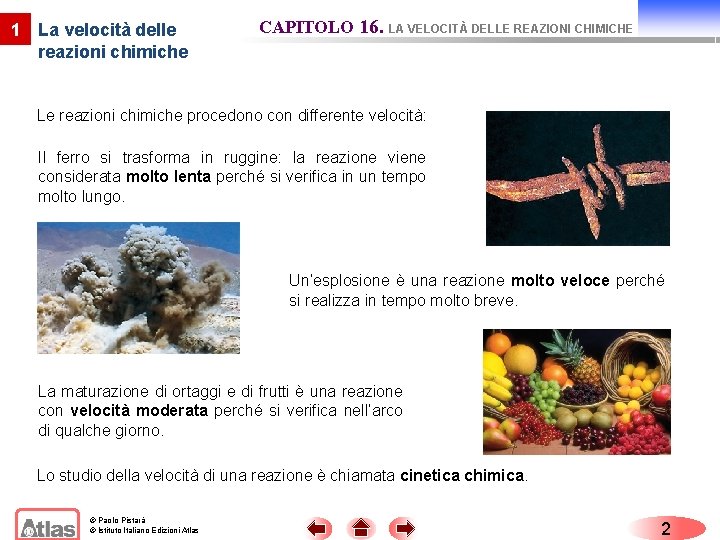
1 La velocità delle reazioni chimiche CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE Le reazioni chimiche procedono con differente velocità: Il ferro si trasforma in ruggine: la reazione viene considerata molto lenta perché si verifica in un tempo molto lungo. Un’esplosione è una reazione molto veloce perché si realizza in tempo molto breve. La maturazione di ortaggi e di frutti è una reazione con velocità moderata perché si verifica nell’arco di qualche giorno. Lo studio della velocità di una reazione è chiamata cinetica chimica. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

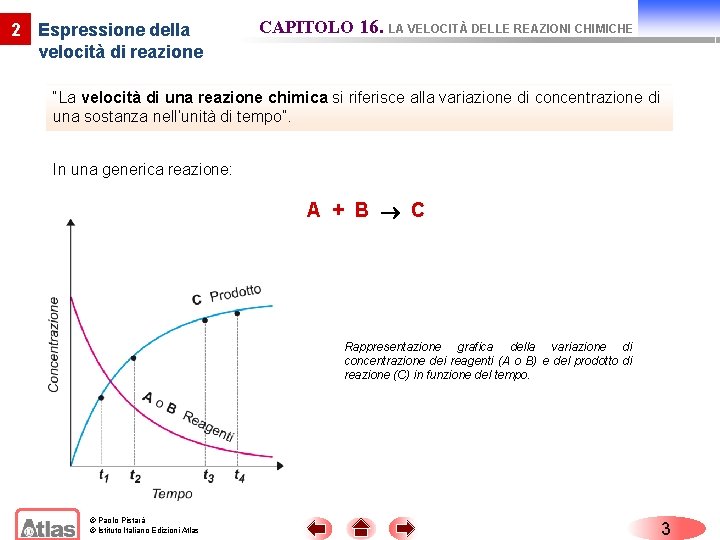
2 Espressione della velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE “La velocità di una reazione chimica si riferisce alla variazione di concentrazione di una sostanza nell’unità di tempo”. In una generica reazione: A + B C Rappresentazione grafica della variazione di concentrazione dei reagenti (A o B) e del prodotto di reazione (C) in funzione del tempo. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

2 Espressione della velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE la concentrazione del reagente A, messa in parentesi ed espressa in mol/L, diminuisce mano che cresce il tempo dall’inizio della reazione, mentre la concentrazione del prodotto C aumenta. A 2 A 1 A velocità media di reazione = − t 2 t 1 t © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

3 Teoria delle collisioni CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE Perché una reazione chimica tra sostanze possa avvenire, le particelle (molecole, atomi, ioni) devono collidere: è questa l’idea su cui poggia la teoria delle collisioni. Le collisioni, inoltre, devono essere efficaci, cioè con una energia cinetica uguale o superiore ad un valore Ea, chiamata energia di attivazione. Le collisioni delle molecole dei reagenti sono efficaci: la reazione tra H 2 e O 2 porta alla formazione di H 2 O. Le collisioni sono inefficaci: le molecole rimbalzano inalterate. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

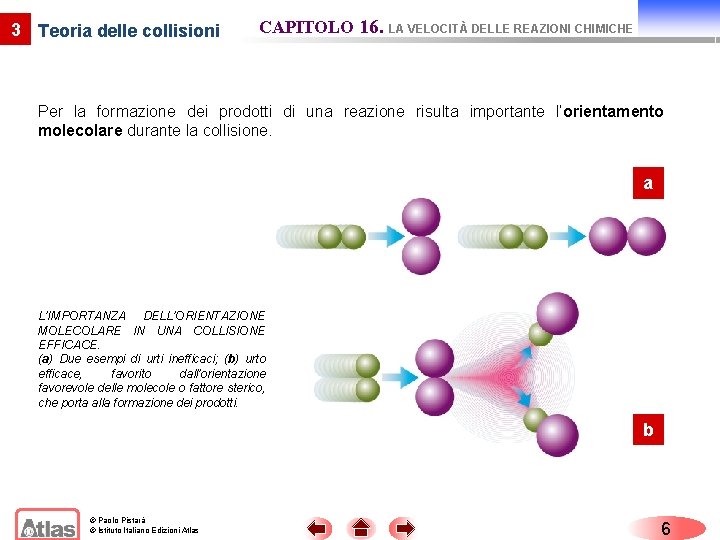
3 Teoria delle collisioni CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE Per la formazione dei prodotti di una reazione risulta importante l’orientamento molecolare durante la collisione. a L’IMPORTANZA DELL’ORIENTAZIONE MOLECOLARE IN UNA COLLISIONE EFFICACE. (a) Due esempi di urti inefficaci; (b) urto efficace, favorito dall’orientazione favorevole delle molecole o fattore sterico, che porta alla formazione dei prodotti. b © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

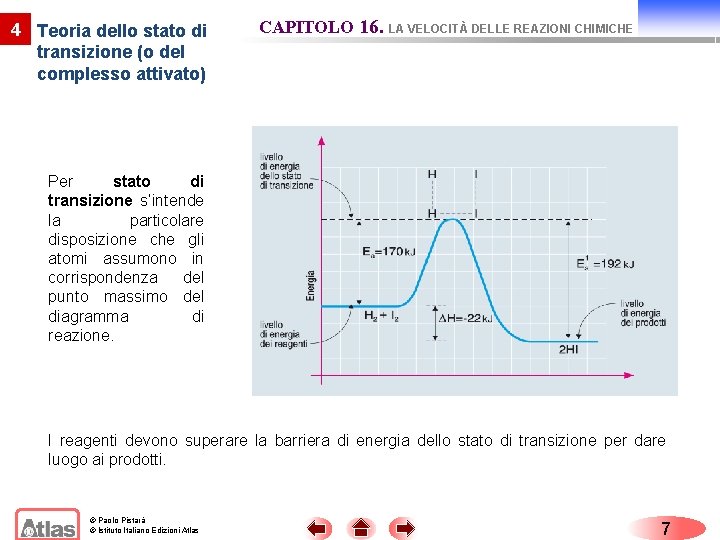
4 Teoria dello stato di transizione (o del complesso attivato) CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE Per stato di transizione s’intende la particolare disposizione che gli atomi assumono in corrispondenza del punto massimo del diagramma di reazione. I reagenti devono superare la barriera di energia dello stato di transizione per dare luogo ai prodotti. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

4 Teoria dello stato di transizione (o del complesso attivato) CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE La differenza tra l’energia dello stato di transizione e l’energia dei reagenti prende il nome di energia di attivazione (Ea). Solo le molecole dei reagenti, con energia uguale o superiore a Ea, possono superare la barriera di energia dello stato di transizione e dare luogo ai prodotti. Pertanto “più è bassa l’energia di attivazione, maggiore è il numero delle molecole che possono superare la barriera di energia, e quindi più veloce è la reazione”. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 8

5 Fattori che influenzano la velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE a. Natura delle sostanze reagenti Ciascuna reazione chimica presenta una sua caratteristica velocità che dipende dalla natura dei reagenti. H 2(g) + F 2(g) 2 HF(g) H 2(g) + Cl 2(g) 2 HCl(g) veloce lenta Il legame in F 2 si rompe più facilmente che in Cl 2. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

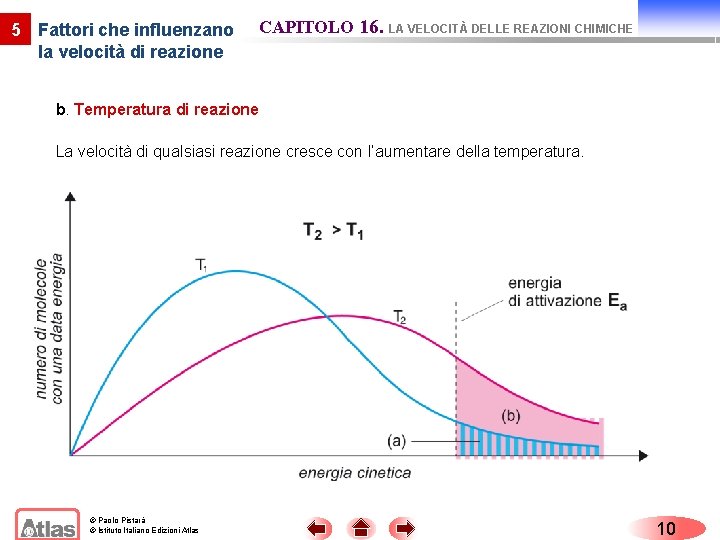
5 Fattori che influenzano la velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE b. Temperatura di reazione La velocità di qualsiasi reazione cresce con l’aumentare della temperatura. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10

5 Fattori che influenzano la velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE c. Concentrazione dei reagenti Ad un aumento della concentrazione delle sostanze reagenti corrisponde sempre un aumento della velocità di reazione perché cresce il numero delle collisioni. Dipendenza del numero di collisioni dalle concentrazioni dei reagenti. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 11

5 Fattori che influenzano la velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE d. Superficie di contatto A parità di massa, se la superficie di contatto è maggiore si ha sempre un aumento della velocità di reazione. Se un solido di 1 cm 3 viene diviso a metà, si vengono a creare due nuove superfici, per cui cresce la superficie di contatto. Continuando la divisione, la superficie di contatto diventa sempre maggiore. © Paolo Pistarà © Istituto Italiano Edizioni Atlas La limatura di ferro reagisce con acido cloridrico più velocemente di una lamina di ferro. Ciò è evidenziato da un maggior sviluppo di idrogeno. 12

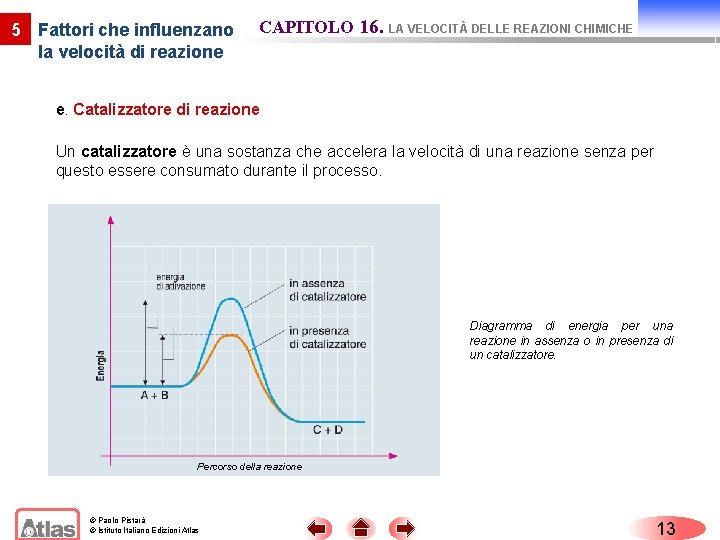
5 Fattori che influenzano la velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE e. Catalizzatore di reazione Un catalizzatore è una sostanza che accelera la velocità di una reazione senza per questo essere consumato durante il processo. Diagramma di energia per una reazione in assenza o in presenza di un catalizzatore. Percorso della reazione © Paolo Pistarà © Istituto Italiano Edizioni Atlas 13

5 Fattori che influenzano la velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE u Enzimi Negli organismi viventi la maggior parte delle reazioni chimiche viene catalizzata da enzimi, proteine caratterizzate da elevata specificità nella loro azione catalitica. u Radiazioni Alcune radiazioni, come quella solare o quella emessa da un filamento incandescente, presentano proprietà catalitiche, ad esempio nella fotosintesi clorofilliana. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 14

6 Legge della velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE La legge della velocità di reazione si può così esprimere: “La velocità di una reazione è proporzionale al prodotto delle concentrazioni dei reagenti, elevate ciascuna ad un esponente ricavato sperimentalmente”: v = k A m B n dove: v velocità k costante di velocità A e B concentrazione dei reagenti m, l’esponente della concentrazione A, è detto ordine di reazione rispetto ad A n, l’esponente della concentrazione B, è detto ordine di reazione rispetto a B La somma degli esponenti corrisponde all’ordine totale della reazione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 15

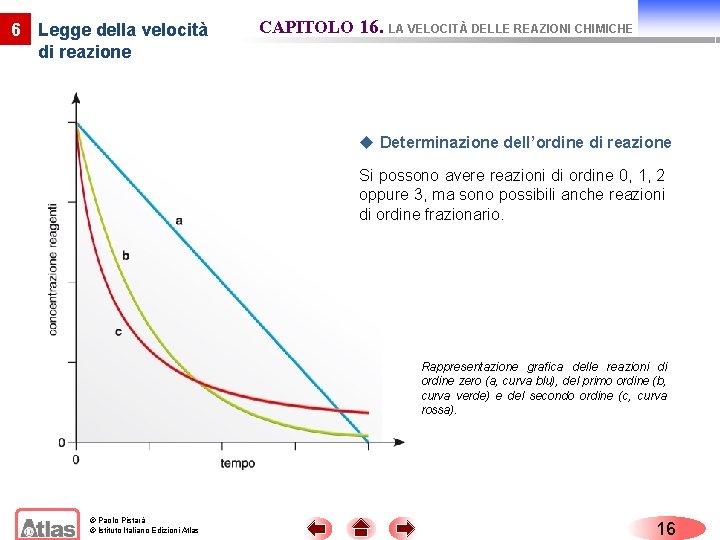
6 Legge della velocità di reazione CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE u Determinazione dell’ordine di reazione Si possono avere reazioni di ordine 0, 1, 2 oppure 3, ma sono possibili anche reazioni di ordine frazionario. Rappresentazione grafica delle reazioni di ordine zero (a, curva blu), del primo ordine (b, curva verde) e del secondo ordine (c, curva rossa). © Paolo Pistarà © Istituto Italiano Edizioni Atlas 16

7 Cinetica e meccanismo di CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE reazione L’insieme dei passaggi attraverso i quali i reagenti si trasformano nei prodotti prende il nome di meccanismo di reazione. In una reazione è lo stadio lento che determina la velocità del processo globale. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 17

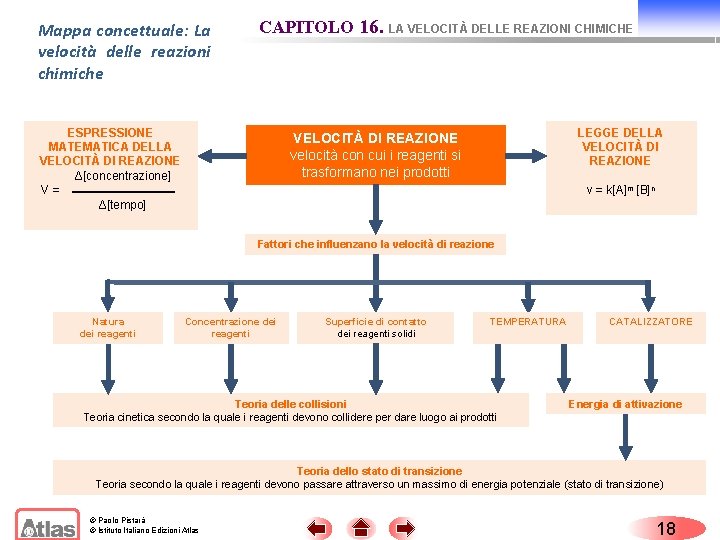
Mappa concettuale: La velocità delle reazioni chimiche CAPITOLO 16. LA VELOCITÀ DELLE REAZIONI CHIMICHE ESPRESSIONE MATEMATICA DELLA VELOCITÀ DI REAZIONE Δ[concentrazione] V = Δ[tempo] LEGGE DELLA VELOCITÀ DI REAZIONE velocità con cui i reagenti si trasformano nei prodotti v = k[A]m [B]n Fattori che influenzano la velocità di reazione Natura dei reagenti Concentrazione dei reagenti Superficie di contatto dei reagenti solidi TEMPERATURA Teoria delle collisioni Teoria cinetica secondo la quale i reagenti devono collidere per dare luogo ai prodotti CATALIZZATORE Energia di attivazione Teoria dello stato di transizione Teoria secondo la quale i reagenti devono passare attraverso un massimo di energia potenziale (stato di transizione) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 18