Vito Posca Tiziana Fiorani Chimica pi verde Capitolo













































- Slides: 49


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 14 Le reazioni chimiche e l’energia

Sommario 1. Esistono diversi tipi di reazioni chimiche 2. La stechiometria definisce gli aspetti quantitativi delle reazioni 3. Come si stabilisce il rapporto in moli tra i reagenti e i prodotti 4. Il reagente limitante in una reazione determina la quantità di prodotto 5. La resa di una reazione è la quantità di prodotto che si forma 6. Durante le reazioni chimiche l’energia si trasforma Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 7. Le reazioni possono essere esotermiche oppure endotermiche 1. L’energia interna di un sistema è una funzione di stato 2. L’entalpia definisce l’energia totale di un sistema 3. L’entropia definisce il grado di disordine di un sistema 4. La spontaneità di una reazione è definita dalla variazione di energia libera Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

Esistono diversi tipi di reazioni chimiche In base al tipo di processo che si verifica tra le sostanze reagenti, le reazioni chimiche si distinguono in: sintesi o combinazione, decomposizione, scambio semplice e doppio scambio. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

Esistono diversi tipi di reazioni chimiche Le reazioni di sintesi o combinazione sono reazioni in cui due elementi (A e B) o composti (AB e BC) si combinano per formare un composto binario (AB) o ternario (ABC): Sono di sintesi le reazioni: 1. tra metallo o non metallo e ossigeno per formare ossidi basici o acidi; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

Esistono diversi tipi di reazioni chimiche 2. tra metallo (alcalino, alcalino-terroso) o non metallo e idrogeno per formare idruri ionici o covalenti e idracidi; 3. tra metallo e non metallo per formare sali di idracidi; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

Esistono diversi tipi di reazioni chimiche 4. tra ossido basico (generalmente di metalli alcalini o alcalino-terrosi) o ossido acido e acqua, per formare un idrossido o un ossiacido; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

Esistono diversi tipi di reazioni chimiche Le reazioni di decomposizione sono reazioni in cui un composto binario (AB) o ternario (ABC) si suddivide rispettivamente in due elementi (A e B) o in due composti binari (AB e BC) fornendo energia termica: Sono reazioni di decomposizione: 1. decomposizione di un ossido basico in metallo e ossigeno; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Esistono diversi tipi di reazioni chimiche 2. decomposizione di un idrossido (tranne quelli di metalli alcalini) in ossido basico e acqua; 3. decomposizione di un clorato in cloruro e ossigeno; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

Esistono diversi tipi di reazioni chimiche 4. decomposizione di un carbonato in ossido basico e diossido di carbonio; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Esistono diversi tipi di reazioni chimiche Le reazioni di scambio semplice o spostamento sono reazioni in cui un metallo A sposta un elemento meno reattivo B (metallo o idrogeno) di un composto BC (acqua, acido): Possono verificarsi solo quando A è più reattivo di B, secondo la serie di reattività dei metalli (e dell’idrogeno): Nella serie di reattività un metallo sposta da un composto tutti gli elementi che lo seguono. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

Esistono diversi tipi di reazioni chimiche Sono di spostamento le reazioni: 1. tra metallo (alcalino o alcalino-terroso) e acqua per formare idrossido e idrogeno; 2. tra metallo e acido (idracido o ossiacido) per formare un sale e idrogeno; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

Esistono diversi tipi di reazioni chimiche Le reazioni di doppio scambio sono reazioni in cui due composti AB e CD (acido, base, sale) si scambiano i loro costituenti (ioni monoatomici o poliatomici) per formare altri due composti AD e CB: Avvengono in soluzione acquosa. Uno dei prodotti che si ottiene si allontana dal sistema di reazione sotto forma di un gas o di un composto insolubile (base o sale) che precipita (reazioni di precipitazione) o di acqua (reazioni acido-base). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

Esistono diversi tipi di reazioni chimiche Sono di doppio scambio le reazioni: 1. tra un sale (carbonato) e un acido con formazione di un sale, un gas (diossido di carbonio) e acqua; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

Esistono diversi tipi di reazioni chimiche 2. tra un sale e un acido con formazione di un sale insolubile e di un acido; 3. tra due sali solubili con formazione di due sali, uno dei quali insolubile; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

Esistono diversi tipi di reazioni chimiche 4. tra un sale e una base con formazione di un sale e di una base insolubile; 5. tra acido e base con formazione di un sale e acqua; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

La stechiometria definisce gli aspetti quantitativi delle reazioni I coefficienti stechiometrici presenti in un’equazione chimica bilanciata indicano il rapporto quantitativo tra reagenti e prodotti. Nella reazione tra zinco e acido cloridrico: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

La stechiometria definisce gli aspetti quantitativi delle reazioni Le relazioni quantitative che si stabiliscono tra reagenti e prodotti di una reazione chimica sono definite dalla stechiometria, che consente di: definire i rapporti (in grammi o moli) tra reagenti o tra reagenti e prodotti; identificare il reagente che si consuma completamente (reagente limitante); prevedere la quantità di un prodotto (resa). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

Come si stabilisce il rapporto in moli tra i reagenti e i prodotti Per definire il rapporto con cui i reagenti si combinano o tra reagenti e prodotti occorre: • rappresentare e bilanciare l’equazione chimica; • trasformare in moli le masse in grammi delle sostanze coinvolte nella reazione chimica; • confrontare il numero delle moli dei reagenti con quello dei prodotti; • trasformare le moli delle sostanze in grammi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Il reagente limitante in una reazione determina la quantità di prodotti Dalla reazione di sintesi tra fosforo e cloro risulta: Se ci sono 3 moli di P e 3 moli di Cl 2, solo 2 moli di P possono reagire. Al termine rimane 1 mole di P. Il reagente che si consuma completamente è il reagente limitante (Cl 2); il reagente che si consuma solo in parte è il reagente in eccesso (P). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

La resa di una reazione è la quantità di prodotto che si forma La quantità di prodotto che si dovrebbe ottenere da un reagente in base alla stechiometria della reazione si chiama resa teorica (Rt). In effetti, la quantità di prodotto che si forma è sempre inferiore a quella prevista. Il motivo principale è il verificarsi di una reazione secondaria che porta alla formazione di un sottoprodotto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

La resa di una reazione è la quantità di prodotto che si forma La quantità di prodotto che si ottiene sperimentalmente in una reazione chimica è la resa reale (Rr). La resa reale è minore della resa teorica. La resa percentuale di un prodotto è il rapporto, in percentuale, tra la quantità di prodotto ottenuta (resa reale) e quella definita dalla stechiometria (resa teorica). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

✓� Mettiamoci alla prova Elenca un esempio per ciascun tipo di reazione chimica: sintesi, decomposizione, scambio semplice e doppio scambio. La resa reale di una reazione chimica è maggiore o minore della resa teorica? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

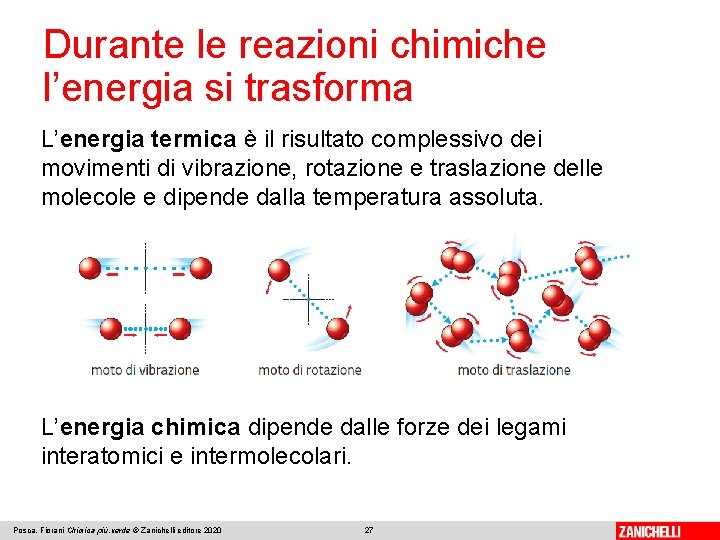
Durante le reazioni chimiche l’energia si trasforma Una reazione chimica è un processo in cui avviene una trasformazione di materia, ma anche una trasformazione di energia. L’energia in un sistema di molecole si presenta sotto forma di energia termica ed energia chimica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

Durante le reazioni chimiche l’energia si trasforma L’energia termica è il risultato complessivo dei movimenti di vibrazione, rotazione e traslazione delle molecole e dipende dalla temperatura assoluta. L’energia chimica dipende dalle forze dei legami interatomici e intermolecolari. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

Durante le reazioni chimiche l’energia si trasforma Le trasformazioni di energia consistono in scambi di energia tra sistema e ambiente. Un sistema termodinamico, o sistema, è l’insieme delle sostanze che partecipano a una reazione chimica. L’ambiente è lo spazio che circonda un sistema. La superficie del becher, nell’esempio, è il confine attraverso cui sistema e ambiente scambiano energia come calore e lavoro. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

Le reazioni possono essere esotermiche oppure endotermiche Si chiama calore di reazione (Q) la quantità di calore che una reazione chimica libera nell’ambiente o assorbe dall’ambiente. Viene espresso in kilojoule (k. J). Lo sviluppo e l’assorbimento di calore è il risultato di scambi che si verificano tra l’energia termica e l’energia chimica del sistema. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

Le reazioni possono essere esotermiche oppure endotermiche Se i prodotti hanno minore quantità di energia chimica dei reagenti, l’energia chimica eccedente si trasforma in energia termica, ceduta dal sistema come calore: la reazione è esotermica. Reazioni esotermiche sono le reazioni di combustione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

Le reazioni possono essere esotermiche oppure endotermiche Se i prodotti hanno maggiore quantità di energia chimica dei reagenti, l’energia termica eccedente si trasforma in energia chimica. Il sistema assorbe energia termica dall’ambiente come calore: la reazione è endotermica. Reazioni endotermiche sono le reazioni di decomposizione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

Le reazioni possono essere esotermiche oppure endotermiche Le reazioni di combustione si verificano tra un combustibile (di solito un composto organico) e un comburente (di solito O 2). Sono fortemente esotermiche e liberano una elevata quantità di calore. In eccesso di O 2: Tra i combustibili organici: metano CH 4, etano C 2 H 6, etanolo C 2 H 5 OH, glucosio C 6 H 12 O 6. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

L’energia interna di un sistema è una funzione di stato La somma dell’energia termica e dell’energia chimica posseduta da un sistema di molecole si chiama energia interna, ed è una grandezza estensiva. Durante una reazione, il valore dell’energia chimica dei reagenti è diversa da quella dei prodotti: si ha una variazione di energia interna (ΔU). Una grandezza la cui variazione dipende solo dallo stato iniziale e dallo stato finale del sistema e non dagli stati intermedi attraverso i quali il sistema procede si chiama funzione di stato. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

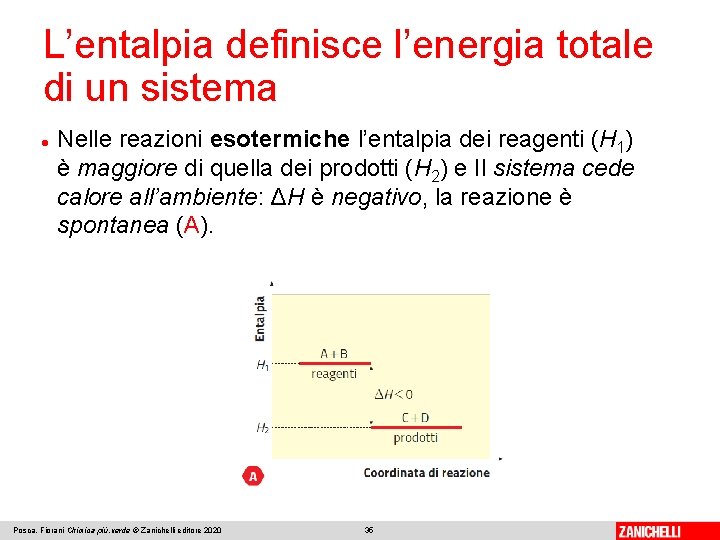
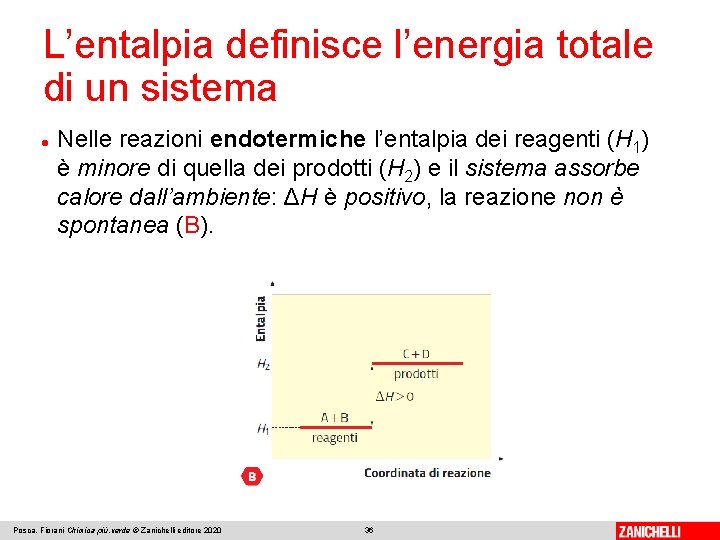
L’entalpia definisce l’energia totale di un sistema L’entalpia (H) di un sistema rappresenta l’energia totale di cui il sistema dispone e corrisponde alla somma della sua energia interna e del lavoro che esso compie sull’ambiente. L’entalpia è una funzione di stato: la variazione di entalpia (ΔH) è la variazione tra stato iniziale e finale del sistema. In una reazione, l’entalpia dello stato finale è quella dei prodotti (H 2), l’entalpia dello stato iniziale è quella dei reagenti (H 1): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34

L’entalpia definisce l’energia totale di un sistema Nelle reazioni esotermiche l’entalpia dei reagenti (H 1) è maggiore di quella dei prodotti (H 2) e Il sistema cede calore all’ambiente: ΔH è negativo, la reazione è spontanea (A). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 35

L’entalpia definisce l’energia totale di un sistema Nelle reazioni endotermiche l’entalpia dei reagenti (H 1) è minore di quella dei prodotti (H 2) e il sistema assorbe calore dall’ambiente: ΔH è positivo, la reazione non è spontanea (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 36

L’entropia definisce il grado di disordine di un sistema L’esotermicità, ovvero la diminuzione di entalpia, non è l’unico criterio per prevedere la spontaneità di una reazione. Esistono infatti reazioni esotermiche non spontanee e reazioni endotermiche spontanee. Un esempio è la reazione di dissociazione ionica di KCl: Tale processo è endotermico (ΔH > 0), ma spontaneo. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 37

L’entropia definisce il grado di disordine di un sistema La spontaneità è dovuta alla diversa disposizione degli ioni nel solido e in soluzione. Nel solido sono disposti in modo ordinato, in soluzione hanno invece elevata libertà di movimento e generare un maggior disordine. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 38

L’entropia definisce il grado di disordine di un sistema Si chiama entropia (S) la funzione di stato termodinamica che misura il grado di disordine di un sistema. In una trasformazione fisica ΔS è definita dallo stato fisico iniziale e finale. La trasformazione è spontanea se lo stato fisico finale ha un’entropia maggiore. I processi fisici che portano a un aumento di entropia sono: passaggi di stato (fusione, vaporizzazione, sublimazione); riscaldamento di un solido, di un liquido o di un gas. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 39

L’entropia definisce il grado di disordine di un sistema In una reazione chimica i processi chimici che portano a un aumento di entropia sono: • reazioni di dissociazione ionica di un solido in acqua; • reazioni chimiche in cui aumenta il numero delle moli nella trasformazione dei reagenti in prodotti. La dissociazione ionica porta a una soluzione, sistema con disordine più elevato di soluto e solvente. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 40

L’entropia definisce il grado di disordine di un sistema In una reazione chimica, la variazione di entropia è definita da: stato fisico finale (entropia prodotti S ) e stato fisico 2 iniziale (entropia reagenti S 1); stechiometria di reazione, moli di reagenti e prodotti. La variazione ΔS è data dalla relazione: Se l’entropia dei prodotti è maggiore dell’entropia dei reagenti, ΔS è positivo e il disordine del sistema aumenta: la trasformazione è spontanea. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 41

L’entropia definisce il grado di disordine di un sistema Nella reazione di sintesi di NH 3 (esotermica), ΔS < 0: la reazione avviene con diminuzione del numero di moli (A). Nella reazione di decomposizione di N 2 O 4 (endotermica), ΔS > 0: il numero delle moli dei prodotti è maggiore di quello dei reagenti (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 42

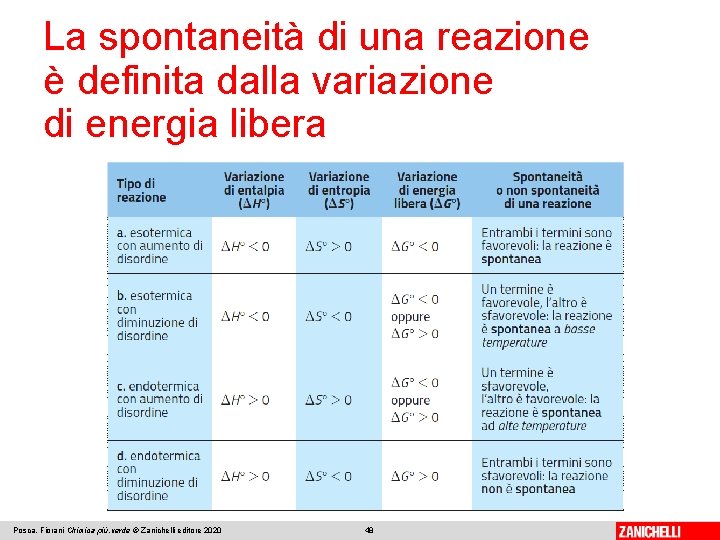
La spontaneità di una reazione è definita dalla variazione di energia libera L’energia libera di Gibbs (G) è una funzione di stato termodinamica, legata all’entalpia H, all’entropia S e alla temperatura assoluta T di un sistema: Si può definire solo la variazione di energia libera (ΔG). In condizioni standard la variazione di energia libera standard (ΔG °, espressa in k. J) si rappresenta: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 43

La spontaneità di una reazione è definita dalla variazione di energia libera A temperatura e pressione costanti, reazione spontanea: ΔG° < 0 Reazioni con ΔH° < 0 e ΔS° > 0 Se la reazione è esotermica (ΔH° < 0) e accompagnata da aumento del disordine (ΔS° > 0), entrambi i fattori favoriscono la spontaneità. Esempio: reazioni di combustione degli idrocarburi Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 44

La spontaneità di una reazione è definita dalla variazione di energia libera Reazioni con ΔH° e ΔS° con stesso segno Con i due fattori in opposizione, la spontaneità della reazione è determinata dalla temperatura. Se la reazione è esotermica (ΔH° < 0) e accompagnata da un aumento di ordine (ΔS° < 0), solo a basse temperature ΔG° è negativo. Esempio: reazione di sintesi dell’ammoniaca Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 45

La spontaneità di una reazione è definita dalla variazione di energia libera Se la reazione è endotermica (ΔH° > 0) e accompagnata da un aumento di disordine (ΔS° > 0), solo ad alte temperature ΔG° è negativo. Esempio: reazione di decomposizione termica del carbonato di calcio Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 46

La spontaneità di una reazione è definita dalla variazione di energia libera Reazioni con ΔH° > 0 e ΔS° < 0 Se la reazione è endotermica (ΔH° > 0) e accompagnata da un aumento di ordine (ΔS° < 0), entrambi i fattori sono sfavorevoli e quindi ΔG ° > 0. Una reazione di questo tipo è non spontanea. Esempio: reazione di sintesi dell’ozono Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 47

La spontaneità di una reazione è definita dalla variazione di energia libera Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 48

✓� Mettiamoci alla prova Quali sono i prodotti di una reazione di combustione? La variazione di entropia in una reazione chimica dipende da due fattori. Quali? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 49