Vito Posca Tiziana Fiorani Chimica pi verde Capitolo



























- Slides: 36


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 13 Le soluzioni

Sommario 1. Le soluzioni sono sistemi omogenei 2. La solubilizzazione di un soluto in un solvente dipende dalla loro polarità o apolarità 3. La solubilità dei solidi in acqua dipende dalla temperatura 4. La solubilità dei liquidi in acqua dalla loro polarità o apolarità 5. La solubilità dei gas in acqua dipende dalla pressione e dalla temperatura 6. La concentrazione di un soluto in una soluzione 7. Come diluire le soluzioni concentrate Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 8. Le proprietà colligative dipendono dal numero di ioni di soluto in soluzione 9. La tensione di vapore di una soluzione è minore di quella del solvente 10. La temperatura di ebollizione di una soluzione è maggiore di quella del solvente 11. La temperatura di congelamento di una soluzione è minore di quella del solvente 12. La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

Le soluzioni sono sistemi omogenei Una soluzione è un sistema omogeneo costituito da due o più componenti: il più abbondante è il solvente, l’altro è il soluto. La formazione di una soluzione comporta la solubilizzazione di un soluto in un solvente. Le soluzioni si distinguono in gassose, liquide e solide Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

La solubilizzazione di un soluto in un solvente dipende dalla loro polarità o apolarità I soluti ionici sono composti polari, quindi solubili in solventi polari: si stabiliscono legami ione-dipolo. I soluti molecolari polari sono solubili in solventi polari: si stabiliscono legami a idrogeno o forze dipolari. I soluti molecolari apolari sono solubili in solventi apolari: si stabiliscono forze di London. In figura: lo iodio, solido apolare, non è solubile in acqua, solvente polare (A), ma è solubile in esano, solvente apolare (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

La solubilizzazione di un soluto in un solvente dipende dalla loro polarità o apolarità La solubilità (s) è la quantità massima di un soluto che a una data temperatura si scioglie in una determinata quantità di solvente. Una soluzione che a una data temperatura contiene: una quantità di soluto inferiore a s, si dice insatura; una quantità di soluto uguale a s, si dice satura. Un solido è solubile in un solvente se ha un valore alto di solubilità; è insolubile se il valore è molto piccolo. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

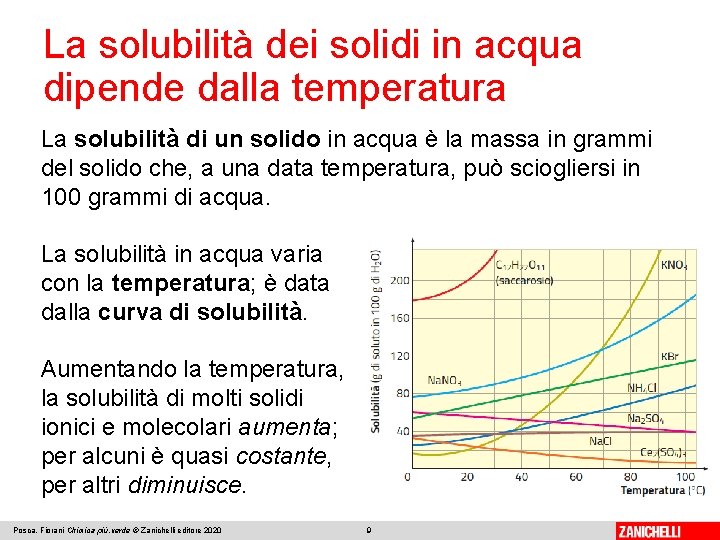
La solubilità dei solidi in acqua dipende dalla temperatura La solubilità di un solido in acqua è la massa in grammi del solido che, a una data temperatura, può sciogliersi in 100 grammi di acqua. La solubilità in acqua varia con la temperatura; è data dalla curva di solubilità. Aumentando la temperatura, la solubilità di molti solidi ionici e molecolari aumenta; per alcuni è quasi costante, per altri diminuisce. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

La solubilità dei solidi in acqua dipende dalla temperatura Se, a una data temperatura, aggiungiamo altro soluto a una soluzione satura, questo non si scioglie e si deposita come corpo di fondo. Una soluzione che contiene, a una data temperatura, una quantità di soluto superiore al valore di solubilità si chiama satura con corpo di fondo. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

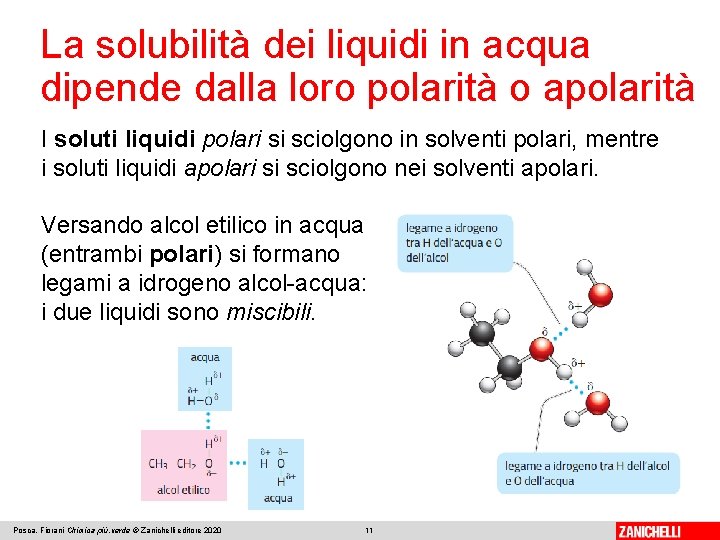
La solubilità dei liquidi in acqua dipende dalla loro polarità o apolarità I soluti liquidi polari si sciolgono in solventi polari, mentre i soluti liquidi apolari si sciolgono nei solventi apolari. Versando alcol etilico in acqua (entrambi polari) si formano legami a idrogeno alcol-acqua: i due liquidi sono miscibili. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

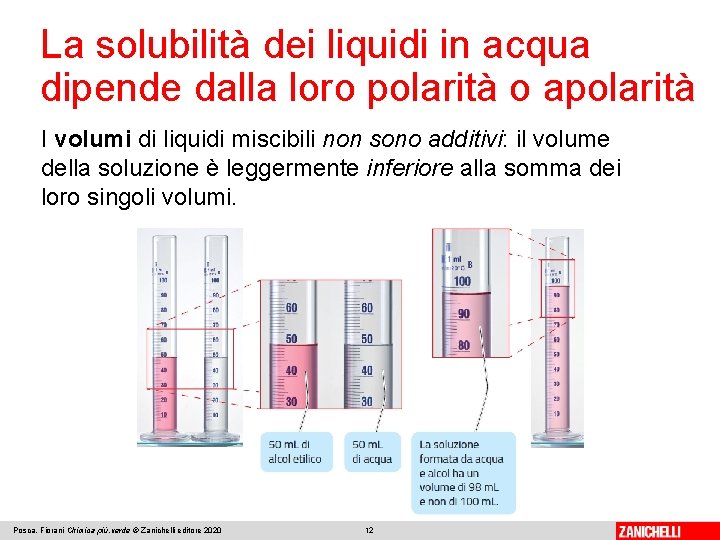
La solubilità dei liquidi in acqua dipende dalla loro polarità o apolarità I volumi di liquidi miscibili non sono additivi: il volume della soluzione è leggermente inferiore alla somma dei loro singoli volumi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

La solubilità dei gas in acqua dipende dalla pressione e dalla temperatura La solubilità di un gas in un liquido è la quantità in moli di gas che può sciogliersi in un litro di soluzione Dipende dalla pressione esercitata dal gas e dalla temperatura della soluzione; si esprime in moli/litro (mol/L). Valori di solubilità in acqua di alcuni gas a 25 °C e 1 atm: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

La solubilità dei gas in acqua dipende dalla pressione e dalla temperatura Consideriamo un gas disciolto in un liquido. Se aumentiamo la pressione si ha una riduzione del volume e un aumento della solubilità del gas. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

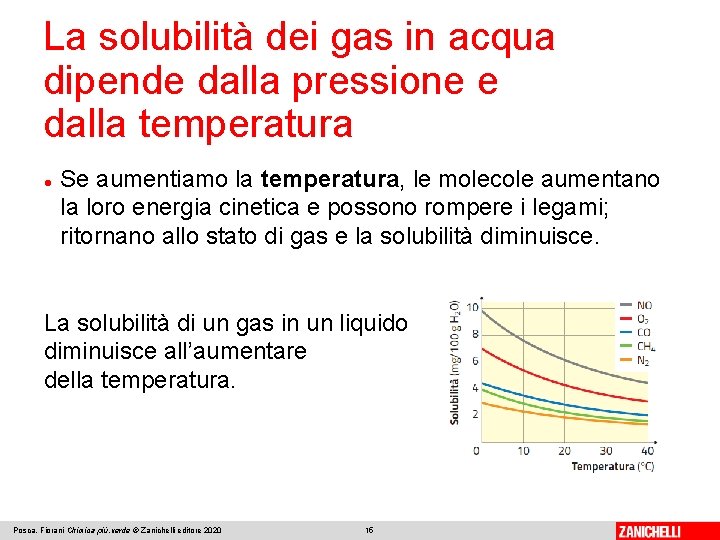
La solubilità dei gas in acqua dipende dalla pressione e dalla temperatura Se aumentiamo la temperatura, le molecole aumentano la loro energia cinetica e possono rompere i legami; ritornano allo stato di gas e la solubilità diminuisce. La solubilità di un gas in un liquido diminuisce all’aumentare della temperatura. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

La concentrazione di un soluto in una soluzione La concentrazione di una soluzione esprime la quantità di soluto contenuta in una determinata quantità di soluzione o di solvente. La concentrazione in parti per milione (Cppm) indica le parti (in massa o in volume) di soluto disciolto in un milione di parti di soluzione: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

La concentrazione di un soluto in una soluzione La concentrazione molare (M), o molarità, indica la quantità di soluto espressa in moli (n) presente in 1 L di soluzione e si esprime in moli/litro (mol/L): Si ricavano le relazioni inverse: Una soluzione 0, 2 M di cloruro di sodio si può indicare con la simbologia: [Na. Cl] = 0, 2 M Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

La concentrazione di un soluto in una soluzione La frazione molare (X) indica il rapporto tra la quantità in moli di un componente della soluzione e la somma delle quantità in moli di tutti i componenti della soluzione (soluto più solvente). Con n. A = moli del soluto e n. B = moli del solvente, la frazione molare del soluto XA e del solvente XB sono: La somma delle frazioni molari di tutti i componenti è uguale a uno: XA + XB = 1 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

La concentrazione di un soluto in una soluzione La molalità (m) indica la quantità in moli (n) di soluto presente in 1 kg di solvente e si esprime in moli/kilogrammo (mol/kg): Si ricavano le relazioni inverse: Una soluzione 1, 2 m di fluoruro di litio Li. F contiene 1, 2 mol di Li. F, ovvero 31, 2 g, in 1 kg di un solvente. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

Come diluire le soluzioni concentrate Per diluire una soluzione e ottenerne una con solubilità minore, se ne preleva un dato volume e si aggiunge solvente, fino a ottenere la concentrazione desiderata. Non varia la quantità in moli di soluto prelevata, ma varia solo il volume della soluzione, cioè la sua concentrazione. L’equazione per calcolare il volume o la concentrazione della soluzione diluita è: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

✓ Mettiamoci alla prova Secondo la curva di solubilità del nitrato di sodio Na. NO 3, come varia la sua solubilità all’aumentare della temperatura? Data una soluzione 0, 6 M, calcola il volume di soluzione che contiene 0, 8 mol di soluto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Le proprietà colligative dipendono dal numero di ioni di soluto in soluzione Le proprietà colligative di una soluzione sono proprietà fisiche dipendono solo dalla concentrazione del soluto e non dal tipo di soluto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

Le proprietà colligative dipendono dal numero di ioni di soluto in soluzione Se il soluto si divide in ioni, si moltiplica il numero di moli di soluto per il coefficiente di van’t Hoff (i), che corrisponde al numero di ioni derivati da una singola molecola o unità formula di soluto. Soluti che si dividono completamente in ioni sono i sali solubili, le basi dei metalli alcalini e alcalino-terrosi e alcuni acidi molto polari. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Le proprietà colligative dipendono dal numero di ioni di soluto in soluzione Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

La tensione di vapore di una soluzione è minore di quella del solvente Consideriamo un solvente volatile (A) e una soluzione dello stesso solvente con soluto non volatile (B) che non si dissocia in ioni. La tensione di vapore della soluzione (p) diminuisce all’aumentare della quantità di soluto. Nella soluzione è minore il numero di molecole di acqua che può evaporare. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

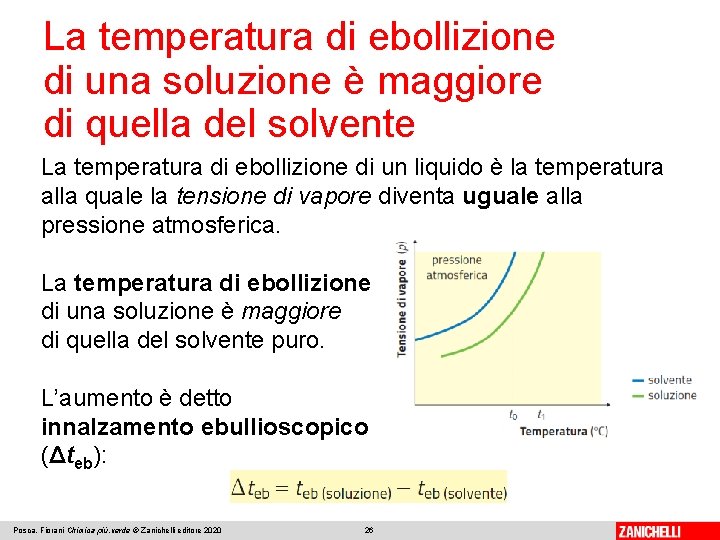
La temperatura di ebollizione di una soluzione è maggiore di quella del solvente La temperatura di ebollizione di un liquido è la temperatura alla quale la tensione di vapore diventa uguale alla pressione atmosferica. La temperatura di ebollizione di una soluzione è maggiore di quella del solvente puro. L’aumento è detto innalzamento ebullioscopico (Δteb): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

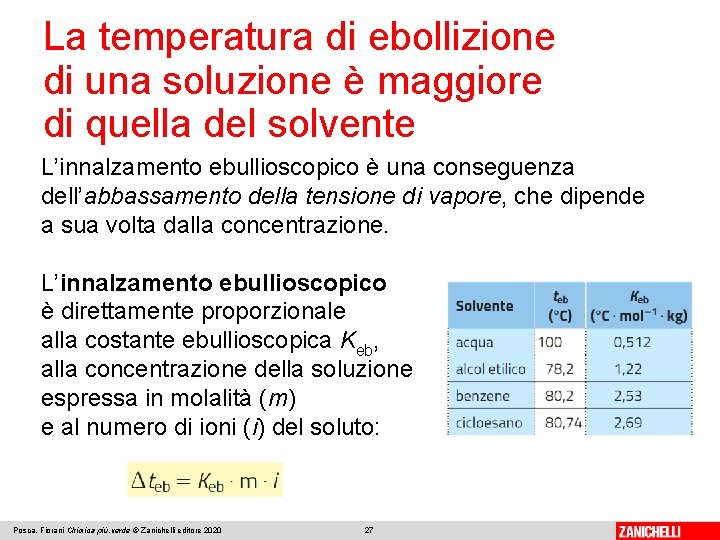
La temperatura di ebollizione di una soluzione è maggiore di quella del solvente L’innalzamento ebullioscopico è una conseguenza dell’abbassamento della tensione di vapore, che dipende a sua volta dalla concentrazione. L’innalzamento ebullioscopico è direttamente proporzionale alla costante ebullioscopica Keb, alla concentrazione della soluzione espressa in molalità (m) e al numero di ioni (i) del soluto: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

La temperatura di congelamento di una soluzione è minore di quella del solvente La temperatura di congelamento di un liquido è la temperatura alla quale diventa solido. In una soluzione gli ioni del soluto ostacolano la solidificazione. La temperatura di congelamento di una soluzione è quindi minore di quella del solvente puro. La diminuzione è detta abbassamento crioscopico (Δtcr): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

La temperatura di congelamento di una soluzione è minore di quella del solvente L’abbassamento crioscopico è direttamente proporzionale alla costante crioscopica Kcr, alla concentrazione della soluzione espressa in molalità (m) e al numero di ioni (i) del soluto: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

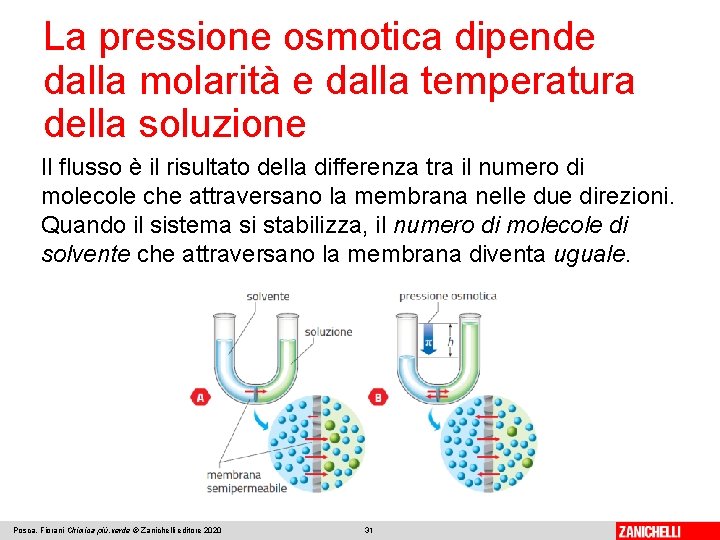
La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Consideriamo un solvente puro e una soluzione formata dallo stesso tipo di solvente separati da una membrana semipermeabile. Si chiama osmosi il flusso spontaneo delle molecole di solvente da un solvente puro a una soluzione, oppure da una soluzione più diluita a una più concentrata. La direzione dell’osmosi dipende solo dalla concentrazione delle soluzioni sui due lati della membrana e non dal tipo di soluto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Il flusso è il risultato della differenza tra il numero di molecole che attraversano la membrana nelle due direzioni. Quando il sistema si stabilizza, il numero di molecole di solvente che attraversano la membrana diventa uguale. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Tra solvente e soluzione si stabilisce un equilibrio che dipende dalla differenza di livello (h) tra soluzione e solvente. La differenza di livello esercita una pressione, detta pressione osmotica. La pressione osmotica (π) di una soluzione è la pressione che si deve esercitare per raggiungere l’equilibrio osmotico, cioè per fermare il flusso, attraverso una membrana semipermeabile, del solvente verso la soluzione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

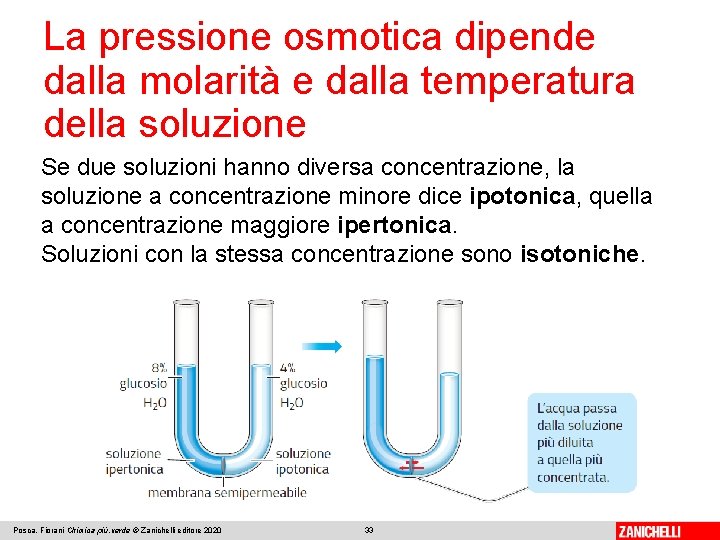
La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Se due soluzioni hanno diversa concentrazione, la soluzione a concentrazione minore dice ipotonica, quella a concentrazione maggiore ipertonica. Soluzioni con la stessa concentrazione sono isotoniche. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Tra la pressione osmotica di una soluzione e la concentrazione di un soluto vale una relazione, chiamata equazione di van’t Hoff: Il valore della pressione osmotica è dato da: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34

La pressione osmotica dipende dalla molarità e dalla temperatura della soluzione Poiché n/V = M (molarità), dalla relazione precedente si ottiene: La pressione osmotica dipende anche dalla temperatura: aumentando la temperatura della soluzione, anche la pressione osmotica aumenta. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 35

✓ Mettiamoci alla prova Rappresenta la dissociazione in ioni di Na 2 SO 4, KCl. O 3 e Mg(OH)2. La temperatura di ebollizione di una soluzione è maggiore o minore di quella del solvente puro? E la temperatura di congelamento? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 36