Vito Posca Tiziana Fiorani Chimica pi verde Capitolo









































![Le soluzioni sono distinte in acide, neutre e basiche Se [H 3 O+] è Le soluzioni sono distinte in acide, neutre e basiche Se [H 3 O+] è](https://slidetodoc.com/presentation_image_h/a61b06bfdeeeced7f92692dc0e4c4b43/image-48.jpg)


















- Slides: 71


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 17 Gli acidi e le basi

Sommario 1. La reazione di dissociazione ionica consiste nella formazione di ioni di carica opposta 2. I composti che in acqua si dissociano in ioni sono elettroliti 3. Gli acidi e le basi si identificano per le diverse proprietà 4. La teoria di Arrhenius: gli acidi in acqua liberano ioni H+, le basi ioni OH 5. La teoria di Brønsted-Lowry: gli acidi cedono protoni, le basi accettano protoni 6. La reazione di protolisi: un protone si trasferisce da un acido a una base 7. I composti anfoteri possono comportarsi da acidi e da basi Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 8. Gli acidi si classificano in forti e deboli secondo la loro tendenza a cedere protoni 9. Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni 8. La teoria di Lewis: gli acidi accettano un doppietto elettronico, le basi lo condividono 9. La reazione di dissociazione dell’acqua è una reazione di autoionizzazione 10. Le soluzioni sono distinte in acide, neutre e basiche 11. La neutralizzazione è una reazione tra un acido e una base 12. La variazione del p. H può derivare anche dalla soluzione di un sale in acqua 13. Le soluzioni tampone impediscono le variazioni di p. H Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

La reazione di dissociazione ionica consiste nella formazione di ioni di carica opposta La reazione mediante la quale acidi, basi e sali solubili in acqua si dissociano in ioni di carica elettrica opposta si chiama dissociazione ionica. Gli acidi sono costituiti da molecole con parziale separazione di cariche elettriche, indicate con δ+ e δ‒. Sono composti molecolari polari (A). L’acqua è costituita da molecole polari (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

La reazione di dissociazione ionica consiste nella formazione di ioni di carica opposta Se versiamo un acido (HCl) in acqua, le molecole di acqua si legano con legami dipolo-dipolo a idrogeno e cloro. La separazione delle cariche elettriche è totale: si formano due ioni (ionizzazione). L’acqua circonda i due ioni (idratazione). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

La reazione di dissociazione ionica consiste nella formazione di ioni di carica opposta In acqua, una base o un sale (composti ionici), vanno incontro a idratazione e dissociazione ionica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

La reazione di dissociazione ionica consiste nella formazione di ioni di carica opposta Equazione di dissociazione ionica di acido cloridrico e acido nitrico: Equazione di dissociazione ionica di idrossido di sodio, idrossido di calcio, cloruro di calcio e solfato di litio: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

I composti che in acqua si dissociano in ioni sono elettroliti La soluzione di un composto che in acqua si dissocia in ioni conduce corrente elettrica (soluzioni elettrolitiche). Gli elettroliti (acidi, basi e sali) sono soluti che in acqua si dissociano in ioni e conducono la corrente elettrica. I composti che non si dissociano in ioni sono non elettroliti. La differenza si evidenzia con un semplice esperimento: solo la soluzione di Na. Cl (elettrolita) conduce elettricità. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

I composti che in acqua si dissociano in ioni sono elettroliti Un elettrolita è forte quando in soluzione acquosa è completamente dissociato in ioni (esempi in tabella). La dissociazione ionica è in questo caso una reazione completa: Un elettrolita è debole quando in soluzione acquosa è parzialmente dissociato in ioni. La dissociazione ionica è una reazione incompleta: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

I composti che in acqua si dissociano in ioni sono elettroliti La reazione di dissociazione ionica di un elettrolita forte è completa (A), di un elettrolita debole è incompleta (B). Il glucosio, solido molecolare che in acqua si dissocia in molecole, è un non elettrolita (C). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Gli acidi e le basi si identificano per le diverse proprietà Alcune proprietà permettono di identificare acidi e basi. Acidi: sapore aspro, elettroliti, colorano di rosso la cartina al tornasole, neutralizzano le soluzioni delle basi. Basi: sapore amaro, elettroliti, colorano di blu la cartina al tornasole, neutralizzano le soluzioni degli acidi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

La teoria di Arrhenius: gli acidi in acqua liberano ioni H+, le basi ioni OH Nel 1887 il chimico Svante Arrhenius formulò la prima teoria relativa agli acidi e alle basi. Arrhenius osservò che gli acidi (HA) e le basi (BOH) sono elettroliti e che gli acidi contengono almeno un atomo di idrogeno, mentre le basi almeno un gruppo idrossido. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

La teoria di Arrhenius: gli acidi in acqua liberano ioni H+, le basi ioni OH Un acido è una specie chimica che in soluzione acquosa si dissocia liberando ioni idrogeno H+. Una base è una specie chimica che in soluzione acquosa si dissocia liberando ioni idrossido OH−. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

La teoria di Arrhenius: gli acidi in acqua liberano ioni H+, le basi ioni OH Gli acidi, a seconda del numero di H+ che possono liberare in soluzione, sono monoprotici, diprotici e triprotici. Le basi, a seconda del numero di OH- che possono liberare sono monobasiche, dibasiche e tribasiche. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

La teoria di Brønsted-Lowry: gli acidi cedono protoni, le basi accettano protoni Nel 1923 sia Johannes Brønsted sia Thomas Lowry, formularono una teoria più ampia, senza collegarla al solvente acqua. Il comportamento di un composto è descritto in termini di trasferimento di protoni H+. Un acido è una molecola o ione capace di cedere un protone. Una base è una molecola o ione capace di accettare un protone. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

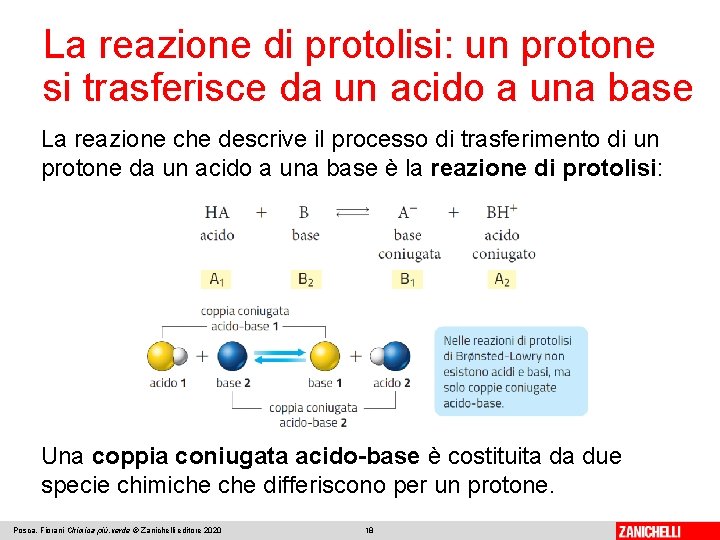
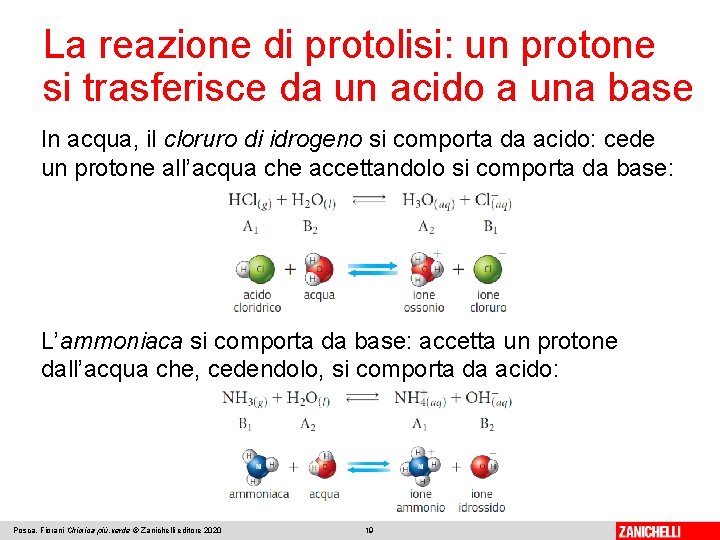
La reazione di protolisi: un protone si trasferisce da un acido a una base La reazione che descrive il processo di trasferimento di un protone da un acido a una base è la reazione di protolisi: Una coppia coniugata acido-base è costituita da due specie chimiche differiscono per un protone. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

La reazione di protolisi: un protone si trasferisce da un acido a una base In acqua, il cloruro di idrogeno si comporta da acido: cede un protone all’acqua che accettandolo si comporta da base: L’ammoniaca si comporta da base: accetta un protone dall’acqua che, cedendolo, si comporta da acido: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

✓ Mettiamoci alla prova Rappresenta l’equazione di dissociazione ionica in acqua degli elettroliti forti HBr e KOH. È corretto sostenere che la teoria su acidi e basi di Brønsted-Lowry sostituisce la teoria di Arrhenius? Perché? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

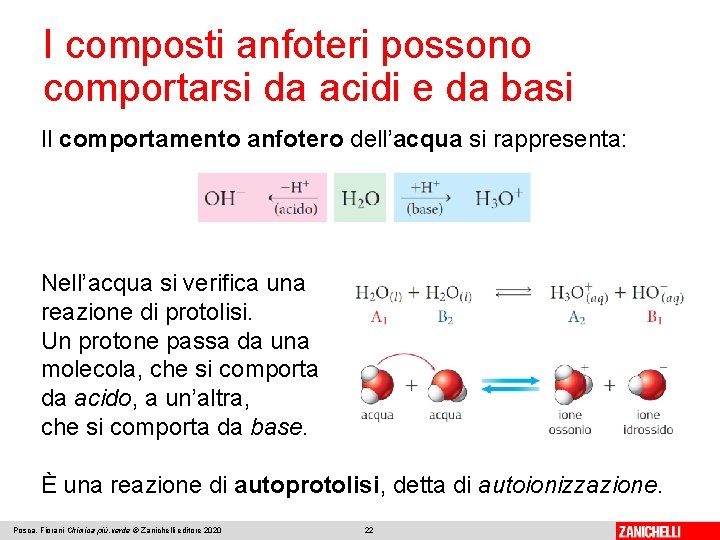
I composti anfoteri possono comportarsi da acidi e da basi Consideriamo le reazioni di protolisi acido-base dell’acido cloridrico e dell’ammoniaca con l’acqua: L’acqua nella prima reazione si comporta da base, nella seconda da acido. Si definiscono anfotere o anfiprotiche le molecole o gli ioni che si comportano da acido in presenza di una base e da base in presenza di un acido. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

I composti anfoteri possono comportarsi da acidi e da basi Il comportamento anfotero dell’acqua si rappresenta: Nell’acqua si verifica una reazione di protolisi. Un protone passa da una molecola, che si comporta da acido, a un’altra, che si comporta da base. È una reazione di autoprotolisi, detta di autoionizzazione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

I composti anfoteri possono comportarsi da acidi e da basi Hanno comportamento anfotero anche l’ammoniaca NH 3 e gli anioni poliatomici con almeno un idrogeno ionizzabile (HS-, HCO 3 -, H 2 PO 4 -). Lo ione carbonato HCO 3 - si comporta da acido, trasformandosi nello ione carbonato CO 32 -, da base trasformandosi in acido carbonico H 2 CO 3: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Gli acidi si classificano in forti e deboli secondo la loro tendenza a cedere protoni Un acido è forte se ha un’alta tendenza a cedere un protone. Quanto maggiore è la tendenza dell’acido a cedere un protone, tanto più l’equilibrio di dissociazione è spostato a destra, tanto più l’acido è forte: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

Gli acidi si classificano in forti e deboli secondo la loro tendenza a cedere protoni Un acido è debole se ha una bassa tendenza a cedere un protone. Quanto minore è la tendenza dell’acido a cedere un protone, tanto più l’equilibrio di dissociazione è spostato a sinistra, tanto più l’acido è debole: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

Gli acidi si classificano in forti e deboli secondo la loro tendenza a cedere protoni La reazione di dissociazione di un acido HA in acqua è una reazione di equilibrio: La forza di un acido è determinata dalla posizione di questo equilibrio. Il parametro che ne esprime la misura quantitativa è la costante di dissociazione acida Ka: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

Gli acidi si classificano in forti e deboli secondo la loro tendenza a cedere protoni Per gli acidi forti l’equilibrio è tutto spostato a destra, per cui il valore di Ka è molto alto. Per gli acidi deboli l’equilibrio è spostato a sinistra, per cui il valore di Ka è basso. Più un acido è forte, più è debole la sua base coniugata. Esempio: dissociazione dell’acido carbonico H 2 CO 3 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

In tabella i valori di Ka dei più comuni acidi deboli a 25°C. La forza di un acido aumenta verso l’alto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

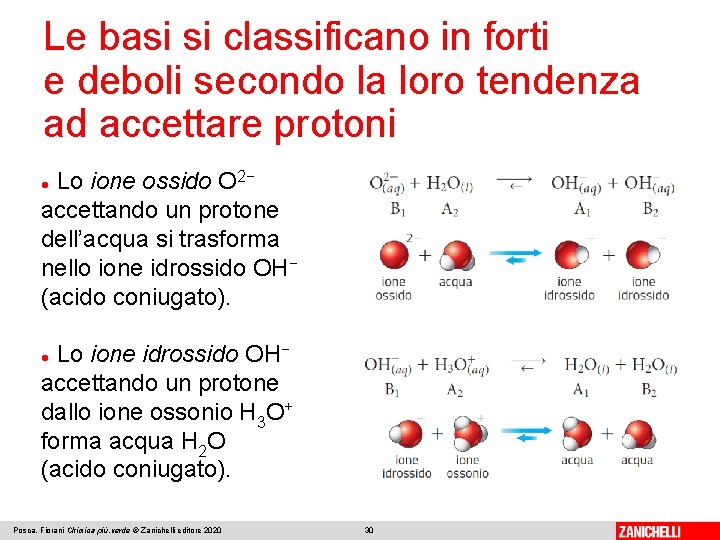
Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni Una base è forte se ha un’alta tendenza ad accettare un protone. Quanto maggiore è la tendenza di una base ad accettare un protone, tanto più l’equilibrio di protonazione è spostato a destra e tanto più la base è forte: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni Lo ione ossido O 2− accettando un protone dell’acqua si trasforma nello ione idrossido OH− (acido coniugato). Lo ione idrossido OH− accettando un protone dallo ione ossonio H 3 O+ forma acqua H 2 O (acido coniugato). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni Una base è debole se ha una bassa tendenza ad accettare un protone. Quanto minore è la tendenza di una base ad accettare un protone, tanto più l’equilibrio di protonazione è spostato a sinistra e tanto più la base è debole: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni La protonazione di una base B in acqua è una reazione di equilibrio: La forza di una base è determinata dalla posizione di questo equilibrio. Il parametro che ne esprime la misura quantitativa è la costante di dissociazione basica Kb: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni Per le basi forti l’equilibrio è tutto spostato a destra, per cui il valore di Kb è molto alto. Per le basi deboli l’equilibrio è spostato a sinistra, per cui il valore di Kb è basso. Più una base è forte, più è debole il suo acido coniugato. Esempio: protonazione dell’ammoniaca NH 3 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

Le basi si classificano in forti e deboli secondo la loro tendenza ad accettare protoni In tabella i valori di Kb di alcune basi deboli a 25°C. La forza della base aumenta verso l’alto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34

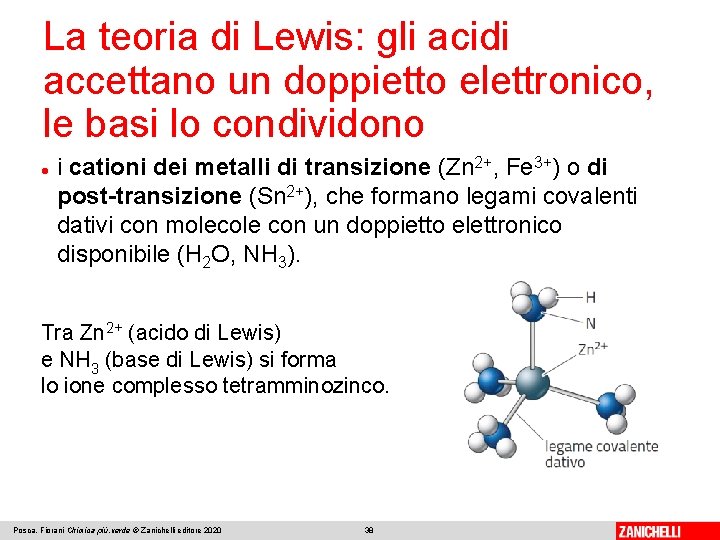
La teoria di Lewis: gli acidi accettano un doppietto elettronico, le basi lo condividono Una definizione più generale e ampia di acido e base fu formulata nel 1923 da Gilbert Newton Lewis. La teoria è definita dalla condivisione di un doppietto elettronico. Un acido è una molecola o uno ione che accetta un doppietto elettronico. Una base è una molecola o uno ione che condivide un doppietto elettronico. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 35

La teoria di Lewis: gli acidi accettano un doppietto elettronico, le basi lo condividono Tra l’acido (A), con un orbitale vuoto, e la base (B), con un doppietto elettronico disponibile, si forma un legame covalente dativo, in cui i due elettroni di legame sono condivisi dallo stesso atomo. Il prodotto di questa reazione è denominato composto di coordinazione o complesso: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 36

La teoria di Lewis: gli acidi accettano un doppietto elettronico, le basi lo condividono Nella teoria di Lewis sono considerati acidi: le molecole con ottetti incompleti, costituite da atomi di boro o di alluminio legati con legami covalenti polari ad atomi di idrogeno o di alogeni (BF 3, Al. Cl 3). Tra Al. Cl 3 (acido di Lewis) e Cl- (base di Lewis) si forma lo ione tetracloruro di alluminio. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 37

La teoria di Lewis: gli acidi accettano un doppietto elettronico, le basi lo condividono i cationi dei metalli di transizione (Zn 2+, Fe 3+) o di post-transizione (Sn 2+), che formano legami covalenti dativi con molecole con un doppietto elettronico disponibile (H 2 O, NH 3). Tra Zn 2+ (acido di Lewis) e NH 3 (base di Lewis) si forma lo ione complesso tetramminozinco. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 38

✓ Mettiamoci alla prova Elenca almeno due molecole o ioni che possono avere comportamento anfotero. Secondo la teoria di Lewis, quale tipo di legame si forma tra un acido e una base per formare un complesso di coordinazione? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 39

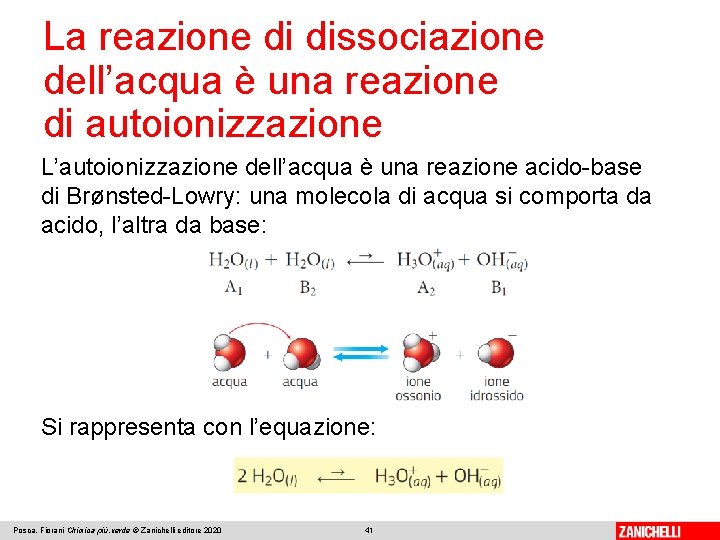
La reazione di dissociazione dell’acqua è una reazione di autoionizzazione Nell’acqua sono presenti, in minima quantità, ioni che derivano da un equilibrio di autoionizzazione, molto spostato a sinistra: Lo ione idrogeno H+ si lega a un’altra molecola d’acqua, formando lo ione ossonio H 3 O+: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 40

La reazione di dissociazione dell’acqua è una reazione di autoionizzazione L’autoionizzazione dell’acqua è una reazione acido-base di Brønsted-Lowry: una molecola di acqua si comporta da acido, l’altra da base: Si rappresenta con l’equazione: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 41

La reazione di dissociazione dell’acqua è una reazione di autoionizzazione La costante di equilibrio Kc è data dalla relazione: La concentrazione dell’acqua dissociata è irrilevante rispetto alla concentrazione dell’acqua indissociata. [H 2 O] può considerarsi costante ed essere inglobato in Kc: Il prodotto tra due costanti è una nuova costante, Kw: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 42

La reazione di dissociazione dell’acqua è una reazione di autoionizzazione Si ricava la relazione che rappresenta il prodotto ionico dell’acqua: Il prodotto ionico dell’acqua è il prodotto della concentrazione degli ioni H 3 O+ e degli ioni OH−. Alla temperatura di 25 °C assume il valore: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 43

La reazione di dissociazione dell’acqua è una reazione di autoionizzazione Nell’acqua pura: La concentrazione dei due ioni si deduce dal prodotto ionico dell’acqua: In una soluzione le concentrazioni di H 3 O+ e OH- variano in modo che il prodotto rimanga uguale a Kw. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 44

La reazione di dissociazione dell’acqua è una reazione di autoionizzazione In una soluzione basica, [OH−] è maggiore di 1, 0 · 10− 7 mol/L. [H 3 O+] si determina con: In una soluzione acida, [H 3 O+] è maggiore di 1, 0 · 10− 7 mol/L. [OH−] si determina con: L’aumento della concentrazione di uno ione determina la diminuzione della concentrazione dell’altro. Il valore del prodotto ionico dell’acqua è costante in una qualunque soluzione acquosa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 45

Le soluzioni sono distinte in acide, neutre e basiche Una soluzione si definisce: acida quando la concentrazione di H 3 O+ è maggiore della concentrazione di OH−: neutra quando la concentrazione di H 3 O+ è uguale alla concentrazione di OH−: basica quando la concentrazione di H 3 O+ è minore della concentrazione di OH−: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 46

Le soluzioni sono distinte in acide, neutre e basiche Il grado di acidità o di basicità di una soluzione è espresso dalla concentrazione di ioni H 3 O+, con una notazione definita p. H. Il p. H di una soluzione è il logaritmo negativo in base 10 della concentrazione degli ioni H 3 O+, espressa in molarità (mol/L): Essendo un logaritmo, è adimensionale. Il suo valore si può calcolare. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 47
![Le soluzioni sono distinte in acide neutre e basiche Se H 3 O è Le soluzioni sono distinte in acide, neutre e basiche Se [H 3 O+] è](https://slidetodoc.com/presentation_image_h/a61b06bfdeeeced7f92692dc0e4c4b43/image-48.jpg)
Le soluzioni sono distinte in acide, neutre e basiche Se [H 3 O+] è il prodotto di 1 per una potenza in base 10, il p. H corrisponde all’esponente cambiato di segno: Se [H 3 O+] ha il primo fattore diverso da 1, il p. H si può determinare con una calcolatrice scientifica (funzione log): Dal p. H si può calcolare la concentrazione degli ioni H 3 O+: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 48

Le soluzioni sono distinte in acide, neutre e basiche Il grado di acidità o di basicità di una soluzione può essere espresso anche dalla concentrazione di ioni OH-. Il p. OH di una soluzione è il logaritmo negativo in base 10 della concentrazione degli ioni OH− espressa in molarità (mol/L): Dal p. OH si può calcolare la concentrazione degli ioni OH−: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 49

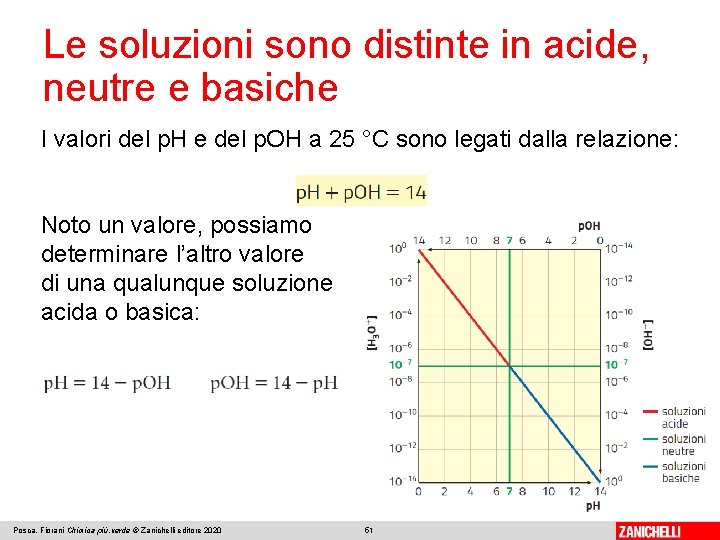
Le soluzioni sono distinte in acide, neutre e basiche Una soluzione è acida se il p. H è minore di 7, neutra se il p. H è uguale a 7, basica se il p. H è maggiore di 7. L’insieme dei valori del p. H o del p. OH costituisce la scala del p. H o del p. OH. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 50

Le soluzioni sono distinte in acide, neutre e basiche I valori del p. H e del p. OH a 25 °C sono legati dalla relazione: Noto un valore, possiamo determinare l’altro valore di una qualunque soluzione acida o basica: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 51

Le soluzioni sono distinte in acide, neutre e basiche Il p. H di una soluzione di acido o base forte Gli acidi forti monoprotici (HCl. O 4, HNO 3, HCl, HBr, HI) in soluzione sono completamente dissociati in ioni. La concentrazione molare di H 3 O+ coincide con la concentrazione iniziale dell’acido (Ca): Le basi forti (idrossidi gruppi 1 e 2) sono completamente dissociate. Nota la concentrazione molare iniziale della base (Cb), si può determinare la concentrazione di OH−. Per le basi forti dei metalli alcalini: Per le basi forti dei metalli alcalino-terrosi: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 52

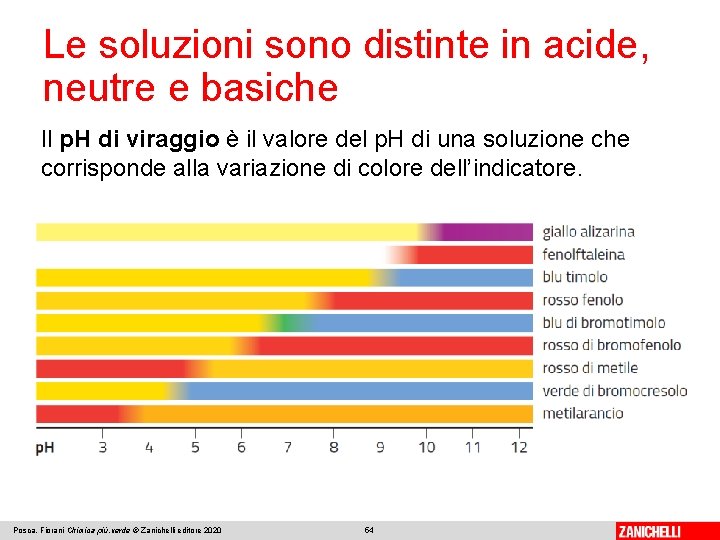
Le soluzioni sono distinte in acide, neutre e basiche La determinazione sperimentale del p. H Gli indicatori sono acidi organici deboli che nella forma indissociata (HIn) sono di un colore diverso dalla forma dissociata (In−). Il rosso di metile è rosso nella forma indissociata e giallo nella forma dissociata: Il suo p. H di viraggio è 5, 2. Per p. H = 5, 2 assume colore arancione (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 53

Le soluzioni sono distinte in acide, neutre e basiche Il p. H di viraggio è il valore del p. H di una soluzione che corrisponde alla variazione di colore dell’indicatore. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 54

Le soluzioni sono distinte in acide, neutre e basiche Si chiamano indicatori di p. H gli acidi deboli che, aggiunti in piccole quantità a una soluzione, assumono un diverso colore a seconda del p. H della soluzione. L’indicatore universale è una soluzione costituita da diversi indicatori. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 55

Le soluzioni sono distinte in acide, neutre e basiche Le cartine indicatrici sono strisce di carta imbevute in uno o più indicatori. La cartina indicatrice acido-base è imbevuta dell’indicatore tornasole (p. H di viraggio 6, 5). In soluzione, assume colore rosso per p. H < 7, blu per p. H > 7 e verde per p. H = 7. La cartina indicatrice universale (A) assume colore diverso a seconda del p. H della soluzione. Il valore di p. H si determina confrontando il colore della cartina con una scala cromatica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 56

Le soluzioni sono distinte in acide, neutre e basiche I piaccametri sono strumenti utilizzati per una determinazione molto accurata e rapida del p. H (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 57

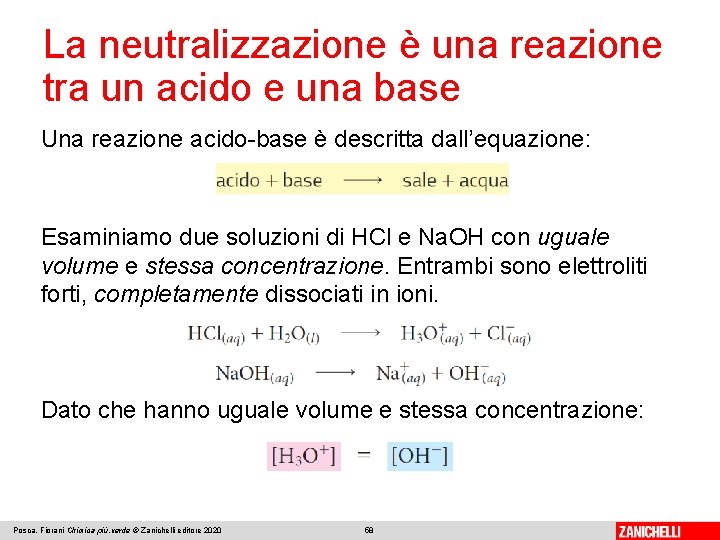
La neutralizzazione è una reazione tra un acido e una base Una reazione acido-base è descritta dall’equazione: Esaminiamo due soluzioni di HCl e Na. OH con uguale volume e stessa concentrazione. Entrambi sono elettroliti forti, completamente dissociati in ioni. Dato che hanno uguale volume e stessa concentrazione: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 58

La neutralizzazione è una reazione tra un acido e una base Aggiungendo la soluzione di HCl a quella di ioni Na. OH, gli ioni H 3 O+ e OH− reagiscono formando acqua. Tutti gli ioni H 3 O+ e OH− reagiscono tra loro: la soluzione risulta neutra. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 59

La neutralizzazione è una reazione tra un acido e una base La neutralizzazione dipende dalla concentrazione delle due soluzioni, ma anche dalla stechiometria. La reazione tra una soluzione di acido diprotico (H 2 SO 4) e una di base monobasica (KOH) evidenzia che occorrono due moli della base per neutralizzare una mole di acido: Le reazioni di neutralizzazione sono reazioni tra una soluzione di un acido forte e la soluzione di una base forte in quantità equimolare (con uguale numero di moli). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 60

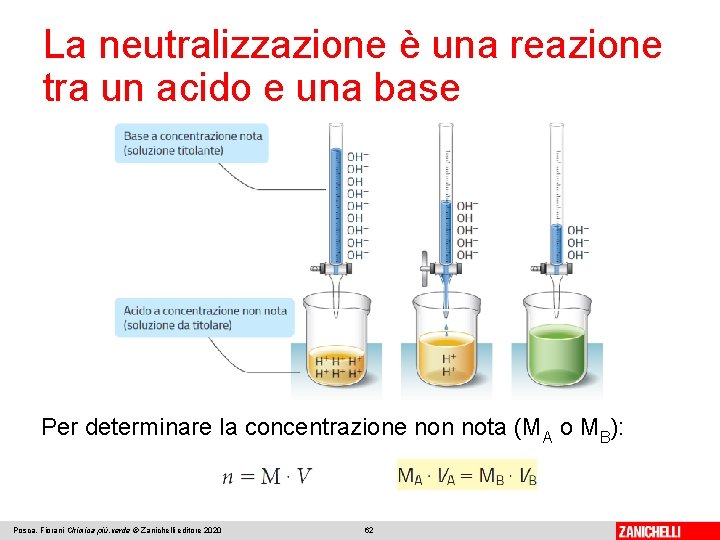
La neutralizzazione è una reazione tra un acido e una base La titolazione acido-base È un’analisi volumetrica che consente di determinare la concentrazione (o titolo) di una soluzione acida (o basica) a volume noto. Si esegue aggiungendo lentamente una soluzione basica (o acida) a titolo noto alla soluzione acida (o basica) a titolo non noto, fino al punto di viraggio. Il punto di viraggio si ha quando il numero di moli (n) degli ioni H+ dell’acido è uguale a quello delle moli degli ioni OH- della base: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 61

La neutralizzazione è una reazione tra un acido e una base Per determinare la concentrazione non nota (MA o MB): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 62

La variazione del p. H può derivare anche dalla soluzione di un sale in acqua Anche i sali in acqua possono dare origine a una soluzione acida o basica a seconda della composizione. L’idrolisi salina è il processo per cui la soluzione di un sale in acqua determina la variazione del p. H. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 63

La variazione del p. H può derivare anche dalla soluzione di un sale in acqua In acqua tutti i sali solubili sono elettroliti forti, dissociati completamente in cationi e anioni. I cationi e gli anioni di basi e acidi forti si legano alle molecole di acqua (idratazione) senza interagire (ioni neutri). NH 4+ reagisce con le molecole di acqua (idrolisi) cedendo protoni (ione acido). Gli anioni di acidi deboli reagiscono con le molecole di acqua (idrolisi) accettando protoni (ioni basici). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 64

La variazione del p. H può derivare anche dalla soluzione di un sale in acqua L’idrolisi acida La soluzione di un sale (NH 4 Cl) che deriva da un acido forte (HCl) e da una base debole (NH 3) è acida. Lo ione ammonio NH 4+, ione acido, cede un protone all’acqua (reazione di idrolisi). La soluzione presenta un eccesso di ioni H 3 O+ (p. H < 7). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 65

La variazione del p. H può derivare anche dalla soluzione di un sale in acqua L’idrolisi basica La soluzione di un sale (Na. HCO 3) che deriva da un acido debole (H 2 CO 3) e da una base forte (Na. OH) è basica. Lo ione ammonio CO 32 -, ione basico, accetta un protone dall’acqua (reazione di idrolisi). La soluzione presenta un eccesso di ioni OH- (p. H > 7). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 66

La variazione del p. H può derivare anche dalla soluzione di un sale in acqua La soluzione di un sale derivante da una base forte e da un acido forte è neutra. Na. Cl deriva da una base forte (Na. OH) e da un acido forte (HCl). Lo ione Na+ e lo ione Cl-, ioni neutri, si legano alle molecole di acqua senza reagire con essa (processo di idratazione). Non si ha idrolisi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 67

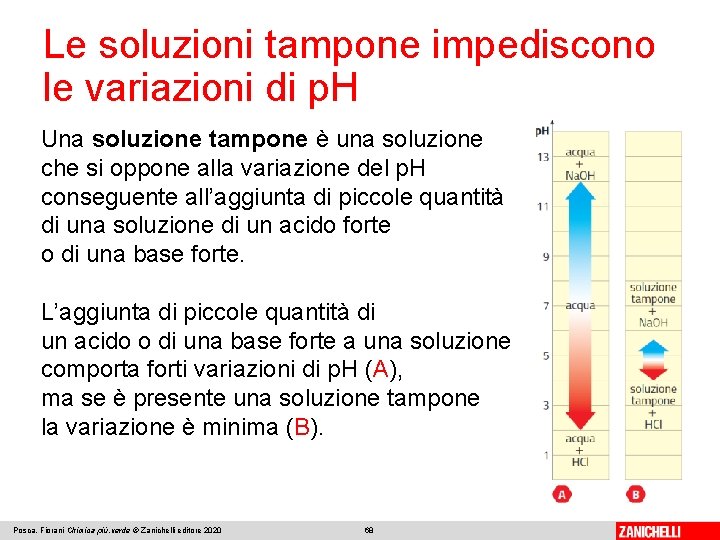
Le soluzioni tampone impediscono le variazioni di p. H Una soluzione tampone è una soluzione che si oppone alla variazione del p. H conseguente all’aggiunta di piccole quantità di una soluzione di un acido forte o di una base forte. L’aggiunta di piccole quantità di un acido o di una base forte a una soluzione comporta forti variazioni di p. H (A), ma se è presente una soluzione tampone la variazione è minima (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 68

Le soluzioni tampone impediscono le variazioni di p. H Una soluzione tampone può essere costituita da: un acido debole e da un suo sale con una base forte (tampone acido); una base debole e da un suo sale con un acido forte (tampone basico). Esaminiamo un tampone acido costituito da una soluzione di acido cianidrico HCN e cianuro di sodio Na. CN. HCN è poco dissociato, Na. CN completamente: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 69

Le soluzioni tampone impediscono le variazioni di p. H Se aggiungiamo piccole quantità di un acido, gli ioni H 3 O+ in eccesso reagiscono con gli ioni CN- del sale per formare HCN: l’equilibrio della reazione di dissociazione dell’acido si sposta a sinistra e la variazione del p. H è minima. Se aggiungiamo piccole quantità di una base, gli ioni OH− in eccesso reagiscono con gli ioni H 3 O+ per formare acqua: l’equilibrio della reazione di dissociazione dell’acido si sposta a destra e la variazione del p. H è minima. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 70

✓ Mettiamoci alla prova Secondo quale relazione, noto il p. H di una soluzione, è possibile calcolarne il p. OH? Quante moli di acido cloridrico HCl sono necessarie per neutralizzare l’idrossido di calcio Ca(OH)2? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 71
 Peso atomico
Peso atomico Posca soluzioni
Posca soluzioni Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17 Chimica piu verde soluzioni
Chimica piu verde soluzioni Soluzioni posca chimica
Soluzioni posca chimica Chimica più soluzioni capitolo 22
Chimica più soluzioni capitolo 22 Hablo y no pienso lloró y no siento río sin
Hablo y no pienso lloró y no siento río sin Soluzioni chimica più capitolo 10
Soluzioni chimica più capitolo 10 Chimica più soluzioni capitolo 14
Chimica più soluzioni capitolo 14 Valitutti soluzioni capitolo 14
Valitutti soluzioni capitolo 14 Zanichelli soluzioni chimica capitolo 16
Zanichelli soluzioni chimica capitolo 16 Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Soluzioni capitolo 16 le reazioni chimiche
Soluzioni capitolo 16 le reazioni chimiche Chimica più soluzioni capitolo 18
Chimica più soluzioni capitolo 18 Capitolo 19 zanichelli chimica
Capitolo 19 zanichelli chimica Soluzioni scoprire la chimica
Soluzioni scoprire la chimica Valitutti soluzioni capitolo 18
Valitutti soluzioni capitolo 18 Soluzioni chimica zanichelli capitolo 13
Soluzioni chimica zanichelli capitolo 13 Chimica più soluzioni capitolo 12
Chimica più soluzioni capitolo 12 Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Il sistema endocrino zanichelli
Il sistema endocrino zanichelli Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Chimica piu capitolo 18 soluzioni
Chimica piu capitolo 18 soluzioni Dissociazione chimica
Dissociazione chimica Capitolo 10 chimica zanichelli
Capitolo 10 chimica zanichelli Leggi ponderali
Leggi ponderali Zanichelli chimica soluzioni capitolo 6
Zanichelli chimica soluzioni capitolo 6 Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Barriere postzigotiche
Barriere postzigotiche Soluzioni chimica capitolo 11
Soluzioni chimica capitolo 11 Soluzioni chimica zanichelli capitolo 14
Soluzioni chimica zanichelli capitolo 14 Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Le proprietà delle soluzioni zanichelli capitolo 13
Le proprietà delle soluzioni zanichelli capitolo 13 Carbonio metabolismo biotech soluzioni
Carbonio metabolismo biotech soluzioni Soluzioni chimica più capitolo 10
Soluzioni chimica più capitolo 10 Legame covalente
Legame covalente Soluzioni capitolo 8
Soluzioni capitolo 8 Solu zanichelli
Solu zanichelli Verde por fuera roja por dentro y bailarinas en el centro
Verde por fuera roja por dentro y bailarinas en el centro Abbordo in mare
Abbordo in mare Tensione di vapore
Tensione di vapore Hipermon
Hipermon Apparato sperimentale effetto fotoelettrico
Apparato sperimentale effetto fotoelettrico Montemarani tiziana
Montemarani tiziana Tiziana de matteis
Tiziana de matteis Tiziana sarnari
Tiziana sarnari Eosc
Eosc Legami chimici schema riassuntivo
Legami chimici schema riassuntivo Donatella fiorani
Donatella fiorani Vito moscato
Vito moscato Liceo filandiere
Liceo filandiere Agriturismo carolina vito d'asio
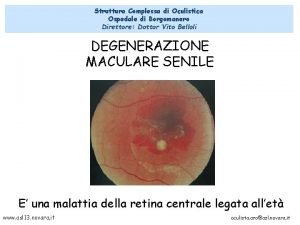
Agriturismo carolina vito d'asio Dott vito belloli oculista
Dott vito belloli oculista Farmakovigjilenca
Farmakovigjilenca Vito fragnelli
Vito fragnelli Vito scarola
Vito scarola Vito alunno rossetti
Vito alunno rossetti Scuola media san vito al tagliamento
Scuola media san vito al tagliamento Vito register
Vito register Dr elizabeth vitale
Dr elizabeth vitale Vito acconci seedbed
Vito acconci seedbed Vito puliafito
Vito puliafito Liceo scientifico statale vito volterra
Liceo scientifico statale vito volterra Is michael corleone a villain
Is michael corleone a villain Elcore 2400 preis
Elcore 2400 preis Vito
Vito Heeresreform marius
Heeresreform marius Vito
Vito Amoris laetitia capitolo 7
Amoris laetitia capitolo 7 Mappa concettuale acidi e basi
Mappa concettuale acidi e basi Il grande gatsby capitolo 3
Il grande gatsby capitolo 3 Mobilizzazione atraumatica definizione
Mobilizzazione atraumatica definizione