Vito Posca Tiziana Fiorani Chimica pi verde Capitolo






























- Slides: 34


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 7 La costante di Avogadro e la mole

Sommario 1. La massa atomica assoluta si esprime in kilogrammi 2. La massa atomica relativa è un numero puro 3. Come si esprimono la massa molecolare e la massa formula relative 4. Il numero di Avogadro collega il mondo microscopico e quello macroscopico 5. Una mole contiene NA atomi, molecole o unità formula 6. La mole di un elemento o di un composto ha un valore di massa definito Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 7. La massa molare è la massa in grammi di una mole 8. La massa molare permette di determinare il numero di moli o la massa in grammi 9. Il volume occupato da una mole di gas è detto volume molare 10. Il calcolo della composizione percentuale degli elementi in un composto 11. Determinare la formula minima e molecolare di un composto Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

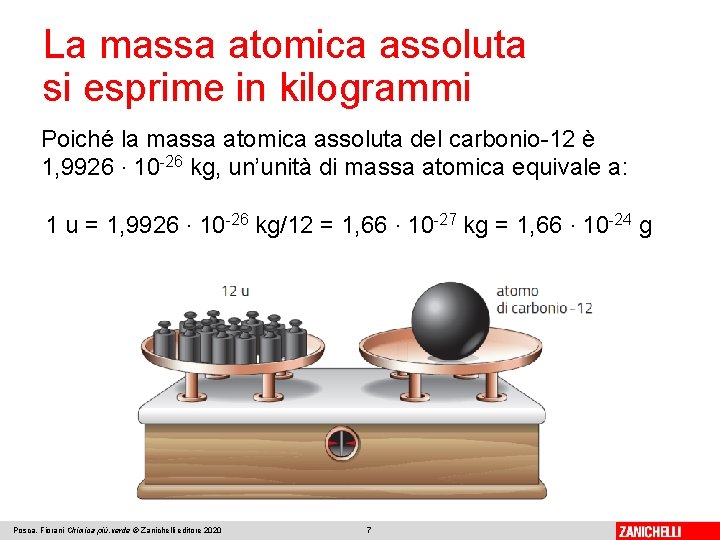
La massa atomica assoluta si esprime in kilogrammi La massa atomica assoluta (Aa) è la massa di un atomo espressa in kg. Le masse atomiche in kilogrammi hanno valori numerici molto piccoli, tra 10 -25 e 10 -27 kg. Conviene allora scegliere come unità di misura una massa piccola come quella degli atomi. L’unità di massa atomica (u) corrisponde a un dodicesimo della massa atomica assoluta dell’isotopo del carbonio-12: 1 u = 1/12 Aa del carbonio-12 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

La massa atomica assoluta si esprime in kilogrammi Poiché la massa atomica assoluta del carbonio-12 è 1, 9926 ∙ 10 -26 kg, un’unità di massa atomica equivale a: 1 u = 1, 9926 ∙ 10 -26 kg/12 = 1, 66 ∙ 10 -27 kg = 1, 66 ∙ 10 -24 g Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

La massa atomica relativa è un numero puro La massa atomica relativa (Ar) è un numero che indica quante volte la massa atomica assoluta è maggiore dell’unità di massa atomica. Poiché la massa atomica relativa deriva da un rapporto tra due masse espresse con la stessa unità di misura, essa è adimensionale, cioè è un numero puro. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

La massa atomica relativa è un numero puro Per ciascun elemento, la tavola periodica riporta il valore della massa atomica relativa sotto o accanto al simbolo dell’elemento e al suo numero atomico. La massa atomica assoluta di un atomo si può calcolare con la relazione: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

Come si esprimono la massa molecolare e la massa formula relative Quando si conosce la formula di un composto molecolare o ionico, è possibile calcolare la massa relativa della sua molecola o della sua unità formula, definite massa molecolare relativa e massa formula relativa. In entrambi i casi il simbolo è Mr. La massa molecolare relativa e la massa formula relativa corrispondono alla somma delle masse atomiche relative degli atomi che costituiscono la molecola o l’unità formula. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Come si esprimono la massa molecolare e la massa formula relative Massa molecolare e formula relativa sono numeri puri. Se nella formula sono presenti gruppi tra parentesi, occorre tenere conto degli indici posti fuori parentesi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

✓ Mettiamoci alla prova Individua sulla tavola periodica il numero atomico e la massa atomica relativa del potassio (K). Qual è la sua massa atomica assoluta? Qual è la massa formula relativa dei composti Al 2(CO 3)3 e Ca(NO 3)2? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Il numero di Avogadro collega il mondo microscopico e quello macroscopico La massa in grammi di atomi e molecole è molto piccola. Serve un numero molto grande di atomi e molecole per far sì che la massa totale sia dell’ordine dei grammi e quindi misurabile con una bilancia. L’ordine di grandezza di tale numero è 1023. Il numero che collega il mondo microscopico degli atomi a quello macroscopico è detto numero di Avogadro. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

Il numero di Avogadro collega il mondo microscopico e quello macroscopico Il numero di Avogadro (NA) è il numero di atomi di carbonio contenuti in 12 grammi di carbonio-12. Il valore si calcola dal rapporto tra la massa di 12 g di carbonio e la massa assoluta di un atomo di carbonio (1, 9926 · 10− 23 g): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

Una mole contiene NA atomi, molecole o unità formula A un pacchetto di sostanza costituito da 6, 022· 1023 atomi o molecole (o unità formula) si dà il nome di mole. La mole è l’unità di misura di una grandezza fisica fondamentale, la quantità di sostanza (n). Se una certa quantità di carbonio contiene un numero di atomi pari al doppio del numero di Avogadro (2 NA) diciamo che è costituita da 2 moli (di atomi di carbonio). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

Una mole contiene NA atomi, molecole o unità formula La mole (mol) è la quantità di sostanza (elemento o composto) che contiene un numero di Avogadro di atomi, di molecole o di unità formula. È quindi più corretto parlare di costante di Avogadro NA, che si esprime in atomi (o molecole o unità formula)∙mol-1, e che ha quindi unità di misura mol− 1: costante di Avogadro (NA) = 6, 022 · 10 23 mol− 1 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

La mole di un elemento o di un composto ha un valore di massa definito Se moltiplichiamo la massa relativa di atomi, molecole o unità formula per il valore dell’unità di massa atomica u, otteniamo la corrispondente massa assoluta. Il prodotto tra la massa assoluta e la costante di Avogadro NA permette di determinare la massa di una mole. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

La mole di un elemento o di un composto ha un valore di massa definito La massa di una mole di atomi, oppure di molecole o di unità formula, è diversa a seconda dell’elemento o del composto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

La mole di un elemento o di un composto ha un valore di massa definito Una mole di sostanza (elemento o composto) ha una massa, in grammi, pari al valore della massa (atomica, molecolare o formula) relativa della sostanza stessa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

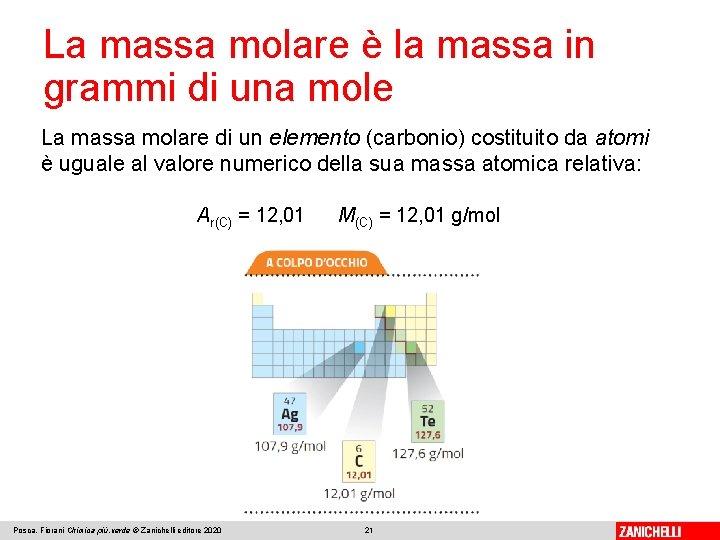
La massa molare è la massa in grammi di una mole La massa molare (M) è la massa in grammi di una mole di un elemento o di un composto La massa molare si esprime in grammi per mole (g/mol). Per stabilire la massa molare di una sostanza di cui si conosce il simbolo o la formula, si deve: • trovare il valore della massa atomica relativa dei corrispondenti atomi sulla tavola periodica; • calcolare, se necessario, la massa molecolare (o formula) della sostanza; • aggiungere l’unità di misura g/mol. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

La massa molare è la massa in grammi di una mole La massa molare di un elemento (carbonio) costituito da atomi è uguale al valore numerico della sua massa atomica relativa: Ar(C) = 12, 01 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 M(C) = 12, 01 g/mol 21

La massa molare è la massa in grammi di una mole La massa molare di un elemento (azoto) costituito da molecole (N 2), o di un composto molecolare (diossido di carbonio) costituito da molecole (CO 2), è uguale al valore numerico della sua massa molecolare relativa: Ar(N) = 14, 00 Ar(C) = 12, 01 Mr(N 2) = 28, 00 M(N 2) = 28, 00 g/mol Ar(O) = 16, 00 Mr(CO 2) = 44, 01 M(CO 2) = 44, 01 g/mol La massa molare di un composto ionico (cloruro di sodio) di formula Na. Cl è uguale al valore numerico della massa formula relativa: Ar(Na) = 22, 99 Ar(Cl) = 35, 45 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 Mr(Na. Cl) = 58, 44 22 M(Na. Cl) = 58, 44 g/mol

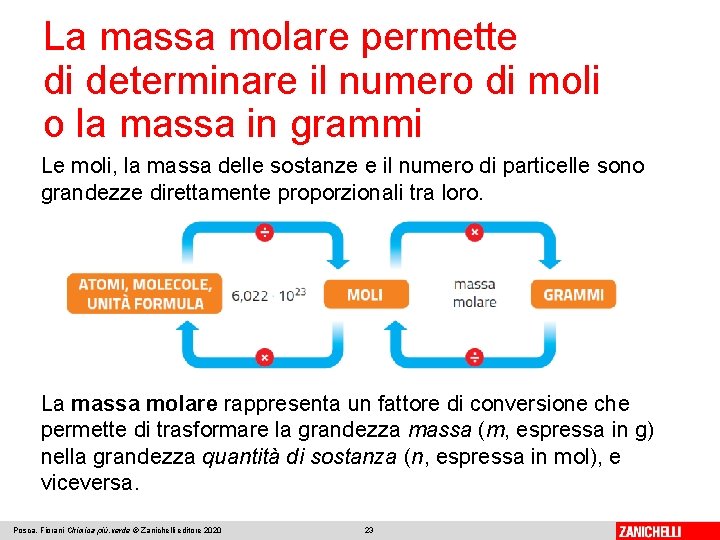
La massa molare permette di determinare il numero di moli o la massa in grammi Le moli, la massa delle sostanze e il numero di particelle sono grandezze direttamente proporzionali tra loro. La massa molare rappresenta un fattore di conversione che permette di trasformare la grandezza massa (m, espressa in g) nella grandezza quantità di sostanza (n, espressa in mol), e viceversa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

La massa molare permette di determinare il numero di moli o la massa in grammi La quantità in moli (n) presente in una determinata massa di un elemento o di un composto è data da: La massa m di un elemento o di un composto a partire dalla sua quantità in moli n è data da: La massa molare M di un elemento o composto, conoscendo la massa e la quantità in moli, è data da: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

La massa molare permette di determinare il numero di moli o la massa in grammi La costante di Avogadro è il fattore di conversione che permette di trasformare un dato numero di entità elementari (atomi, molecole o unità formula) nella grandezza quantità di sostanza (n, espressa in mol) e viceversa. La quantità di sostanza si ottiene dal rapporto: Il numero di entità elementari si ottiene dal prodotto: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

Il volume occupato da una mole di gas è detto volume molare Una mole di cloro Cl 2 (71 g) e una mole di diossido di carbonio CO 2 (44 g) sono costituiti dallo stesso numero di molecole (NA). Alla stessa temperatura esercitano la stessa pressione e occupano lo stesso volume. Il volume occupato da una mole di gas è detto volume molare (Vm). Alla temperatura di 0 °C e alla pressione di 1 bar, condizioni indicate come condizioni normali (c. n. ): Vm = 22, 7 L/mol Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

Il volume occupato da una mole di gas è detto volume molare Il volume di una mole di gas a c. n. è uguale per tutti i gas e contiene NA atomi o molecole, ma ha una massa molare che varia a seconda del gas. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

Il volume occupato da una mole di gas è detto volume molare All’aumentare della quantità di moli di gas aumenta anche il volume: Si può determinare la quantità di moli di gas presente in un volume a c. n. : Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

Il calcolo della composizione percentuale degli elementi in un composto La composizione percentuale di un composto rappresenta la massa in grammi di ogni elemento presente in 100 grammi di composto. Per determinarla a partire dalla formula, è necessario definire la massa (m(elemento)) in g di ogni elemento in una mole del composto e la massa (m(composto)) in g di una mole del composto: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

Il calcolo della composizione percentuale degli elementi in un composto In una mole di Si. O 2 (60 g), la massa del silicio è 28 g e quella di ossigeno è 16 g. Per determinare i grammi di Si in 100 g di Si. O 2, risolviamo la proporzione: La massa restante è ossigeno, pari a 53, 3 g. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

Determinare la formula minima e molecolare di un composto Per stabilire la formula minima e molecolare di un composto è necessario eseguire due tipi di analisi: • l’analisi qualitativa, identifica quali elementi chimici costituiscono un composto; • l’analisi quantitativa, determina la quantità in grammi di ciascun elemento in 100 g del composto, ovvero la composizione percentuale. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

Determinare la formula minima e molecolare di un composto Per determinare la formula minima di un composto: 1. esprimiamo in grammi il valore percentuale di ogni elemento; 2. determiniamo la quantità in moli (n) di ogni elemento dividendo il valore della massa (in g) per il valore della massa molare M (in g/mol); 3. identifichiamo il più piccolo tra i valori di n e dividiamo tutti gli altri per questo valore; 4. i numeri che si ottengono sono gli indici della formula minima: se uno è un numero decimale moltiplichiamo tutti gli indici della formula per il fattore che lo rende intero; 5. scriviamo i simboli degli elementi e riportiamo accanto a essi i rispettivi indici. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

Determinare la formula minima e molecolare di un composto Per stabilire la formula molecolare dobbiamo conoscere la formula minima e la massa molecolare relativa (Mr) del composto. Procediamo nel modo seguente: 1. calcoliamo la massa relativa della formula minima; 2. calcoliamo il rapporto tra la Mr del composto e la Mr della formula minima; 3. moltiplichiamo gli indici della formula minima per il valore numerico del rapporto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

✓ Mettiamoci alla prova Nel calcolo della quantità in moli di una sostanza, quali sono le unità di misura utilizzate per la massa, la massa molare e la quantità di sostanza? Prendi in esame volumi uguali di gas diversi a c. n. , ricava n e m e confronta le masse: 1) 2, 27 L di He e 2, 27 L di CO 2 2) 45, 4 L di N 2 e 45, 4 L di Cl 2 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34