Vito Posca Tiziana Fiorani Chimica pi verde Capitolo


























- Slides: 29


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 16 L’equilibrio chimico

Sommario 1. Le reazioni chimiche possono essere irreversibili o reversibili 2. Le reazioni reversibili raggiungono l’equilibrio 3. Il valore della costante di equilibrio definisce la posizione dell’equilibrio 4. Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema 5. La presenza di un catalizzatore in un sistema all’equilibrio Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Le reazioni chimiche possono essere irreversibili o reversibili A reazione avvenuta, se nel sistema sono presenti solo i prodotti, la reazione è completa o irreversibile. Nella sintesi del cloruro di idrogeno, H 2 e Cl 2 si trasformano completamente in HCl. La reazione si rappresenta con una sola freccia diretta dai reagenti ai prodotti. Una reazione chimica che avviene solo in una direzione, dai reagenti ai prodotti, è completa o irreversibile. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

Le reazioni chimiche possono essere irreversibili o reversibili A reazione avvenuta, se sono presenti sia i reagenti sia i prodotti, la reazione è incompleta o reversibile. Nella sintesi e nella decomposizione dello ioduro di idrogeno, a reazioni avvenute nel sistema sono presenti HI, H 2 e I 2. Il sistema è lo stesso, che la reazione inizi da H 2 e I 2 o da HI. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

Le reazioni chimiche possono essere irreversibili o reversibili Le due reazioni incomplete si rappresentano con un’unica equazione, interponendo tra reagenti e prodotti due frecce con verso opposto. Una reazione chimica che avviene in entrambi i sensi è incompleta o reversibile. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

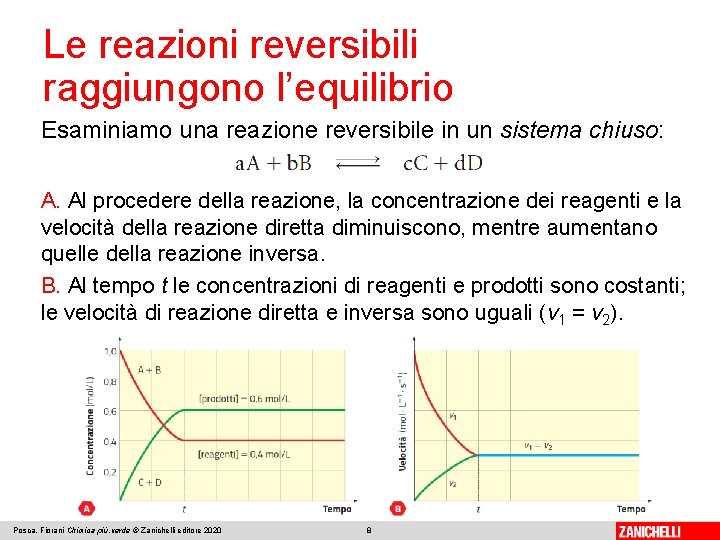
Le reazioni reversibili raggiungono l’equilibrio Esaminiamo una reazione reversibile in un sistema chiuso: A. Al procedere della reazione, la concentrazione dei reagenti e la velocità della reazione diretta diminuiscono, mentre aumentano quelle della reazione inversa. B. Al tempo t le concentrazioni di reagenti e prodotti sono costanti; le velocità di reazione diretta e inversa sono uguali (v 1 = v 2). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

Le reazioni reversibili raggiungono l’equilibrio La reazione chimica ha raggiunto l’equilibrio, condizione in cui la sua composizione chimica non cambia se non vengono modificate le condizioni del sistema. L’equilibrio raggiunto è un equilibrio dinamico. Una reazione chimica raggiunge l’equilibrio quando le concentrazioni dei reagenti e dei prodotti rimangono costanti nel tempo e la velocità della reazione diretta è uguale a quella della reazione inversa: v 1 = v 2 Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

Le reazioni reversibili raggiungono l’equilibrio Nelle condizioni di equilibrio, a una certa temperatura, il rapporto tra concentrazione di prodotti e reagenti è una costante detta costante di equilibrio (K): Questa relazione esprime la legge di azione di massa: In una reazione chimica all’equilibrio, il rapporto tra il prodotto delle concentrazioni molari dei prodotti e il prodotto delle concentrazioni molari dei reagenti, ciascuna elevata a un esponente corrispondente al proprio coefficiente stechiometrico, è pari a una costante. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Le reazioni reversibili raggiungono l’equilibrio La costante di equilibrio espressa in funzione della concentrazione molare è indicata dal simbolo Kc: Le concentrazioni sono quelle alle condizioni di equilibrio in mol/L, elevate al coefficiente stechiometrico nell’equazione bilanciata. Il valore di Kc dipende solo dalla temperatura: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

Le reazioni reversibili raggiungono l’equilibrio La costante di equilibrio di una reazione in fase eterogenea si esprime prendendo in considerazione solo i componenti gassosi e non le concentrazioni dei liquidi puri o dei solidi presenti, che sono costanti. Per una generica reazione reversibile in fase eterogenea la costante di equilibrio è: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

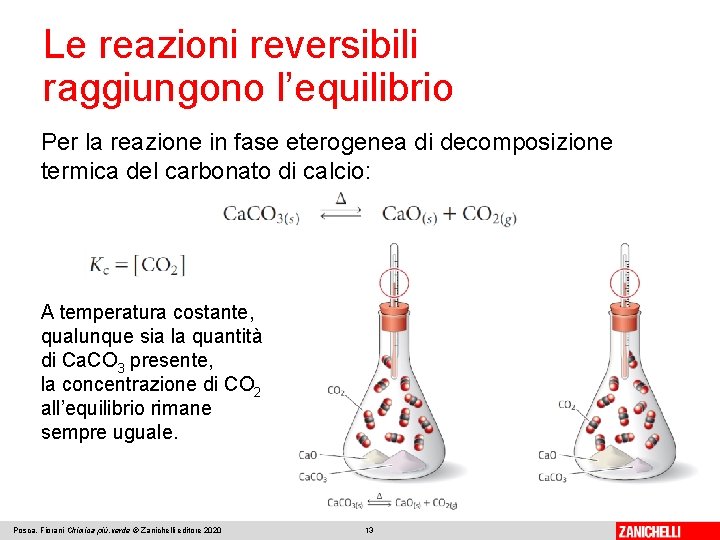
Le reazioni reversibili raggiungono l’equilibrio Per la reazione in fase eterogenea di decomposizione termica del carbonato di calcio: A temperatura costante, qualunque sia la quantità di Ca. CO 3 presente, la concentrazione di CO 2 all’equilibrio rimane sempre uguale. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

✓ Mettiamoci alla prova Rappresenta la costante di equilibrio per la reazione in fase omogenea: 2 SO 3 ⇄ 2 SO + O 2 Rappresenta la costante di equilibrio per la reazione in fase eterogenea: CO(g) + 3 H 2(g) ⇄ CH 4(g) + H 2 O(l) Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

Il valore della costante di equilibrio definisce la posizione dell’equilibrio Il valore numerico di K permette di stabilire se, all’equilibrio, la concentrazione dei prodotti è maggiore o minore dei reagenti e definire la posizione dell’equilibrio. Valore di K maggiore di 1 (K > 1) L’equilibrio è spostato a destra: la reazione favorisce la formazione dei prodotti. In una reazione con alto valore della costante di equilibrio, un’elevata quantità di reagenti si trasforma in prodotti. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

Il valore della costante di equilibrio definisce la posizione dell’equilibrio Valore di K minore di 1 (K < 1) L’equilibrio è spostato a sinistra: la reazione favorisce la formazione dei reagenti. In una reazione con basso valore della costante di equilibrio, solo una piccola quantità di reagenti si trasforma in prodotti. Il valore numerico di K permette di calcolare la concentrazione all’equilibrio di un reagente o prodotto, note le concentrazioni all’equilibrio degli altri. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema Lo stato di equilibrio raggiunto da una reazione chimica non cambia fino a quando le condizioni del sistema rimangono invariate. La direzione in cui si sposta l’equilibrio è prevista dal principio di Le Châtelier: un sistema chimico all’equilibrio reagisce alle variazioni a cui viene sottoposto in modo da annullarne gli effetti e raggiungere un nuovo stato di equilibrio. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

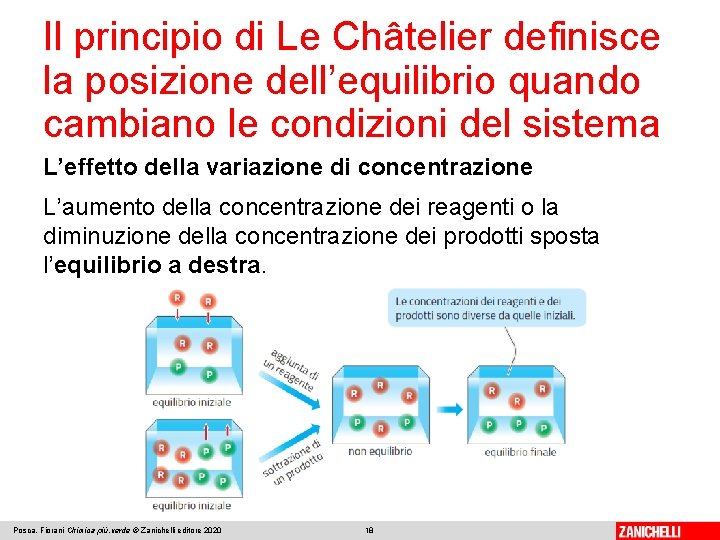
Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema L’effetto della variazione di concentrazione L’aumento della concentrazione dei reagenti o la diminuzione della concentrazione dei prodotti sposta l’equilibrio a destra. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema L’aumento della concentrazione dei prodotti o la diminuzione della concentrazione dei reagenti sposta l’equilibrio a sinistra. Le concentrazioni assumono nuovi valori, lasciando invariata Kc. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema Spostamenti dell’equilibrio chimico possibili per la reazione di ossidazione dello zolfo (SO 2): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema L’effetto della variazione di pressione o volume Una variazione di pressione o di volume ha effetto significativo solo quando si verifica una variazione del numero delle moli e, a ogni modo, quando: tutti i componenti sono in fase gassosa; un reagente solido si decompone formando un prodotto aeriforme. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema a. Esaminiamo una reazione omogenea in fase gassosa che avviene con variazione del numero di moli: Un aumento di pressione con diminuzione di volume su un sistema all’equilibrio favorisce la reazione che porta a una diminuzione del numero delle moli. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema Una diminuzione di pressione con aumento di volume su un sistema all’equilibrio favorisce la reazione che porta a un aumento del numero delle moli. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema b. Consideriamo una reazione omogenea in fase gassosa che avviene senza variazione del numero di moli: Un aumento o una diminuzione di pressione (e quindi di volume) non ha nessun effetto sulla posizione dell’equilibrio. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema c. Consideriamo un sistema all’equilibrio in fase eterogenea. La variazione della pressione o del volume ha effetto solo sui componenti gassosi. Nell’esempio non si considera il carbonio (solido): un aumento di pressione (diminuzione di volume) sposta l’equilibrio verso i reagenti, con diminuzione del numero di moli; una diminuzione di pressione (aumento di volume) sposta l’equilibrio verso i prodotti, con aumento del numero di moli; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema L’effetto della variazione di temperatura Il valore numerico della Kc dipende solo dalla temperatura. La variazione di temperatura in un sistema all’equilibrio modifica sia la posizione dell’equilibrio, sia il valore di Kc a. Nelle reazioni di equilibrio esotermiche (ΔH < 0) l’aumento di temperatura sposta l’equilibrio a sinistra, la diminuzione verso i prodotti. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

Il principio di Le Châtelier definisce la posizione dell’equilibrio quando cambiano le condizioni del sistema b. Nelle reazioni di equilibrio endotermiche (ΔH > 0) l’aumento di temperatura sposta l’equilibrio verso i prodotti, la diminuzione a sinistra. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

La presenza di un catalizzatore in un sistema all’equilibrio La presenza di un catalizzatore non modifica la posizione dell’equilibrio: l’effetto si manifesta in ugual misura sia sulla velocità della reazione diretta sia su quella inversa. La presenza del catalizzatore in una reazione reversibile permette di arrivare all’equilibrio in un tempo minore. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

✓ Mettiamoci alla prova In una reazione in fase gassosa, la variazione di pressione del sistema come modifica il volume? La variazione di temperatura su un sistema modifica soltanto la posizione dell’equilibrio? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29