Vito Posca Tiziana Fiorani Chimica pi verde Capitolo
































- Slides: 33


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 2 Sistemi, miscele e soluzioni

Sommario 1. I sistemi sono campioni limitati di materia 2. I sistemi sono distinti in omogenei ed eterogenei 3. Le miscele sono distinte in omogenee ed eterogenee 4. Come si separano i componenti di una miscela eterogenea 5. Come si separano i componenti di una miscela omogenea 6. Le soluzioni sono distinte in gassose, liquide o solide 7. La solubilità indica la quantità massima di soluto che si scioglie in un solvente 8. La concentrazione indica la quantità di soluto in una soluzione Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

I sistemi sono campioni limitati di materia Un sistema è un campione limitato di materia distinto dall’ambiente circostante. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

I sistemi sono campioni limitati di materia I sistemi aperti possono scambiare con l’ambiente esterno sia materia sia energia. I sistemi chiusi possono scambiare con l’ambiente soltanto energia. I sistemi isolati non scambiano con l’ambiente né materia né energia. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

I sistemi sono campioni limitati di materia Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

I sistemi sono distinti in omogenei ed eterogenei Una fase è un sistema o la parte di un sistema delimitata da superfici nette e che presenta le stesse caratteristiche fisiche (stato fisico, colore, lucentezza, densità, durezza). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

I sistemi sono distinti in omogenei ed eterogenei Un sistema omogeneo è costituito da una sola fase (acqua zuccherata). Un sistema eterogeneo è costituito da due o più fasi (frammento di granito, acqua contenente una compressa effervescente). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

Le miscele sono distinte in omogenee ed eterogenee Le miscele omogenee o soluzioni sono formate da due o più componenti che non sono più distinguibili e presentano le stesse proprietà in ogni punto del sistema. Nelle soluzioni si distinguono: • il solvente (componente più abbondante); • il soluto (componente o componenti meno abbondanti). I componenti di una soluzione sono costituiti da particelle il cui diametro è inferiore a 1 nanometro (1 nm = 10− 9 m). Una soluzione è trasparente alla luce e non filtrabile. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Le miscele sono distinte in omogenee ed eterogenee Le miscele eterogenee sono formate da due o più componenti che sono distinguibili e ciascun componente mantiene le sue proprietà caratteristiche. Le miscele eterogenee possono essere costituite: • da più solidi diversi; • da due liquidi non miscibili, e sono dette emulsioni; • da un solido in un liquido, e sono dette sospensioni. Una sospensione è opaca alla luce e filtrabile. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

Le miscele sono distinte in omogenee ed eterogenee A. La sospensione di terriccio in acqua è opaca. B. Quando la terra è completamente depositata, il solido e il liquido si separano facilmente tramite filtrazione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Le miscele sono distinte in omogenee ed eterogenee Le miscele microeterogenee in cui almeno un componente ha particelle con diametro compreso tra 1 nm e 1000 nm sono chiamate sistemi colloidali o dispersioni colloidali o semplicemente colloidi. I tipi di colloidi si distinguono per lo stato fisico delle fasi disperdente e dispersa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

Le miscele sono distinte in omogenee ed eterogenee I sistemi colloidali sono opachi alla luce e non filtrabili con la normale carta da filtro. Il latte (emulsione) e le nuvole (aerosol liquido) sono alcuni tipi di sistemi colloidali. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

✓ Mettiamoci alla prova Qual è la differenza tra i termini incolore, trasparente e opaco? Ricorda un esempio per ciascun tipo di dispersione colloidale: sol, gel, emulsione, aerosol liquido e aerosol solido. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

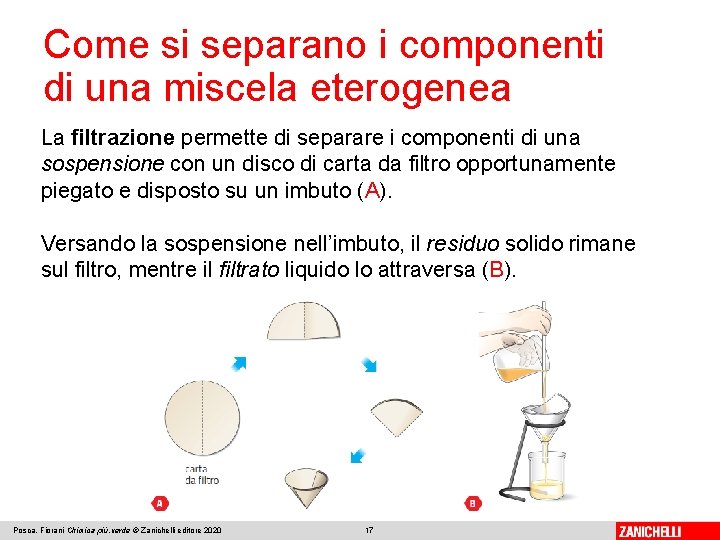
Come si separano i componenti di una miscela eterogenea I metodi più utilizzati per separare i componenti delle miscele eterogenee sono: la filtrazione, che sfrutta le diverse dimensioni dei componenti; la centrifugazione, che sfrutta la diversa densità dei componenti. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

Come si separano i componenti di una miscela eterogenea La filtrazione permette di separare i componenti di una sospensione con un disco di carta da filtro opportunamente piegato e disposto su un imbuto (A). Versando la sospensione nell’imbuto, il residuo solido rimane sul filtro, mentre il filtrato liquido lo attraversa (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

Come si separano i componenti di una miscela eterogenea La centrifugazione è utilizzata per separare i componenti di una emulsione o sospensione con diversa densità. Si versa la miscela in una provetta posta in una centrifuga (A). Ruotando, la centrifuga sviluppa una forza centrifuga maggiore sul componente più denso (liquido o solido), che si deposita sul fondo della provetta (C). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

Come si separano i componenti di una miscela omogenea I metodi per separare i componenti delle miscele omogenee sono: l’estrazione con solvente e la cristallizzazione, che sfruttano la diversa solubilità dei componenti; la distillazione, che sfrutta il diverso punto di ebollizione dei componenti; la cromatografia. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

Come si separano i componenti di una miscela omogenea La cristallizzazione si utilizza per allontanare da un componente solido piccole quantità di altri componenti che lo rendono impuro. Si basa sulla diversa solubilità in un certo solvente del componente da purificare rispetto alle impurità. Il solfato di rame viene purificato sfruttando le diverse solubilità di sale e impurezze. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

Come si separano i componenti di una miscela omogenea L’estrazione con solvente permette di separare due soluti (esempio: cromato di potassio e iodio) entrambi presenti in un solvente (esempio: acqua). In un imbuto separatore si aggiunge alla soluzione un secondo solvente (esempio: trielina), in cui è solubile solo uno dei due soluti (esempio: lo iodio). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Come si separano i componenti di una miscela omogenea La cromatografia sfrutta la diversa velocità con cui i componenti di una soluzione trascinati da un fluido, detto fase mobile, migrano su un supporto, detto fase stazionaria. La fase stazionaria è costituita, per esempio, da carta porosa o da uno strato di gel di silice o di altro materiale. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

Come si separano i componenti di una miscela omogenea La distillazione consiste nel riscaldare una soluzione per trasformare uno dei componenti in vapore. Per successivo raffreddamento esso ritorna allo stato liquido e si separa dal soluto solido o da altri liquidi con diversa temperatura di ebollizione. La distillazione semplice separa il solvente (per esempio acqua) da una soluzione contenente un soluto solido (per esempio sale). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Come si separano i componenti di una miscela omogenea La distillazione frazionata separa due o più liquidi di una soluzione con temperature di ebollizione simili. Se i liquidi bollono a temperature simili, riscaldando la soluzione si ha il passaggio allo stato di vapore di entrambe le sostanze e il distillato è ancora una miscela. In questi casi si inserisce nel pallone da distillazione una colonna di frazionamento. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

Le soluzioni sono distinte in gassose, liquide o solide Le soluzioni gassose sono costituite da soluto gassoso disciolto in un solvente gassoso. Il processo che porta alla formazione di una soluzione gassosa è spontaneo. I gas si possono mescolare completamente e in tutte le proporzioni. L’aria priva di particelle solide o liquide in sospensione è l’esempio più comune di soluzione gassosa, costituita essenzialmente da azoto e ossigeno. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

Le soluzioni sono distinte in gassose, liquide o solide Le soluzioni liquide più diffuse sono le soluzioni acquose, in cui il solvente è l’acqua e il soluto può essere solido, liquido o gassoso. A. Il sale nell’acqua per la pasta forma una soluzione solido-liquido. B. Il vino è una soluzione di alcol in acqua, cioè liquido-liquido. C. L’acqua di fiume contiene gas disciolti (ossigeno e diossido di carbonio) Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

Le soluzioni sono distinte in gassose, liquide o solide Le soluzioni solide sono costituite da un solido disciolto in un altro solido. Una lega, è una soluzione solida costituita da un componente metallico, detto di base, e da uno o più componenti metallici o non metallici, detti alliganti: • il bronzo è una lega rame-stagno; • l’ottone è una lega rame-zinco; • la ghisa e l’acciaio sono leghe ferro-carbonio; • l’amalgama è una lega tra mercurio e altri metalli. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

La solubilità indica la quantità massima di soluto che si scioglie in un solvente La formazione di una soluzione avviene per solubilizzazione o dissoluzione di un soluto in un solvente. A parte i gas e alcuni liquidi, che si sciolgono tra loro in tutte le proporzioni, in genere esiste un limite alla quantità di soluto che si scioglie in un solvente. La quantità massima di soluto che a una data temperatura si può sciogliere in una determinata quantità di solvente si definisce solubilità. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

La solubilità indica la quantità massima di soluto che si scioglie in un solvente A una data temperatura, una soluzione che contiene una quantità di soluto: • inferiore al valore di solubilità si dice insatura (a sinistra); • uguale al valore di solubilità si dice satura (a destra). Se si aggiunge soluto in una soluzione satura, questo non si scioglie e si deposita formando il corpo di fondo. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

La concentrazione indica la quantità di soluto in una soluzione La concentrazione di una soluzione esprime la quantità di soluto contenuta in una determinata quantità di soluzione: Una soluzione è diluita se la quantità di soluto disciolto nel solvente è piccola, se è grande si dice invece concentrata. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

La concentrazione indica la quantità di soluto in una soluzione La concentrazione percentuale in massa (%m/m) indica la quantità in grammi di soluto presente in 100 g di soluzione: La concentrazione percentuale in volume (%V/V) esprime la quantità in m. L di soluto disciolti in 100 m. L di soluzione: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

La concentrazione indica la quantità di soluto in una soluzione La concentrazione percentuale massa/volume (%m/V) indica la quantità in grammi di soluto presente in 100 m. L di soluzione: È possibile trasformare la %m/V in %m/m o viceversa se si conosce la densità: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

✓ Mettiamoci alla prova È possibile separare le soluzioni di due o più liquidi tramite distillazione? E se i liquidi bollono a temperature simili? Calcola la concentrazione in g/L delle seguenti soluzioni di sale da cucina: a) 30 g in 200 m. L di soluzione b) 150 g in 1 L di soluzione Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33
 Peso atomico
Peso atomico Soluzioni chimica più dalla mole alla nomenclatura
Soluzioni chimica più dalla mole alla nomenclatura Chimica più posca fiorani soluzioni
Chimica più posca fiorani soluzioni Soluzioni chimica più verde
Soluzioni chimica più verde Posca soluzioni
Posca soluzioni Elettrolisi idrogeno
Elettrolisi idrogeno Adivina quién soy cuando voy vengo y cuando vengo voy
Adivina quién soy cuando voy vengo y cuando vengo voy Coefficienti stechiometrici
Coefficienti stechiometrici Stati condensati della materia
Stati condensati della materia Chimica più verde soluzioni
Chimica più verde soluzioni Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17 Barriere prezigotiche
Barriere prezigotiche Soluzioni capitolo 6 zanichelli chimica
Soluzioni capitolo 6 zanichelli chimica La nuova chimica di rippa soluzioni
La nuova chimica di rippa soluzioni Soluzioni capitolo 14 chimica più
Soluzioni capitolo 14 chimica più Pila di volta zanichelli
Pila di volta zanichelli Klein soluzioni
Klein soluzioni Capitolo a1 dal carbonio agli idrocarburi
Capitolo a1 dal carbonio agli idrocarburi Legame covalente dativo
Legame covalente dativo Chimica molecole in movimento soluzioni capitolo 11
Chimica molecole in movimento soluzioni capitolo 11 Soluzioni chimica zanichelli capitolo 11
Soluzioni chimica zanichelli capitolo 11 Soluzioni chimica più capitolo 10
Soluzioni chimica più capitolo 10 Molecole in movimento soluzioni capitolo 14
Molecole in movimento soluzioni capitolo 14 Soluzioni chimica capitolo 18
Soluzioni chimica capitolo 18 Valitutti soluzioni capitolo 14
Valitutti soluzioni capitolo 14 Soluzioni capitolo 16 le reazioni chimiche
Soluzioni capitolo 16 le reazioni chimiche Chimica zanichelli soluzioni capitolo 16
Chimica zanichelli soluzioni capitolo 16 Chimica più soluzioni capitolo 18
Chimica più soluzioni capitolo 18 Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Soluzioni chimica zanichelli capitolo 10
Soluzioni chimica zanichelli capitolo 10 Le ossidoriduzioni e l'elettrochimica
Le ossidoriduzioni e l'elettrochimica Soluzioni chimica capitolo 13
Soluzioni chimica capitolo 13 Soluzioni chimica capitolo 17
Soluzioni chimica capitolo 17 Numero quantico magnetico
Numero quantico magnetico