Vito Posca Tiziana Fiorani Chimica pi verde Capitolo














































- Slides: 52


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 11 I legami chimici

Sommario 1. I legami chimici primari sono forze attrattive tra atomi 2. La configurazione elettronica dell’ottetto è stabile 3. Il legame ionico si forma tra atomi di metalli e atomi di non metalli 4. Il legame covalente si forma tra atomi di non metalli uguali o diversi 5. Nel legame covalente dativo gli elettroni di legame sono forniti da un solo atomo 6. Il tipo di legame è definito dalla differenza di elettronegatività tra due atomi Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 7. Le formule di struttura indicano i legami tra gli atomi di una molecola 8. La teoria VSEPR definisce la geometria della molecola 9. La polarità delle molecole dipende dalla differenza di elettronegatività e dalla geometria 10. Il legame metallico si forma tra atomi dello stesso metallo 11. I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

I legami chimici primari sono forze attrattive tra atomi Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un’elevata energia. Per aumentare la stabilità e diminuire la loro energia, modificano la loro configurazione elettronica esterna, formando legami chimici con atomi dello stesso tipo o diversi. I legami chimici sono forze attrattive che si stabiliscono tra gli elettroni del livello energetico esterno (elettroni di legame) e i nuclei di due o più atomi uguali o diversi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

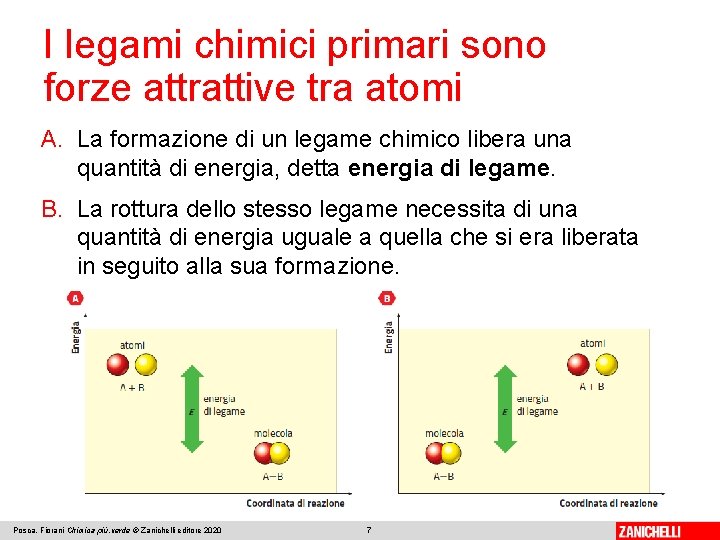
I legami chimici primari sono forze attrattive tra atomi A. La formazione di un legame chimico libera una quantità di energia, detta energia di legame. B. La rottura dello stesso legame necessita di una quantità di energia uguale a quella che si era liberata in seguito alla sua formazione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

I legami chimici primari sono forze attrattive tra atomi Per rappresentare la configurazione elettronica esterna si ricorre alla notazione di Lewis, che permette di dedurre numero e tipo di legami che l’atomo può formare. Si rappresenta il simbolo dell’elemento circondato dagli elettroni del livello esterno: un puntino per elettrone singolo, due puntini o trattino per le coppie di elettroni (doppietti). Viene utilizzata solo per gli atomi con elettroni esterni negli orbitali s e p (elementi principali). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

La configurazione elettronica dell’ottetto è stabile Gli elementi del gruppo 18 (VIII) sono stati denominati gas nobili o gas inerti. La loro bassa reattività, e di conseguenza grande stabilità, è dovuta alla loro configurazione esterna ns 2 np 6 (ottetto). Ogni atomo tende a raggiungere la configurazione elettronica esterna dell’ottetto mediante la formazione di legami chimici. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

La configurazione elettronica dell’ottetto è stabile La stabilità si può realizzare anche con una configurazione non otteziale (minore di otto elettroni): • l’elio (1 s 2) consegue la stabilità con due elettroni perché ha solo l’orbitale s; • l’idrogeno (1 s 1) raggiunge la stabilità con due elettroni. La tendenza degli elementi a raggiungere la configurazione elettronica stabile è alla base della formazione dei legami chimici primari: ionico, covalente e metallico. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Il legame ionico si forma tra atomi di metalli e atomi di non metalli Il legame ionico si realizza per il trasferimento di elettroni tra atomi con un’elevata differenza di elettronegatività (ΔEn). Il legame ionico si forma quindi tra atomi di metalli e non metalli. La differenza di elettronegatività tra atomi di un metallo e di un non metallo deve essere maggiore di 1, 9. Tra berillio e alluminio e gli alogeni ΔEn è minore di 1, 9 quindi non si stabilisce un legame ionico ma covalente polare. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

Il legame ionico si forma tra atomi di metalli e atomi di non metalli Il sodio è un metallo che tende a perdere un elettrone trasformandosi nello ione Na+. Il cloro è un non metallo che tende ad acquistare un elettrone trasformandosi in Cl‒. La forza di attrazione elettrostatica che si stabilisce tra i due ioni di carica opposta è il legame ionico. Si forma un composto ionico, il cloruro di sodio: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Il legame ionico si forma tra atomi di metalli e atomi di non metalli Il legame ionico porta alla formazione di una unità formula, che indica il rapporto quantitativo che esiste tra gli ioni di un composto ionico allo stato liquido o solido. Nel cloruro di sodio, per ogni ione Na+ si ha uno ione Cl-, quindi l’unità formula è Na+Cl-. Si esprime con la formula chimica Na. Cl, in cui si omettono le cariche. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

Il legame ionico si forma tra atomi di metalli e atomi di non metalli Gli ioni poliatomici sono gruppi di due o più atomi legati tra di loro mediante legami covalenti e recanti una o più cariche elettriche positive o negative. I più comuni sono: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

Il legame covalente si forma tra atomi di non metalli uguali o diversi Il legame covalente si stabilisce tra atomi uguali o diversi di non metalli, con stessa elettronegatività o con una piccola differenza. Si realizza mediante la condivisione di una o più coppie di elettroni (doppietti), in modo che i due atomi possano raggiungere la configurazione elettronica esterna stabile. Generalmente ognuno dei due atomi fornisce uno degli elettroni (omopolare o eteropolare). Talvolta entrambi gli elettroni sono forniti dallo stesso atomo (dativo). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

Il legame covalente si forma tra atomi di non metalli uguali o diversi Il legame covalente omopolare o puro si stabilisce tra due atomi dello stesso elemento non metallico (ΔEn = 0) o tra due atomi di non metalli con una irrilevante differenza di elettronegatività (ΔEn < 0, 4). Gli atomi, avendo la stessa elettronegatività, esercitano un’uguale forza di attrazione sugli elettroni di legame, che quindi sono condivisi esattamente tra i due atomi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

Il legame covalente si forma tra atomi di non metalli uguali o diversi Due atomi di idrogeno hanno configurazione esterna ns 1; per raggiungere la stabilità ogni atomo tende ad avere due elettroni, mettendo il proprio a disposizione dell’altro. I due atomi di H hanno stessa elettronegatività: il legame è omopolare. I due atomi condividono una sola coppia elettronica e il legame è un legame semplice. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

Il legame covalente si forma tra atomi di non metalli uguali o diversi Due atomi di ossigeno hanno 6 elettroni esterni e, per raggiungere l’ottetto, ciascuno mette in comune 2 elettroni. I due atomi condividono due coppie elettroniche e il legame è un legame doppio. Due atomi di azoto hanno 5 elettroni esterni e, per raggiungere l’ottetto, ciascuno mette in comune 3 elettroni. I due atomi condividono tre coppie elettroniche e il legame è un legame triplo. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

Il legame covalente si forma tra atomi di non metalli uguali o diversi Il legame covalente polare o eteropolare si stabilisce tra due atomi diversi di elementi non metallici, quindi con piccola differenza di elettronegatività (0, 4 < ΔEn < 1, 7). Gli atomi, avendo diversa elettronegatività, esercitano una forza diversa di attrazione sugli elettroni di legame, che sono attratti con maggiore forza dal nucleo dell’atomo più elettronegativo. Sull’atomo meno elettronegativo si stabilisce una parziale carica positiva, su quello più elettronegativo una parziale carica negativa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

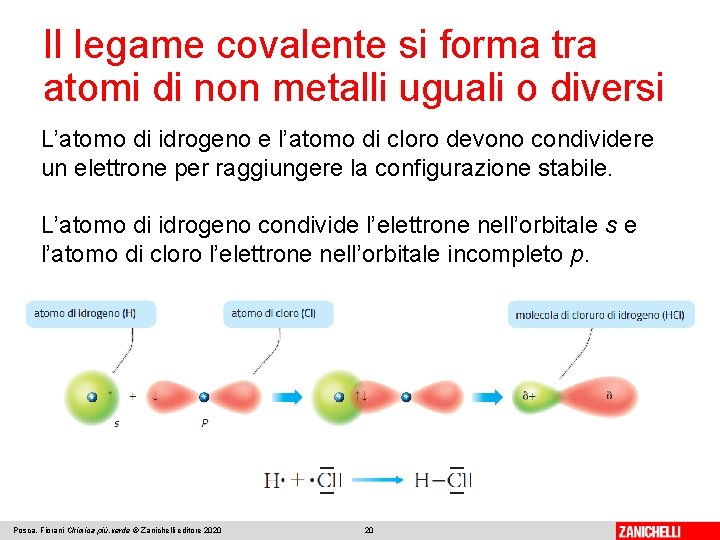
Il legame covalente si forma tra atomi di non metalli uguali o diversi L’atomo di idrogeno e l’atomo di cloro devono condividere un elettrone per raggiungere la configurazione stabile. L’atomo di idrogeno condivide l’elettrone nell’orbitale s e l’atomo di cloro l’elettrone nell’orbitale incompleto p. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

Il legame covalente si forma tra atomi di non metalli uguali o diversi La molecola di cloruro di idrogeno (HCl) è costituita da due atomi con diversa elettronegatività. L’atomo di cloro assume una parziale carica negativa (δ-), l’atomo di idrogeno una parziale carica positiva (δ+). Si forma un dipolo elettrico. Il legame è eteropolare. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Nel legame covalente dativo gli elettroni di legame sono forniti da un solo atomo Il legame covalente dativo è un legame covalente eteropolare in cui un solo atomo fornisce i due elettroni condivisi nella formazione del legame. L’atomo che fornisce entrambi gli elettroni (donatore) ha già raggiunto l’ottetto e deve avere un doppietto elettronico non impegnato in legami. L’atomo o lo ione positivo che usufruisce dei due elettroni (accettore) deve avere un orbitale vuoto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

Nel legame covalente dativo gli elettroni di legame sono forniti da un solo atomo Nella molecola dell’ammoniaca (NH 3), il doppietto dell’azoto è condiviso con lo ione H+ che ha orbitale s vuoto. Si stabilisce un legame covalente dativo con formazione dello ione poliatomico ammonio (NH 4+). Altri esempi di legame dativo: H 3 O+, CO, SO 2. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Il tipo di legame è definito dalla differenza di elettronegatività tra due atomi Il tipo di legame tra due atomi dipende dalla loro differenza di elettronegatività: se è uguale a 0, il legame è covalente omopolare; se è compresa tra 0, 4 e 1, 9 si ha legame covalente eteropolare; se è maggiore di 1, 9 il legame è ionico. Maggiore è la differenza di elettronegatività tra i due atomi, maggiore è il grado di polarità del legame. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

✓ Mettiamoci alla prova Quale tipo di legame si stabilisce tra le coppie Ca/Cl e K/S? Scrivi la formula del composto che ne deriva. Quale tipo di legame si stabilisce tra gli atomi all’interno della molecola dell’acqua (H 2 O)? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

Le formule di struttura indicano i legami tra gli atomi di una molecola La formula di struttura indica come gli atomi sono legati in una molecola (biatomica o poliatomica) o in uno ione (biatomico o poliatomico). Per rappresentare le strutture di Lewis di molecole biatomiche e di ioni biatomici: 1. indichiamo i simboli dei due atomi della molecola o ione; 2. calcoliamo il numero delle coppie elettroniche, del livello energetico esterno, sottraendo (o aggiungendo) per gli ioni un elettrone per ogni carica positiva (o negativa); 3. disponiamo le coppie elettroniche in modo che ogni atomo completi l’ottetto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

Le formule di struttura indicano i legami tra gli atomi di una molecola Nella molecola di fluoro (F 2), gli elettroni del livello esterno sono 14, quindi 7 coppie elettroniche: Nello ione cianuro (CN-) gli elettroni del livello esterno, tenendo conto della carica negativa, sono 10, quindi 5 coppie elettroniche: La struttura dello ione si racchiude tra parentesi quadre con dello ione in alto a destra. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

Le formule di struttura indicano i legami tra gli atomi di una molecola Per rappresentare le strutture di Lewis di molecole poliatomiche e di ioni poliatomici: 1. individuiamo e rappresentiamo il simbolo dell’atomo centrale, generalmente il meno elettronegativo; 2. disponiamo i simboli degli atomi terminali simmetricamente intorno all’atomo centrale; 3. calcoliamo il numero delle coppie elettroniche; 4. usiamo le coppie elettroniche per formare legami singoli tra l’atomo centrale e i terminali; poi disponiamo le altre coppie in modo che ogni atomo terminale completi l’ottetto. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

Le formule di struttura indicano i legami tra gli atomi di una molecola Nel tricloruro di fosforo (PCl 3) si contano 13 coppie elettroniche; il fosforo centrale forma tre legami singoli e raggiunge l’ottetto con un doppietto libero. Negli ossoacidi, l’atomo centrale è legato agli atomi di ossigeno, a loro volta legati agli atomi di idrogeno. Così avviene per l’acido borico (H 3 BO 3), dove il boro è stabile con sei elettroni. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

Le formule di struttura indicano i legami tra gli atomi di una molecola 5. Se le coppie elettroniche non sono sufficienti per far raggiungere l’ottetto all’atomo centrale, utilizziamo le coppie elettroniche non condivise dagli atomi terminali per formare doppi e tripli legami con l’atomo centrale. Nello ione carbonato (CO 32 -) il carbonio centrale forma tre legami singoli con l’ossigeno, ma non raggiunge l’ottetto. Si forma un doppio legame tra il carbonio e un atomo di ossigeno: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

La teoria VSEPR definisce la geometria delle molecole Le proprietà chimiche di una molecola dipendono dalla geometria, ovvero dalla disposizione spaziale degli atomi. La disposizione dipende dal numero di atomi e dalla lunghezza e dall’angolo che i legami formano tra loro. La lunghezza di legame, in pm, è la distanza tra i nuclei di due atomi uniti da un legame covalente. Aumenta all’aumentare del raggio (A) e diminuisce all’aumentare del numero di legami (B): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

La teoria VSEPR definisce la geometria delle molecole L’angolo di legame, misurato in gradi, è l’angolo formato dagli assi di due legami chimici che partono dallo stesso atomo. Secondo la teoria VSEPR, l’angolo di legame dipende dal numero di coppie elettroniche, sia impegnate nel legame sia libere, che circondano l’atomo centrale: le coppie elettroniche, avendo carica negativa, si dispongono e si orientano in modo da risultare il più lontano possibile l’una dall’altra. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

La teoria VSEPR definisce la geometria delle molecole Una molecola o ione con due coppie elettroniche ha una geometria lineare. Una molecola o ione con tre coppie elettroniche ha geometria planare triangolare. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

La teoria VSEPR definisce la geometria delle molecole Una molecola o ione con quattro coppie elettroniche ha geometria tetraedrica (A). Una molecola o ione con quattro coppie elettroniche e un doppietto elettronico libero ha geometria piramidale triangolare (B). Una molecola o ione con quattro coppie elettroniche e due doppietti elettronici liberi ha geometria angolare (C). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34

La teoria VSEPR definisce la geometria delle molecole Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 35

La polarità delle molecole dipende dalla differenza di elettronegatività e dalla geometria La polarità in una molecola biatomica dipende da una differenza di elettronegatività diversa da zero che determina un legame covalente polare. Se la molecola è formata da: due atomi uguali, quindi ΔEn = 0, la disposizione degli elettroni di legame è simmetrica: la molecola è apolare (A). due atomi diversi, quindi ΔEn ≠ 0, la disposizione degli elettroni di legame è asimmetrica: la molecola è polare (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 36

La polarità delle molecole dipende dalla differenza di elettronegatività e dalla geometria In una molecola poliatomica, in cui ogni singolo legame covalente è polare, la polarità dipende dalla geometria. Nelle molecole con geometria lineare, planare triangolare e tetraedrica e con atomi terminali dello stesso tipo, la disposizione degli elettroni di legame è simmetrica: le molecole sono apolari. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 37

La polarità delle molecole dipende dalla differenza di elettronegatività e dalla geometria Nelle molecole con geometria lineare, planare triangolare e tetraedrica, ma con atomi terminali diversi, la disposizione degli elettroni di legame è asimmetrica: le molecole sono polari. Nelle molecole con geometria angolare e piramidale triangolare la disposizione degli elettroni di legame è asimmetrica: le molecole sono polari. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 38

Il legame metallico si forma tra atomi dello stesso metallo I metalli sono elementi con bassi valori di energia di ionizzazione, per cui tendono a cedere facilmente elettroni trasformandosi in ioni positivi. Data la facilità con cui i loro elettroni esterni sono liberi di muoversi, si ipotizza che abbiano una struttura costituita da ioni positivi (nuclei atomici ed elettroni interni) immersi in una nube di elettroni mobili (quelli esterni). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 39

Il legame metallico si forma tra atomi dello stesso metallo Il legame metallico consiste nella forza di attrazione che si stabilisce tra gli ioni positivi di un metallo e tutti gli elettroni del livello energetico esterno (elettroni di legame) che sono in continuo movimento intorno agli ioni. Si rappresenta con il simbolo dell’elemento, specificando lo stato fisico: Ag(s), Hg(l). Questo tipo di legame giustifica le proprietà dei metalli: conducibilità elettrica e termica dipendono dalla bassa energia di ionizzazione e quindi dall’elevata mobilità degli elettroni di legame; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 40

Il legame metallico si forma tra atomi dello stesso metallo malleabilità e duttilità, che indicano la capacità di un metallo di essere ridotto in sottili lamine e fili, dipendono dalla distribuzione uniforme degli elettroni: lo spostamento degli ioni in seguito a sollecitazioni meccaniche non fa insorgere forze repulsive. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 41

I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo I legami chimici secondari sono deboli legami elettrostatici generati da forze attrattive tra molecole elettricamente neutre (interazioni intermolecolari) o tra ioni e molecole polari (interazioni ione-dipolo). Le interazioni intermolecolari sono il legame a idrogeno e le interazioni di van der Waals. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 42

I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Il legame a idrogeno è una forza attrattiva che si stabilisce tra molecole polari in cui è presente l’atomo di idrogeno legato covalentemente a un atomo dal piccolo raggio atomico e molto elettronegativo (ossigeno, fluoro e azoto). Si stabilisce quindi tra molecole di acqua (H 2 O), floruro di idrogeno (HF) e ammoniaca (NH 3). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 43

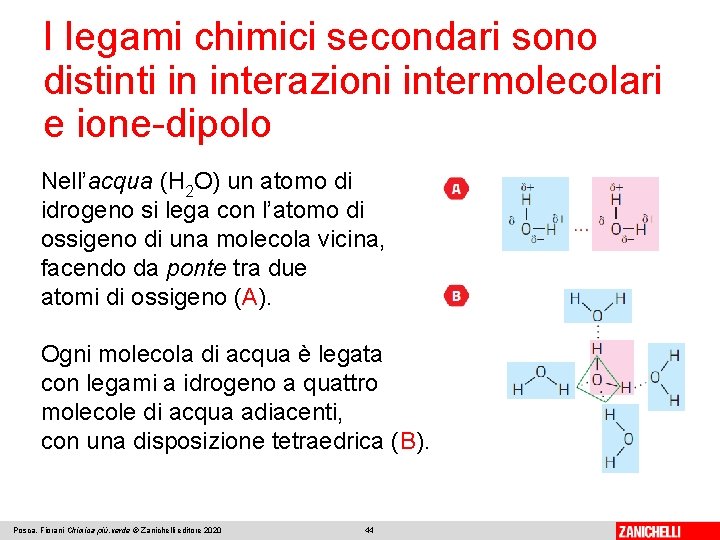
I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Nell’acqua (H 2 O) un atomo di idrogeno si lega con l’atomo di ossigeno di una molecola vicina, facendo da ponte tra due atomi di ossigeno (A). Ogni molecola di acqua è legata con legami a idrogeno a quattro molecole di acqua adiacenti, con una disposizione tetraedrica (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 44

I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Il legame a idrogeno conferisce all’acqua alcune proprietà. Allo stato liquido: temperatura di ebollizione di 100 °C. Allo stato solido: disposizione esagonale delle molecole, con aumento di volume e minore densità del ghiaccio rispetto all’acqua. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 45

I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Nel fluoruro di idrogeno (HF), il legame a idrogeno si stabilisce tra idrogeno di una molecola e fluoro di una adiacente; le molecole assumono disposizione angolare (A). Nell’ammoniaca (NH 3) il legame a idrogeno si stabilisce per la presenza di parziale carica positiva su idrogeno e parziale carica negativa su azoto (B). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 46

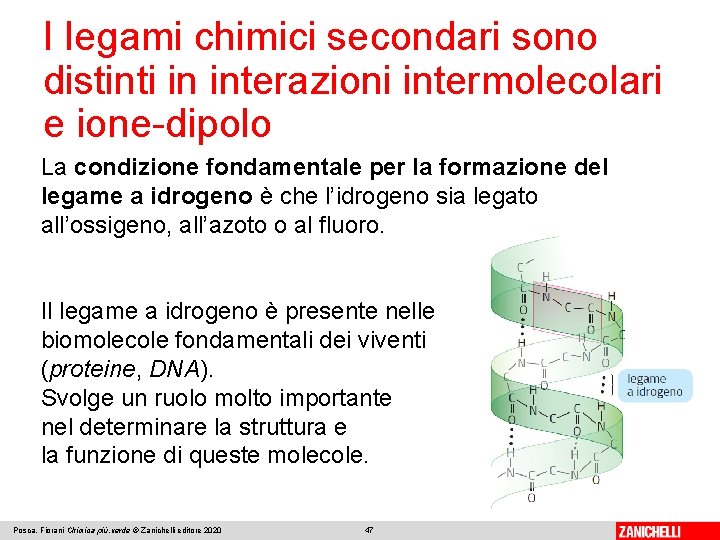
I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo La condizione fondamentale per la formazione del legame a idrogeno è che l’idrogeno sia legato all’ossigeno, all’azoto o al fluoro. Il legame a idrogeno è presente nelle biomolecole fondamentali dei viventi (proteine, DNA). Svolge un ruolo molto importante nel determinare la struttura e la funzione di queste molecole. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 47

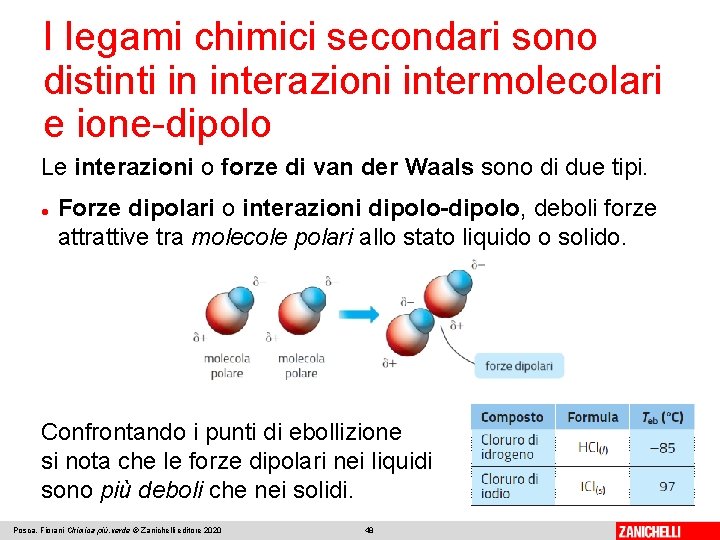
I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Le interazioni o forze di van der Waals sono di due tipi. Forze dipolari o interazioni dipolo-dipolo, deboli forze attrattive tra molecole polari allo stato liquido o solido. Confrontando i punti di ebollizione si nota che le forze dipolari nei liquidi sono più deboli che nei solidi. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 48

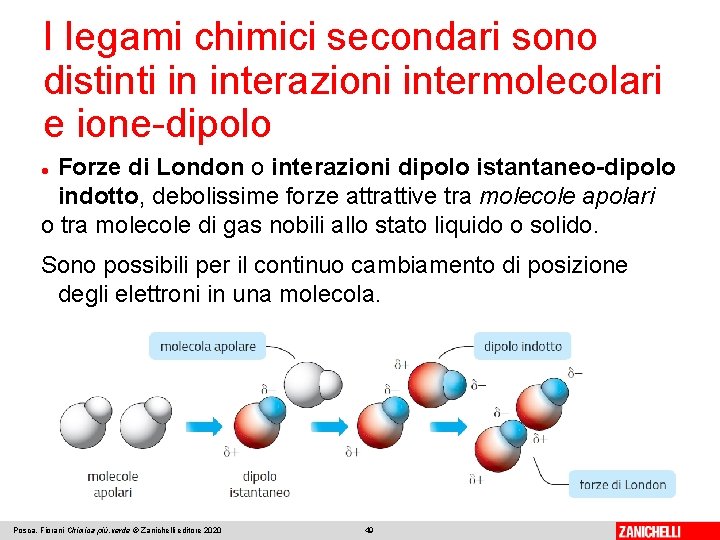
I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Forze di London o interazioni dipolo istantaneo-dipolo indotto, debolissime forze attrattive tra molecole apolari o tra molecole di gas nobili allo stato liquido o solido. Sono possibili per il continuo cambiamento di posizione degli elettroni in una molecola. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 49

I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo Confrontando i punti di ebollizione si nota che le forze di London sono più intense quando aumenta la massa molecolare relativa. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 50

I legami chimici secondari sono distinti in interazioni intermolecolari e ione-dipolo L’interazione-dipolo è la forza di attrazione elettrostatica che si stabilisce tra uno ione e una molecola polare (in genere l’acqua). Un composto, ionico o molecolare polare, in acqua si dissocia in ioni di carica opposta. Ogni ione è circondato da un numero elevato di molecole d’acqua (idratazione). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 51

✓ Mettiamoci alla prova Scrivi la struttura di Lewis CO 2 e SO 3. Quale geometria hanno? Sono polari o apolari? A quali elementi chimici deve essere legato l’idrogeno perché tra le diverse molecole si stabilisca il legame a idrogeno? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 52